薬剤耐性細菌の出現の原因となる多剤排出輸送体の構造および機能の解明
田中良樹・濡木 理
(東京大学大学院理学系研究科 生物化学専攻)
email:田中良樹,濡木 理
DOI: 10.7875/first.author.2013.052
Structural basis for the drug extrusion mechanism by a MATE multidrug transporter.
Yoshiki Tanaka, Christopher J. Hipolito, Andrés D. Maturana, Koichi Ito, Teruo Kuroda, Takashi Higuchi, Takayuki Katoh, Hideaki E. Kato, Motoyuki Hattori, Kaoru Kumazaki, Tomoya Tsukazaki, Ryuichiro Ishitani, Hiroaki Suga, Osamu Nureki
Nature, 496, 247-251 (2013)
MATEファミリータンパク質は生物界に広く存在する膜タンパク質輸送体であり,イオン濃度勾配を利用してさまざまな異物を細胞外へと排出することにより細胞の機能を維持している.そのため,病原細菌やがん細胞においては,薬剤を排出しその効果を低下させる薬剤耐性の一端を担うものであり,輸送機構の解明が望まれている.今回,筆者らは,好熱古細菌に由来するMATEファミリータンパク質の単体,基質との複合体,阻害活性ペプチドとの複合体のX線結晶構造を決定した.そして,膜貫通ヘリックスの1つが大きく折れ曲がることにより基質結合ポケットを縮小して基質を排出する構造変化を発見し,その輸送機構について新たな仮説を提唱した.
近年,注目されている輸送体に薬物の能動的な排出系にかかわるものがある.これは細胞において毒性のある物質を細胞外へと積極的に排出するものである.これらの輸送体の特徴のひとつとして,構造および作用機序の異なる複数の薬剤を認識し排出できることがあげられる.このような輸送体は多剤排出輸送体と称され,原核生物から高等真核生物まで広く存在している.構造面からその作用機序を明らかにすることは,薬剤を効果的に使用するためにも重要な意味をもつ.
MATE(multidrug and toxic compound extrusion,多剤・毒性化合物排出)ファミリータンパク質は原核生物から高等真核生物にいたるまで広く保存されている多剤排出輸送体ファミリーのひとつである1).およそ450アミノ酸残基からなり,12の膜貫通ヘリックスをもち,薬剤をNa+もしくはH+の濃度勾配を利用した対向輸送により排出する.細菌における生化学的な研究から,おもな基質として陽イオン性の有機化合物が知られている.哺乳類においてもホモログとしてSLC47が同定されており,腎臓や肝臓において有機カチオン性化合物とH+とを対向輸送し,排泄の最終段階を担うことが知られている2).
この研究では,MATEファミリータンパク質が多様な基質を認識するしくみ,および,その排出機構について,X線結晶構造解析を用いた立体構造からの解明を試みた.
20世紀前半から,抗菌作用など生理活性をもつ多くのペプチドが発見されてきている.これまでに発見された薬理作用をもつペプチドには,大環状構造や修飾ペプチド,D-アミノ酸など,特殊な構造およびアミノ酸残基をもつものが含まれており,それらが生理活性に重要であると考えられている.また,環状構造はペプチダーゼへの高い耐性を示すことが知られている.特殊ペプチドのスクリーニングは困難とされてきたが,標的とするタンパク質に高い結合能をもつ特殊ペプチドの探索を可能にするRaPID(random peptide integrated discovery)法が開発されている3).また,標的とするタンパク質に対し特異的に結合する抗体などはタンパク質の構造の安定化や結晶パッキングを補助し,結晶の成長を促進することが知られている.膜タンパク質への高い結合能をもつ特殊ペプチドは,薬剤としての可能性だけでなく,結合により構造を安定化させる結晶構造解析においての補助手段としても期待されている.今後のペプチド創薬や構造解析への利用のためには,共結晶化による複合体の構造の解明が必要であると考えられる.
膜タンパク質における解析の困難さは,その発現量の少なさと安定性の低さに起因するところが大きい.そこで今回の研究では,MATEファミリータンパク質が原核生物から古細菌,真核生物とひろく存在していることから,好熱性古細菌を中心として発現スクリーニングを行った.好熱性の生物を構成するタンパク質は高温においても安定な構造を保つため,精製や結晶化において有利なことが多い.最終的に,そのなかからPyrococcus furiosusに由来するMATEファミリータンパク質(PfMATE)を構造解析の対象として選択した.PfMATEを大腸菌C41(DE3)株を使用して大量発現し,精製して結晶化に供した.結晶化法としては,脂質のなかに膜タンパク質を再構成してから結晶化する脂質キュービック相法を適用した.なお,脂質キュービック相法を導入する以前から,蒸気拡散法により結晶は得られてはいたものの,構造決定に必要な分解能をもつ回折データを得ることはできていなかった.脂質キュービック相法により得られたPfMATEの結晶は最高でも長辺30μmと構造解析にあたっては微小であったが,大型放射光施設SPring-8のビームラインBL32XUにおいてマイクロフォーカスX線ビームを利用することにより,単独の結晶から高分解能データセット(分解能2.1~3.0Å)の収集に成功した.分子置換法による構造決定に失敗したため,位相決定はセレノメチオニン置換体の結晶を用いることにした.しかしこのとき,セレノメチオニン置換体の結晶は成長が悪く,解析に必要なだけのデータ収集が不可能であった.そこで,特異的な結合能をもつチオエステル化大環状ペプチドをin vitroセレクション法により探索しこれを合成,共結晶化を試みたところ,そのうちのひとつが結晶の再現性および大きさを向上させ,その複合体について単波長異常分散法による位相決定に成功した.決定した構造をもとに,分子置換法によりそのほかの条件における構造を決定した.
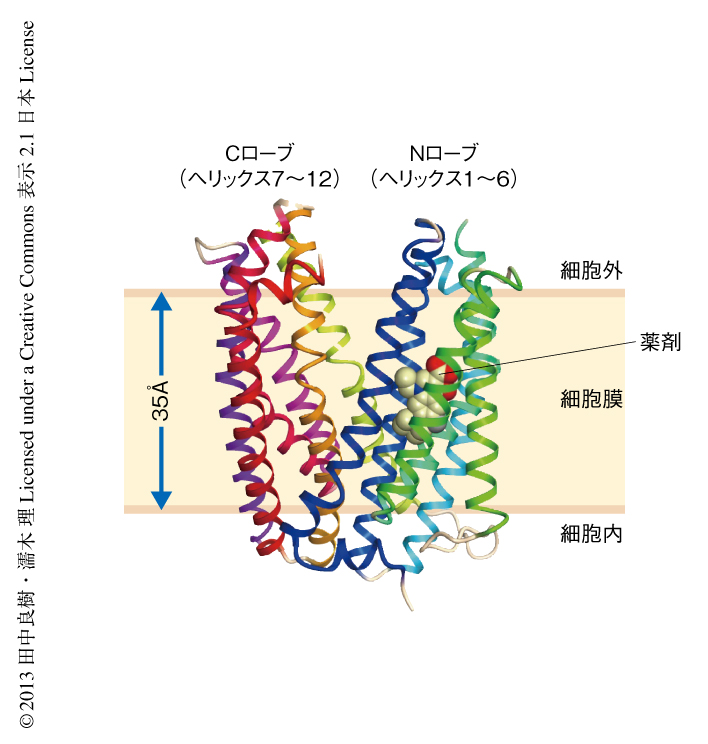
決定されたPfMATEの構造は,2つの単体の構造(PDB ID:3VVN,3VVO),輸送基質との複合体の構造(PDB ID:3VVP),3つの環状ペプチドとの複合体の構造(PDB ID:3VVQ,3VVR,3VVS),26番目のProをAlaに置換した変異体の単体での構造(PDB ID:3W4T)であった.それぞれの全体構造はいずれも,さきに構造の報告されたVibrio choleraeに由来するもの4) と同じく,Nローブ(ヘリックス1~ヘリックス6)とCローブ(ヘリックス7~ヘリックス12)の2つの対称性をもつヘリックス束が大きな内部空洞を形成し,それが細胞の外側に開いた構造をとっていた(図1).また,おのおのの膜貫通ヘリックスの配置もよく一致していた.一方,同時に示されていたNa+の結合位置については,周辺のアミノ酸残基は保存されておらず,PfMATEにおいてはかさ高い側鎖によりうめられていた.このことから,PfMATEはNa+ではなくH+の濃度勾配を利用するタイプであることが確認された.ゆえに,Na+結合位置の構造の違いは,陽イオンの輸送経路が輸送駆動力により異なることを示唆した.
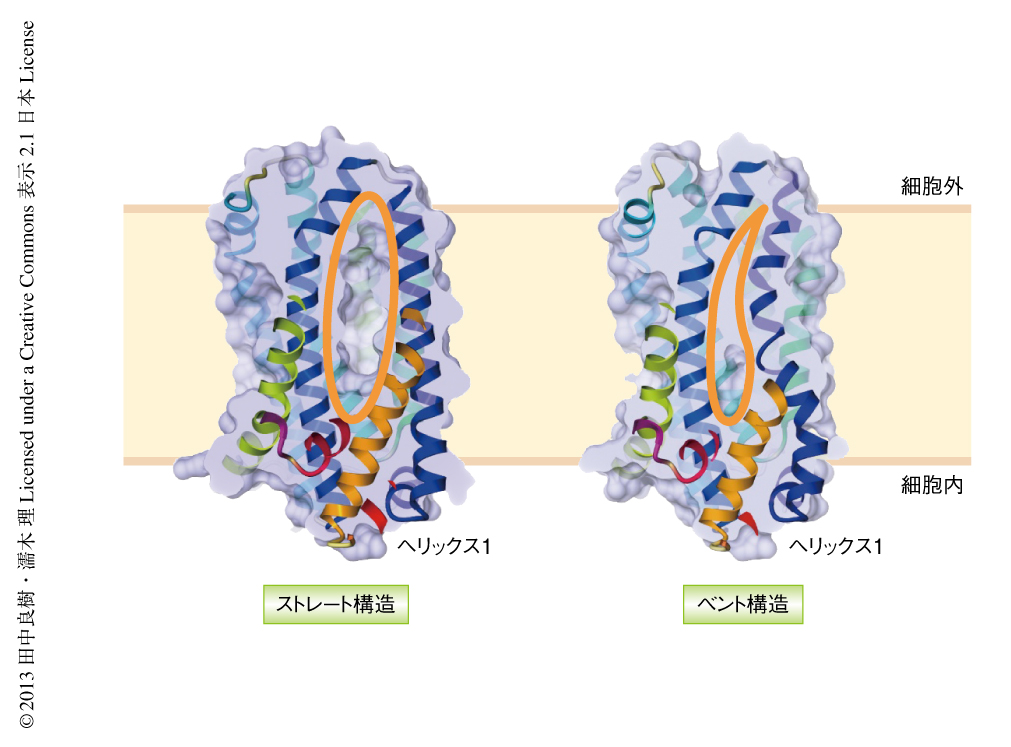
決定された構造はすべて,内部の空洞が細胞の外側に開いた構造であったが,部分的に構造の異なるものが発見された.そこで,この異なる2つの構造をヘリックス1の構造変化のようすから“ストレート構造”および“ベント構造”と名づけた(図2).この2つの構造では結晶化の条件が異なっており,前者はpH 7.0~8.0において,後者はpH 6.0付近において現われた.既知の構造に近く,ヘリックス1が真っ直ぐなストレート構造に対し,ベント構造ではヘリックス1は中間にあるPro26とGly30の位置で折れ曲がりヘリックス2に接近していた(プロリン残基は,その構造にαヘリックスを形成する水素結合のために必要な水素をもたないため,ヘリックスを壊すはたらきをもつ).この動きにより,Nローブの側にあった空間はつぶれてしまっていた(図2).また,ヘリックス5およびヘリックス6の細胞外側が外側にむけ曲げられており,NローブおよびCローブはより細胞の外側に開いていた.この構造変化の基点となっているアミノ酸残基のうち,Pro26はMATEファミリータンパク質の全体において高い保存性をもっており,これをAlaに変異させると輸送活性が失われた.また,このPro26の変異体についてpH 6.0の条件において複数の結晶構造を決定したが,すべてストレート構造をとっていた.以上のことから,Pro26によるヘリックス1の屈曲はMATEファミリータンパク質の輸送活性において重要な要素であることが示された.
ヘリックス1の屈曲によりもっとも大きくアミノ酸残基の再配置が起こったのは,Nローブの細胞外側の末端であった.この部位はアミノ酸残基の保存性が高い.ストレート構造において,Asp184は周囲のTyr37,Asn180,Thr202の側鎖と水素結合距離にあり,Asp41とは水素結合距離で近接していた.このように,酸性残基どうしが接近した状態,かつ,タンパク質の内部に安定な状態でいたことから,Asp184はプロトン化していると予測された.これは,電荷をもつ側鎖がタンパク質の内部のような絶縁的な環境にあることはエネルギー的に不安定であり,H+の結合による電気的な中和が必要であると考えられたためである.対して,Asp41は中央部に開いた溝の側に側鎖を露出しており,この構造ではイオン化していると考えられた.一方,ベント構造になると,露出していたAsp41がTyr139やThr202と水素結合を形成し,タンパク質の内部へ側鎖が入り込むかたちになり,かつ,Asp184との距離は同様に近いままであったことから,ベント構造にはAsp41とAsp184の両方のプロトン化が必要であると考えられた.この構造変化は結晶化のときのpH条件の違いとも関連しており,より酸性側,つまり,H+の多く存在する条件においてベント構造をとる結晶が得られたことと矛盾しない結果であった.また,この部位において水素結合ネットワークを構成するアミノ酸残基にAla変異を導入すると,いずれの場合もH+および薬剤の輸送活性を失った.以上のことから,Asp41のプロトン化が引き金となってNローブの細胞外側の末端のアミノ酸残基の配置が変化し,Pro26においてヘリックス1が折れ曲がり,ストレート構造からベント構造へと移行するという仮説を提唱した(図3).
疎水的なタンパク質の内部の空間には,脂質キュービック相法による結晶化に用いたモノオレインと考えられる電子密度が確認され,これらは疎水的な性質の輸送基質を擬態している可能性が考えられた.モノオレイン様の電子密度はストレート構造およびベント構造の両方の空洞において確認できた.とくに,ストレート構造の大きく開いたNローブ側の空間は基質が入り込むのに十分な容積があり,また,さきの構造変化により大きな変化が確認された部位でもあるため,ここが基質結合ポケットに相当すると予想した.そこで,基質の結合位置を確認するため,基質との共結晶化を試みた.数種類の輸送基質との共結晶化を行った結果,ノルフロキサシンの誘導体(ノルフロキサシンの6-フルオロ基をブロモ基に置換したもの)との複合体の構造を分解能2.9Åで決定した(図1,PDB ID:3VVP).予想されていたように,ストレート構造においてNローブ側の空間に電子密度が確認された.基質を配置したモデル構造から,ノルフロキサシン誘導体はおもに形状に相補的な認識をうけており,さらに,Gln34(ヘリックス1),Asn157(ヘリックス4),Asn180(ヘリックス5)の側鎖との水素結合の存在も予測された.この結果を確認するため,基質認識において関連の予測されたアミノ酸残基に対し点変異を導入し,基質輸送への影響をみた.その結果,ノルフロキサシンへの耐性は導入した変異の影響によりほぼ失われ,また,対向輸送されているH+の輸送も,Ser177のLeuへの置換,および,Met206のTyrへの置換の場合を除き失われていた.この2つの変異体においては,基質認識部位への大きな側鎖の導入により基質が入り込めなくなる一方で,擬似的な基質結合状態となり輸送サイクルの“空回り”が発生している可能性が考えられた.
以上のことから,ストレート構造からベント構造への構造変化は,基質結合ポケットを縮小し,タンパク質の内部に存在する基質を細胞の外側へと排出する役割を担っており,これは基質の排出の最終段階に相当すると考えられた.
複合体の構造解析に成功した環状ペプチドについて,薬剤排出機構との関連を調べるための実験を行った.まず,構造的な特徴について述べる.in vitroセレクション法により得られた環状ペプチドは,MaL6,MaD,MaD3Sであった.MaL6は17アミノ酸残基からなる大きな環状構造をもち,環の全体でβヘアピン構造を形成していた.一方,MaD5は7アミノ酸残基からなる環状構造と,安定した構造をとらない13アミノ酸残基のテイル部分から構成されていた.MaD3SはMaD5と同じ環状構造をもち,テイル部分が8アミノ酸残基に短縮されたものであった.いずれも内部の空洞が細胞の外側に開いた構造のPfMATEに結合していたが,環状ペプチドの結合部位はMaL6とMaD5(および,MaD3S)では大きく異なっており,前者は中央の溝の細胞外側の端にはさまるように,後者はさきに示した基質結合ポケットに環状部分が入り込んで結合していた.PfMATEとMaL6との複合体(PDB ID:3VVQ)は,さきに述べたように,単体での結晶化よりも結晶の再現性が向上し高分解能での構造決定が可能であった.これは,環状ペプチド自体が安定な構造をとることと,タンパク質のパッキングに邪魔しない結合様式であることによると思われた.一方,PfMATEとMaD5(PDB ID:3VVR)との複合体ではタンパク質の内部に結合した環状構造の部分の電子密度は確認できたものの,テイルの大部分は構造をとっていなかった.PfMATEとMaD3Sとの複合体(PDB ID:3VVS)でも同様であり,分解能はMaD5の場合と比べ向上したものの,やはりテイル部分の電子密度の観測にはいたらなかった.
それぞれの環状ペプチドの存在のもと,臭化エチジウムの蓄積量を基準にして活性を測定した.その結果,MaD5,MaD3S,MaL6の順に阻害活性は低くなっていることがわかった.MaL6のように内部の基質結合ポケットにまで入り込まなくても輸送が阻害されたことは,ロッカースイッチ機構5)(NローブとCローブとが剛体として可動して内開きと外開きの構造を行き来することにより,基質を輸送するしくみ)による構造変化を阻害し,その結果として輸送が阻害されることを示唆していた(図3).MaD5とMaD3Sは同様の結合様式でありながら,阻害活性はMaD5のほうが強かった.これは,結晶構造においてみえていないテイル部分が2つのローブのあいだに(一定の構造をとらず)強く結合することにより,構造変化を阻害しているものと予想された.環状構造の部分の結合は強さが不十分で,かつ,基質の排出機構により破壊されてしまう可能性があり,テイル部分の長さが阻害活性に影響したと考えられた.
今回の研究においては,複数の条件における結晶構造の決定に成功したことにより,Asp41のプロトン化からはじまるヘリックス1の構造変化が基質結合ポケットを縮小させることにより基質の排出が完結する,という仮説にたどりつくことができた(図3).これには,脂質キュービック相法による結晶化と,マイクロフォーカスX線ビームが欠かせない要素であった.脂質キュービック相法が筆者らの研究室に導入された2010年の段階では,その膜輸送体の結晶化への適用は未知数であり,少量でのスクリーニングを可能にする結晶化ロボットもわが国にはほとんど導入されていなかった.そのような段階で,Gタンパク質共役受容体について解析の経験のある京都大学大学院医学研究科の岩田研究室において脂質キュービック相法について学ぶことのできたこと,結晶化ロボットの導入がいち早くなされたことは僥倖であった.また,脂質キュービック相法による結晶は,分解能こそ高いものの微小であるため,単独の結晶からのデータセットの収集は不可能であると思われた.その測定を可能にしたのが,その年に稼働がはじまった大型放射光施設SPring-8のビームラインBL32XUであった.この段階では,膜貫通ヘリックスが構造変化することはまったく予想外のことであり,複数の結晶からデータを合成して構造解析することをめざしていた場合,より困難なことになっていただろう.研究を開始した当初はMATEファミリータンパク質の構造は未決定であり,“一番乗り”をめざして構造解析をはじめたわけであるが,2010年にさきをこされてしまった4).このときは論文と同じ程度の分解能の結晶を得ていた段階であり非常に落胆したが,“もっといい構造をだそう”との励ましにより,ここまで研究をつづけることができた.新しく開発された技術や装置に助けられながら成果を発表するにいたったことは,幸運の連続であったと感じている.
略歴:2012年 東京大学大学院理学系研究科 修了,同年より京都大学大学院医学研究科 特定研究員.
研究テーマ:膜タンパク質輸送体および膜タンパク質受容体の結晶構造解析.
抱負:最先端の技術を身につけ使いこなして,構造生物学の発展に寄与していきたい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2013 田中良樹・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:田中良樹,濡木 理
DOI: 10.7875/first.author.2013.052
Structural basis for the drug extrusion mechanism by a MATE multidrug transporter.
Yoshiki Tanaka, Christopher J. Hipolito, Andrés D. Maturana, Koichi Ito, Teruo Kuroda, Takashi Higuchi, Takayuki Katoh, Hideaki E. Kato, Motoyuki Hattori, Kaoru Kumazaki, Tomoya Tsukazaki, Ryuichiro Ishitani, Hiroaki Suga, Osamu Nureki
Nature, 496, 247-251 (2013)
要 約
MATEファミリータンパク質は生物界に広く存在する膜タンパク質輸送体であり,イオン濃度勾配を利用してさまざまな異物を細胞外へと排出することにより細胞の機能を維持している.そのため,病原細菌やがん細胞においては,薬剤を排出しその効果を低下させる薬剤耐性の一端を担うものであり,輸送機構の解明が望まれている.今回,筆者らは,好熱古細菌に由来するMATEファミリータンパク質の単体,基質との複合体,阻害活性ペプチドとの複合体のX線結晶構造を決定した.そして,膜貫通ヘリックスの1つが大きく折れ曲がることにより基質結合ポケットを縮小して基質を排出する構造変化を発見し,その輸送機構について新たな仮説を提唱した.
はじめに
近年,注目されている輸送体に薬物の能動的な排出系にかかわるものがある.これは細胞において毒性のある物質を細胞外へと積極的に排出するものである.これらの輸送体の特徴のひとつとして,構造および作用機序の異なる複数の薬剤を認識し排出できることがあげられる.このような輸送体は多剤排出輸送体と称され,原核生物から高等真核生物まで広く存在している.構造面からその作用機序を明らかにすることは,薬剤を効果的に使用するためにも重要な意味をもつ.
MATE(multidrug and toxic compound extrusion,多剤・毒性化合物排出)ファミリータンパク質は原核生物から高等真核生物にいたるまで広く保存されている多剤排出輸送体ファミリーのひとつである1).およそ450アミノ酸残基からなり,12の膜貫通ヘリックスをもち,薬剤をNa+もしくはH+の濃度勾配を利用した対向輸送により排出する.細菌における生化学的な研究から,おもな基質として陽イオン性の有機化合物が知られている.哺乳類においてもホモログとしてSLC47が同定されており,腎臓や肝臓において有機カチオン性化合物とH+とを対向輸送し,排泄の最終段階を担うことが知られている2).
この研究では,MATEファミリータンパク質が多様な基質を認識するしくみ,および,その排出機構について,X線結晶構造解析を用いた立体構造からの解明を試みた.
1.特殊ペプチドの探索と共結晶化の意義
20世紀前半から,抗菌作用など生理活性をもつ多くのペプチドが発見されてきている.これまでに発見された薬理作用をもつペプチドには,大環状構造や修飾ペプチド,D-アミノ酸など,特殊な構造およびアミノ酸残基をもつものが含まれており,それらが生理活性に重要であると考えられている.また,環状構造はペプチダーゼへの高い耐性を示すことが知られている.特殊ペプチドのスクリーニングは困難とされてきたが,標的とするタンパク質に高い結合能をもつ特殊ペプチドの探索を可能にするRaPID(random peptide integrated discovery)法が開発されている3).また,標的とするタンパク質に対し特異的に結合する抗体などはタンパク質の構造の安定化や結晶パッキングを補助し,結晶の成長を促進することが知られている.膜タンパク質への高い結合能をもつ特殊ペプチドは,薬剤としての可能性だけでなく,結合により構造を安定化させる結晶構造解析においての補助手段としても期待されている.今後のペプチド創薬や構造解析への利用のためには,共結晶化による複合体の構造の解明が必要であると考えられる.
2.MATEファミリータンパク質の発現と構造決定
膜タンパク質における解析の困難さは,その発現量の少なさと安定性の低さに起因するところが大きい.そこで今回の研究では,MATEファミリータンパク質が原核生物から古細菌,真核生物とひろく存在していることから,好熱性古細菌を中心として発現スクリーニングを行った.好熱性の生物を構成するタンパク質は高温においても安定な構造を保つため,精製や結晶化において有利なことが多い.最終的に,そのなかからPyrococcus furiosusに由来するMATEファミリータンパク質(PfMATE)を構造解析の対象として選択した.PfMATEを大腸菌C41(DE3)株を使用して大量発現し,精製して結晶化に供した.結晶化法としては,脂質のなかに膜タンパク質を再構成してから結晶化する脂質キュービック相法を適用した.なお,脂質キュービック相法を導入する以前から,蒸気拡散法により結晶は得られてはいたものの,構造決定に必要な分解能をもつ回折データを得ることはできていなかった.脂質キュービック相法により得られたPfMATEの結晶は最高でも長辺30μmと構造解析にあたっては微小であったが,大型放射光施設SPring-8のビームラインBL32XUにおいてマイクロフォーカスX線ビームを利用することにより,単独の結晶から高分解能データセット(分解能2.1~3.0Å)の収集に成功した.分子置換法による構造決定に失敗したため,位相決定はセレノメチオニン置換体の結晶を用いることにした.しかしこのとき,セレノメチオニン置換体の結晶は成長が悪く,解析に必要なだけのデータ収集が不可能であった.そこで,特異的な結合能をもつチオエステル化大環状ペプチドをin vitroセレクション法により探索しこれを合成,共結晶化を試みたところ,そのうちのひとつが結晶の再現性および大きさを向上させ,その複合体について単波長異常分散法による位相決定に成功した.決定した構造をもとに,分子置換法によりそのほかの条件における構造を決定した.
3.全体の構造および既知の構造との比較
決定されたPfMATEの構造は,2つの単体の構造(PDB ID:3VVN,3VVO),輸送基質との複合体の構造(PDB ID:3VVP),3つの環状ペプチドとの複合体の構造(PDB ID:3VVQ,3VVR,3VVS),26番目のProをAlaに置換した変異体の単体での構造(PDB ID:3W4T)であった.それぞれの全体構造はいずれも,さきに構造の報告されたVibrio choleraeに由来するもの4) と同じく,Nローブ(ヘリックス1~ヘリックス6)とCローブ(ヘリックス7~ヘリックス12)の2つの対称性をもつヘリックス束が大きな内部空洞を形成し,それが細胞の外側に開いた構造をとっていた(図1).また,おのおのの膜貫通ヘリックスの配置もよく一致していた.一方,同時に示されていたNa+の結合位置については,周辺のアミノ酸残基は保存されておらず,PfMATEにおいてはかさ高い側鎖によりうめられていた.このことから,PfMATEはNa+ではなくH+の濃度勾配を利用するタイプであることが確認された.ゆえに,Na+結合位置の構造の違いは,陽イオンの輸送経路が輸送駆動力により異なることを示唆した.
4.膜貫通ヘリックスの構造変化と酸性残基のプロトン化
決定された構造はすべて,内部の空洞が細胞の外側に開いた構造であったが,部分的に構造の異なるものが発見された.そこで,この異なる2つの構造をヘリックス1の構造変化のようすから“ストレート構造”および“ベント構造”と名づけた(図2).この2つの構造では結晶化の条件が異なっており,前者はpH 7.0~8.0において,後者はpH 6.0付近において現われた.既知の構造に近く,ヘリックス1が真っ直ぐなストレート構造に対し,ベント構造ではヘリックス1は中間にあるPro26とGly30の位置で折れ曲がりヘリックス2に接近していた(プロリン残基は,その構造にαヘリックスを形成する水素結合のために必要な水素をもたないため,ヘリックスを壊すはたらきをもつ).この動きにより,Nローブの側にあった空間はつぶれてしまっていた(図2).また,ヘリックス5およびヘリックス6の細胞外側が外側にむけ曲げられており,NローブおよびCローブはより細胞の外側に開いていた.この構造変化の基点となっているアミノ酸残基のうち,Pro26はMATEファミリータンパク質の全体において高い保存性をもっており,これをAlaに変異させると輸送活性が失われた.また,このPro26の変異体についてpH 6.0の条件において複数の結晶構造を決定したが,すべてストレート構造をとっていた.以上のことから,Pro26によるヘリックス1の屈曲はMATEファミリータンパク質の輸送活性において重要な要素であることが示された.
ヘリックス1の屈曲によりもっとも大きくアミノ酸残基の再配置が起こったのは,Nローブの細胞外側の末端であった.この部位はアミノ酸残基の保存性が高い.ストレート構造において,Asp184は周囲のTyr37,Asn180,Thr202の側鎖と水素結合距離にあり,Asp41とは水素結合距離で近接していた.このように,酸性残基どうしが接近した状態,かつ,タンパク質の内部に安定な状態でいたことから,Asp184はプロトン化していると予測された.これは,電荷をもつ側鎖がタンパク質の内部のような絶縁的な環境にあることはエネルギー的に不安定であり,H+の結合による電気的な中和が必要であると考えられたためである.対して,Asp41は中央部に開いた溝の側に側鎖を露出しており,この構造ではイオン化していると考えられた.一方,ベント構造になると,露出していたAsp41がTyr139やThr202と水素結合を形成し,タンパク質の内部へ側鎖が入り込むかたちになり,かつ,Asp184との距離は同様に近いままであったことから,ベント構造にはAsp41とAsp184の両方のプロトン化が必要であると考えられた.この構造変化は結晶化のときのpH条件の違いとも関連しており,より酸性側,つまり,H+の多く存在する条件においてベント構造をとる結晶が得られたことと矛盾しない結果であった.また,この部位において水素結合ネットワークを構成するアミノ酸残基にAla変異を導入すると,いずれの場合もH+および薬剤の輸送活性を失った.以上のことから,Asp41のプロトン化が引き金となってNローブの細胞外側の末端のアミノ酸残基の配置が変化し,Pro26においてヘリックス1が折れ曲がり,ストレート構造からベント構造へと移行するという仮説を提唱した(図3).
5.基質結合ポケット
疎水的なタンパク質の内部の空間には,脂質キュービック相法による結晶化に用いたモノオレインと考えられる電子密度が確認され,これらは疎水的な性質の輸送基質を擬態している可能性が考えられた.モノオレイン様の電子密度はストレート構造およびベント構造の両方の空洞において確認できた.とくに,ストレート構造の大きく開いたNローブ側の空間は基質が入り込むのに十分な容積があり,また,さきの構造変化により大きな変化が確認された部位でもあるため,ここが基質結合ポケットに相当すると予想した.そこで,基質の結合位置を確認するため,基質との共結晶化を試みた.数種類の輸送基質との共結晶化を行った結果,ノルフロキサシンの誘導体(ノルフロキサシンの6-フルオロ基をブロモ基に置換したもの)との複合体の構造を分解能2.9Åで決定した(図1,PDB ID:3VVP).予想されていたように,ストレート構造においてNローブ側の空間に電子密度が確認された.基質を配置したモデル構造から,ノルフロキサシン誘導体はおもに形状に相補的な認識をうけており,さらに,Gln34(ヘリックス1),Asn157(ヘリックス4),Asn180(ヘリックス5)の側鎖との水素結合の存在も予測された.この結果を確認するため,基質認識において関連の予測されたアミノ酸残基に対し点変異を導入し,基質輸送への影響をみた.その結果,ノルフロキサシンへの耐性は導入した変異の影響によりほぼ失われ,また,対向輸送されているH+の輸送も,Ser177のLeuへの置換,および,Met206のTyrへの置換の場合を除き失われていた.この2つの変異体においては,基質認識部位への大きな側鎖の導入により基質が入り込めなくなる一方で,擬似的な基質結合状態となり輸送サイクルの“空回り”が発生している可能性が考えられた.
以上のことから,ストレート構造からベント構造への構造変化は,基質結合ポケットを縮小し,タンパク質の内部に存在する基質を細胞の外側へと排出する役割を担っており,これは基質の排出の最終段階に相当すると考えられた.
6.環状ペプチドによる輸送阻害の機構
複合体の構造解析に成功した環状ペプチドについて,薬剤排出機構との関連を調べるための実験を行った.まず,構造的な特徴について述べる.in vitroセレクション法により得られた環状ペプチドは,MaL6,MaD,MaD3Sであった.MaL6は17アミノ酸残基からなる大きな環状構造をもち,環の全体でβヘアピン構造を形成していた.一方,MaD5は7アミノ酸残基からなる環状構造と,安定した構造をとらない13アミノ酸残基のテイル部分から構成されていた.MaD3SはMaD5と同じ環状構造をもち,テイル部分が8アミノ酸残基に短縮されたものであった.いずれも内部の空洞が細胞の外側に開いた構造のPfMATEに結合していたが,環状ペプチドの結合部位はMaL6とMaD5(および,MaD3S)では大きく異なっており,前者は中央の溝の細胞外側の端にはさまるように,後者はさきに示した基質結合ポケットに環状部分が入り込んで結合していた.PfMATEとMaL6との複合体(PDB ID:3VVQ)は,さきに述べたように,単体での結晶化よりも結晶の再現性が向上し高分解能での構造決定が可能であった.これは,環状ペプチド自体が安定な構造をとることと,タンパク質のパッキングに邪魔しない結合様式であることによると思われた.一方,PfMATEとMaD5(PDB ID:3VVR)との複合体ではタンパク質の内部に結合した環状構造の部分の電子密度は確認できたものの,テイルの大部分は構造をとっていなかった.PfMATEとMaD3Sとの複合体(PDB ID:3VVS)でも同様であり,分解能はMaD5の場合と比べ向上したものの,やはりテイル部分の電子密度の観測にはいたらなかった.
それぞれの環状ペプチドの存在のもと,臭化エチジウムの蓄積量を基準にして活性を測定した.その結果,MaD5,MaD3S,MaL6の順に阻害活性は低くなっていることがわかった.MaL6のように内部の基質結合ポケットにまで入り込まなくても輸送が阻害されたことは,ロッカースイッチ機構5)(NローブとCローブとが剛体として可動して内開きと外開きの構造を行き来することにより,基質を輸送するしくみ)による構造変化を阻害し,その結果として輸送が阻害されることを示唆していた(図3).MaD5とMaD3Sは同様の結合様式でありながら,阻害活性はMaD5のほうが強かった.これは,結晶構造においてみえていないテイル部分が2つのローブのあいだに(一定の構造をとらず)強く結合することにより,構造変化を阻害しているものと予想された.環状構造の部分の結合は強さが不十分で,かつ,基質の排出機構により破壊されてしまう可能性があり,テイル部分の長さが阻害活性に影響したと考えられた.
おわりに
今回の研究においては,複数の条件における結晶構造の決定に成功したことにより,Asp41のプロトン化からはじまるヘリックス1の構造変化が基質結合ポケットを縮小させることにより基質の排出が完結する,という仮説にたどりつくことができた(図3).これには,脂質キュービック相法による結晶化と,マイクロフォーカスX線ビームが欠かせない要素であった.脂質キュービック相法が筆者らの研究室に導入された2010年の段階では,その膜輸送体の結晶化への適用は未知数であり,少量でのスクリーニングを可能にする結晶化ロボットもわが国にはほとんど導入されていなかった.そのような段階で,Gタンパク質共役受容体について解析の経験のある京都大学大学院医学研究科の岩田研究室において脂質キュービック相法について学ぶことのできたこと,結晶化ロボットの導入がいち早くなされたことは僥倖であった.また,脂質キュービック相法による結晶は,分解能こそ高いものの微小であるため,単独の結晶からのデータセットの収集は不可能であると思われた.その測定を可能にしたのが,その年に稼働がはじまった大型放射光施設SPring-8のビームラインBL32XUであった.この段階では,膜貫通ヘリックスが構造変化することはまったく予想外のことであり,複数の結晶からデータを合成して構造解析することをめざしていた場合,より困難なことになっていただろう.研究を開始した当初はMATEファミリータンパク質の構造は未決定であり,“一番乗り”をめざして構造解析をはじめたわけであるが,2010年にさきをこされてしまった4).このときは論文と同じ程度の分解能の結晶を得ていた段階であり非常に落胆したが,“もっといい構造をだそう”との励ましにより,ここまで研究をつづけることができた.新しく開発された技術や装置に助けられながら成果を発表するにいたったことは,幸運の連続であったと感じている.
文 献
- Brown, M. H., Paulsen, I. T. & Skurray, R. A.: The multidrug efflux protein NorM is a prototype of a new family of transporters. Mol. Microbiol., 31, 394-395 (1999)[PubMed]
- Damme, K., Nies, A. T., Schaeffeler, E. et al.: Mammalian MATE (SLC47A) transport proteins: impact on efflux of endogenous substrates and xenobiotics. Drug Metab. Rev., 43, 499-523 (2011)[PubMed]
- Yamagishi, Y., Shoji, I., Miyagawa, S. et al.: Natural product-like macrocyclic N-methyl-peptide inhibitors against a ubiquitin ligase uncovered from a ribosome-expressed de novo library. Chem. Biol., 18, 1562-1570 (2011)[PubMed]
- He, X., Szewczyk, P., Karyakin, A. et al.: Structure of a cation-bound multidrug and toxic compound extrusion transporter. Nature, 467, 991-994 (2010)[PubMed]
- Law, C. J., Maloney, P. C. & Wang, D. N.: Ins and outs of major facilitator superfamily antiporters. Annu. Rev. Microbiol., 62, 289-305 (2008)[PubMed]
著者プロフィール
略歴:2012年 東京大学大学院理学系研究科 修了,同年より京都大学大学院医学研究科 特定研究員.
研究テーマ:膜タンパク質輸送体および膜タンパク質受容体の結晶構造解析.
抱負:最先端の技術を身につけ使いこなして,構造生物学の発展に寄与していきたい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2013 田中良樹・濡木 理 Licensed under CC 表示 2.1 日本