DEPDC5遺伝子の変異が常染色体優性焦点性てんかんをひき起こす
石田 紗恵子
(フランスNational Institute for Health and Medical Research,Brain & Spine Institute)
email:石田紗恵子
DOI: 10.7875/first.author.2013.047
Mutations of DEPDC5 cause autosomal dominant focal epilepsies.
Saeko Ishida, Fabienne Picard, Gabrielle Rudolf, Eric Noé, Guillaume Achaz, Pierre Thomas, Pierre Genton, Emeline Mundwiller, Markus Wolff, Christian Marescaux, Richard Miles, Michel Baulac, Edouard Hirsch, Eric Leguern, Stéphanie Baulac
Nature Genetics, 45, 552-555 (2013)
常染色体優性夜間前頭葉てんかん,家族性側頭葉てんかん,多様な焦点を示す家族性焦点性てんかんは,主要な家族性焦点性てんかんである.筆者らは,多様な焦点を示す家族性焦点性てんかんの家系の連鎖解析と全エクソーム解析から,DEPDC5遺伝子のフレームシフト変異を同定した.また,そのほか15の焦点性てんかんの家系において,次世代シークエンサーによりDEPDC5遺伝子の変異を解析したところ,4つのナンセンス変異と1つのミスセンス変異を見い出した.DEPDC5遺伝子の変異は焦点性てんかんの家系の約37%において認められ,その機能欠損によりてんかんをひき起こしている可能性が示唆された.DEPDC5はDEPドメインをもつが,このDEPドメインは膜輸送やGタンパク質シグナル伝達系に関与する多くのタンパク質に認められる.
大脳のニューロンの過剰な放電に由来する反復性の発作を主徴とするてんかんは,人口の約1%に生じる頻度の高い神経疾患である.しかしながら,多くの場合に根本的な治療法はなく,抗てんかん薬を長期間にわたり服用する対症療法にたよらざるをえない.近年,腫瘍などの病変が認められない非病変性てんかんの病因として,特定の遺伝子の変異が報告されている.新たな原因遺伝子の同定およびその分子機構の解明により,新たな予防法および治療法の開発につながることが期待されている.
焦点性てんかんは発作の起始が脳の一部分に限局するてんかんである.このうち,常染色体優性夜間前頭葉てんかんの原因遺伝子として,CHRNA4遺伝子,CHRNA2遺伝子,CHRNB2遺伝子,KCNT1遺伝子が1,2),また,家族性側頭葉てんかんに分類される聴覚症状をともなう常染色体優性てんかんにはLGI1遺伝子の変異が報告されている3).しかしながら,同じく焦点性てんかんに分類される多様な焦点を示す家族性焦点性てんかんには,染色体22q12に連鎖部位が報告されているものの4-8),これまで原因遺伝子は報告されていない.
筆者らは,これまでに,常染色体優性遺伝形式を呈する焦点性てんかん19家系における脳波・臨床症候群について報告している9).このうち,多様な焦点を示す家族性焦点性てんかんの2つの家系において高密度ゲノムワイドスキャンを用いた連鎖解析を行ったところ,先行研究と同様に,染色体22q12に連鎖部位を確認した.そこで,同じ家系に属する2名の患者において全エクソーム解析を行った.その結果,染色体22q12に位置するDEPDC5(DEP domain-containing protein 5)遺伝子に1塩基の欠失変異を見い出した.この変異はフレームシフトをひき起こし読み枠の途中に終止コドンを生じるものであった.同じ家系のほかの家族に対してSanger法によるシークエンスによりDEPDC5遺伝子の変異解析を行ったところ,この変異は同じ家系においててんかんの症状と共分離していた.
連鎖解析に用いたもう一方の多様な焦点を示す家族性焦点性てんかんの家系を含めた15の常染色体優性焦点性てんかん家系において,次世代シークエンサーによりDEPDC5遺伝子の変異を探索した.その結果,新たに5つの家系において4つのナンセンス変異と1つのミスセンス変異を発見した.それぞれの変異は,ほかの家族のメンバーのサンプルが有用でなかった1つの家系を除き,すべての家系においててんかんの症状との共分離が確認された.
今回,発見された6つの変異とも,dbSNP135,1000 Genomes Project,Exome Variant Serverといった一塩基多型データベースにおいて報告されていない未知の変異であった.Exome Variant Serverには,これまでDEPDC5遺伝子において,1つのナンセンス変異,および,1つのフレームシフト変異が報告されている.また,Database of Genomic VariantsにはDEPDC5遺伝子のコード配列を欠損させるようなコピー数多型は報告されていない.ゆえに,DEPDC5遺伝子の変異は調査した家系において,てんかんの患者に顕著に高い頻度で認められるといえた.
ミスセンス変異の同定されたDEPDC5の485番目のアルギニン残基は,昆虫からヒトまできわめてよく保存されていた.また,アミノ酸変異がタンパク質の機能にあたえる影響を予測するMutationTaster,SIFT,PolyPhen2といったソフトフェアは,それぞれ,このミスセンス変異をdisease causing,Tolerated,possibly damagingと予測しており,この変異がDEPDC5の機能になんらかの影響をあたえていることが推測された.
今回,発見されたフレームシフト変異およびナンセンス変異では読み枠の途中に終止コドンが生じた.ナンセンス変異依存mRNA分解(nonsense-mediated mRNA decay:NMD)はこのような終止コドンをもつ異常なmRNAを識別し分解除去する機構であり,正常なmRNAを翻訳するためのRNA品質管理機構のひとつである.最後のエキソンに位置する1つのナンセンス変異を除き,ほかの変異ではNMDがはたらいていると予想された.そこで,239番目のアルギニン残基におけるナンセンス変異をもつてんかんの患者および健常者のリンパ芽球を用いて,NMDの検証実験を行った.おのおののリンパ芽球をNMDを抑制する薬剤Emetineの処理もしくは非処理のもと,1晩の培養を行った.そののち,それぞれからRNAを抽出,RT-PCR法によりcDNAを合成し,Sanger法によるシークエンシングにより塩基配列を確認した.その結果,Emetineで処理されたナンセンス変異をもつリンパ芽球においてのみ,この変異をもつ配列が認められ,この変異がNMDをひき起こしていることが示された.
以上のことから,一方の対立遺伝子におけるDEPDC5遺伝子の変異によりDEPDC5の量が半分に減少し遺伝子の機能を喪失するハプロ不全が,焦点性てんかんの主要な病因のひとつであることが示唆された.
この研究では,コホートのうち1/3の家系においてDEPDC5遺伝子の変異を確認した.DEPDC5遺伝子の変異は多様な焦点を示す家族性焦点性てんかんの家系のみならず,常染色体優性夜間前頭葉てんかんや家族性側頭葉てんかんの家系からも同定された.これは,1つの遺伝子であるDEPDC5遺伝子がさまざまな焦点性てんかんの発症機構において共通の役割を担っていることを示す重要な発見であった.
DEPDC5遺伝子の転写産物はヒトの脳のcDNAライブラリーにおいて最初に発見された.また,DEPDC5遺伝子の転写産物はHuman Brain Transcriptome Databaseにおいて,ヒトの発達期および成人の脳における発現が示されている.これらはDEPDC5遺伝子がてんかんの発症機序にかかわることと一致した.
これまで,てんかん原因遺伝子として報告されてきた遺伝子の多くはイオンチャネル関連遺伝子,もしくは,伝達物質受容体のサブユニットである.聴覚症状をともなう常染色体優性てんかんの原因遺伝子として報告されているLGI1(leucine-rich, glioma inactivated 1)遺伝子は,そのいずれでもない遺伝子として最初に発見された.DEPDC5は膜貫通ドメインをもたないことが予測され,イオンチャネルとの相同性はないと考えられた.DEPDC5遺伝子はLGI1遺伝子についで2番目に発見された,新しいタイプのてんかん原因遺伝子となり,そのてんかんの発症機序は既知のものとは異なることが推測された.
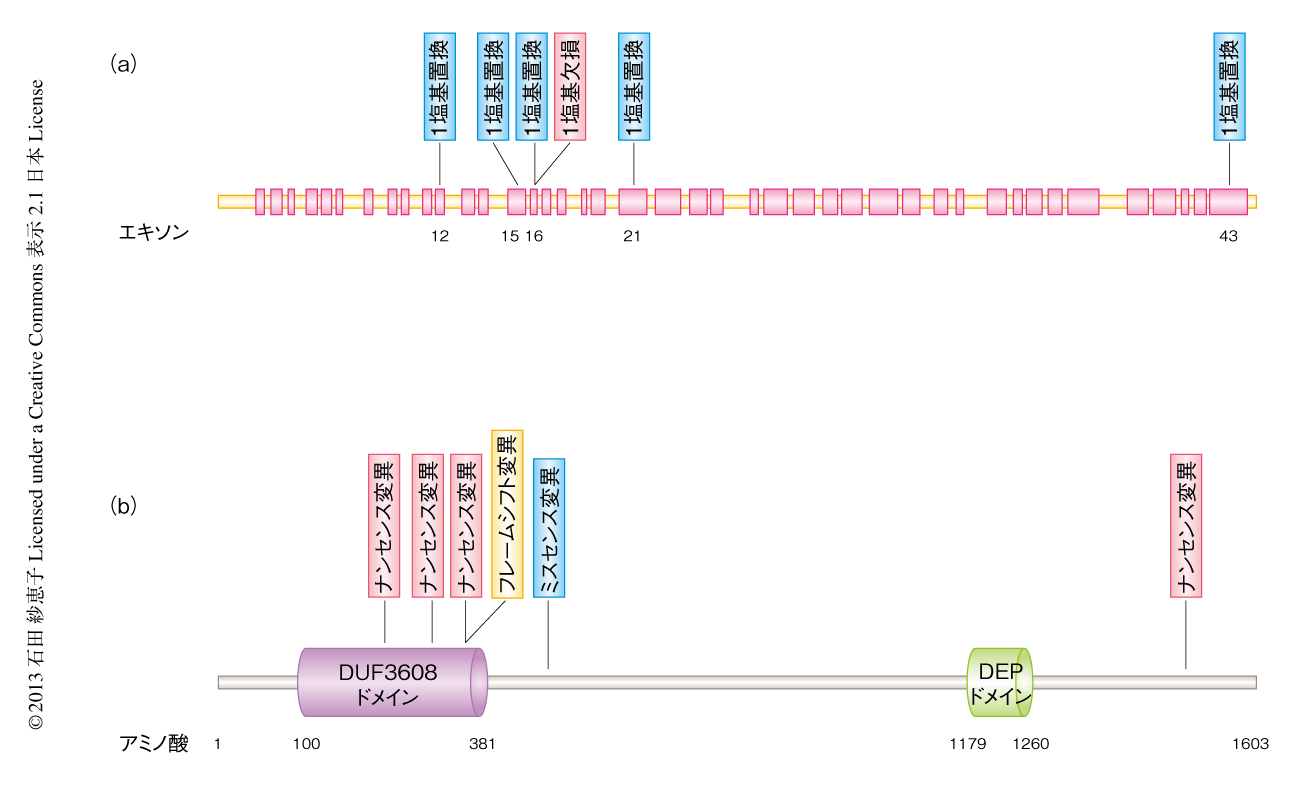
DEPDC5はそのN末端側に機能未知のDUF3608ドメイン,C末端側にDEPドメインをもつ(図1).DEPドメインはGタンパク質シグナル伝達系に関与する多くのタンパク質に認められている.また,出芽酵母におけるDEPDC5のホモログであるYjr138p(SEA1)は,膜輸送にかかわるSEA複合体の構成タンパク質である10).DEPDC5遺伝子は発がんの過程への関与も報告されており,2つの膠芽腫における欠失11) や,イントロンに存在するSNPと肝がんの発症リスクとの関連12) が報告されている.しかしながら,DEPDC5遺伝子の明確な機能はいまだ明らかにされていない.
今後のDEPDC5遺伝子の機能解析,および,てんかんの発症機序の解明は,焦点性てんかんのみならず,未解明の多くのてんかんの発症機序の解明に新たな知見を提供し,てんかんの治療法および予防法の開発に貢献すると期待される.
略歴:2012年 京都大学大学院医学研究科博士課程 修了,同 特定研究員を経て,フランスNational Institute for Health and Medical Research研究員.
研究テーマ:ヒトにおけるてんかん原因遺伝子の探索とその機能解析.てんかんモデル動物の表現型の解析.
抱負:ヒト神経疾患のよりよい予防法および治療法の開発につながる研究をめざす.
© 2013 石田 紗恵子 Licensed under CC 表示 2.1 日本
(フランスNational Institute for Health and Medical Research,Brain & Spine Institute)
email:石田紗恵子
DOI: 10.7875/first.author.2013.047
Mutations of DEPDC5 cause autosomal dominant focal epilepsies.
Saeko Ishida, Fabienne Picard, Gabrielle Rudolf, Eric Noé, Guillaume Achaz, Pierre Thomas, Pierre Genton, Emeline Mundwiller, Markus Wolff, Christian Marescaux, Richard Miles, Michel Baulac, Edouard Hirsch, Eric Leguern, Stéphanie Baulac
Nature Genetics, 45, 552-555 (2013)
要 約
常染色体優性夜間前頭葉てんかん,家族性側頭葉てんかん,多様な焦点を示す家族性焦点性てんかんは,主要な家族性焦点性てんかんである.筆者らは,多様な焦点を示す家族性焦点性てんかんの家系の連鎖解析と全エクソーム解析から,DEPDC5遺伝子のフレームシフト変異を同定した.また,そのほか15の焦点性てんかんの家系において,次世代シークエンサーによりDEPDC5遺伝子の変異を解析したところ,4つのナンセンス変異と1つのミスセンス変異を見い出した.DEPDC5遺伝子の変異は焦点性てんかんの家系の約37%において認められ,その機能欠損によりてんかんをひき起こしている可能性が示唆された.DEPDC5はDEPドメインをもつが,このDEPドメインは膜輸送やGタンパク質シグナル伝達系に関与する多くのタンパク質に認められる.
はじめに
大脳のニューロンの過剰な放電に由来する反復性の発作を主徴とするてんかんは,人口の約1%に生じる頻度の高い神経疾患である.しかしながら,多くの場合に根本的な治療法はなく,抗てんかん薬を長期間にわたり服用する対症療法にたよらざるをえない.近年,腫瘍などの病変が認められない非病変性てんかんの病因として,特定の遺伝子の変異が報告されている.新たな原因遺伝子の同定およびその分子機構の解明により,新たな予防法および治療法の開発につながることが期待されている.
焦点性てんかんは発作の起始が脳の一部分に限局するてんかんである.このうち,常染色体優性夜間前頭葉てんかんの原因遺伝子として,CHRNA4遺伝子,CHRNA2遺伝子,CHRNB2遺伝子,KCNT1遺伝子が1,2),また,家族性側頭葉てんかんに分類される聴覚症状をともなう常染色体優性てんかんにはLGI1遺伝子の変異が報告されている3).しかしながら,同じく焦点性てんかんに分類される多様な焦点を示す家族性焦点性てんかんには,染色体22q12に連鎖部位が報告されているものの4-8),これまで原因遺伝子は報告されていない.
1.多様な焦点を示す家族性焦点性てんかんの家系からDEPDC5遺伝子の変異を同定した
筆者らは,これまでに,常染色体優性遺伝形式を呈する焦点性てんかん19家系における脳波・臨床症候群について報告している9).このうち,多様な焦点を示す家族性焦点性てんかんの2つの家系において高密度ゲノムワイドスキャンを用いた連鎖解析を行ったところ,先行研究と同様に,染色体22q12に連鎖部位を確認した.そこで,同じ家系に属する2名の患者において全エクソーム解析を行った.その結果,染色体22q12に位置するDEPDC5(DEP domain-containing protein 5)遺伝子に1塩基の欠失変異を見い出した.この変異はフレームシフトをひき起こし読み枠の途中に終止コドンを生じるものであった.同じ家系のほかの家族に対してSanger法によるシークエンスによりDEPDC5遺伝子の変異解析を行ったところ,この変異は同じ家系においててんかんの症状と共分離していた.
2.ほかの常染色体優性焦点性てんかんの家系からもDEPDC5遺伝子の変異を同定した
連鎖解析に用いたもう一方の多様な焦点を示す家族性焦点性てんかんの家系を含めた15の常染色体優性焦点性てんかん家系において,次世代シークエンサーによりDEPDC5遺伝子の変異を探索した.その結果,新たに5つの家系において4つのナンセンス変異と1つのミスセンス変異を発見した.それぞれの変異は,ほかの家族のメンバーのサンプルが有用でなかった1つの家系を除き,すべての家系においててんかんの症状との共分離が確認された.
3.同定されたDEPDC5遺伝子の変異はてんかんの患者に顕著に認められる
今回,発見された6つの変異とも,dbSNP135,1000 Genomes Project,Exome Variant Serverといった一塩基多型データベースにおいて報告されていない未知の変異であった.Exome Variant Serverには,これまでDEPDC5遺伝子において,1つのナンセンス変異,および,1つのフレームシフト変異が報告されている.また,Database of Genomic VariantsにはDEPDC5遺伝子のコード配列を欠損させるようなコピー数多型は報告されていない.ゆえに,DEPDC5遺伝子の変異は調査した家系において,てんかんの患者に顕著に高い頻度で認められるといえた.
4.DEPDC5遺伝子のハプロ不全が焦点性てんかんのおもな病因のひとつである
ミスセンス変異の同定されたDEPDC5の485番目のアルギニン残基は,昆虫からヒトまできわめてよく保存されていた.また,アミノ酸変異がタンパク質の機能にあたえる影響を予測するMutationTaster,SIFT,PolyPhen2といったソフトフェアは,それぞれ,このミスセンス変異をdisease causing,Tolerated,possibly damagingと予測しており,この変異がDEPDC5の機能になんらかの影響をあたえていることが推測された.
今回,発見されたフレームシフト変異およびナンセンス変異では読み枠の途中に終止コドンが生じた.ナンセンス変異依存mRNA分解(nonsense-mediated mRNA decay:NMD)はこのような終止コドンをもつ異常なmRNAを識別し分解除去する機構であり,正常なmRNAを翻訳するためのRNA品質管理機構のひとつである.最後のエキソンに位置する1つのナンセンス変異を除き,ほかの変異ではNMDがはたらいていると予想された.そこで,239番目のアルギニン残基におけるナンセンス変異をもつてんかんの患者および健常者のリンパ芽球を用いて,NMDの検証実験を行った.おのおののリンパ芽球をNMDを抑制する薬剤Emetineの処理もしくは非処理のもと,1晩の培養を行った.そののち,それぞれからRNAを抽出,RT-PCR法によりcDNAを合成し,Sanger法によるシークエンシングにより塩基配列を確認した.その結果,Emetineで処理されたナンセンス変異をもつリンパ芽球においてのみ,この変異をもつ配列が認められ,この変異がNMDをひき起こしていることが示された.
以上のことから,一方の対立遺伝子におけるDEPDC5遺伝子の変異によりDEPDC5の量が半分に減少し遺伝子の機能を喪失するハプロ不全が,焦点性てんかんの主要な病因のひとつであることが示唆された.
おわりに
この研究では,コホートのうち1/3の家系においてDEPDC5遺伝子の変異を確認した.DEPDC5遺伝子の変異は多様な焦点を示す家族性焦点性てんかんの家系のみならず,常染色体優性夜間前頭葉てんかんや家族性側頭葉てんかんの家系からも同定された.これは,1つの遺伝子であるDEPDC5遺伝子がさまざまな焦点性てんかんの発症機構において共通の役割を担っていることを示す重要な発見であった.
DEPDC5遺伝子の転写産物はヒトの脳のcDNAライブラリーにおいて最初に発見された.また,DEPDC5遺伝子の転写産物はHuman Brain Transcriptome Databaseにおいて,ヒトの発達期および成人の脳における発現が示されている.これらはDEPDC5遺伝子がてんかんの発症機序にかかわることと一致した.
これまで,てんかん原因遺伝子として報告されてきた遺伝子の多くはイオンチャネル関連遺伝子,もしくは,伝達物質受容体のサブユニットである.聴覚症状をともなう常染色体優性てんかんの原因遺伝子として報告されているLGI1(leucine-rich, glioma inactivated 1)遺伝子は,そのいずれでもない遺伝子として最初に発見された.DEPDC5は膜貫通ドメインをもたないことが予測され,イオンチャネルとの相同性はないと考えられた.DEPDC5遺伝子はLGI1遺伝子についで2番目に発見された,新しいタイプのてんかん原因遺伝子となり,そのてんかんの発症機序は既知のものとは異なることが推測された.
DEPDC5はそのN末端側に機能未知のDUF3608ドメイン,C末端側にDEPドメインをもつ(図1).DEPドメインはGタンパク質シグナル伝達系に関与する多くのタンパク質に認められている.また,出芽酵母におけるDEPDC5のホモログであるYjr138p(SEA1)は,膜輸送にかかわるSEA複合体の構成タンパク質である10).DEPDC5遺伝子は発がんの過程への関与も報告されており,2つの膠芽腫における欠失11) や,イントロンに存在するSNPと肝がんの発症リスクとの関連12) が報告されている.しかしながら,DEPDC5遺伝子の明確な機能はいまだ明らかにされていない.
今後のDEPDC5遺伝子の機能解析,および,てんかんの発症機序の解明は,焦点性てんかんのみならず,未解明の多くのてんかんの発症機序の解明に新たな知見を提供し,てんかんの治療法および予防法の開発に貢献すると期待される.
文 献
- Baulac, S. & Baulac, M.: Advances on the genetics of mendelian idiopathic epilepsies. Clin. Lab. Med., 30, 911-929 (2010)[PubMed]
- Heron, S. E., Smith, K. R., Bahlo, M. et al.: Missense mutations in the sodium-gated potassium channel gene KCNT1 cause severe autosomal dominant nocturnal frontal lobe epilepsy. Nat. Genet., 44, 1188-1190 (2012)[PubMed]
- Kalachikov, S., Evgrafov, O., Ross, B. et al.: Mutations in LGI1 cause autosomal-dominant partial epilepsy with auditory features. Nat. Genet., 30, 335-341 (2002)[PubMed]
- Klein, K. M., O'Brien, T. J., Praveen, K. et al.: Familial focal epilepsy with variable foci mapped to chromosome 22q12: expansion of the phenotypic spectrum. Epilepsia, 53, e151-e155 (2012)[PubMed]
- Berkovic, S. F., Serratosa, J. M., Phillips, H. A. et al.: Familial partial epilepsy with variable foci: clinical features and linkage to chromosome 22q12. Epilepsia, 45, 1054-1060 (2004)[PubMed]
- Callenbach, P. M., van den Maagdenberg, A. M., Hottenga, J. J. et a.: Familial partial epilepsy with variable foci in a Dutch family: clinical characteristics and confirmation of linkage to chromosome 22q. Epilepsia, 44, 1298-1305 (2003)[PubMed]
- Morales-Corraliza, J., Gomez-Garre, P., Sanz, R. et al.: Familial partial epilepsy with variable foci: a new family with suggestion of linkage to chromosome 22q12. Epilepsia, 51, 1910-1914 (2010)[PubMed]
- Xiong, L., Labuda, M., Li, D. S. et al.: Mapping of a gene determining familial partial epilepsy with variable foci to chromosome 22q11-q12. Am. J. Hum. Genet., 65, 1698-1710 (1999)[PubMed]
- Picard, F., Baulac, S., Kahane, P. et al.: Dominant partial epilepsies. A clinical, electrophysiological and genetic study of 19 European families. Brain, 123, 1247-1262 (2000)[PubMed]
- Dokudovskaya, S., Waharte, F., Schlessinger, A. et al.: A conserved coatomer-related complex containing Sec13 and Seh1 dynamically associates with the vacuole in Saccharomyces cerevisiae. Mol. Cell. Proteomics, 10, M110.006478 (2011)[PubMed]
- Seng, T. J., Ichimura, K., Liu, L. et al.: Complex chromosome 22 rearrangements in astrocytic tumors identified using microsatellite and chromosome 22 tile path array analysis. Genes Chromosomes Cancer, 43, 181-193 (2005)[PubMed]
- Miki, D., Ochi, H., Hayes, C. N. et al.: Variation in the DEPDC5 locus is associated with progression to hepatocellular carcinoma in chronic hepatitis C virus carriers. Nat. Genet., 43, 797-800 (2011)[PubMed]
著者プロフィール
略歴:2012年 京都大学大学院医学研究科博士課程 修了,同 特定研究員を経て,フランスNational Institute for Health and Medical Research研究員.
研究テーマ:ヒトにおけるてんかん原因遺伝子の探索とその機能解析.てんかんモデル動物の表現型の解析.
抱負:ヒト神経疾患のよりよい予防法および治療法の開発につながる研究をめざす.
© 2013 石田 紗恵子 Licensed under CC 表示 2.1 日本