脳の体液Na+濃度センサーであるNaxチャネルの感度はエンドセリン3により制御される
檜山武史・野田昌晴
(基礎生物学研究所 統合神経生物学研究部門)
email:檜山武史,野田昌晴
DOI: 10.7875/first.author.2013.045
Endothelin-3 expression in the subfornical organ enhances the sensitivity of Nax, the brain sodium-level sensor, to suppress salt intake.
Takeshi Y. Hiyama, Masahide Yoshida, Masahito Matsumoto, Ryoko Suzuki, Takashi Matsuda, Eiji Watanabe, Masaharu Noda
Cell Metabolism, 17, 507-519 (2013)
体液のNa+濃度は脳においてつねに監視されており,水分や塩分の摂取および排出の制御をつうじて135~145 mMに厳密に維持されている.筆者らは,脳において体液のNa+濃度の上昇を検出するセンサーがNaxチャネルであることを提唱してきた.Naxチャネルが真に脳の体液Na+濃度センサーであるとすれば生理的な範囲のNa+濃度の変化を感知できるはずであるが,Naxチャネルは体外ではNa+濃度が約150 mMをこえてはじめて活性化するという特性を示した.今回,筆者らは,この残されていた矛盾を解決することに成功した.この研究により,Naxチャネルの活性化の閾値は,体内では血圧制御ホルモンのひとつであるエンドセリン3により制御されており,生理的な範囲におけるNa+濃度の上昇に応答できることがわかった.Naxチャネルの活性化閾値は脱水状態に応じたエンドセリン3の発現により制御されていることもわかった.従来から,血中のNa+濃度と血圧とのあいだには強いつながりがあるとされてきたが,今回の発見は,今後,そのしくみを明らかにする端緒になると期待される.
動物の生存にとって体液(血液や脳脊髄液を含む細胞外液の総称)の塩濃度を一定に保つことは必須である(体液恒常性).このため,動物は体液のNa+濃度と浸透圧とを常時モニターするしくみを獲得したと考えられる.体液のNa+と水とのバランスがくずれたとき,たとえば,長時間の脱水は体液におけるNa+濃度を上昇させる.このとき,われわれは喉の渇きをおぼえ,ただちに水分を補給するとともに塩分の摂取を抑制し,また,尿へのNa+の排泄および再吸収を制御する.筆者らは,この体液のNa+濃度の上昇を検出するセンサーがNaxチャネルであり,その検出中枢が脳の感覚性脳室周囲器官にあることを,以下のような一連の研究をとおして示してきた.
Naxチャネルは電位依存性Na+チャネルファミリーに属するが,電位依存性を示さない1).脳において感覚性脳室周囲器官(脳弓下器官や終板脈管器官)のグリア細胞に分布している2).これらの神経核は第三脳室の前壁に位置し,脳脊髄液に接している.さらに,血液-脳関門を欠失していることから,体液の状態をモニターすることに適している.脳弓下器官においてNaxチャネルを発現している細胞を単離して電気生理学的に解析したところ,Naxチャネルは細胞外のNa+濃度の上昇を感知して開口し,その閾値は約150 mMであることが明らかになった3).Naxノックアウトマウスは脱水条件において体液のNa+濃度が上昇してもこれを感知できず,塩分の摂取を抑制しなかった2).このノックアウトマウスの行動異常は,脳弓下器官の局所的に正常なNax遺伝子をもどすことにより野生型マウスと同様の行動へと回復させることができた4).
Naxチャネルは体外では活性化の閾値が約150 mMであったが,体液のNa+濃度は通常135~145 mMに厳密に維持されている.Naxチャネルがこの生理的な範囲のNa+濃度の変化を感知できるよう,生体ではなんらかの因子によりNaxチャネルの活性化閾値が制御をうけているものと推察された.
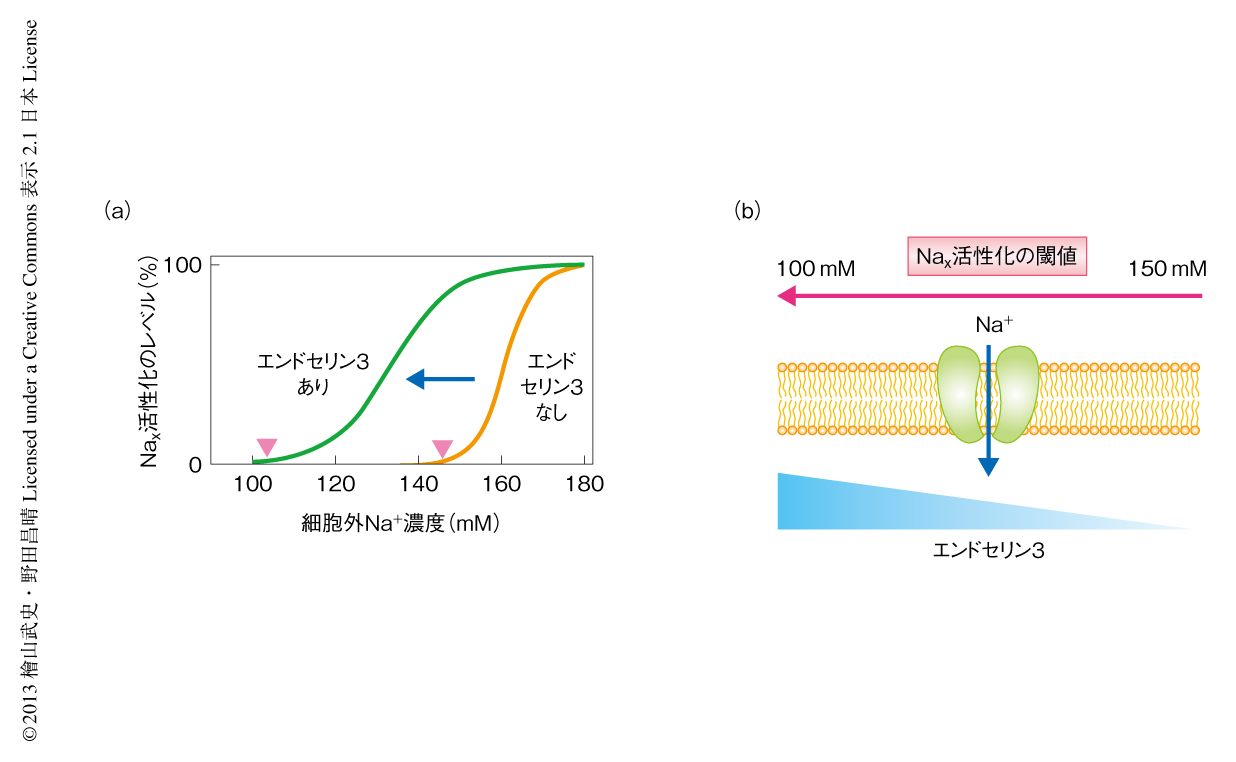
血中のNa+濃度は血圧と相関することがよく知られている.脳弓下器官は,血圧制御ホルモンであるアンジオテンシンIIやエンドセリン類の受容体の多く発現している場所でもある.そこで,これらのホルモンのなかにNaxチャネルの細胞外のNa+濃度への感受性に影響をあたえるものはないか調べたところ,エンドセリン3が用量依存的にこれを高めることが明らかになった(図1).Naxチャネルはエンドセリン3が存在しない場合には細胞外Na+濃度が約150 mMをこえるとはじめて開口しはじめる.ところが,エンドセリン3が1 nMあると135~145 mMでも開口するという結果が得られた.脳弓下器官には通常の状態でも一定量のエンドセリン3が発現しており,Naxチャネルの体内での活性化の閾値は生理的なNa+濃度の範囲にあると考えられた.
エンドセリン受容体であるETB受容体は,脳弓下器官のグリア細胞においてNaxチャネルと共発現していることが確認された.ETB受容体はGタンパク質共役型受容体であり,その下流においてタンパク質のリン酸化を介したシグナル伝達が行われる.詳細な薬理学的な解析から,エンドセリン3によるNaxチャネルの活性化にはプロテインキナーゼCおよびERK1/ERK2の活性化が必要であることがわかった.
Naxチャネルはグリア細胞に発現しているが,その情報が塩分の摂取行動の制御に結びつくためには,グリア細胞からニューロンへと情報を伝達し神経活動を制御する機構が必要である.筆者らの以前の研究から,Naxチャネルを発現するグリア細胞ではNaxチャネルとNa+/K+-ATPaseとが結合していること,脳弓下器官において細胞外Na+濃度の上昇に応じNaxチャネルが活性化すると,Naxチャネルをつうじて流入したNa+によりNa+/K+-ATPaseが活性化すること,Na+/Na+-ATPaseにATPを供給するため嫌気的な糖代謝が活性化し,Naxチャネルを発現するグリア細胞から最終代謝産物である乳酸が放出されること,その乳酸がグリア細胞に隣接するGABAニューロンに取り込まれ発火頻度が上昇すること,がわかっていた5).今回の研究において,この機構がNa+濃度の上昇ではなく,エンドセリン3によりNaxチャネルが活性化した場合にもはたらくかどうかを調べた.脳弓下器官の急性スライスにおいて電気生理学的にGABAニューロンの神経活動を記録し,そこにエンドセリン3あるいはETB受容体の活性化剤を投与したところ,GABAニューロンの発火頻度が上昇することが確認された.
個体が脱水状態におちいったとき脳弓下器官におけるエンドセリン3の発現に変化はないのか.in situハイブリダイゼーション法により調べた結果,脱水にともないエンドセリン3の発現が上昇することが明らかになった.脱水状態のマウスに水と食塩水を自由に摂取させると,水を大量に摂取すると同時に食塩水を回避する行動を示すが,Naxノックアウトマウスはこれを回避しない.あらかじめETB受容体の阻害剤を脳室に投与したマウスについて同様の行動を解析したところ,通常のマウスに比べ有意に塩分摂取を回避せず,Naxノックアウトマウスに近い行動を示した.このように,脱水状態のときには脳弓下器官においてエンドセリン3の発現が誘導され,細胞外Na+濃度に対するNaxチャネルの感受性を高めて,鋭敏に塩分摂取を回避するよう行動を制御していることが明らかになった.
この研究により,脳の体液Na+濃度センサーであるNaxチャネルの活性化の閾値は,血圧制御ホルモンのひとつであるエンドセリン3により制御されていることが明らかになった.これは,体液におけるNa+恒常性の制御機構の理解を一歩前進させる成果であった.また,従来から,血中のNa+濃度と血圧とのあいだには強いつながりがあるとされてきたが,今回の発見は,そのしくみを明らかにする端緒になると考えられる.今後,Naxノックアウトマウスの血圧に異常がないか調べる予定である.
一方,脱水状態のときの脳弓下器官におけるエンドセリン3の発現の誘導はNaxノックアウトマウスにも起こったことから,Naxチャネル以外のセンサーがこれを感知していると考えられた.今回の成果により,どのようなセンサーが脱水状態を感知してエンドセリン3の発現を誘導しているのか,という新しい“謎”が出現した.
また,感覚性脳室周囲器官のほかの場所に発現するNaxチャネルについては,これまでその生理機能が不明であったが,今回の研究により,それらの活性化がエンドセリン3により行われている可能性がでてきた.Naxチャネルは感覚性脳室周囲器官のほかにも,肺,子宮筋,脊髄後根神経節などに発現しており2),今後,エンドセリン3の発現と分泌の制御機構が明らかになれば,体内のさまざまな部位におけるNaxチャネルの生理機能の解明が一気に進むものと期待される.
略歴:2002年 総合研究大学院大学生命科学研究科 修了,同年より基礎生物学研究所 助手(現 助教).
研究テーマ:体液恒常性の維持と制御の機構.
関心事:水や塩分に対する欲求が惹起されるしくみの解明.
野田 昌晴(Masaharu Noda)
基礎生物学研究所 教授.
研究室URL:http://niwww3.nibb.ac.jp/
© 2013 檜山武史・野田昌晴 Licensed under CC 表示 2.1 日本
(基礎生物学研究所 統合神経生物学研究部門)
email:檜山武史,野田昌晴
DOI: 10.7875/first.author.2013.045
Endothelin-3 expression in the subfornical organ enhances the sensitivity of Nax, the brain sodium-level sensor, to suppress salt intake.
Takeshi Y. Hiyama, Masahide Yoshida, Masahito Matsumoto, Ryoko Suzuki, Takashi Matsuda, Eiji Watanabe, Masaharu Noda
Cell Metabolism, 17, 507-519 (2013)
要 約
体液のNa+濃度は脳においてつねに監視されており,水分や塩分の摂取および排出の制御をつうじて135~145 mMに厳密に維持されている.筆者らは,脳において体液のNa+濃度の上昇を検出するセンサーがNaxチャネルであることを提唱してきた.Naxチャネルが真に脳の体液Na+濃度センサーであるとすれば生理的な範囲のNa+濃度の変化を感知できるはずであるが,Naxチャネルは体外ではNa+濃度が約150 mMをこえてはじめて活性化するという特性を示した.今回,筆者らは,この残されていた矛盾を解決することに成功した.この研究により,Naxチャネルの活性化の閾値は,体内では血圧制御ホルモンのひとつであるエンドセリン3により制御されており,生理的な範囲におけるNa+濃度の上昇に応答できることがわかった.Naxチャネルの活性化閾値は脱水状態に応じたエンドセリン3の発現により制御されていることもわかった.従来から,血中のNa+濃度と血圧とのあいだには強いつながりがあるとされてきたが,今回の発見は,今後,そのしくみを明らかにする端緒になると期待される.
はじめに
動物の生存にとって体液(血液や脳脊髄液を含む細胞外液の総称)の塩濃度を一定に保つことは必須である(体液恒常性).このため,動物は体液のNa+濃度と浸透圧とを常時モニターするしくみを獲得したと考えられる.体液のNa+と水とのバランスがくずれたとき,たとえば,長時間の脱水は体液におけるNa+濃度を上昇させる.このとき,われわれは喉の渇きをおぼえ,ただちに水分を補給するとともに塩分の摂取を抑制し,また,尿へのNa+の排泄および再吸収を制御する.筆者らは,この体液のNa+濃度の上昇を検出するセンサーがNaxチャネルであり,その検出中枢が脳の感覚性脳室周囲器官にあることを,以下のような一連の研究をとおして示してきた.
Naxチャネルは電位依存性Na+チャネルファミリーに属するが,電位依存性を示さない1).脳において感覚性脳室周囲器官(脳弓下器官や終板脈管器官)のグリア細胞に分布している2).これらの神経核は第三脳室の前壁に位置し,脳脊髄液に接している.さらに,血液-脳関門を欠失していることから,体液の状態をモニターすることに適している.脳弓下器官においてNaxチャネルを発現している細胞を単離して電気生理学的に解析したところ,Naxチャネルは細胞外のNa+濃度の上昇を感知して開口し,その閾値は約150 mMであることが明らかになった3).Naxノックアウトマウスは脱水条件において体液のNa+濃度が上昇してもこれを感知できず,塩分の摂取を抑制しなかった2).このノックアウトマウスの行動異常は,脳弓下器官の局所的に正常なNax遺伝子をもどすことにより野生型マウスと同様の行動へと回復させることができた4).
Naxチャネルは体外では活性化の閾値が約150 mMであったが,体液のNa+濃度は通常135~145 mMに厳密に維持されている.Naxチャネルがこの生理的な範囲のNa+濃度の変化を感知できるよう,生体ではなんらかの因子によりNaxチャネルの活性化閾値が制御をうけているものと推察された.
1.脳弓下器官においてエンドセリン3はNaxチャネルのNa+濃度への感受性を高める
血中のNa+濃度は血圧と相関することがよく知られている.脳弓下器官は,血圧制御ホルモンであるアンジオテンシンIIやエンドセリン類の受容体の多く発現している場所でもある.そこで,これらのホルモンのなかにNaxチャネルの細胞外のNa+濃度への感受性に影響をあたえるものはないか調べたところ,エンドセリン3が用量依存的にこれを高めることが明らかになった(図1).Naxチャネルはエンドセリン3が存在しない場合には細胞外Na+濃度が約150 mMをこえるとはじめて開口しはじめる.ところが,エンドセリン3が1 nMあると135~145 mMでも開口するという結果が得られた.脳弓下器官には通常の状態でも一定量のエンドセリン3が発現しており,Naxチャネルの体内での活性化の閾値は生理的なNa+濃度の範囲にあると考えられた.
エンドセリン受容体であるETB受容体は,脳弓下器官のグリア細胞においてNaxチャネルと共発現していることが確認された.ETB受容体はGタンパク質共役型受容体であり,その下流においてタンパク質のリン酸化を介したシグナル伝達が行われる.詳細な薬理学的な解析から,エンドセリン3によるNaxチャネルの活性化にはプロテインキナーゼCおよびERK1/ERK2の活性化が必要であることがわかった.
2.脳弓下器官におけるエンドセリン3によるNaxチャネルの活性化は嫌気的な糖代謝を活性化しGABAニューロンの活動を高める
Naxチャネルはグリア細胞に発現しているが,その情報が塩分の摂取行動の制御に結びつくためには,グリア細胞からニューロンへと情報を伝達し神経活動を制御する機構が必要である.筆者らの以前の研究から,Naxチャネルを発現するグリア細胞ではNaxチャネルとNa+/K+-ATPaseとが結合していること,脳弓下器官において細胞外Na+濃度の上昇に応じNaxチャネルが活性化すると,Naxチャネルをつうじて流入したNa+によりNa+/K+-ATPaseが活性化すること,Na+/Na+-ATPaseにATPを供給するため嫌気的な糖代謝が活性化し,Naxチャネルを発現するグリア細胞から最終代謝産物である乳酸が放出されること,その乳酸がグリア細胞に隣接するGABAニューロンに取り込まれ発火頻度が上昇すること,がわかっていた5).今回の研究において,この機構がNa+濃度の上昇ではなく,エンドセリン3によりNaxチャネルが活性化した場合にもはたらくかどうかを調べた.脳弓下器官の急性スライスにおいて電気生理学的にGABAニューロンの神経活動を記録し,そこにエンドセリン3あるいはETB受容体の活性化剤を投与したところ,GABAニューロンの発火頻度が上昇することが確認された.
3.脱水にともない脳弓下器官におけるエンドセリン3の発現は上昇し塩分の回避行動は強まる
個体が脱水状態におちいったとき脳弓下器官におけるエンドセリン3の発現に変化はないのか.in situハイブリダイゼーション法により調べた結果,脱水にともないエンドセリン3の発現が上昇することが明らかになった.脱水状態のマウスに水と食塩水を自由に摂取させると,水を大量に摂取すると同時に食塩水を回避する行動を示すが,Naxノックアウトマウスはこれを回避しない.あらかじめETB受容体の阻害剤を脳室に投与したマウスについて同様の行動を解析したところ,通常のマウスに比べ有意に塩分摂取を回避せず,Naxノックアウトマウスに近い行動を示した.このように,脱水状態のときには脳弓下器官においてエンドセリン3の発現が誘導され,細胞外Na+濃度に対するNaxチャネルの感受性を高めて,鋭敏に塩分摂取を回避するよう行動を制御していることが明らかになった.
おわりに
この研究により,脳の体液Na+濃度センサーであるNaxチャネルの活性化の閾値は,血圧制御ホルモンのひとつであるエンドセリン3により制御されていることが明らかになった.これは,体液におけるNa+恒常性の制御機構の理解を一歩前進させる成果であった.また,従来から,血中のNa+濃度と血圧とのあいだには強いつながりがあるとされてきたが,今回の発見は,そのしくみを明らかにする端緒になると考えられる.今後,Naxノックアウトマウスの血圧に異常がないか調べる予定である.
一方,脱水状態のときの脳弓下器官におけるエンドセリン3の発現の誘導はNaxノックアウトマウスにも起こったことから,Naxチャネル以外のセンサーがこれを感知していると考えられた.今回の成果により,どのようなセンサーが脱水状態を感知してエンドセリン3の発現を誘導しているのか,という新しい“謎”が出現した.
また,感覚性脳室周囲器官のほかの場所に発現するNaxチャネルについては,これまでその生理機能が不明であったが,今回の研究により,それらの活性化がエンドセリン3により行われている可能性がでてきた.Naxチャネルは感覚性脳室周囲器官のほかにも,肺,子宮筋,脊髄後根神経節などに発現しており2),今後,エンドセリン3の発現と分泌の制御機構が明らかになれば,体内のさまざまな部位におけるNaxチャネルの生理機能の解明が一気に進むものと期待される.
文 献
- Noda, M.: The subfornical organ, a specialized sodium channel, and the sensing of sodium levels in the brain. Neuroscientist, 12, 80-91 (2006)[PubMed]
- Watanabe, E., Fujikawa, A., Matsunaga, H. et al.: Nav2/NaG channel is involved in control of salt-intake behavior in the CNS. J. Neurosci., 20, 7743-7751 (2000)[PubMed]
- Hiyama, T. Y., Watanabe, E., Ono, K. et al.: Nax channel involved in CNS sodium-level sensing. Nat. Neurosci., 5, 511-512 (2002)[PubMed]
- Hiyama, T. Y., Watanabe, E., Okado, H. et al.: The subfornical organ is the primary locus of sodium-level sensing by Nax sodium channels for the control of salt-intake behavior. J. Neurosci., 24, 9276-9281 (2004)[PubMed]
- Shimizu, H., Watanabe, E., Hiyama, T. Y. et al.: Glial Nax channels control lactate signaling to neurons for brain [Na+] sensing. Neuron, 54, 59-72 (2007)[PubMed]
著者プロフィール
略歴:2002年 総合研究大学院大学生命科学研究科 修了,同年より基礎生物学研究所 助手(現 助教).
研究テーマ:体液恒常性の維持と制御の機構.
関心事:水や塩分に対する欲求が惹起されるしくみの解明.
野田 昌晴(Masaharu Noda)
基礎生物学研究所 教授.
研究室URL:http://niwww3.nibb.ac.jp/
© 2013 檜山武史・野田昌晴 Licensed under CC 表示 2.1 日本