糸球体モジュールにおける多様な匂い応答の表現
菊田 周1,2・永山 晋2
(1東京大学医学部附属病院 耳鼻咽喉科・聴覚音声外科,2米国Texas大学Medical School at Houston,Department of Neurobiology and Anatomy)
email:菊田 周
DOI: 10.7875/first.author.2013.043
Odorant response properties of individual neurons in an olfactory glomerular module.
Shu Kikuta, Max L. Fletcher, Ryota Homma, Tatsuya Yamasoba, Shin Nagayama
Neuron, 77, 1122-1135 (2013)
マウスの嗅球は鼻に吸い込まれた匂い情報を最初に処理する脳の領域であり,われわれがどのようにして多くの匂い情報を識別しているのかを知るうえで手がかりとなる領域である.これまでの研究により,鼻腔のひとつの受容細胞はたった1種類の匂い分子受容体を発現し,同じ匂い分子受容体を発現する受容細胞は嗅球にある2~3の糸球体へと特異的に軸索を投射することがわかっていた.しかし,この収束された匂い情報を嗅球の細胞がどのように連携して処理し,匂い識別のしくみにかかわっているのかは不明であった.筆者らは,同じ糸球体から嗅覚情報を受け取る細胞を選択的に可視化し,その神経活動を直接に計測して比較することにはじめて成功した.その結果,同じ嗅覚受容体から情報を受け取る細胞は,これまで考えられてきたように深さ方向に円柱状で狭い範囲に存在するのではなく,嗅球において広範囲に分布していることをみつけた.さらに,細胞の深さ方向や横へのひろがりといった空間的な配置により神経活動に違いの生じることをつきとめた.これは,同じ嗅覚受容体から情報を受け取る細胞は同じ受容体からの刺激に同じように反応する,とするこれまでの定説をくつがえし,同じ受容体からの刺激に多様に反応する巧妙な情報処理の様式が嗅球の基本構造単位に存在することを示唆した.これにより哺乳類はかぎられた嗅覚受容体でより多くの匂い情報を識別できるものと考えられた.この研究は,われわれの脳において行われている匂い情報の処理機構についての理解を深めただけでなく,中枢性嗅覚障害の病態生理の解明の糸口ともなることが期待される.
感覚情報の認識は,多くの場合,対象物のある特徴にだけ反応するニューロンが大脳皮質の深さ方向に円柱状に並んで存在し,機能単位として情報処理を行うことによりなしとげられていると考えられている.たとえば視覚系でいうと,ある特定の傾きをもった線分にだけ応答する“方位選択性カラム”や,特定の“ひげ”に応答する“バレル”といった構造単位である1).このような機能単位における情報処理の機構を明らかにすることは,感覚の情報処理における基本原則を理解するうえでの基盤となる.
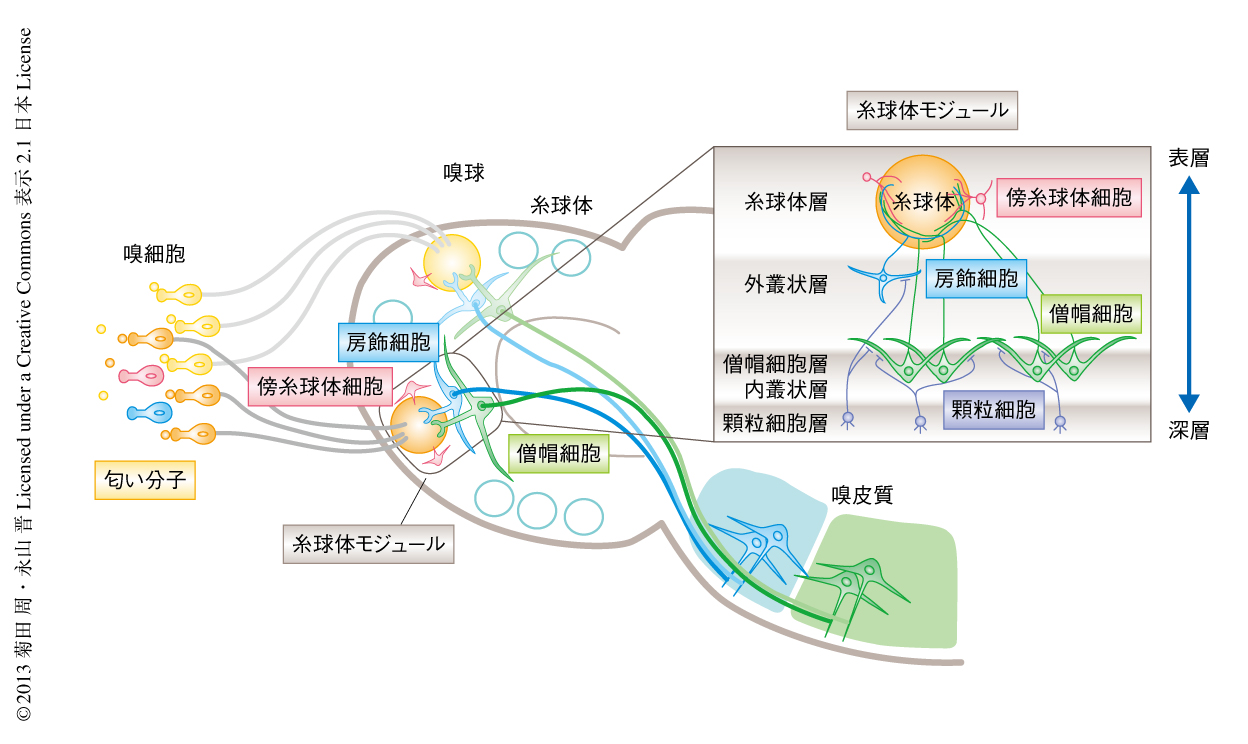
鼻には1千万以上の嗅神経があるが,それぞれは1種類の嗅覚受容体を選択的に発現している2,3).マウスには約千種類の嗅覚受容体があり,同じ種類の嗅覚受容体を発現する嗅細胞は同じ糸球体にあつまる4).さらに,糸球体においては多くのシナプスが形成され,嗅細胞からの匂い情報は嗅球の細胞に伝達される(図1).嗅球は大脳新皮質と同様に層構造になっており,層に特異的に存在する出力ニューロンや抑制性介在ニューロンが嗅球における情報処理にかかわっている5).同じ糸球体に接続する細胞は“糸球体モジュール”とよばれ,同質の匂い情報処理にかかわるとされて,ほかの感覚系で観察されるカラムやバレルと同じく基本構造単位であると考えられてきた(図1).しかし,糸球体モジュールを選択的に可視化することは困難であったため,糸球体モジュールが実際にどのような構造をしていて,匂い情報をどのように処理することで匂い識別のしくみにかかわっているのか不明であった.
嗅細胞の軸索が蛍光を発するSpHマウスを用いることにより6),糸球体を可視化した.匂い刺激には直鎖型アルデヒド類の7種類(3CHO~9CHO)を使用した.これら匂い分子の刺激に対する糸球体の活動をCCDカメラで検出したのち,2光子励起顕微鏡により観察している状態において,匂い応答を示す標的の糸球体にCa2+感受性の蛍光色素を含むガラス電極を刺入した.筆者らがこれまでに確立した電気穿孔法により7),ひとつの糸球体モジュールに選択的に蛍光色素を取り込ませることに成功した.その結果,糸球体モジュールの嗅球におけるひろがりや細胞形態の観察,匂い刺激に対するCa2+応答を直接に計測することが可能になった.
可視化された糸球体モジュールの嗅球における分布を詳細に調べたところ,糸球体モジュールはほかの感覚系で観察される“方位選択性カラム”や“バレル”といった密集した円柱状の構造ではなく,それよりもさらに広い裾野をもっていた.傍糸球体細胞は所属する糸球体の比較的近傍に局在していたのに対し,房飾細胞や僧帽細胞は所属する糸球体の大きさ(直径は約100μm)の2~3倍のひろがりをもって分布していた.これは個々の糸球体モジュールは隔離された構造ではなく,まわりの糸球体モジュールと多く重なり合っていることを意味し,その重なり合いがほかの糸球体モジュールや顆粒細胞との多様な相互作用を生み出し,匂い情報が多様に修飾をうける可能性を示していた.
嗅神経において表現された匂い情報が糸球体モジュールにどのように伝達され,さらに匂い情報が処理されているのかを調べるため,まず,嗅神経(糸球体の活動をCCDカメラにより計測)と嗅球出力ニューロン(Ca2+シグナルを2光子顕微鏡により計測)の神経活動を直接に比較した.糸球体の近辺に分布する傍糸球体細胞は刺激した匂い分子の多くに興奮性の応答を示し,嗅神経における興奮性匂い分子の受容範囲と同様に,広い受容範囲をもっていた.それに対し,房飾細胞では興奮性匂い分子の受容範囲は傍糸球体と比較して有意に狭くなり,僧帽細胞ではもっとも狭かった(図2a).おもしろいことに,房飾細胞や僧帽細胞を活性化する匂い分子は,つねに嗅神経を活性化する匂い分子の組合せに含まれていた.これらの結果は,嗅細胞が取り扱う比較的多くの匂い分子情報について,浅い層にある傍糸球体細胞はより直接的に受容し利用しているが,深い層にある房飾細胞や僧帽細胞はさらに厳選し,よりシャープな情報として伝達していることを示した.
つぎに,僧帽細胞で観察された匂い情報の修飾が,僧帽細胞すべてに一様に起こっているのかどうかを調べるため,僧帽細胞どうしの匂い応答の選択性について調べた.驚いたことに,近傍に位置する僧帽細胞どうしは似た応答選択性を示したのに対し,離れた位置に存在する僧帽細胞どうしで比較すると応答選択性は異なっていた.この事実は,同じ糸球体モジュールに属し同じ匂い情報を受け取る僧帽細胞がすべて一律に修飾されるのではなく,その空間的な配置に依存して多様な修飾をうけて匂い応答の特性の多様性をつくりだしていることを示した.
顆粒細胞は僧帽細胞のもつ2次樹状突起において樹状突起のあいだにシナプスを形成し,抑制性入力を介して僧帽細胞の出力に影響をあたえる3,5).とくに,僧帽細胞の近くにシナプスを形成する顆粒細胞は僧帽細胞の近傍に位置しており,その活動は僧帽細胞の出力を大きく変容させる8,9).僧帽細胞のCa2+応答の多様性がひき起こされるひとつの原因として,僧帽細胞の出力の変容が複数の異なる顆粒細胞の活動により制御されていることが考えられる.僧帽細胞におけるCa2+応答の相違が複数の顆粒細胞との相互作用により生み出されているのかどうかを調べるため,僧帽細胞の応答の類似性と細胞間の距離との相関関係を調べた.
傍糸球体細胞においては細胞どうしの応答の類似性に細胞間の距離との有意な相関関係が観察されず,似た応答特性を示した.これに対して,僧帽細胞では細胞どうしの応答の類似性と細胞間の距離に負の相関が存在し,細胞どうしが離れるほどその応答の類似性は低下した.この結果は,近傍に位置する僧帽細胞は同じ顆粒細胞と相互作用するが,離れた位置にある僧帽細胞は異なる顆粒細胞と相互作用することにより,同じ嗅覚受容体からの刺激に異なる応答をしていることを示した.多様な匂い応答パターンは匂い情報伝達の細分化を意味し,細分化された匂い情報を個々の僧帽細胞が高次中枢へと伝達していることを示唆した10)(図2b).この糸球体モジュールの内部での多様な匂い表現パターンにより,哺乳類はかぎられた嗅覚受容体でより多くの匂い情報を識別できるものと考えられた.
この研究は,脳の基本構造単位である“糸球体モジュール”の構造と機能の特徴を明らかにした.今後は,この機能単位構造を中心に,嗅球における匂い情報処理の神経機構についての理解がより深まるものと考える11).さらに,顆粒細胞が制御する僧帽細胞との組合せは新しい機能単位の候補と考えられ,この新しい“顆粒細胞-僧帽細胞”機能単位を中心として中枢への軸索投射様式を調べることにより,嗅覚中枢での匂い情報処理のさらなる解明が期待される.
2009年 東京大学大学院医学系研究科博士課程,修了,2010年 米国Texas大学Medical School at Houston博士研究員を経て,2011年より東京大学医学部附属病院 助教.
永山 晋(Shin Nagayama)
米国Texas大学Medical School at Houston助教.
© 2013 菊田 周・永山 晋 Licensed under CC 表示 2.1 日本
(1東京大学医学部附属病院 耳鼻咽喉科・聴覚音声外科,2米国Texas大学Medical School at Houston,Department of Neurobiology and Anatomy)
email:菊田 周
DOI: 10.7875/first.author.2013.043
Odorant response properties of individual neurons in an olfactory glomerular module.
Shu Kikuta, Max L. Fletcher, Ryota Homma, Tatsuya Yamasoba, Shin Nagayama
Neuron, 77, 1122-1135 (2013)
要 約
マウスの嗅球は鼻に吸い込まれた匂い情報を最初に処理する脳の領域であり,われわれがどのようにして多くの匂い情報を識別しているのかを知るうえで手がかりとなる領域である.これまでの研究により,鼻腔のひとつの受容細胞はたった1種類の匂い分子受容体を発現し,同じ匂い分子受容体を発現する受容細胞は嗅球にある2~3の糸球体へと特異的に軸索を投射することがわかっていた.しかし,この収束された匂い情報を嗅球の細胞がどのように連携して処理し,匂い識別のしくみにかかわっているのかは不明であった.筆者らは,同じ糸球体から嗅覚情報を受け取る細胞を選択的に可視化し,その神経活動を直接に計測して比較することにはじめて成功した.その結果,同じ嗅覚受容体から情報を受け取る細胞は,これまで考えられてきたように深さ方向に円柱状で狭い範囲に存在するのではなく,嗅球において広範囲に分布していることをみつけた.さらに,細胞の深さ方向や横へのひろがりといった空間的な配置により神経活動に違いの生じることをつきとめた.これは,同じ嗅覚受容体から情報を受け取る細胞は同じ受容体からの刺激に同じように反応する,とするこれまでの定説をくつがえし,同じ受容体からの刺激に多様に反応する巧妙な情報処理の様式が嗅球の基本構造単位に存在することを示唆した.これにより哺乳類はかぎられた嗅覚受容体でより多くの匂い情報を識別できるものと考えられた.この研究は,われわれの脳において行われている匂い情報の処理機構についての理解を深めただけでなく,中枢性嗅覚障害の病態生理の解明の糸口ともなることが期待される.
はじめに
感覚情報の認識は,多くの場合,対象物のある特徴にだけ反応するニューロンが大脳皮質の深さ方向に円柱状に並んで存在し,機能単位として情報処理を行うことによりなしとげられていると考えられている.たとえば視覚系でいうと,ある特定の傾きをもった線分にだけ応答する“方位選択性カラム”や,特定の“ひげ”に応答する“バレル”といった構造単位である1).このような機能単位における情報処理の機構を明らかにすることは,感覚の情報処理における基本原則を理解するうえでの基盤となる.
鼻には1千万以上の嗅神経があるが,それぞれは1種類の嗅覚受容体を選択的に発現している2,3).マウスには約千種類の嗅覚受容体があり,同じ種類の嗅覚受容体を発現する嗅細胞は同じ糸球体にあつまる4).さらに,糸球体においては多くのシナプスが形成され,嗅細胞からの匂い情報は嗅球の細胞に伝達される(図1).嗅球は大脳新皮質と同様に層構造になっており,層に特異的に存在する出力ニューロンや抑制性介在ニューロンが嗅球における情報処理にかかわっている5).同じ糸球体に接続する細胞は“糸球体モジュール”とよばれ,同質の匂い情報処理にかかわるとされて,ほかの感覚系で観察されるカラムやバレルと同じく基本構造単位であると考えられてきた(図1).しかし,糸球体モジュールを選択的に可視化することは困難であったため,糸球体モジュールが実際にどのような構造をしていて,匂い情報をどのように処理することで匂い識別のしくみにかかわっているのか不明であった.
1.糸球体モジュールの可視化
嗅細胞の軸索が蛍光を発するSpHマウスを用いることにより6),糸球体を可視化した.匂い刺激には直鎖型アルデヒド類の7種類(3CHO~9CHO)を使用した.これら匂い分子の刺激に対する糸球体の活動をCCDカメラで検出したのち,2光子励起顕微鏡により観察している状態において,匂い応答を示す標的の糸球体にCa2+感受性の蛍光色素を含むガラス電極を刺入した.筆者らがこれまでに確立した電気穿孔法により7),ひとつの糸球体モジュールに選択的に蛍光色素を取り込ませることに成功した.その結果,糸球体モジュールの嗅球におけるひろがりや細胞形態の観察,匂い刺激に対するCa2+応答を直接に計測することが可能になった.
2.糸球体モジュールは広範囲にひろがった構造をもつ
可視化された糸球体モジュールの嗅球における分布を詳細に調べたところ,糸球体モジュールはほかの感覚系で観察される“方位選択性カラム”や“バレル”といった密集した円柱状の構造ではなく,それよりもさらに広い裾野をもっていた.傍糸球体細胞は所属する糸球体の比較的近傍に局在していたのに対し,房飾細胞や僧帽細胞は所属する糸球体の大きさ(直径は約100μm)の2~3倍のひろがりをもって分布していた.これは個々の糸球体モジュールは隔離された構造ではなく,まわりの糸球体モジュールと多く重なり合っていることを意味し,その重なり合いがほかの糸球体モジュールや顆粒細胞との多様な相互作用を生み出し,匂い情報が多様に修飾をうける可能性を示していた.
3.糸球体モジュールにおける細胞の空間的な配置の相違が神経活動の多様性を生み出す
嗅神経において表現された匂い情報が糸球体モジュールにどのように伝達され,さらに匂い情報が処理されているのかを調べるため,まず,嗅神経(糸球体の活動をCCDカメラにより計測)と嗅球出力ニューロン(Ca2+シグナルを2光子顕微鏡により計測)の神経活動を直接に比較した.糸球体の近辺に分布する傍糸球体細胞は刺激した匂い分子の多くに興奮性の応答を示し,嗅神経における興奮性匂い分子の受容範囲と同様に,広い受容範囲をもっていた.それに対し,房飾細胞では興奮性匂い分子の受容範囲は傍糸球体と比較して有意に狭くなり,僧帽細胞ではもっとも狭かった(図2a).おもしろいことに,房飾細胞や僧帽細胞を活性化する匂い分子は,つねに嗅神経を活性化する匂い分子の組合せに含まれていた.これらの結果は,嗅細胞が取り扱う比較的多くの匂い分子情報について,浅い層にある傍糸球体細胞はより直接的に受容し利用しているが,深い層にある房飾細胞や僧帽細胞はさらに厳選し,よりシャープな情報として伝達していることを示した.
つぎに,僧帽細胞で観察された匂い情報の修飾が,僧帽細胞すべてに一様に起こっているのかどうかを調べるため,僧帽細胞どうしの匂い応答の選択性について調べた.驚いたことに,近傍に位置する僧帽細胞どうしは似た応答選択性を示したのに対し,離れた位置に存在する僧帽細胞どうしで比較すると応答選択性は異なっていた.この事実は,同じ糸球体モジュールに属し同じ匂い情報を受け取る僧帽細胞がすべて一律に修飾されるのではなく,その空間的な配置に依存して多様な修飾をうけて匂い応答の特性の多様性をつくりだしていることを示した.
4.僧帽細胞の神経活動は細胞間の距離により規定される
顆粒細胞は僧帽細胞のもつ2次樹状突起において樹状突起のあいだにシナプスを形成し,抑制性入力を介して僧帽細胞の出力に影響をあたえる3,5).とくに,僧帽細胞の近くにシナプスを形成する顆粒細胞は僧帽細胞の近傍に位置しており,その活動は僧帽細胞の出力を大きく変容させる8,9).僧帽細胞のCa2+応答の多様性がひき起こされるひとつの原因として,僧帽細胞の出力の変容が複数の異なる顆粒細胞の活動により制御されていることが考えられる.僧帽細胞におけるCa2+応答の相違が複数の顆粒細胞との相互作用により生み出されているのかどうかを調べるため,僧帽細胞の応答の類似性と細胞間の距離との相関関係を調べた.
傍糸球体細胞においては細胞どうしの応答の類似性に細胞間の距離との有意な相関関係が観察されず,似た応答特性を示した.これに対して,僧帽細胞では細胞どうしの応答の類似性と細胞間の距離に負の相関が存在し,細胞どうしが離れるほどその応答の類似性は低下した.この結果は,近傍に位置する僧帽細胞は同じ顆粒細胞と相互作用するが,離れた位置にある僧帽細胞は異なる顆粒細胞と相互作用することにより,同じ嗅覚受容体からの刺激に異なる応答をしていることを示した.多様な匂い応答パターンは匂い情報伝達の細分化を意味し,細分化された匂い情報を個々の僧帽細胞が高次中枢へと伝達していることを示唆した10)(図2b).この糸球体モジュールの内部での多様な匂い表現パターンにより,哺乳類はかぎられた嗅覚受容体でより多くの匂い情報を識別できるものと考えられた.
おわりに
この研究は,脳の基本構造単位である“糸球体モジュール”の構造と機能の特徴を明らかにした.今後は,この機能単位構造を中心に,嗅球における匂い情報処理の神経機構についての理解がより深まるものと考える11).さらに,顆粒細胞が制御する僧帽細胞との組合せは新しい機能単位の候補と考えられ,この新しい“顆粒細胞-僧帽細胞”機能単位を中心として中枢への軸索投射様式を調べることにより,嗅覚中枢での匂い情報処理のさらなる解明が期待される.
文 献
- Mountcastle, V. B.: The columnar organization of the neocortex. Brain, 120, 701-722 (1997)[PubMed]
- Buck, L. & Axel, R.: A novel multigene family may encode odorant resceptors: a molecular basis for odor recognition. Cell, 65, 175-187 (1991)[PubMed]
- Mori, K. & Sakano, H.: How is the olfactory map formed and interpreted in the mammalian brain? Annu. Rev. Neurosci., 34, 467-499 (2011)[PubMed]
- Mombaerts, P., Wang, F., Dulac, C. et al.: Visualizing an olfactory sensory map. Cell, 87, 675-686 (1996)[PubMed]
- Shepherd, G. M., Chen, W. R. & Greer, C. A.: Olfactory bulb. in The Synaptic Organization of the Brain (Shepherd, G. M. ed.), pp. 165-216, Oxford University Press, Oxford (2004)
- Bozza, T., McGann, J. P., Mombaerts, P. et al.: In vivo imaging of neuronal activity by targeted expression of a genetically encoded probe in the mouse. Neuron, 42, 9-21 (2004)[PubMed]
- Nagayama, S., Zeng, S., Xiong, W. et al.: In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron, 53, 789-803. (2007)[PubMed]
- Lowe, G.: Inhibition of backpropagating action potentials in mitral cell secondary dendrites. J. Neurophysiol., 88, 64-85 (2002)[PubMed]
- Naritsuka, H., Sakai, K., Hashikawa, T. et al.: Perisomatic-targeting granule cells in the mouse olfactory bulb. J. Comp. Neurol., 515, 409-426 (2009)[PubMed]
- Tan, J., Savigner, A., Ma, M. et al.: Odor information processing by the olfactory bulb analyzed in gene-targeted mice. Neuron, 65, 912-926 (2010)[PubMed]
- Dhawale, A. K., Hagiwara, A., Bhalla, U. S. et al.: Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nat. Neurosci., 13, 979-987 (2010)[PubMed]
著者プロフィール
2009年 東京大学大学院医学系研究科博士課程,修了,2010年 米国Texas大学Medical School at Houston博士研究員を経て,2011年より東京大学医学部附属病院 助教.
永山 晋(Shin Nagayama)
米国Texas大学Medical School at Houston助教.
© 2013 菊田 周・永山 晋 Licensed under CC 表示 2.1 日本