Toll様受容体であるTLR8二量体はリガンドとの結合により再構成される
丹治裕美・大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2013.044
Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands.
Hiromi Tanji, Umeharu Ohto, Takuma Shibata, Kensuke Miyake, Toshiyuki Shimizu
Science, 339, 1426-1429 (2013)
Toll様受容体のうちTLR7およびTLR8はウイルスに由来する1本鎖RNAを認識し自然免疫反応をひき起こす.TLR7およびTLR8の合成低分子リガンドは抗ウイルス薬やがんに対する治療薬としてすでに臨床に応用されているが,これらのリガンドによるTLR7あるいはTLR8の活性化機構およびリガンド認識機構はまったく不明であった.今回,筆者らは,ヒトのTLR8についてリガンド非結合型二量体およびリガンド結合型二量体のX線結晶構造解析を行い,低分子リガンドの認識機構を明らかにした.その結果,いずれの構造においてもTLR8は細胞外ドメインに存在する約40残基の挿入ループであるZループにおいて切断されていたが,N末端側の断片とC末端側の断片とが会合してリング形の構造を保っていることがわかった.また,TLR8の二量体構造は,リガンド非結合型およびリガンド結合型のいずれも,C末端どうしでむかいあったm字型をしており,リガンドとの結合により二量体の相互作用面が変化しC末端どうしの距離が接近することが明らかになった.このことから,リガンドとの結合によりTLR8二量体は再構成されシグナルを細胞内に伝達しているものと結論づけた.
Toll様受容体(Toll like receptor:TLR)は細菌やウイルスなど病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質である1).Toll様受容体の認識する分子パターンはリポタンパク質,リポ多糖,フラジェリン,核酸など多岐にわたり,マクロファージや樹状細胞,単球などに存在する2).Toll様受容体は細胞外に分子パターン認識を行うLRRドメインをもち,細胞内にはシグナル伝達を行うTIRドメインをもつ.一般に,Toll様受容体はリガンド非結合型では単量体であり,リガンドとの結合により二量体の活性化状態となり細胞内ドメインが接近することにより細胞内にシグナルを伝達すると考えられている3).Toll様受容体のうちTLR7およびTLR8はエンドソームに存在し,ウイルスに由来する1本鎖RNAやイミダゾキノリン系の合成低分子リガンドなどを認識する4-7).TLR7あるいはTLR8を活性化または不活性化させる化合物は抗ウイルス薬あるいはがんに対する治療薬として注目されているが,それらによるRNAや低分子リガンドの認識機構やシグナル伝達機構は不明であった.
TLR8の細胞外ドメインはLRR1からLRR26により構成され,LRR14とLRR15とのあいだには約40残基の挿入ループであるZループが存在する.このZループはサブファミリーを構成するTLR7,TLR8,TLR9のあいだで保存されており,TLR7およびTLR9に関してはZループにおける切断が活性化に必要であるという報告がある8,9).また,TLR8およびTLR9はリガンド非結合型でも二量体を形成しているとの報告がある10,11).今回,筆者らは,ヒトのTLR8について,リガンド非結合型およびリガンド結合型のX線結晶構造解析を行い,リガンド認識機構および活性化機構に関する構造基盤を報告した.
ヒトのTLR8について,その細胞外ドメインの全長をC末端にプロテインAタグをつけたコンストラクトを用い,糖鎖生合成の阻害剤であるキフネンシンの存在下においてショウジョウバエS2細胞を用いて分泌発現させ,数段階の精製ステップをへて高純度の精製試料を得た.TLR8は精製の途中ですでにZループにおいて切断され2本のポリペプチド鎖に分かれていた.この2本のポリペプチド鎖は精製の途中で分離しなかったことから,切断ののちN末端側の断片とC末端側の断片とは強く会合していることが示唆された.ゲルろ過クロマトグラフィーとX線小角散乱を用いて溶液状態での性状を調べたところ,TLR8はリガンド非存在下および存在下とも二量体であるが,リガンドに依存的に構造変化を起こしていることが明らかになった.この構造変化をより詳細に明らかにするため,得られた精製試料を用いて結晶化を行った.結晶化の際には,TLR8のアゴニストであるイミダゾキノリン系低分子リガンド(CL097,R848)およびチアゾキノリン系低分子リガンド(CL075)を用いた.リガンド非結合型で1種,リガンド結合型で5種の結晶が得られた.リガンド結合型の結晶のうちひとつについて重原子同型置換法により位相を決定し,ほかの結晶の構造は分子置換法により構造解析を行った.最終的に,リガンド非結合型は分解能2.3Å(PDB ID:3W3G),リガンド結合型は分解能2.0~2.7Å(PDB ID:3W3J,3W3K,3W3L,3W3M,3W3N)で構造を決定した.
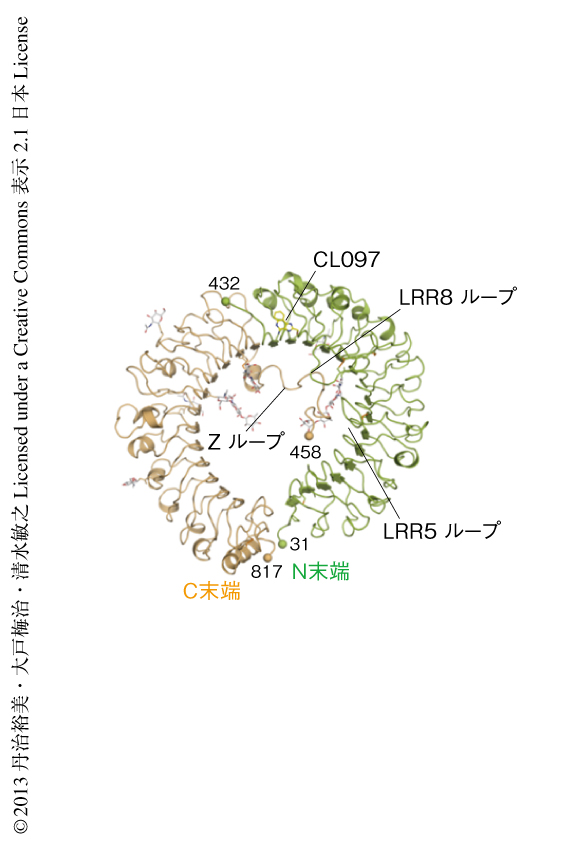
TLR8はいずれの結晶においても二量体を形成していた.そのプロトマーはZループにおいて切断をうけていたが,N末端側の断片とC末端側の断片とのあいだには複数の相互作用があり,全体としてリング形の構造を形成していた(図1).この構造はこれまで報告されているToll様受容体の馬蹄形の構造3) とは異なっていた.一般的に,LRRドメインはとなりあうLRRドメインどうしで相互作用し,馬蹄形構造の内側で平行βシートを,外側でループ間相互作用を形成する3).TLR8の場合も,切断部位であるZループをはさんだLRR14とLRR15は,ほかのLRRドメインと同様に,リング状構造の内側で平行βシートを形成していた.一方で,LRR13とLRR15のループの部分が相互作用しており,LRR14のループの部分は馬蹄形構造から押し出されていた.また,ZループのC末端側はLRR5やLRR8のループの部分などと疎水性相互作用を形成しリングの内側に収納されていた.また,ZループのC末端側にはαヘリックスが存在し,これはCys479(Zループ)とCys506(LRR16)とのジスルフィド結合により安定化されていた.
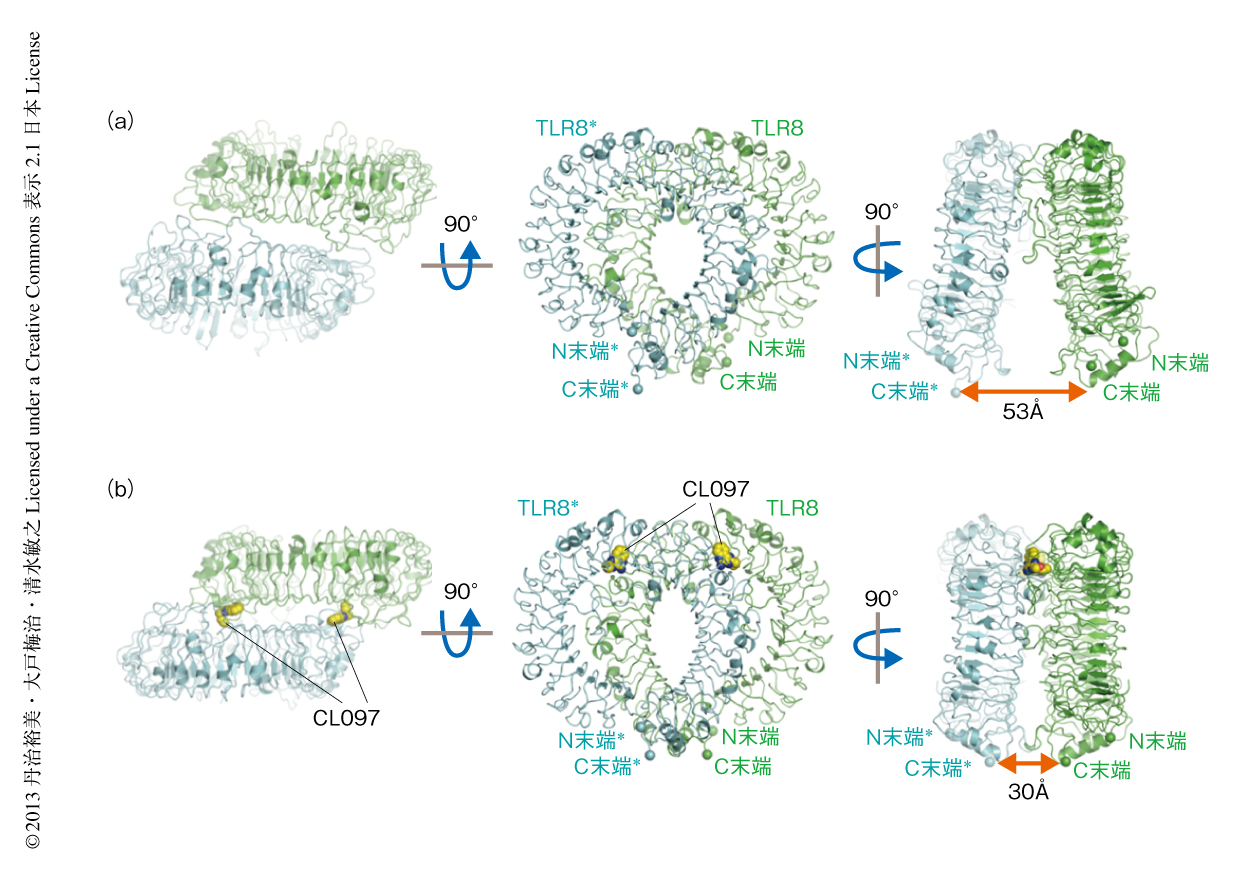
TLR8はリガンド非結合型およびリガンド結合型のいずれにおいても,C末端どうしでむかいあったm字型の2回対称をとる二量体を形成していた(図2).これはゲルろ過クロマトグラフィーおよびX線小角散乱の結果と対応していた.リガンドは二量体の界面の2か所に等価な様式で結合していた.
リガンド非結合型では2つのプロトマーのC末端どうしは53Å離れており(図2a),生体では細胞内にあるTIRドメインの二量体化は起こらないと考えられた.このことから,リガンド非結合型のTLR8は不活性化型の構造であると結論づけた.一方で,リガンド結合型では2つのプロトマーのC末端どうしの距離は約30Åと接近していた(図2b).この構造は,解析された5種類のリガンド結合型の構造においていずれも同様であったことから,結晶において生じた人工的な構造ではなく真の構造を反映したものと考えた.リガンド結合型では2つのプロトマーのC末端どうしが接近しており,生体では細胞内のTIRドメインも二量体を形成し細胞内にシグナルを伝達しているものと考えられた.よって,リガンド結合型のTLR8は活性化型の構造であると結論づけた.
リガンド非結合型では二量体の界面は水素結合と疎水性相互作用により構成されていた.一方,リガンド結合型では二量体の界面は大きく再構成されており,より広範囲な領域にわたり相互作用していた.
リガンドの電子密度はいずれの結晶構造においても二量体の界面の2か所にはっきりと観察された.リガンドはLRR11~14とLRR16*~18*とのあいだに1分子,および,LRR11*~14*とLRR16~18とのあいだに1分子が結合しており,2つのプロトマーをつなぐ糊のような役割をはたしていた(図2b).また,Zループにおいて切断されたN末端側の断片とC末端側の断片は,いずれもリガンドの認識にかかわっていた.Zループにおける切断と活性との関連の構造的な詳細は現時点では不明だが,少なくとも,活性化型のTLR8にはそのN末端側の断片とC末端側の断片の両方が必要であることが示された.TLR7およびTLR9においても,機能および構造的な類推から同様である可能性が高い.
リガンドの芳香環はTLR8のPhe405とスタッキング相互作用を形成していた.また,リガンドのアミジン基とTLR8のAsp543*の側鎖,および,リガンドのイミダゾール基やチアゾール基の窒素原子とTLR8のThr574*の主鎖の窒素原子とは水素結合を形成していた.リガンドの2-エトキシメチル基や2-プロピル基は,TLR8のPhe346,Tyr348,Val378,Ile403,Phe405,Val573*により形成された疎水性ポケットに入っていた.これらリガンドと相互作用していた残基の重要性を確認するため,これらの残基のAla変異体を用いてNF-κBリポーターアッセイを行った.低分子リガンドにより刺激した際にPhe405,Asp543,Tyr348,Val520,Thr574の変異体では顕著な活性の低下がみられ,これらの残基が低分子リガンドの認識に重要であることが示された.同様に,1本鎖RNAにより刺激した際にもPhe405,Asp543,Tyr348,Thr574の変異体では活性の低下が観察され,これらの残基が1本鎖RNAの認識にもかかわっていることが示唆された.一方で,Arg429やVal378の変異体では低分子リガンドに対する応答は変化しなかったが1本鎖RNAへの応答が減少しており,これらの残基は1本鎖RNAに特異的な認識にかかわっている可能性が高いと思われた.低分子リガンドの大きさはRNAの1塩基分に相当すると考えられるので,TLR8は1本鎖RNAの1塩基を低分子リガンドと同様の機構により認識するのではないかと推測された.
リガンド非結合型では二量体の界面はLRR8とLRR18*,LRR11~13とLRR14*~15*から構成されていた(図3).一方,リガンド結合型では,LRR8はLRR18*~20*に,LRR11はLRR18*に,LRR11~13はLRR17*~18*に,それぞれ相互作用の相手を変え,さらに,新たにLRR5とLRR20*との相互作用が生じていた.この二量体構造の再構成は,全体としてみると,それぞれのプロトマーのリング状構造の回転運動,および,ヒンジ運動によるC末端側の接近という2つの動きから構成されていた.結果として,リガンド非結合型において形成されていた2つのプロトマーのあいだの相互作用は,リガンド結合型では完全に再構成されていた.特徴的な相互作用の変化として,リガンド非結合型ではPhe405はPhe494*とスタッキング相互作用を形成していたが,リガンド結合型ではリガンドの芳香環と相互作用を形成していた.これらを総合すると,リガンドとの結合により二量体が再構成されてC末端どうしが接近した活性化型の構造となり,その結果,細胞内ドメインも二量体となりシグナルが細胞内に伝達すると考えられた.
TLR8においてリガンド結合部位を形成するポケットは,リガンド非結合型では別の残基でしめられ存在しなかった.そのため,リガンドが結合するにはTLR8の2つのプロトマーが協調して構造変化する必要がある.一方,これまでの構造解析の結果では,不活性化型の単量体がリガンドとの結合により二量体化し活性化型になると考えられている.たとえば,リポ多糖を認識するTLR4-MD-2複合体の場合には,リガンド結合部位であるMD-2のポケットはもともと存在している12).ひとつのTLR4-MD-2複合体に対し1分子のリポ多糖が結合してTLR4-MD-2-リポ多糖複合体となり,これが二量体化すると考えられている.TLR8がなぜこのようにユニークな活性化機構を採用しているのか,非常に興味深い.
この研究により,TLR8のリガンド非結合型とリガンド結合型の詳細な立体構造が明らかになった.その結果,リガンド非結合型およびリガンド結合型のTLR8はいずれも二量体として存在し,リガンドと結合することによりそのC末端側が近接するよう二量体が再構成されることが明らかになった.この二量体の再構成により細胞内ドメインも接近し細胞内にシグナルを伝達するものと考えられた.これはToll様受容体の新しい活性化機構を実証するものであった.また,TLR8によるリガンド認識機構が原子レベルで明らかになった.この結果は,TLR8をターゲットとした抗ウイルス薬あるいはがんに対する治療薬などの開発につながるものと期待される.
略歴:東京大学大学院薬学系研究科修士課程 在籍中.
研究テーマ:自然免疫系受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 助教.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2013 丹治裕美・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2013.044
Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands.
Hiromi Tanji, Umeharu Ohto, Takuma Shibata, Kensuke Miyake, Toshiyuki Shimizu
Science, 339, 1426-1429 (2013)
要 約
Toll様受容体のうちTLR7およびTLR8はウイルスに由来する1本鎖RNAを認識し自然免疫反応をひき起こす.TLR7およびTLR8の合成低分子リガンドは抗ウイルス薬やがんに対する治療薬としてすでに臨床に応用されているが,これらのリガンドによるTLR7あるいはTLR8の活性化機構およびリガンド認識機構はまったく不明であった.今回,筆者らは,ヒトのTLR8についてリガンド非結合型二量体およびリガンド結合型二量体のX線結晶構造解析を行い,低分子リガンドの認識機構を明らかにした.その結果,いずれの構造においてもTLR8は細胞外ドメインに存在する約40残基の挿入ループであるZループにおいて切断されていたが,N末端側の断片とC末端側の断片とが会合してリング形の構造を保っていることがわかった.また,TLR8の二量体構造は,リガンド非結合型およびリガンド結合型のいずれも,C末端どうしでむかいあったm字型をしており,リガンドとの結合により二量体の相互作用面が変化しC末端どうしの距離が接近することが明らかになった.このことから,リガンドとの結合によりTLR8二量体は再構成されシグナルを細胞内に伝達しているものと結論づけた.
はじめに
Toll様受容体(Toll like receptor:TLR)は細菌やウイルスなど病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質である1).Toll様受容体の認識する分子パターンはリポタンパク質,リポ多糖,フラジェリン,核酸など多岐にわたり,マクロファージや樹状細胞,単球などに存在する2).Toll様受容体は細胞外に分子パターン認識を行うLRRドメインをもち,細胞内にはシグナル伝達を行うTIRドメインをもつ.一般に,Toll様受容体はリガンド非結合型では単量体であり,リガンドとの結合により二量体の活性化状態となり細胞内ドメインが接近することにより細胞内にシグナルを伝達すると考えられている3).Toll様受容体のうちTLR7およびTLR8はエンドソームに存在し,ウイルスに由来する1本鎖RNAやイミダゾキノリン系の合成低分子リガンドなどを認識する4-7).TLR7あるいはTLR8を活性化または不活性化させる化合物は抗ウイルス薬あるいはがんに対する治療薬として注目されているが,それらによるRNAや低分子リガンドの認識機構やシグナル伝達機構は不明であった.
TLR8の細胞外ドメインはLRR1からLRR26により構成され,LRR14とLRR15とのあいだには約40残基の挿入ループであるZループが存在する.このZループはサブファミリーを構成するTLR7,TLR8,TLR9のあいだで保存されており,TLR7およびTLR9に関してはZループにおける切断が活性化に必要であるという報告がある8,9).また,TLR8およびTLR9はリガンド非結合型でも二量体を形成しているとの報告がある10,11).今回,筆者らは,ヒトのTLR8について,リガンド非結合型およびリガンド結合型のX線結晶構造解析を行い,リガンド認識機構および活性化機構に関する構造基盤を報告した.
1.TLR8の細胞外ドメインの発現,性状解析,構造決定
ヒトのTLR8について,その細胞外ドメインの全長をC末端にプロテインAタグをつけたコンストラクトを用い,糖鎖生合成の阻害剤であるキフネンシンの存在下においてショウジョウバエS2細胞を用いて分泌発現させ,数段階の精製ステップをへて高純度の精製試料を得た.TLR8は精製の途中ですでにZループにおいて切断され2本のポリペプチド鎖に分かれていた.この2本のポリペプチド鎖は精製の途中で分離しなかったことから,切断ののちN末端側の断片とC末端側の断片とは強く会合していることが示唆された.ゲルろ過クロマトグラフィーとX線小角散乱を用いて溶液状態での性状を調べたところ,TLR8はリガンド非存在下および存在下とも二量体であるが,リガンドに依存的に構造変化を起こしていることが明らかになった.この構造変化をより詳細に明らかにするため,得られた精製試料を用いて結晶化を行った.結晶化の際には,TLR8のアゴニストであるイミダゾキノリン系低分子リガンド(CL097,R848)およびチアゾキノリン系低分子リガンド(CL075)を用いた.リガンド非結合型で1種,リガンド結合型で5種の結晶が得られた.リガンド結合型の結晶のうちひとつについて重原子同型置換法により位相を決定し,ほかの結晶の構造は分子置換法により構造解析を行った.最終的に,リガンド非結合型は分解能2.3Å(PDB ID:3W3G),リガンド結合型は分解能2.0~2.7Å(PDB ID:3W3J,3W3K,3W3L,3W3M,3W3N)で構造を決定した.
2.TLR8の単量体の構造
TLR8はいずれの結晶においても二量体を形成していた.そのプロトマーはZループにおいて切断をうけていたが,N末端側の断片とC末端側の断片とのあいだには複数の相互作用があり,全体としてリング形の構造を形成していた(図1).この構造はこれまで報告されているToll様受容体の馬蹄形の構造3) とは異なっていた.一般的に,LRRドメインはとなりあうLRRドメインどうしで相互作用し,馬蹄形構造の内側で平行βシートを,外側でループ間相互作用を形成する3).TLR8の場合も,切断部位であるZループをはさんだLRR14とLRR15は,ほかのLRRドメインと同様に,リング状構造の内側で平行βシートを形成していた.一方で,LRR13とLRR15のループの部分が相互作用しており,LRR14のループの部分は馬蹄形構造から押し出されていた.また,ZループのC末端側はLRR5やLRR8のループの部分などと疎水性相互作用を形成しリングの内側に収納されていた.また,ZループのC末端側にはαヘリックスが存在し,これはCys479(Zループ)とCys506(LRR16)とのジスルフィド結合により安定化されていた.
3.TLR8の二量体の構造
TLR8はリガンド非結合型およびリガンド結合型のいずれにおいても,C末端どうしでむかいあったm字型の2回対称をとる二量体を形成していた(図2).これはゲルろ過クロマトグラフィーおよびX線小角散乱の結果と対応していた.リガンドは二量体の界面の2か所に等価な様式で結合していた.
リガンド非結合型では2つのプロトマーのC末端どうしは53Å離れており(図2a),生体では細胞内にあるTIRドメインの二量体化は起こらないと考えられた.このことから,リガンド非結合型のTLR8は不活性化型の構造であると結論づけた.一方で,リガンド結合型では2つのプロトマーのC末端どうしの距離は約30Åと接近していた(図2b).この構造は,解析された5種類のリガンド結合型の構造においていずれも同様であったことから,結晶において生じた人工的な構造ではなく真の構造を反映したものと考えた.リガンド結合型では2つのプロトマーのC末端どうしが接近しており,生体では細胞内のTIRドメインも二量体を形成し細胞内にシグナルを伝達しているものと考えられた.よって,リガンド結合型のTLR8は活性化型の構造であると結論づけた.
リガンド非結合型では二量体の界面は水素結合と疎水性相互作用により構成されていた.一方,リガンド結合型では二量体の界面は大きく再構成されており,より広範囲な領域にわたり相互作用していた.
4.TLR8のリガンド認識機構
リガンドの電子密度はいずれの結晶構造においても二量体の界面の2か所にはっきりと観察された.リガンドはLRR11~14とLRR16*~18*とのあいだに1分子,および,LRR11*~14*とLRR16~18とのあいだに1分子が結合しており,2つのプロトマーをつなぐ糊のような役割をはたしていた(図2b).また,Zループにおいて切断されたN末端側の断片とC末端側の断片は,いずれもリガンドの認識にかかわっていた.Zループにおける切断と活性との関連の構造的な詳細は現時点では不明だが,少なくとも,活性化型のTLR8にはそのN末端側の断片とC末端側の断片の両方が必要であることが示された.TLR7およびTLR9においても,機能および構造的な類推から同様である可能性が高い.
リガンドの芳香環はTLR8のPhe405とスタッキング相互作用を形成していた.また,リガンドのアミジン基とTLR8のAsp543*の側鎖,および,リガンドのイミダゾール基やチアゾール基の窒素原子とTLR8のThr574*の主鎖の窒素原子とは水素結合を形成していた.リガンドの2-エトキシメチル基や2-プロピル基は,TLR8のPhe346,Tyr348,Val378,Ile403,Phe405,Val573*により形成された疎水性ポケットに入っていた.これらリガンドと相互作用していた残基の重要性を確認するため,これらの残基のAla変異体を用いてNF-κBリポーターアッセイを行った.低分子リガンドにより刺激した際にPhe405,Asp543,Tyr348,Val520,Thr574の変異体では顕著な活性の低下がみられ,これらの残基が低分子リガンドの認識に重要であることが示された.同様に,1本鎖RNAにより刺激した際にもPhe405,Asp543,Tyr348,Thr574の変異体では活性の低下が観察され,これらの残基が1本鎖RNAの認識にもかかわっていることが示唆された.一方で,Arg429やVal378の変異体では低分子リガンドに対する応答は変化しなかったが1本鎖RNAへの応答が減少しており,これらの残基は1本鎖RNAに特異的な認識にかかわっている可能性が高いと思われた.低分子リガンドの大きさはRNAの1塩基分に相当すると考えられるので,TLR8は1本鎖RNAの1塩基を低分子リガンドと同様の機構により認識するのではないかと推測された.
5.リガンドとの結合によるTLR8二量体の再構成
リガンド非結合型では二量体の界面はLRR8とLRR18*,LRR11~13とLRR14*~15*から構成されていた(図3).一方,リガンド結合型では,LRR8はLRR18*~20*に,LRR11はLRR18*に,LRR11~13はLRR17*~18*に,それぞれ相互作用の相手を変え,さらに,新たにLRR5とLRR20*との相互作用が生じていた.この二量体構造の再構成は,全体としてみると,それぞれのプロトマーのリング状構造の回転運動,および,ヒンジ運動によるC末端側の接近という2つの動きから構成されていた.結果として,リガンド非結合型において形成されていた2つのプロトマーのあいだの相互作用は,リガンド結合型では完全に再構成されていた.特徴的な相互作用の変化として,リガンド非結合型ではPhe405はPhe494*とスタッキング相互作用を形成していたが,リガンド結合型ではリガンドの芳香環と相互作用を形成していた.これらを総合すると,リガンドとの結合により二量体が再構成されてC末端どうしが接近した活性化型の構造となり,その結果,細胞内ドメインも二量体となりシグナルが細胞内に伝達すると考えられた.
TLR8においてリガンド結合部位を形成するポケットは,リガンド非結合型では別の残基でしめられ存在しなかった.そのため,リガンドが結合するにはTLR8の2つのプロトマーが協調して構造変化する必要がある.一方,これまでの構造解析の結果では,不活性化型の単量体がリガンドとの結合により二量体化し活性化型になると考えられている.たとえば,リポ多糖を認識するTLR4-MD-2複合体の場合には,リガンド結合部位であるMD-2のポケットはもともと存在している12).ひとつのTLR4-MD-2複合体に対し1分子のリポ多糖が結合してTLR4-MD-2-リポ多糖複合体となり,これが二量体化すると考えられている.TLR8がなぜこのようにユニークな活性化機構を採用しているのか,非常に興味深い.
おわりに
この研究により,TLR8のリガンド非結合型とリガンド結合型の詳細な立体構造が明らかになった.その結果,リガンド非結合型およびリガンド結合型のTLR8はいずれも二量体として存在し,リガンドと結合することによりそのC末端側が近接するよう二量体が再構成されることが明らかになった.この二量体の再構成により細胞内ドメインも接近し細胞内にシグナルを伝達するものと考えられた.これはToll様受容体の新しい活性化機構を実証するものであった.また,TLR8によるリガンド認識機構が原子レベルで明らかになった.この結果は,TLR8をターゲットとした抗ウイルス薬あるいはがんに対する治療薬などの開発につながるものと期待される.
文 献
- Janeway, C. A. Jr. & Medzhitov, R.: Innate immune recognition. Annu. Rev. Immunol., 20, 197-216 (2002)[PubMed]
- Hornung, V., Rothenfusser, S., Britsch, S. et al.: Quantitative expression of toll-like receptor 1-10 mRNA in cellular subsets of human peripheral blood mononuclear cells and sensitivity to CpG oligodeoxynucleotides. J. Immunol. 168, 4531-4537 (2002)[PubMed]
- Song, D. H. & Lee, J. O.: Sensing of microbial molecular patterns by Toll-like receptors. Immunol. Rev., 250, 216-229 (2012)[PubMed]
- Diebold, S. S., Kaisho, T., Hemmi, H. et al.: Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science, 303, 1529-1531 (2004)[PubMed]
- Heil, F., Hemmi, H., Hochrein, H. et al.: Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8. Science, 303, 1526-1529 (2004)[PubMed]
- Jurk, M., Heil, F., Vollmer, J. et al.: Human TLR7 or TLR8 independently confer responsiveness to the antiviral compound R-848. Nat. Immunol., 3, 499 (2002)[PubMed]
- Hemmi, H., Kaisho, T., Takeuchi, O. et al.: Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nat. Immunol., 3, 196-200 (2002)[PubMed]
- Ewald, S. E., Engel, A., Lee, J. et al.: Nucleic acid recognition by Toll-like receptors is coupled to stepwise processing by cathepsins and asparagine endopeptidase. J. Exp. Med., 208, 643-651 (2011)[PubMed]
- Ewald, S. E., Lee, B. L., Lau, L. et al.: The ectodomain of Toll-like receptor 9 is cleaved to generate a functional receptor. Nature, 456, 658-662 (2008)[PubMed]
- Zhu, J., van Drunen Littel-van den Hurk, S., Brownlie, R. et al.: Multiple molecular regions confer intracellular localization of bovine Toll-like receptor 8. Mol. Immunol., 46, 884-892 (2009)[PubMed]
- Latz, E., Verma, A., Visintin, A. et al.: Ligand-induced conformational changes allosterically activate Toll-like receptor 9. Nat. Immunol., 8, 772-779 (2007)[PubMed]
- Park, B. S., Song, D. H., Kim, H. M. et al.: The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex. Nature, 458, 1191-1195 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院薬学系研究科修士課程 在籍中.
研究テーマ:自然免疫系受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 助教.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2013 丹治裕美・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本