ポリコーム抑制複合体PRC1は雌性始原生殖細胞の性分化のタイミングを制御する
横林 しほり
(スイスFriedrich Miescher Institute for Biomedical Research)
email:横林しほり
DOI: 10.7875/first.author.2013.039
PRC1 coordinates timing of sexual differentiation of female primordial germ cells.
Shihori Yokobayashi, Ching-Yeu Liang, Hubertus Kohler, Peter Nestorov, Zichuan Liu, Miguel Vidal, Maarten van Lohuizen, Tim C. Roloff, Antoine H. F. M. Peters
Nature, 495, 236-240 (2013)
哺乳類における始原生殖細胞の性分化は環境からの外的な要因により決定される.マウスの雌の始原生殖細胞では,中腎から供給されるレチノイン酸に応答してStra8遺伝子の発現と減数分裂が誘導される.レチノイン酸シグナルは発生において広範囲に作用することが知られており,始原生殖細胞において適切なタイミングでのStra8遺伝子の発現と減数分裂の開始を可能にする分子機構はわかっていない.この研究では,ポリコーム抑制複合体PRC1の中心的な構成タンパク質をコードするRing1遺伝子とRnf2遺伝子について,始原生殖細胞の発生における遺伝子量に依存的な役割を明らかにした.Ring1遺伝子とRnf2遺伝子は胎生10.5日から胎生11.5日のあいだ始原生殖細胞の発生に必須である.そののち,雌の始原生殖細胞においてRnf2遺伝子は,Oct4遺伝子とNanog遺伝子の高い発現レベルの維持,および,減数分裂期遺伝子の早期発現の誘導と減数分裂前期への早期進行の抑制に必要である.レチノイン酸シグナルを化学的に抑制すると,Rnf2遺伝子を欠失した雌の始原生殖細胞における早期のOct4遺伝子の発現減少とStra8遺伝子の活性化が部分的に抑圧された.クロマチン免疫沈降法による解析により,始原生殖細胞においてStra8がポリコーム抑制複合体であるPRC1とPRC2の直接の標的であることが示された.以上の結果は,PRC1の構成タンパク質をコードする遺伝子の遺伝子量は,始原生殖細胞の発生と雌の始原生殖細胞における性決定のタイミングを制御するうえで重要であり,外部からのレチノイン酸シグナルに対し拮抗的にはたらくことを示した.
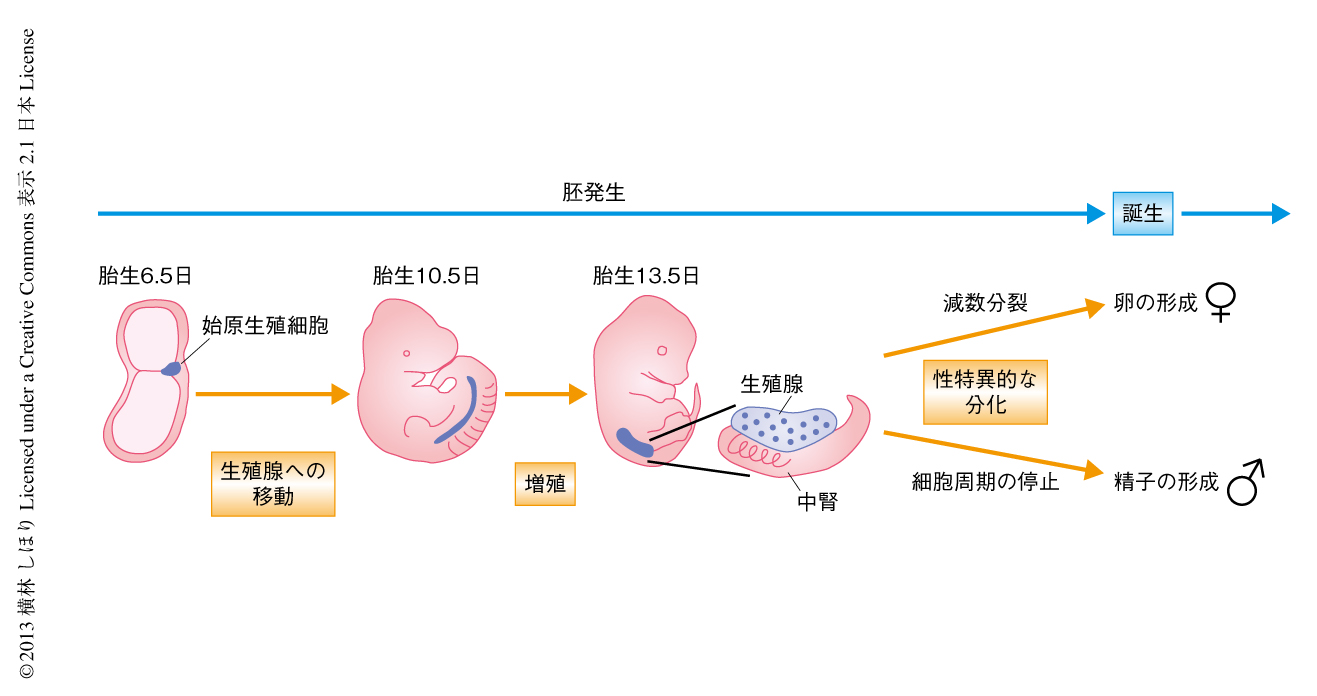
哺乳類では,始原生殖細胞(primordial germ cell:PGC)は着床ののちの胚発生期に周囲からのシグナル伝達に応答して胚外中胚葉に出現する1).マウスでは,胎生7日ごろに約40の細胞が始原生殖細胞として特定される.そののち,始原生殖細胞は増殖し,後腸内胚葉をとおり生殖腺への移動を開始する.始原生殖細胞は胎生10日ごろまでに生殖腺に到達したのち,細胞分裂を再開し最終的に胎生13.5日までに数千個から1万個にまで増殖する.そののち,雄の始原生殖細胞はG1期/G0期において細胞周期を停止し誕生するまで待機するが,雌の始原生殖細胞は減数分裂を開始する(図1).
この雌の始原生殖細胞における減数分裂の誘導には,これまで,レチノイン酸シグナルが重要なはたらきをしていることが示されている2).雌の胚では胎生11.5日ごろから生殖腺に隣接する中腎からレチノイン酸が分泌されはじめる.そのレチノイン酸シグナルに応答して,胎生13.5日ごろから始原生殖細胞においてStra8(stimulated by retinoic acid gene 8)遺伝子の発現が誘導される3,4).Stra8遺伝子は減数分裂の誘導の鍵となる遺伝子であり,Stra8ノックアウトマウスでは減数分裂前DNA合成の異常が観察されている5).しかし,Stra8遺伝子の発現誘導のタイミングを決める分子機構は明らかではなかった.
ポリコーム抑制複合体(polycomb repressive complex:PRC)は高等真核生物に広く保存されているタンパク質複合体であり,哺乳類にはPRC1とPRC2が存在する6).PRC2はヒストンH3の27番目のリジン残基にトリメチル基を付加する活性,一方,PRC1はヒストンH2Aの119番目のリジン残基をモノユビキチン化する活性をもち,ともに遺伝子発現の抑制に関与する.ES細胞などを用いたゲノムワイドなクロマチン免疫沈降法による解析から,PRC1とPRC2は多くの場合において共通の遺伝子を標的にすることが示されている.また,その標的となる遺伝子には発生や分化にかかわる転写因子をコードする遺伝子が多く含まれていることから,ポリコーム抑制複合体は細胞の幹細胞性や自己複製能の維持および分化過程の制御において重要な役割を担っていると考えられている.そこで,この研究では,始原生殖細胞の発生過程におけるポリコーム複合体PRC1の機能解析を試みた.
PRC1のユビキチン化活性はその構成タンパク質であるRnf2とそのパラログRing1によって担われている.Rnf2ノックアウトマウスは胚性致死となるが,Ring1ノックアウトマウスは胚発生および生殖に問題はなくおもだった表現型を示さない.始原生殖細胞におけるRnf2の機能を解析するため,始原生殖細胞においてRnf2を特異的に欠損するコンディショナルノックアウトマウスを作製した7).PRC1の機能を包括的に解析するためRing1とRnf2のダブルノックアウトマウスも作製した.
まず,始原生殖細胞に特異的なRnf2コンディショナルノックアウトマウスの胚の生殖腺を始原生殖細胞の発生中期から後期(胎生10.5日~胎生13.5日)にかけて観察したところ,雄では野生型マウスの胚との明らかな違いは観察されなかったのに対し,雌では胎生12.5日から始原生殖細胞マーカーに陽性を示す細胞の数が減少していた.免疫染色および遺伝子発現解析を定量的に行ったところ,Rnf2を欠損した細胞では多能性のマーカーであるOct4遺伝子およびNanogの発現が,とくに雌の始原生殖細胞において有意に減少していた.一方,Ring1欠損と始原生殖細胞に特異的なRnf2欠損の二重変異をもつ胚では,雌雄ともにすでに胎生11.5日において始原生殖細胞マーカーに陽性を示す細胞の減少が観察された.このことから,PRC1はおそらく始原生殖細胞において多能性遺伝子の発現を正に制御することにより,始原生殖細胞の増殖に必須の役割をはたしていることが示唆された.さらに,Rnf2欠損胚と,Ring1 Rnf2二重欠損胚との表現型の違いから,雌性始原生殖細胞の発生においてはRing1遺伝子だけでは十分でなくRnf2遺伝子が必要であることが示された.
始原生殖細胞に特異的なRnf2欠損胚において,なぜ雌に特異的に始原生殖細胞の増殖に異常がみられるのかを調べるため,生殖腺から始原生殖細胞を単離してmRNAを抽出し,マイクロアレイ法を用いて遺伝子発現解析を行った.胎生11.5日において始原生殖細胞を比較すると,始原生殖細胞に特異的なRnf2欠損胚から単離した始原生殖細胞において異常な発現量を示す遺伝子は,雌雄ともに多くはみつからなかった.しかし,胎生12.5日では,雌において500以上の遺伝子がRnf2を欠損した始原生殖細胞で有意に発現量の異常を示す一方,雄では発現量の異常を示す遺伝子は50以下にとどまった.これらの遺伝子のうち90%以上は野生型の始原生殖細胞に比べRnf2を欠損した始原生殖細胞において発現が上昇しており,このことはRnf2あるいはPRC1が遺伝子発現の抑制に関与しているという知見と合致した.遺伝子オントロジー解析によりこれらの遺伝子を機能により分類すると,雌のRnf2を欠損した始原生殖細胞において発現量の上昇した遺伝子には減数分裂に関与する遺伝子が多く含まれていた.しかし,予想とは異なり,ES細胞などにおいてポリコーム抑制複合体の標的として知られている発生や分化にかかわる基本的な遺伝子はほとんど含まれてなかった.このことから,雌のRnf2を欠損した始原生殖細胞では始原生殖細胞の発生から分化の過程に特異的にかかわる遺伝子の発現が異常になっていることが考えられた.
そこで,始原生殖細胞の発生後期に起こる遺伝子発現の変化を調べるため,まず野生型の胚から始原生殖細胞を経時的に単離しマイクロアレイ解析を行った.胎生11.5日と胎生13.5日とを比較すると,雌の始原生殖細胞では約1000,雄の始原生殖細胞では約300の遺伝子が胎生13.5日において発現量が上昇していることがわかった.胎生11.5日の始原生殖細胞では雌雄の違いは観察されないが,胎生13.5日では始原生殖細胞においてすでに性特異的な分化がはじまっていると考えられていることから,これらの遺伝子は始原生殖細胞の分化プログラムにより発現誘導される遺伝子であると考えられた.雌の野生型の始原生殖細胞において胎生11.5日から胎生13.5日にかけて発現量の上昇した遺伝子と比較すると,雌のRnf2を欠損した始原生殖細胞において胎生12.5日に異常な発現上昇のみられた遺伝子のうち40%以上が重複していた.さらに,この野生型の始原生殖細胞において胎生11.5日から胎生13.5日にかけて発現の上昇が誘導される遺伝子について個々のマイクロアレイデータをクラスタリング解析したところ,雄では胎生12.5日のRnf2を欠損した始原生殖細胞は胎生12.5日の野生型の始原生殖細胞にもっとも近い遺伝子発現パターンを示したのに対し,雌では胎生12.5日のRnf2を欠損した始原生殖細胞は胎生12.5日ではなく胎生13.5日の野生型の雌の始原生殖細胞とクラスターを形成した.このことは,胎生12.5日の雌のRnf2を欠損した始原生殖細胞では,すでに胎生13.5日の雌性始原生殖細胞様の遺伝子発現が誘導されている,つまり,雌の分化プログラムが1日早く誘導されている可能性が示唆された.
実際におのおのの遺伝子のmRNAを定量的に調べたところ,雌のRnf2を欠損した始原生殖細胞では,Stra8遺伝子をはじめとして,Rec8遺伝子,Sycp3遺伝子,Hormad2遺伝子など減数分裂期遺伝子が,野生型の始原生殖細胞に比べ胎生12.5日においてすでに発現が上昇,つまり,脱抑制していた.一方,これらの遺伝子発現は雄のRnf2を欠損した始原生殖細胞においては野生型の始原生殖細胞に比べ有意な差はみられなかった.免疫染色によりそれぞれのタンパク質の局在を観察したところ,雌の野生型の胚ではStra8の核における局在が胎生13.5日から観察されはじめたのに対し,始原生殖細胞に特異的にRnf2を欠損した胚では胎生12.5日においてすでにStra8の核への蓄積が認められた.通常,野生型の胚では胎生13.5日から始原生殖細胞は徐々に減数分裂期に入りはじめ,つづく減数分裂前期では相同染色体が対合し組換え反応をへて凝集しはじめる8).この減数分裂前期の進行はこの時期に相同染色体のあいだに形成されるシナプトネマ複合体の構成タンパク質であるSycp3の染色パターンを調べることによりモニターすることができる.すると,野生型の胚では胎生14.5日においてSycp3の核への集積が観察され,レプトテン期からザイゴテン期様の染色像が観察された.一方,始原生殖細胞に特異的にRnf2を欠損した胚では胎生13.5日においてすでにSycp3が核にはっきりと蓄積しており,胎生14.5日ではザイゴテン期からさらに凝集の進んだパキテン期様の核まで観察された.これらの結果は,Rnf2遺伝子の欠損した始原生殖細胞では雌の分化にかかわる遺伝子の脱抑制が起こっているだけでなく,実際に分化(減数分裂)が早期に進行していることを示唆した.通常の雌の胚では,減数分裂が誘導されはじめる胎生13.5日まで始原生殖細胞は細胞増殖期にいることをふまえると,始原生殖細胞に特異的にRnf2を欠損した胚ではこれら減数分裂の誘導にかかわる遺伝子が早期に発現しはじめることにより,細胞増殖期から減数分裂期への移行のタイミングが異常になり細胞増殖期が早期に中断され,生殖細胞の減少が観察されたと考えられた.
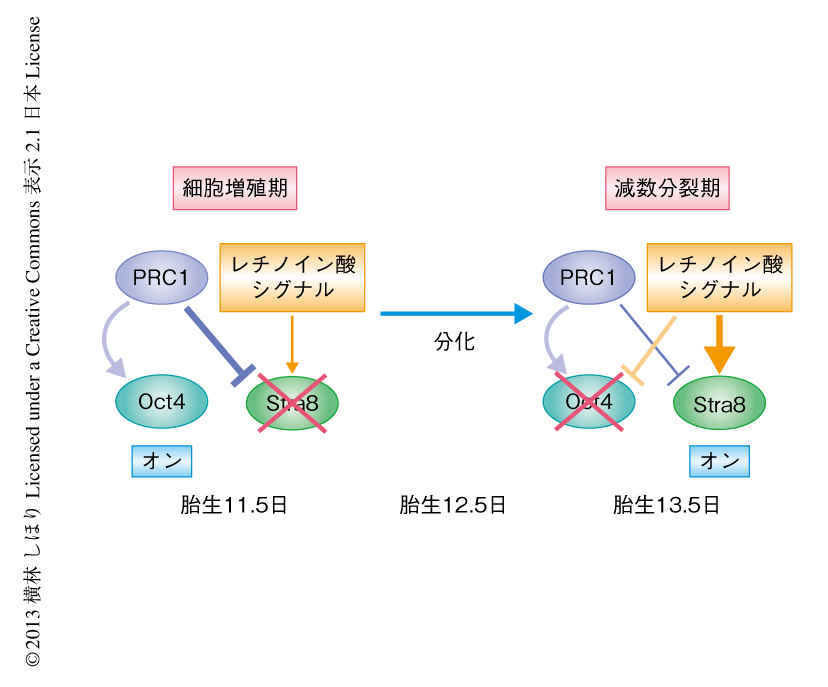
それでは,なぜRnf2を欠損させることによるStra8遺伝子の脱抑制は雌の始原生殖細胞でのみ観察されたのであろうか.雄の胚でも胎生11.5日ごろからレチノイン酸が分泌されはじめる.しかし,雄の生殖腺ではY染色体にコードされるSry遺伝子の発現によりFgf9が活性化し,このFgf9シグナルがレチノイン酸シグナルと拮抗的に作用することが近年になり報告された9).さらに,レチノイン酸の分解に寄与するCyp26b1も雄の生殖腺においては発現誘導される10).つまり,雄の胚ではすでにこれらのシグナルが生殖腺に分泌されるレチノイン酸シグナルの効果を打ち消すはたらきをしているため,PRC1はStra8遺伝子の抑制に必要不可欠ではないと考えられた.この可能性を調べるため,胎生11.5日の胚から生殖腺を中腎とともに単離し,過剰量の全trans型レチノイン酸の存在下で培養した.すると,雌のRnf2を欠損した始原生殖細胞だけでなく,雄のRnf2を欠損した始原生殖細胞でも野生型の始原生殖細胞に比べStra8遺伝子の発現量が有意に上昇することがわかった.逆に,レチノイン酸合成酵素の阻害剤であるWIN18446の存在下で培養すると,雌雄ともにRnf2を欠損した始原生殖細胞におけるStra8遺伝子の脱抑制はみられなくなった.これらの結果は,Stra8遺伝子の発現制御においてPRC1とレチノイン酸シグナルが拮抗的に作用していることを示唆した(図2).さらに,このレチノイン酸合成酵素の阻害剤WIN18446を妊娠したマウスに投与して胎生12.5日において生殖腺を観察すると,雌の始原生殖細胞に特異的にRnf2を欠損した胚において観察されていた始原生殖細胞の減少が部分的に回復していた.このことは,雌の始原生殖細胞に特異的にRnf2を欠損した胚ではPRC1のレチノイン酸シグナルへの拮抗がくずれることにより,始原生殖細胞が正常に増殖できなくなっていることを示唆した.
始原生殖細胞を単離してクロマチン免疫沈降を行うことにより,Rnf2がStra8遺伝子のプロモーター領域に局在していることも確認された.さらに,クロマチン免疫沈降法によりStra8遺伝子のプロモーター領域のヒストンH3の27番目のリジン残基がトリメチル化されていることもわかった.これはPRC2の触媒するヒストン修飾であることから,Stra8遺伝子はPRC1およびPRC2の直接の標的であると考えられた.
今回の筆者らの研究により,ポリコーム抑制複合体が始原生殖細胞においてOct4遺伝子など多能性遺伝子の発現レベルの維持に重要な役割をはたしていること,さらに,Stra8遺伝子や,おそらくほかの減数分裂期遺伝子の発現を直接に抑制することにより,これらの遺伝子の発現のタイミングを微細に制御していることが明らかになった.おそらく,ポリコーム抑制複合体は細胞外からのレチノイン酸シグナルに対する始原生殖細胞の“感受性”を制御することにより,減数分裂の誘導開始の時期を決定しているのではないかと考えられた.ポリコーム抑制複合体の非存在下ではこの制御ができず始原生殖細胞が早期に応答してしまうため,細胞増殖期から減数分裂期への移行が噛みあわず時期尚早に減数分裂が開始されてしまったのであろう.始原生殖細胞に特異的にRnf2を欠損した雌の成体のマウスでは,Rnf2を欠損した始原生殖細胞に由来する卵細胞はほとんど観察されなかったことから,PRC1による減数分裂期への移行のタイミングの制御は始原生殖細胞の生存率,さらには,そののちの正常な卵の形成に重要な役割をはたしているといえた.
略歴:2005年 東京大学大学院理学系研究科博士課程 修了,2006年 スイスFriedrich Miescher Institute for Biomedical Research研究員を経て,2012年より京都大学iPS細胞研究所 研究員.
研究テーマ:哺乳類における生殖細胞の特定と分化機構.
関心事:次世代に遺伝情報を伝える担い手である生殖細胞の,生殖細胞たるゆえんを探ること.
© 2013 横林 しほり Licensed under CC 表示 2.1 日本
(スイスFriedrich Miescher Institute for Biomedical Research)
email:横林しほり
DOI: 10.7875/first.author.2013.039
PRC1 coordinates timing of sexual differentiation of female primordial germ cells.
Shihori Yokobayashi, Ching-Yeu Liang, Hubertus Kohler, Peter Nestorov, Zichuan Liu, Miguel Vidal, Maarten van Lohuizen, Tim C. Roloff, Antoine H. F. M. Peters
Nature, 495, 236-240 (2013)
要 約
哺乳類における始原生殖細胞の性分化は環境からの外的な要因により決定される.マウスの雌の始原生殖細胞では,中腎から供給されるレチノイン酸に応答してStra8遺伝子の発現と減数分裂が誘導される.レチノイン酸シグナルは発生において広範囲に作用することが知られており,始原生殖細胞において適切なタイミングでのStra8遺伝子の発現と減数分裂の開始を可能にする分子機構はわかっていない.この研究では,ポリコーム抑制複合体PRC1の中心的な構成タンパク質をコードするRing1遺伝子とRnf2遺伝子について,始原生殖細胞の発生における遺伝子量に依存的な役割を明らかにした.Ring1遺伝子とRnf2遺伝子は胎生10.5日から胎生11.5日のあいだ始原生殖細胞の発生に必須である.そののち,雌の始原生殖細胞においてRnf2遺伝子は,Oct4遺伝子とNanog遺伝子の高い発現レベルの維持,および,減数分裂期遺伝子の早期発現の誘導と減数分裂前期への早期進行の抑制に必要である.レチノイン酸シグナルを化学的に抑制すると,Rnf2遺伝子を欠失した雌の始原生殖細胞における早期のOct4遺伝子の発現減少とStra8遺伝子の活性化が部分的に抑圧された.クロマチン免疫沈降法による解析により,始原生殖細胞においてStra8がポリコーム抑制複合体であるPRC1とPRC2の直接の標的であることが示された.以上の結果は,PRC1の構成タンパク質をコードする遺伝子の遺伝子量は,始原生殖細胞の発生と雌の始原生殖細胞における性決定のタイミングを制御するうえで重要であり,外部からのレチノイン酸シグナルに対し拮抗的にはたらくことを示した.
はじめに
哺乳類では,始原生殖細胞(primordial germ cell:PGC)は着床ののちの胚発生期に周囲からのシグナル伝達に応答して胚外中胚葉に出現する1).マウスでは,胎生7日ごろに約40の細胞が始原生殖細胞として特定される.そののち,始原生殖細胞は増殖し,後腸内胚葉をとおり生殖腺への移動を開始する.始原生殖細胞は胎生10日ごろまでに生殖腺に到達したのち,細胞分裂を再開し最終的に胎生13.5日までに数千個から1万個にまで増殖する.そののち,雄の始原生殖細胞はG1期/G0期において細胞周期を停止し誕生するまで待機するが,雌の始原生殖細胞は減数分裂を開始する(図1).
この雌の始原生殖細胞における減数分裂の誘導には,これまで,レチノイン酸シグナルが重要なはたらきをしていることが示されている2).雌の胚では胎生11.5日ごろから生殖腺に隣接する中腎からレチノイン酸が分泌されはじめる.そのレチノイン酸シグナルに応答して,胎生13.5日ごろから始原生殖細胞においてStra8(stimulated by retinoic acid gene 8)遺伝子の発現が誘導される3,4).Stra8遺伝子は減数分裂の誘導の鍵となる遺伝子であり,Stra8ノックアウトマウスでは減数分裂前DNA合成の異常が観察されている5).しかし,Stra8遺伝子の発現誘導のタイミングを決める分子機構は明らかではなかった.
ポリコーム抑制複合体(polycomb repressive complex:PRC)は高等真核生物に広く保存されているタンパク質複合体であり,哺乳類にはPRC1とPRC2が存在する6).PRC2はヒストンH3の27番目のリジン残基にトリメチル基を付加する活性,一方,PRC1はヒストンH2Aの119番目のリジン残基をモノユビキチン化する活性をもち,ともに遺伝子発現の抑制に関与する.ES細胞などを用いたゲノムワイドなクロマチン免疫沈降法による解析から,PRC1とPRC2は多くの場合において共通の遺伝子を標的にすることが示されている.また,その標的となる遺伝子には発生や分化にかかわる転写因子をコードする遺伝子が多く含まれていることから,ポリコーム抑制複合体は細胞の幹細胞性や自己複製能の維持および分化過程の制御において重要な役割を担っていると考えられている.そこで,この研究では,始原生殖細胞の発生過程におけるポリコーム複合体PRC1の機能解析を試みた.
1.PRC1は雌の始原生殖細胞の増殖に必要である
PRC1のユビキチン化活性はその構成タンパク質であるRnf2とそのパラログRing1によって担われている.Rnf2ノックアウトマウスは胚性致死となるが,Ring1ノックアウトマウスは胚発生および生殖に問題はなくおもだった表現型を示さない.始原生殖細胞におけるRnf2の機能を解析するため,始原生殖細胞においてRnf2を特異的に欠損するコンディショナルノックアウトマウスを作製した7).PRC1の機能を包括的に解析するためRing1とRnf2のダブルノックアウトマウスも作製した.
まず,始原生殖細胞に特異的なRnf2コンディショナルノックアウトマウスの胚の生殖腺を始原生殖細胞の発生中期から後期(胎生10.5日~胎生13.5日)にかけて観察したところ,雄では野生型マウスの胚との明らかな違いは観察されなかったのに対し,雌では胎生12.5日から始原生殖細胞マーカーに陽性を示す細胞の数が減少していた.免疫染色および遺伝子発現解析を定量的に行ったところ,Rnf2を欠損した細胞では多能性のマーカーであるOct4遺伝子およびNanogの発現が,とくに雌の始原生殖細胞において有意に減少していた.一方,Ring1欠損と始原生殖細胞に特異的なRnf2欠損の二重変異をもつ胚では,雌雄ともにすでに胎生11.5日において始原生殖細胞マーカーに陽性を示す細胞の減少が観察された.このことから,PRC1はおそらく始原生殖細胞において多能性遺伝子の発現を正に制御することにより,始原生殖細胞の増殖に必須の役割をはたしていることが示唆された.さらに,Rnf2欠損胚と,Ring1 Rnf2二重欠損胚との表現型の違いから,雌性始原生殖細胞の発生においてはRing1遺伝子だけでは十分でなくRnf2遺伝子が必要であることが示された.
2.雌のRnf2遺伝子を欠損した始原生殖細胞では雄の始原生殖細胞に比べ遺伝子発現の異常が強く観察される
始原生殖細胞に特異的なRnf2欠損胚において,なぜ雌に特異的に始原生殖細胞の増殖に異常がみられるのかを調べるため,生殖腺から始原生殖細胞を単離してmRNAを抽出し,マイクロアレイ法を用いて遺伝子発現解析を行った.胎生11.5日において始原生殖細胞を比較すると,始原生殖細胞に特異的なRnf2欠損胚から単離した始原生殖細胞において異常な発現量を示す遺伝子は,雌雄ともに多くはみつからなかった.しかし,胎生12.5日では,雌において500以上の遺伝子がRnf2を欠損した始原生殖細胞で有意に発現量の異常を示す一方,雄では発現量の異常を示す遺伝子は50以下にとどまった.これらの遺伝子のうち90%以上は野生型の始原生殖細胞に比べRnf2を欠損した始原生殖細胞において発現が上昇しており,このことはRnf2あるいはPRC1が遺伝子発現の抑制に関与しているという知見と合致した.遺伝子オントロジー解析によりこれらの遺伝子を機能により分類すると,雌のRnf2を欠損した始原生殖細胞において発現量の上昇した遺伝子には減数分裂に関与する遺伝子が多く含まれていた.しかし,予想とは異なり,ES細胞などにおいてポリコーム抑制複合体の標的として知られている発生や分化にかかわる基本的な遺伝子はほとんど含まれてなかった.このことから,雌のRnf2を欠損した始原生殖細胞では始原生殖細胞の発生から分化の過程に特異的にかかわる遺伝子の発現が異常になっていることが考えられた.
そこで,始原生殖細胞の発生後期に起こる遺伝子発現の変化を調べるため,まず野生型の胚から始原生殖細胞を経時的に単離しマイクロアレイ解析を行った.胎生11.5日と胎生13.5日とを比較すると,雌の始原生殖細胞では約1000,雄の始原生殖細胞では約300の遺伝子が胎生13.5日において発現量が上昇していることがわかった.胎生11.5日の始原生殖細胞では雌雄の違いは観察されないが,胎生13.5日では始原生殖細胞においてすでに性特異的な分化がはじまっていると考えられていることから,これらの遺伝子は始原生殖細胞の分化プログラムにより発現誘導される遺伝子であると考えられた.雌の野生型の始原生殖細胞において胎生11.5日から胎生13.5日にかけて発現量の上昇した遺伝子と比較すると,雌のRnf2を欠損した始原生殖細胞において胎生12.5日に異常な発現上昇のみられた遺伝子のうち40%以上が重複していた.さらに,この野生型の始原生殖細胞において胎生11.5日から胎生13.5日にかけて発現の上昇が誘導される遺伝子について個々のマイクロアレイデータをクラスタリング解析したところ,雄では胎生12.5日のRnf2を欠損した始原生殖細胞は胎生12.5日の野生型の始原生殖細胞にもっとも近い遺伝子発現パターンを示したのに対し,雌では胎生12.5日のRnf2を欠損した始原生殖細胞は胎生12.5日ではなく胎生13.5日の野生型の雌の始原生殖細胞とクラスターを形成した.このことは,胎生12.5日の雌のRnf2を欠損した始原生殖細胞では,すでに胎生13.5日の雌性始原生殖細胞様の遺伝子発現が誘導されている,つまり,雌の分化プログラムが1日早く誘導されている可能性が示唆された.
3.雌のRnf2を欠損した始原生殖細胞では減数分裂前期が早期に進行する
実際におのおのの遺伝子のmRNAを定量的に調べたところ,雌のRnf2を欠損した始原生殖細胞では,Stra8遺伝子をはじめとして,Rec8遺伝子,Sycp3遺伝子,Hormad2遺伝子など減数分裂期遺伝子が,野生型の始原生殖細胞に比べ胎生12.5日においてすでに発現が上昇,つまり,脱抑制していた.一方,これらの遺伝子発現は雄のRnf2を欠損した始原生殖細胞においては野生型の始原生殖細胞に比べ有意な差はみられなかった.免疫染色によりそれぞれのタンパク質の局在を観察したところ,雌の野生型の胚ではStra8の核における局在が胎生13.5日から観察されはじめたのに対し,始原生殖細胞に特異的にRnf2を欠損した胚では胎生12.5日においてすでにStra8の核への蓄積が認められた.通常,野生型の胚では胎生13.5日から始原生殖細胞は徐々に減数分裂期に入りはじめ,つづく減数分裂前期では相同染色体が対合し組換え反応をへて凝集しはじめる8).この減数分裂前期の進行はこの時期に相同染色体のあいだに形成されるシナプトネマ複合体の構成タンパク質であるSycp3の染色パターンを調べることによりモニターすることができる.すると,野生型の胚では胎生14.5日においてSycp3の核への集積が観察され,レプトテン期からザイゴテン期様の染色像が観察された.一方,始原生殖細胞に特異的にRnf2を欠損した胚では胎生13.5日においてすでにSycp3が核にはっきりと蓄積しており,胎生14.5日ではザイゴテン期からさらに凝集の進んだパキテン期様の核まで観察された.これらの結果は,Rnf2遺伝子の欠損した始原生殖細胞では雌の分化にかかわる遺伝子の脱抑制が起こっているだけでなく,実際に分化(減数分裂)が早期に進行していることを示唆した.通常の雌の胚では,減数分裂が誘導されはじめる胎生13.5日まで始原生殖細胞は細胞増殖期にいることをふまえると,始原生殖細胞に特異的にRnf2を欠損した胚ではこれら減数分裂の誘導にかかわる遺伝子が早期に発現しはじめることにより,細胞増殖期から減数分裂期への移行のタイミングが異常になり細胞増殖期が早期に中断され,生殖細胞の減少が観察されたと考えられた.
4.PRC1はレチノイン酸シグナルに拮抗してStra8遺伝子を抑制する
それでは,なぜRnf2を欠損させることによるStra8遺伝子の脱抑制は雌の始原生殖細胞でのみ観察されたのであろうか.雄の胚でも胎生11.5日ごろからレチノイン酸が分泌されはじめる.しかし,雄の生殖腺ではY染色体にコードされるSry遺伝子の発現によりFgf9が活性化し,このFgf9シグナルがレチノイン酸シグナルと拮抗的に作用することが近年になり報告された9).さらに,レチノイン酸の分解に寄与するCyp26b1も雄の生殖腺においては発現誘導される10).つまり,雄の胚ではすでにこれらのシグナルが生殖腺に分泌されるレチノイン酸シグナルの効果を打ち消すはたらきをしているため,PRC1はStra8遺伝子の抑制に必要不可欠ではないと考えられた.この可能性を調べるため,胎生11.5日の胚から生殖腺を中腎とともに単離し,過剰量の全trans型レチノイン酸の存在下で培養した.すると,雌のRnf2を欠損した始原生殖細胞だけでなく,雄のRnf2を欠損した始原生殖細胞でも野生型の始原生殖細胞に比べStra8遺伝子の発現量が有意に上昇することがわかった.逆に,レチノイン酸合成酵素の阻害剤であるWIN18446の存在下で培養すると,雌雄ともにRnf2を欠損した始原生殖細胞におけるStra8遺伝子の脱抑制はみられなくなった.これらの結果は,Stra8遺伝子の発現制御においてPRC1とレチノイン酸シグナルが拮抗的に作用していることを示唆した(図2).さらに,このレチノイン酸合成酵素の阻害剤WIN18446を妊娠したマウスに投与して胎生12.5日において生殖腺を観察すると,雌の始原生殖細胞に特異的にRnf2を欠損した胚において観察されていた始原生殖細胞の減少が部分的に回復していた.このことは,雌の始原生殖細胞に特異的にRnf2を欠損した胚ではPRC1のレチノイン酸シグナルへの拮抗がくずれることにより,始原生殖細胞が正常に増殖できなくなっていることを示唆した.
始原生殖細胞を単離してクロマチン免疫沈降を行うことにより,Rnf2がStra8遺伝子のプロモーター領域に局在していることも確認された.さらに,クロマチン免疫沈降法によりStra8遺伝子のプロモーター領域のヒストンH3の27番目のリジン残基がトリメチル化されていることもわかった.これはPRC2の触媒するヒストン修飾であることから,Stra8遺伝子はPRC1およびPRC2の直接の標的であると考えられた.
おわりに
今回の筆者らの研究により,ポリコーム抑制複合体が始原生殖細胞においてOct4遺伝子など多能性遺伝子の発現レベルの維持に重要な役割をはたしていること,さらに,Stra8遺伝子や,おそらくほかの減数分裂期遺伝子の発現を直接に抑制することにより,これらの遺伝子の発現のタイミングを微細に制御していることが明らかになった.おそらく,ポリコーム抑制複合体は細胞外からのレチノイン酸シグナルに対する始原生殖細胞の“感受性”を制御することにより,減数分裂の誘導開始の時期を決定しているのではないかと考えられた.ポリコーム抑制複合体の非存在下ではこの制御ができず始原生殖細胞が早期に応答してしまうため,細胞増殖期から減数分裂期への移行が噛みあわず時期尚早に減数分裂が開始されてしまったのであろう.始原生殖細胞に特異的にRnf2を欠損した雌の成体のマウスでは,Rnf2を欠損した始原生殖細胞に由来する卵細胞はほとんど観察されなかったことから,PRC1による減数分裂期への移行のタイミングの制御は始原生殖細胞の生存率,さらには,そののちの正常な卵の形成に重要な役割をはたしているといえた.
文 献
- Saitou, M., Kagiwada, S. & Kurimoto, K.: Epigenetic reprogramming in mouse pre-implantation development and primordial germ cells. Development, 139, 15-31 (2012)[PubMed]
- Brennan, J. & Capel, B.: One tissue, two fates: molecular genetic events that underlie testis versus ovary development. Nat. Rev. Genet., 5, 509-521 (2004)[PubMed]
- Koubova, J., Menke, D. B., Zhou, Q. et al.: Retinoic acid regulates sex-specific timing of meiotic initiation in mice. Proc. Natl. Acad. Sci. USA, 103, 2474-2479 (2006)[PubMed]
- Bowles, J., Knight, D., Smith, C. et al.: Retinoid signaling determines germ cell fate in mice. Science, 312, 596-600 (2006)[PubMed]
- Baltus, A. E., Menke, D. B., Hu, Y. C. et al.: In germ cells of mouse embryonic ovaries, the decision to enter meiosis precedes premeiotic DNA replication. Nat. Genet., 38, 1430-1434 (2006)[PubMed]
- Sparmann, A. & van Lohuizen, M.: Polycomb silencers control cell fate, development and cancer. Nat. Rev. Cancer, 6, 846-856 (2006)[PubMed]
- Lomeli, H., Ramos-Mejia, V., Gertsenstein, M. et al.: Targeted insertion of Cre recombinase into the TNAP gene: excision in primordial germ cells. Genesis, 26, 116-117 (2000)[PubMed]
- Handel, M. A. & Schimenti, J. C.: Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet., 11, 124-136 (2010)[PubMed]
- Bowles, J., Feng, C. W., Spiller, C. et al.: FGF9 suppresses meiosis and promotes male germ cell fate in mice. Dev. Cell., 19, 440-449 (2010)[PubMed]
- MacLean, G., Li, H., Metzger, D. et al.: Apoptotic extinction of germ cells in testes of Cyp26b1 knockout mice. Endocrinology, 148, 4560-4567 (2007)[PubMed]
著者プロフィール
略歴:2005年 東京大学大学院理学系研究科博士課程 修了,2006年 スイスFriedrich Miescher Institute for Biomedical Research研究員を経て,2012年より京都大学iPS細胞研究所 研究員.
研究テーマ:哺乳類における生殖細胞の特定と分化機構.
関心事:次世代に遺伝情報を伝える担い手である生殖細胞の,生殖細胞たるゆえんを探ること.
© 2013 横林 しほり Licensed under CC 表示 2.1 日本