脳の発達期においてミクログリアは大脳皮質第5層のニューロンの生存に寄与する
上野将紀・藤田 幸・山下俊英
(大阪大学大学院医学系研究科 分子神経科学)
email:上野将紀,山下俊英
DOI: 10.7875/first.author.2013.037
Layer V cortical neurons require microglial support for survival during postnatal development.
Masaki Ueno, Yuki Fujita, Tatsuhide Tanaka, Yuka Nakamura, Junichi Kikuta, Masaru Ishii, Toshihide Yamashita
Nature Neuroscience, 16, 543-551 (2013)
発達期の脳において,ニューロンやそれらが構成する神経回路は周囲の環境より栄養をうけ維持されていると考えられてきたが,その実体は不明のままであった.筆者らは,脳の免疫細胞とされるミクログリアが運動機能をつかさどる大脳皮質第5層のニューロンの生存にかかわることを発見した.この研究では,まず,脳の発達期においてミクログリアがニューロンの軸索の周囲にあつまるという特徴的な分布を示すことに着目した.このミクログリアの機能を解明するため,阻害薬や遺伝子改変マウスを用いてミクログリアの機能を抑制して脳を観察したところ,大脳皮質第5層のニューロンに選択的に細胞死が誘導されることを見い出した.これらの結果から,ミクログリアが特定のニューロンの生存にかかわることが示された.また,ミクログリアの放出するIGF1がその機能に関与していることが明らかになった.この研究から,グリア細胞とニューロンとの相互作用による神経回路およびニューロンの新たな維持機構が明らかになった.
発達期の脳ではニューロンによる活発な神経回路の構築が行われている.以前から,神経回路の周囲の環境にはこのダイナミックに変化する神経回路およびニューロンの生存を維持するしくみが存在すると考えられてきた1).実際に,末梢神経系ではニューロンの標的となる器官より放出される栄養因子により神経回路およびニューロンが維持されていることが知られているが2),中枢神経系においてもこのようなしくみが本当に存在するのか,また,その場合,どのような細胞や周囲の環境がこれに寄与するのかについては不明のままであった.
哺乳類の大脳皮質は6層の構造からなり,おのおのの層に位置するニューロンは特異的なはたらきをもつことが知られている.これらのニューロンが発達期においてどのようなしくみにより維持されているのかはいまだ不明であるが,in vitroにおける解析から,種々の栄養因子や周囲の細胞による維持機構の存在することが示唆されはじめている.たとえば,第2層,第3層,第5層に存在し反対側の大脳皮質へと軸索を伸ばす脳梁投射ニューロンや,第5層に局在し大脳皮質より下位へと軸索を伸ばす皮質下投射ニューロンは,培養下において特定の神経栄養因子が生存に必要であることが示されており,また,血管由来因子が第5層のニューロンの生存に重要であることも示唆されている3,4).しかしながら,実際に生体においてこれら栄養因子や周囲の細胞が重要であるという証拠はいまだ提示されていない.
一方で,脳の免疫細胞とされるミクログリアは病態下の脳において組織の炎症,修復,除去といった機能に特化する細胞と考えられてきた.しかし近年の研究から,正常な脳あるいは発達期の脳においても,ミクログリアは形態を変化させシナプスや死細胞の除去といった脳の環境の維持に不可欠な事象に積極的にかかわっていることが示されてきている5).ミクログリアは神経幹細胞に由来するほかのグリア細胞やニューロンと違い,卵黄嚢にある骨髄性前駆細胞に由来する6).マウスでは胎生9.5日ごろより脳の原基である神経管に侵入しはじめ,やがて脳に広く分布するようになる.また,この分布の進行する発達期の脳では,活性化したミクログリアがニューロンの軸索の通過する白質にあつまるという特徴的な所見が認められている7).このような現象はげっ歯類のみならずヒトにおいても報告されているが,これらの細胞がどのような役割をもつのかはまったく不明のままであった.
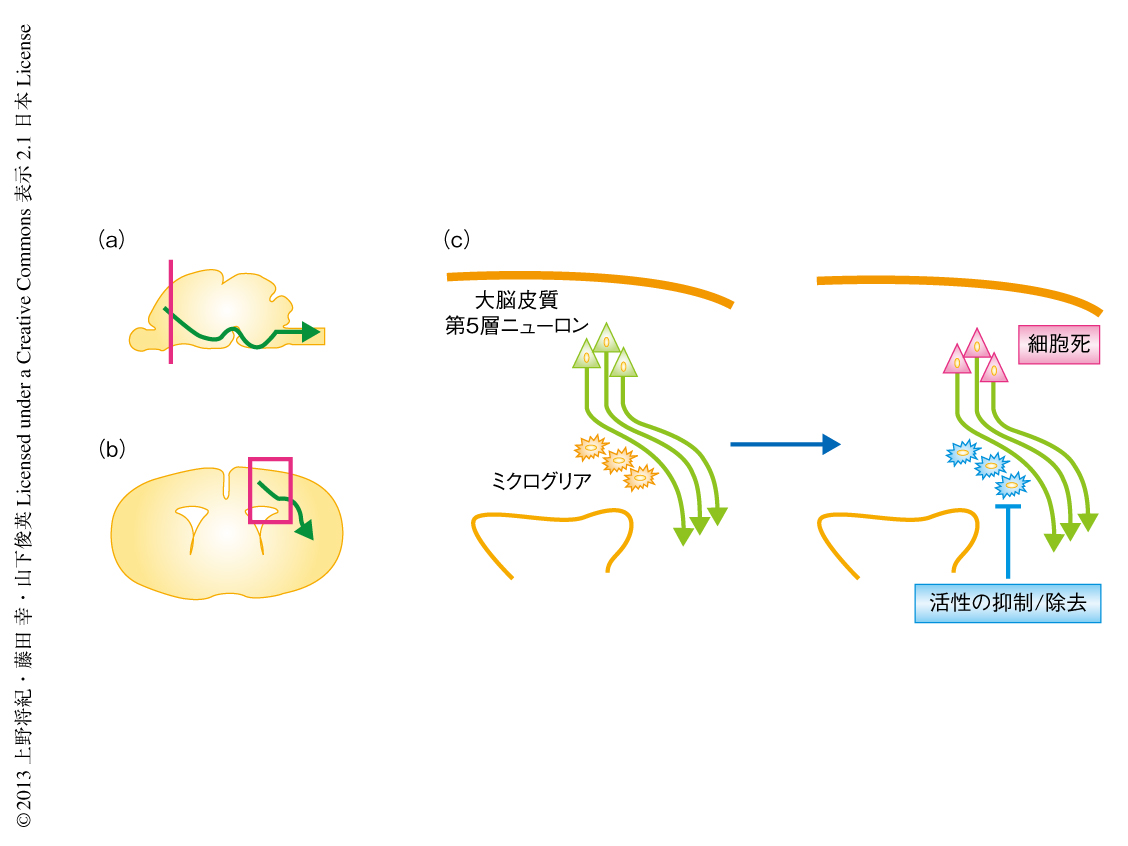
脳の発達期におけるミクログリアの役割を調べる目的で,脳におけるミクログリアの分布を調べることからはじめた.マウスにおいて,ミクログリアは生後1週間のあいだに脳梁,内包,大脳脚,小脳白質といった白質部位にあつまり,その形態的な特徴から活性化していることがわかった(図1).脳梁,内包,大脳脚といった部位は大脳皮質の皮質下投射ニューロンや脳梁投射ニューロンから伸びる軸索の通過する部位であることからGFP発現レンチウイルスを用いてその軸索を標識したところ,これら軸索の周囲に活性化したミクログリアがあつまっていることがわかった.この特徴的な分布と活性化した形態は生後2週目以降から成体にかけて認められなくなった.これらの観察から,脳の発達期においてミクログリアが神経軸索に対しなんらかの生理的な役割をもつのではないかと推察された.
この役割を解明するため,まず,ミクログリアの活性化を抑制する薬剤ミノサイクリンを新生仔マウスに投与して脳に起こる変化を観察した.すると驚くべきことに,大脳皮質の第5層において特異的に細胞死のひき起こされることを発見した(図1c).これらの細胞は大部分がCTIP2陽性の皮質下投射ニューロンおよびSATB2陽性の脳梁投射ニューロンであった.逆行性トレーサーによってもこれらニューロンの特徴は確かめられた.細胞死の誘導は,ミクログリアの集積が白質に認められる生後3~5日には認められたが,ミクログリアの集積が認められない胎生18.5日あるいは生後16日には認められなかった.これらの結果から,脳の発達における特定の時期に,ミクログリアは軸索と密接にかかわりながら大脳皮質第5層のニューロンの生存を維持していると考えられた.
ミクログリアの役割をより直接的に検証するため,CD11b-DTRマウスにより選択的にミクログリアを除去し大脳皮質ニューロンの生存を評価することを試みた.このマウスはミクログリアのマーカーであるCD11b遺伝子のプロモーターの下流にてジフテリア毒素受容体を発現するトランスジェニックマウスであり,ジフテリア毒素の投与により選択的にミクログリアを減少させられることがわかった.そこで大脳皮質の第5層を観察したところ,ミノサイクリン投与の実験系と同様に,細胞死の誘導されることがわかった(図1c).
つぎに,Fractalkine-Cx3cr1シグナルに着目し実験を進めた.Fractalkineはニューロンに,その受容体であるCx3cr1はミクログリアに特異的に発現していることから,ミクログリアとニューロンとのあいだの相互作用に関しながらく注目されてきたタンパク質である.このシグナルによりミクログリアが軸索の周囲にあつまるという機序を想定していたが,Cx3cr1ノックアウトマウスにおいてミクログリアを観察したところ,予想に反してミクログリアの増加が認められた.このマウスの大脳皮質第5層を観察したところ,驚くべきことに,ニューロンに細胞死の誘導されていることがわかった.したがって,このマウスではニューロンへの生存維持作用をもたないミクログリアが増加していることが考えられた.
最後に,ミクログリアのニューロンへの生存維持作用をよりシンプルな実験系である培養系を用い直接に確認した.大脳皮質ニューロンをミクログリアと共培養すると,ニューロン単独で培養するよりも有意に生存が増加した.また,これら共培養下においてミノサイクリンを添加,あるいは,Cx3cr1欠損ミクログリアを使用すると,ミクログリアの生存維持作用は有意に減少した.
ミクログリアによりニューロンの生存が促される分子機構を解明することをめざした.ミクログリアから放出されるタンパク質を網羅的に調べた結果,IGF1が脳の発達期のミクログリアに多く発現していることがわかった(図2a).実際に,CD11b-DTRマウスにおいてミクログリアを除去すると脳においてIGF1の発現量は有意に低下した.培養系あるいはマウスにおいて,IGF1の拮抗剤H-1356やsiRNAを用いてミクログリアから放出されるIGF1を阻害したところ,大脳皮質ニューロンに細胞死が誘導された.このことから,ミクログリアから放出されるIGF1がニューロンの生存維持に関与していることが明らかになった.
一方,ミノサイクリンを投与したマウスやCx3cr1ノックアウトマウスにおいては,IGF1のmRNAレベルでの発現量は変化しなかった.しかしおもしろいことに,いずれの実験系でもIGF1に結合しIGF1シグナルを抑制するIGF結合タンパク質の発現が増加していることを見い出された.実際に,IGF結合タンパク質に結合していないIGF1の量はいずれの実験系でも減少していた.ミノサイクリンを投与したマウスでは,IGF1の投与あるいはIGF結合タンパク質のひとつIGFBP5の発現抑制により細胞死は抑制された.このことから,IGF結合タンパク質の増加によるIGF1シグナルの減少が大脳皮質第5層ニューロンの細胞死を誘導したことが示された.
この研究により,1)脳の発達期にニューロンおよびその回路が維持される新たな分子機構,2)脳の免疫細胞と考えられていたミクログリアの新たな機能,が明らかになった(図2b).近年の研究から,ミクログリアは脳の発達期において,シナプスの除去,神経幹細胞の制御,死細胞の誘導および貪食,といった多岐にわたる機能をもつことが明らかになってきており,その脳における重要性が認知されはじめている.さらに,ミクログリアは休止型から活性型へと性質を動的に変化させることが知られており,また,活性型のミクログリアにも脳組織に対し保護作用あるいは毒性作用をもつものがあるなど,多種多様な顔をもつことが明らかになっている.この研究をとおして生理的な条件におけるミクログリアの機能の全貌が明らかになっていけば,病態下の脳において活性化するミクログリアを制御し病態を緩和に導く可能性も開けてくるであろう8).とくに,大脳皮質第5層に存在する皮質下投射ニューロンのひとつである皮質脊髄路ニューロンは,脊髄損傷,脳血管障害,筋萎縮性側索硬化症といった病態下で傷害をうけ,その結果,運動機能に重篤な障害のもたらされることが知られている9).ミクログリアによりこれらニューロンを保護する効果を誘導することができれば,新たな治療法の開発にもつながると期待される.
略歴:2006年 東京大学大学院農学生命科学研究科 修了,同年 理化学研究所脳科学総合研究センター 研究員,千葉大学大学院医学研究院 研究員,大阪大学大学院医学系研究科 助教を経て,2012年より米国Cincinnati Children’s Hospital Medical Center研究員.
研究テーマ:発達期と中枢神経疾患における神経回路の動作原理.
藤田 幸(Yuki Fujita)
大阪大学大学院医学系研究科 特任助教.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2013 上野将紀・藤田 幸・山下俊英 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 分子神経科学)
email:上野将紀,山下俊英
DOI: 10.7875/first.author.2013.037
Layer V cortical neurons require microglial support for survival during postnatal development.
Masaki Ueno, Yuki Fujita, Tatsuhide Tanaka, Yuka Nakamura, Junichi Kikuta, Masaru Ishii, Toshihide Yamashita
Nature Neuroscience, 16, 543-551 (2013)
要 約
発達期の脳において,ニューロンやそれらが構成する神経回路は周囲の環境より栄養をうけ維持されていると考えられてきたが,その実体は不明のままであった.筆者らは,脳の免疫細胞とされるミクログリアが運動機能をつかさどる大脳皮質第5層のニューロンの生存にかかわることを発見した.この研究では,まず,脳の発達期においてミクログリアがニューロンの軸索の周囲にあつまるという特徴的な分布を示すことに着目した.このミクログリアの機能を解明するため,阻害薬や遺伝子改変マウスを用いてミクログリアの機能を抑制して脳を観察したところ,大脳皮質第5層のニューロンに選択的に細胞死が誘導されることを見い出した.これらの結果から,ミクログリアが特定のニューロンの生存にかかわることが示された.また,ミクログリアの放出するIGF1がその機能に関与していることが明らかになった.この研究から,グリア細胞とニューロンとの相互作用による神経回路およびニューロンの新たな維持機構が明らかになった.
はじめに
発達期の脳ではニューロンによる活発な神経回路の構築が行われている.以前から,神経回路の周囲の環境にはこのダイナミックに変化する神経回路およびニューロンの生存を維持するしくみが存在すると考えられてきた1).実際に,末梢神経系ではニューロンの標的となる器官より放出される栄養因子により神経回路およびニューロンが維持されていることが知られているが2),中枢神経系においてもこのようなしくみが本当に存在するのか,また,その場合,どのような細胞や周囲の環境がこれに寄与するのかについては不明のままであった.
哺乳類の大脳皮質は6層の構造からなり,おのおのの層に位置するニューロンは特異的なはたらきをもつことが知られている.これらのニューロンが発達期においてどのようなしくみにより維持されているのかはいまだ不明であるが,in vitroにおける解析から,種々の栄養因子や周囲の細胞による維持機構の存在することが示唆されはじめている.たとえば,第2層,第3層,第5層に存在し反対側の大脳皮質へと軸索を伸ばす脳梁投射ニューロンや,第5層に局在し大脳皮質より下位へと軸索を伸ばす皮質下投射ニューロンは,培養下において特定の神経栄養因子が生存に必要であることが示されており,また,血管由来因子が第5層のニューロンの生存に重要であることも示唆されている3,4).しかしながら,実際に生体においてこれら栄養因子や周囲の細胞が重要であるという証拠はいまだ提示されていない.
一方で,脳の免疫細胞とされるミクログリアは病態下の脳において組織の炎症,修復,除去といった機能に特化する細胞と考えられてきた.しかし近年の研究から,正常な脳あるいは発達期の脳においても,ミクログリアは形態を変化させシナプスや死細胞の除去といった脳の環境の維持に不可欠な事象に積極的にかかわっていることが示されてきている5).ミクログリアは神経幹細胞に由来するほかのグリア細胞やニューロンと違い,卵黄嚢にある骨髄性前駆細胞に由来する6).マウスでは胎生9.5日ごろより脳の原基である神経管に侵入しはじめ,やがて脳に広く分布するようになる.また,この分布の進行する発達期の脳では,活性化したミクログリアがニューロンの軸索の通過する白質にあつまるという特徴的な所見が認められている7).このような現象はげっ歯類のみならずヒトにおいても報告されているが,これらの細胞がどのような役割をもつのかはまったく不明のままであった.
1.脳の発達期においてミクログリアは軸索の周囲にあつまる
脳の発達期におけるミクログリアの役割を調べる目的で,脳におけるミクログリアの分布を調べることからはじめた.マウスにおいて,ミクログリアは生後1週間のあいだに脳梁,内包,大脳脚,小脳白質といった白質部位にあつまり,その形態的な特徴から活性化していることがわかった(図1).脳梁,内包,大脳脚といった部位は大脳皮質の皮質下投射ニューロンや脳梁投射ニューロンから伸びる軸索の通過する部位であることからGFP発現レンチウイルスを用いてその軸索を標識したところ,これら軸索の周囲に活性化したミクログリアがあつまっていることがわかった.この特徴的な分布と活性化した形態は生後2週目以降から成体にかけて認められなくなった.これらの観察から,脳の発達期においてミクログリアが神経軸索に対しなんらかの生理的な役割をもつのではないかと推察された.
2.ミクログリアの活性化の阻害あるいは除去により大脳皮質第5層のニューロンは細胞死にいたる
この役割を解明するため,まず,ミクログリアの活性化を抑制する薬剤ミノサイクリンを新生仔マウスに投与して脳に起こる変化を観察した.すると驚くべきことに,大脳皮質の第5層において特異的に細胞死のひき起こされることを発見した(図1c).これらの細胞は大部分がCTIP2陽性の皮質下投射ニューロンおよびSATB2陽性の脳梁投射ニューロンであった.逆行性トレーサーによってもこれらニューロンの特徴は確かめられた.細胞死の誘導は,ミクログリアの集積が白質に認められる生後3~5日には認められたが,ミクログリアの集積が認められない胎生18.5日あるいは生後16日には認められなかった.これらの結果から,脳の発達における特定の時期に,ミクログリアは軸索と密接にかかわりながら大脳皮質第5層のニューロンの生存を維持していると考えられた.
ミクログリアの役割をより直接的に検証するため,CD11b-DTRマウスにより選択的にミクログリアを除去し大脳皮質ニューロンの生存を評価することを試みた.このマウスはミクログリアのマーカーであるCD11b遺伝子のプロモーターの下流にてジフテリア毒素受容体を発現するトランスジェニックマウスであり,ジフテリア毒素の投与により選択的にミクログリアを減少させられることがわかった.そこで大脳皮質の第5層を観察したところ,ミノサイクリン投与の実験系と同様に,細胞死の誘導されることがわかった(図1c).
つぎに,Fractalkine-Cx3cr1シグナルに着目し実験を進めた.Fractalkineはニューロンに,その受容体であるCx3cr1はミクログリアに特異的に発現していることから,ミクログリアとニューロンとのあいだの相互作用に関しながらく注目されてきたタンパク質である.このシグナルによりミクログリアが軸索の周囲にあつまるという機序を想定していたが,Cx3cr1ノックアウトマウスにおいてミクログリアを観察したところ,予想に反してミクログリアの増加が認められた.このマウスの大脳皮質第5層を観察したところ,驚くべきことに,ニューロンに細胞死の誘導されていることがわかった.したがって,このマウスではニューロンへの生存維持作用をもたないミクログリアが増加していることが考えられた.
最後に,ミクログリアのニューロンへの生存維持作用をよりシンプルな実験系である培養系を用い直接に確認した.大脳皮質ニューロンをミクログリアと共培養すると,ニューロン単独で培養するよりも有意に生存が増加した.また,これら共培養下においてミノサイクリンを添加,あるいは,Cx3cr1欠損ミクログリアを使用すると,ミクログリアの生存維持作用は有意に減少した.
3.ミクログリアから分泌されるIGF1によりニューロンの生存は維持される
ミクログリアによりニューロンの生存が促される分子機構を解明することをめざした.ミクログリアから放出されるタンパク質を網羅的に調べた結果,IGF1が脳の発達期のミクログリアに多く発現していることがわかった(図2a).実際に,CD11b-DTRマウスにおいてミクログリアを除去すると脳においてIGF1の発現量は有意に低下した.培養系あるいはマウスにおいて,IGF1の拮抗剤H-1356やsiRNAを用いてミクログリアから放出されるIGF1を阻害したところ,大脳皮質ニューロンに細胞死が誘導された.このことから,ミクログリアから放出されるIGF1がニューロンの生存維持に関与していることが明らかになった.
一方,ミノサイクリンを投与したマウスやCx3cr1ノックアウトマウスにおいては,IGF1のmRNAレベルでの発現量は変化しなかった.しかしおもしろいことに,いずれの実験系でもIGF1に結合しIGF1シグナルを抑制するIGF結合タンパク質の発現が増加していることを見い出された.実際に,IGF結合タンパク質に結合していないIGF1の量はいずれの実験系でも減少していた.ミノサイクリンを投与したマウスでは,IGF1の投与あるいはIGF結合タンパク質のひとつIGFBP5の発現抑制により細胞死は抑制された.このことから,IGF結合タンパク質の増加によるIGF1シグナルの減少が大脳皮質第5層ニューロンの細胞死を誘導したことが示された.
おわりに
この研究により,1)脳の発達期にニューロンおよびその回路が維持される新たな分子機構,2)脳の免疫細胞と考えられていたミクログリアの新たな機能,が明らかになった(図2b).近年の研究から,ミクログリアは脳の発達期において,シナプスの除去,神経幹細胞の制御,死細胞の誘導および貪食,といった多岐にわたる機能をもつことが明らかになってきており,その脳における重要性が認知されはじめている.さらに,ミクログリアは休止型から活性型へと性質を動的に変化させることが知られており,また,活性型のミクログリアにも脳組織に対し保護作用あるいは毒性作用をもつものがあるなど,多種多様な顔をもつことが明らかになっている.この研究をとおして生理的な条件におけるミクログリアの機能の全貌が明らかになっていけば,病態下の脳において活性化するミクログリアを制御し病態を緩和に導く可能性も開けてくるであろう8).とくに,大脳皮質第5層に存在する皮質下投射ニューロンのひとつである皮質脊髄路ニューロンは,脊髄損傷,脳血管障害,筋萎縮性側索硬化症といった病態下で傷害をうけ,その結果,運動機能に重篤な障害のもたらされることが知られている9).ミクログリアによりこれらニューロンを保護する効果を誘導することができれば,新たな治療法の開発にもつながると期待される.
文 献
- Oppenheim, R. W. & Johnson, J. E.: Programmed cell death and neurotrophic factors. in Fundamental Neuroscience, 2nd Ed. (Squire, L. R., Bloom, F. E., McConnell, S. K. et al. eds.), pp. 499-532, Academic Press, New York (2003)
- Huang, E. J. & Reichardt, L. F.: Neurotrophins: roles in neuronal development and function. Annu. Rev. Neurosci., 24, 677-736 (2001)[PubMed]
- Catapano, L. A., Arnold, M. W., Perez, F. A. et al.: Specific neurotrophic factors support the survival of cortical projection neurons at distinct stages of development. J. Neurosci., 21, 8863-8872 (2001)[PubMed]
- Dugas, J. C., Mandemakers, W., Rogers, M. et al.: A novel purification method for CNS projection neurons leads to the identification of brain vascular cells as a source of trophic support for corticospinal motor neurons. J. Neurosci., 28, 8294-8305 (2008)[PubMed]
- Tremblay, M. E., Stevens, B., Sierra, A. et al.: The role of microglia in the healthy brain. J. Neurosci., 31, 16064-16069 (2011)[PubMed]
- Ginhoux, F., Greter, M., Leboeuf, M. et al.: Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science, 330, 841-845 (2010)[PubMed]
- Hristova, M., Cuthill, D., Zbarsky, V. et al.: Activation and deactivation of periventricular white matter phagocytes during postnatal mouse development. Glia, 58, 11-28 (2010)[PubMed]
- David, S. & Kroner, A.: Repertoire of microglial and macrophage responses after spinal cord injury. Nat. Rev. Neurosci., 12, 388-399 (2011)[PubMed]
- Ueno, M. & Yamashita, T.: Strategies for regenerating injured axons after spinal cord injury: insights from brain development. Biologics, 2, 253-264 (2008)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院農学生命科学研究科 修了,同年 理化学研究所脳科学総合研究センター 研究員,千葉大学大学院医学研究院 研究員,大阪大学大学院医学系研究科 助教を経て,2012年より米国Cincinnati Children’s Hospital Medical Center研究員.
研究テーマ:発達期と中枢神経疾患における神経回路の動作原理.
藤田 幸(Yuki Fujita)
大阪大学大学院医学系研究科 特任助教.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2013 上野将紀・藤田 幸・山下俊英 Licensed under CC 表示 2.1 日本