STINGによる自己および非自己に由来するDNA成分の認識と自然免疫応答の制御
阿部隆之・Glen N. Barber
(米国Miami大学Miller School of Medicine,Department of Cell Biology)
email:阿部隆之
DOI: 10.7875/first.author.2013.038
STING recognition of cytoplasmic DNA instigates cellular defense.
Takayuki Abe, Ai Harashima, Tianli Xia, Hiroyasu Konno, Keiko Konno, Alejo Morales, Jeonghyun Ahn, Delia Gutman, Glen N. Barber
Molecular Cell, 50, 5-15 (2013)
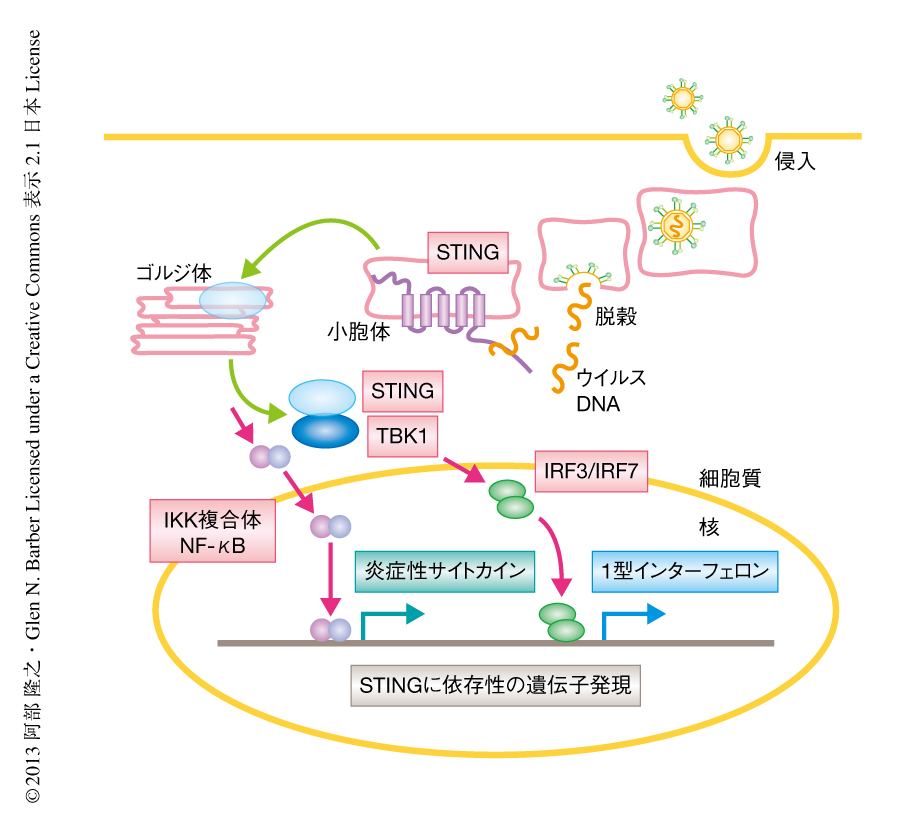
小胞体に局在する膜タンパク質として同定されたSTINGは,さまざまなRNAウイルスおよびDNAウイルスの感染に対する生体防御機構において重要な役割をはたす.また,STINGはウイルスおよび細菌に由来するDNA成分に対する自然免疫応答の誘導に重要な役割を示すことが報告されているが,その分子機序は明らかにされていなかった.この論文において,筆者らは,STINGはウイルスに由来するゲノムDNAのみならず,ISDとよばれる45~90塩基対の合成2本鎖DNA,さらに,アポトーシス細胞に由来する自己のDNA成分と複合体を形成しうることを明らかにした.in vitroにおけるDNA相互作用領域の解析より,STINGのC末端側の領域が重要であることが示された.STINGによるさまざまなDNA成分の認識はSTINGの核膜の周辺領域へのダイナミックな局在の変化を誘発し,TBK1の活性化を介しインターフェロンの産生を誘導することが示された.さらに,STINGは微生物に由来する非自己のDNA成分のみならず,自己のDNA成分の認識を介した慢性的な炎症性の応答の制御にも関与している可能性が示唆された.
われわれの生体には,細菌などの微生物やウイルスの感染に対する初期の生体防御反応に関与する認識タンパク質(外来の異物に対するセンサータンパク質とも呼称される)がいくつか存在することが,近年の自然免疫学の進展から明らかにされている1-3).初期のブレークスルーとしては,細菌の細胞壁を構成する脂質や,非メチル化CpGモチーフ配列をもつゲノムDNAなど,グラム陰性細菌あるいはグラム陽性細菌に由来するさまざまな構成物を特異的に認識するToll様受容体(TLR:Toll-like receptor)の報告があげられる.Toll様受容体は細胞膜における異物の感知が主体となるが,Toll様受容体ファミリーのなかでもTLR7やTLR9のようにウイルスに由来する核酸成分(ゲノムRNAとゲノムDNA)を認識するものも報告されている.Toll様受容体による核酸成分の認識はおもに形質細胞様樹状細胞がその中心となり,核酸成分を取り込んだファゴソームとオートファゴソームとの融合の過程においてインターフェロンの産生シグナルが伝達される.つぎに,RNAウイルスの感染におけるゲノム複製の過程などにおいて産生されるゲノムRNAに対するセンサータンパク質として,RIG-IおよびMDA5とよばれるタンパク質が同定された.RIG-IおよびMDA5は細胞質において暴露されたウイルスに由来するゲノムRNAの感知におもに関与しており,ウイルスの種によりこの2つのタンパク質による識別の異なることが報告されている.では,単純ヘルペスウイルスなどに代表されるDNAウイルスやそれらを模倣した合成DNAの導入,あるいは,自己ならびに非自己に由来するDNA成分に関与する,いわゆるDNAセンサーは存在するのか? この残された命題に対しては,近年,ZBP1,IFI16,ならびに,RNAヘリカーゼであるDDX41など,いくつかの候補タンパク質が報告されてきた3).これらのタンパク質は,DNAウイルスの感染に対する初期応答には関与するものの,特定の細胞種に限局する傾向が示唆されている.また,インターフェロンの産生に対する応答がB-DNAとよばれる右巻きらせん構造をもつ合成DNAの反応に依存しているため,RIG-I経路に依存したシグナル伝達系の部分的な関与が推察された.さらに,遺伝子改変マウスを用いた系での立証が残されているため,本質的なDNAセンサーの同定においては依然として統一した見解が得られていないという背景があった.
小胞体に局在する膜タンパク質であるSTING(stimulator of interferon genes)がISD(IFN-stimulatory DNA)とよばれる45~90塩基対の合成2本鎖DNAの細胞への導入やDNAウイルスの感染に対する自然免疫応答において重要であることは遺伝子改変マウスを用いた系により立証されてきたが,それらの遺伝子発現の制御パターンは詳細には解析されていなかった.マイクロアレイによる網羅的な解析から,ISDの導入およびDNAウイルスの感染によるインターフェロンの産生ならびに多くのインターフェロン誘導関連遺伝子の発現がSTINGの発現に依存していることが明らかになった.それらの遺伝子発現の制御パターンは転写因子STAT1の欠損によりほとんど影響をうけなかったことから,インターフェロン受容体を介したオートクライン効果ならびにパラクライン効果には依存せず,STING-TBK1-IRF経路に強く依存するものであった.さらに,2本鎖DNAに由来するISDほどではないが,1本鎖DNAに由来するISDの導入もSTINGに依存的なインターフェロンの産生誘導を示し,STINGの核膜の周辺領域への局在変化も確認された.ISDの培養細胞への導入により観察されたSTING依存的に発現する遺伝子の発現パターンは,I型単純ヘルペスウイルス変異株のマウス胎仔線維芽細胞への感染実験でも証明された.また,アポトーシス細胞に由来する自己DNA成分に対しても同様の知見が得られていることから4),さまざまな自己および非自己のDNA成分に対するSTING依存的に発現する遺伝子の応答が慢性的な炎症反応をともなう自己免疫性疾患の誘発に関与している可能性が示唆された.
STINGはいかなる機序をもってDNA成分に依存的な遺伝子発現の発動に関与するのであろうか? STINGとDNA成分との複合体の形成の可能性を検討するため,培養細胞におけるSTINGと2本鎖DNAに由来するISDとの複合体の検出を試みた.hTERT-BJ1細胞およびマウス胎仔線維芽細胞に末端ビオチンラベルを施した2本鎖ISDを導入したのち,紫外線の照射あるいはDSS試薬により架橋固定を行った.細胞の溶解をへてプルダウンアッセイを行い,イムノブロット法により内在性のSTINGの検出を試みたところ,ISDを導入した細胞にのみSTINGの発現が検出された.また,STINGを欠損したマウス胎仔線維芽細胞を使用した同じ実験からも,検出されたバンドがSTINGに特異的であることが立証された.つぎに,STINGの各種の欠損変異体を作製し,293T細胞に発現させたのち,2本鎖DNAに由来するISDによりプルダウンを行うことにより複合体の形成にかかわるSTINGの責任領域を決定した.その結果,STINGの細胞質領域であるC末端側(181~379アミノ酸残基),とくに,242~290アミノ酸残基の領域がDNAとの複合体の形成に重要であることが示唆された.さらに,242~290アミノ酸残基の領域の異種間の相同性アミノ酸部位の変異体を用いた解析から,少なくとも,245番目のチロシン残基と268番目のロイシン残基がDNAとの複合体の形成,インターフェロンの産生誘導活性,ならびに,STINGの細胞内局在の変化のすべてに重要であることが示された.
STINGとDNAとの複合体の形成に及ぼすほかのDNAセンサー候補タンパク質の影響についても検討した.2本鎖DNAに由来するISDを用いたDNAプルダウンアッセイの結果から,STINGとDNAとの複合体の形成はIFI16ならびにDDX41のRNAi法によるノックダウンの影響をうけないことが示された.このことから,間接的ではあるがIFI16およびDDX41は2本鎖ISDの認識プロセスには関与していない可能性が示唆された.また,IFI16ならびにDDX41のhTERT-BJ1細胞におけるノックダウンは,2本鎖DNAに由来するISDの刺激にともなうインターフェロンの産生誘導や,種々のDNAウイルスの感染にともなうSTINGの細胞内局在の変化に影響を及ぼさなかったことから,IFI16およびDDX41のDNA成分に依存的な自然免疫シグナル経路(STINGに依存した自然免疫の誘導経路)への関与は低いものと考察された.
STINGはDNAとの複合体の形成において宿主に由来するなんらかのタンパク質を必要とするのだろうか? 大腸菌において発現精製したSTINGを用いて,in vitroにおいて2本鎖DNAに由来するISDによるDNAプルダウンアッセイを行った.その結果,精製されたSTINGは2本鎖ISDによりプルダウンされることが示されたことから,少なくとも,STINGは細胞に由来するほかのタンパク質なしでもDNAと複合体を形成しうることが示された.一方,表面プラズモン共鳴法を用いた分子間相互作用の解析からは,STINGと2本鎖DNAに由来するISDとの複合体の形成において13.7μMという結合解離定数が得られた.さらに,18塩基対あるいは30塩基対の短鎖のDNAを用いた蛍光分極アッセイからも,STINGと2本鎖DNAとの複合体の形成が観察された.
これまで,セカンドメッセンジャーであるサイクリックdi-GMPが骨髄に由来するマクロファージ細胞や樹状細胞に対しTBK1-IRF3経路に依存的にインターフェロンの産生を誘導することが報告されていた5).その作用機序はながらく明らかにされていなかったが,近年,このサイクリックdi-GMPがSTINGと結合することによりインターフェロン誘導性のリガンドとして機能することが報告された6).今回,ビオチンラベルを施したサイクリックdi-GMPを用いて,hTERT-BJ1細胞,マウス胎仔線維芽細胞,および,マウスマクロファージ細胞株Raw264.7に対するプルダウンアッセイを行ったが,内在性のSTINGの検出は認められなかった.さらに,筆者らの用いた評価系では,サイクリックdi-GMPの細胞への導入にともなうインターフェロンの産生誘導やSTINGの細胞内局在の変化も認めなかった.これらの結果より,サイクリックdi-GMPによる自然免疫応答には細胞種について特異性のともなう可能性が示唆されたが,今後,DNAリガンドとの作用機序の相違点について検討が必要であると思われた.
ここ10年ほどの自然免疫学の進展にはめざましいものがあり,病原微生物の初期感染における生体防御機構の理解が急速に深まっている.STINGは当初の発見より,Toll様受容体に対するMyD88,ならびに,RIG-IやMDA5に対するIPS-1のように,シグナル伝達系におけるアダプタータンパク質としての役割が示唆されていた.しかしながら,この論文で明らかにされたように,微生物に由来するDNA成分に対する直接的なセンサータンパク質としても機能する可能性が示唆された(図1).一方で,STINGは単純ヘルペスウイルスなどDNAウイルスのみならず,RNAウイルスである水疱性口内炎ウイルスの感染防御にも寄与することが報告されている1).RNAウイルスの感染に対するSTINGの役割には不明な点が多く残されているが,STINGはRNAウイルスも含めた広範なウイルスの感染に対する重要な生体防御タンパク質であることが示唆された.さらに,STINGはDNA成分の感知にともない小胞体膜から核膜の周辺領域へとダイナミックな局在変化を示すが,その詳細な分子機序は明らかにされていない.今後,免疫学的な解析のみならず,細胞生物学的な視点からも考察する必要があると思われる.また,STINGは,アポトーシス細胞に由来する自己DNA成分にも反応し過剰な炎症性応答を惹起する要因にもなりうることから,STINGに依存的なシグナル伝達経路の制御は自己免疫性疾患の改善に寄与することが期待される.
略歴:2002年 千葉工業大学大学院工学研究科 修了,同年 大阪大学微生物病研究所 研究員,2005年 同 助教を経て,2011年より米国Miami大学Miller School of MedicineにてResearch associate-II.
研究テーマ:ウイルス感染による自然免疫の誘導.
抱負:病原微生物に対する宿主の防御機構の全貌の解明に貢献し,治療法や予防法の開発につなげたい.
Glen N. Barber
米国Miami大学Miller School of MedicineにてProfessor.
© 2013 阿部隆之・Glen N. Barber Licensed under CC 表示 2.1 日本
(米国Miami大学Miller School of Medicine,Department of Cell Biology)
email:阿部隆之
DOI: 10.7875/first.author.2013.038
STING recognition of cytoplasmic DNA instigates cellular defense.
Takayuki Abe, Ai Harashima, Tianli Xia, Hiroyasu Konno, Keiko Konno, Alejo Morales, Jeonghyun Ahn, Delia Gutman, Glen N. Barber
Molecular Cell, 50, 5-15 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
STING(Q3TBT3), TBK1(Q9WUN2), インターフェロン, Toll様受容体, TLR, Toll-like receptor, TLR7(P58681), TLR9(Q9EQU3), RIG-I(Q6Q899), MDA5(Q8R5F7), ZBP1(O88477), IFI16(Q16666), RNAヘリカーゼ, DDX41(Q91VN6), stimulator of interferon genes(Q3TBT3), STAT1(P42225), インターフェロン受容体, IRF, TERT(O14746), IRF3(P70671), MyD88(P22366), IPS-1(Q8VCF0), NF-κB, 炎症性サイトカイン
要 約
小胞体に局在する膜タンパク質として同定されたSTINGは,さまざまなRNAウイルスおよびDNAウイルスの感染に対する生体防御機構において重要な役割をはたす.また,STINGはウイルスおよび細菌に由来するDNA成分に対する自然免疫応答の誘導に重要な役割を示すことが報告されているが,その分子機序は明らかにされていなかった.この論文において,筆者らは,STINGはウイルスに由来するゲノムDNAのみならず,ISDとよばれる45~90塩基対の合成2本鎖DNA,さらに,アポトーシス細胞に由来する自己のDNA成分と複合体を形成しうることを明らかにした.in vitroにおけるDNA相互作用領域の解析より,STINGのC末端側の領域が重要であることが示された.STINGによるさまざまなDNA成分の認識はSTINGの核膜の周辺領域へのダイナミックな局在の変化を誘発し,TBK1の活性化を介しインターフェロンの産生を誘導することが示された.さらに,STINGは微生物に由来する非自己のDNA成分のみならず,自己のDNA成分の認識を介した慢性的な炎症性の応答の制御にも関与している可能性が示唆された.
はじめに
われわれの生体には,細菌などの微生物やウイルスの感染に対する初期の生体防御反応に関与する認識タンパク質(外来の異物に対するセンサータンパク質とも呼称される)がいくつか存在することが,近年の自然免疫学の進展から明らかにされている1-3).初期のブレークスルーとしては,細菌の細胞壁を構成する脂質や,非メチル化CpGモチーフ配列をもつゲノムDNAなど,グラム陰性細菌あるいはグラム陽性細菌に由来するさまざまな構成物を特異的に認識するToll様受容体(TLR:Toll-like receptor)の報告があげられる.Toll様受容体は細胞膜における異物の感知が主体となるが,Toll様受容体ファミリーのなかでもTLR7やTLR9のようにウイルスに由来する核酸成分(ゲノムRNAとゲノムDNA)を認識するものも報告されている.Toll様受容体による核酸成分の認識はおもに形質細胞様樹状細胞がその中心となり,核酸成分を取り込んだファゴソームとオートファゴソームとの融合の過程においてインターフェロンの産生シグナルが伝達される.つぎに,RNAウイルスの感染におけるゲノム複製の過程などにおいて産生されるゲノムRNAに対するセンサータンパク質として,RIG-IおよびMDA5とよばれるタンパク質が同定された.RIG-IおよびMDA5は細胞質において暴露されたウイルスに由来するゲノムRNAの感知におもに関与しており,ウイルスの種によりこの2つのタンパク質による識別の異なることが報告されている.では,単純ヘルペスウイルスなどに代表されるDNAウイルスやそれらを模倣した合成DNAの導入,あるいは,自己ならびに非自己に由来するDNA成分に関与する,いわゆるDNAセンサーは存在するのか? この残された命題に対しては,近年,ZBP1,IFI16,ならびに,RNAヘリカーゼであるDDX41など,いくつかの候補タンパク質が報告されてきた3).これらのタンパク質は,DNAウイルスの感染に対する初期応答には関与するものの,特定の細胞種に限局する傾向が示唆されている.また,インターフェロンの産生に対する応答がB-DNAとよばれる右巻きらせん構造をもつ合成DNAの反応に依存しているため,RIG-I経路に依存したシグナル伝達系の部分的な関与が推察された.さらに,遺伝子改変マウスを用いた系での立証が残されているため,本質的なDNAセンサーの同定においては依然として統一した見解が得られていないという背景があった.
1.STINGによるさまざまなDNA成分に対する自然免疫応答の誘導
小胞体に局在する膜タンパク質であるSTING(stimulator of interferon genes)がISD(IFN-stimulatory DNA)とよばれる45~90塩基対の合成2本鎖DNAの細胞への導入やDNAウイルスの感染に対する自然免疫応答において重要であることは遺伝子改変マウスを用いた系により立証されてきたが,それらの遺伝子発現の制御パターンは詳細には解析されていなかった.マイクロアレイによる網羅的な解析から,ISDの導入およびDNAウイルスの感染によるインターフェロンの産生ならびに多くのインターフェロン誘導関連遺伝子の発現がSTINGの発現に依存していることが明らかになった.それらの遺伝子発現の制御パターンは転写因子STAT1の欠損によりほとんど影響をうけなかったことから,インターフェロン受容体を介したオートクライン効果ならびにパラクライン効果には依存せず,STING-TBK1-IRF経路に強く依存するものであった.さらに,2本鎖DNAに由来するISDほどではないが,1本鎖DNAに由来するISDの導入もSTINGに依存的なインターフェロンの産生誘導を示し,STINGの核膜の周辺領域への局在変化も確認された.ISDの培養細胞への導入により観察されたSTING依存的に発現する遺伝子の発現パターンは,I型単純ヘルペスウイルス変異株のマウス胎仔線維芽細胞への感染実験でも証明された.また,アポトーシス細胞に由来する自己DNA成分に対しても同様の知見が得られていることから4),さまざまな自己および非自己のDNA成分に対するSTING依存的に発現する遺伝子の応答が慢性的な炎症反応をともなう自己免疫性疾患の誘発に関与している可能性が示唆された.
2.in vivoにおけるSTINGと2本鎖DNAとの複合体の形成
STINGはいかなる機序をもってDNA成分に依存的な遺伝子発現の発動に関与するのであろうか? STINGとDNA成分との複合体の形成の可能性を検討するため,培養細胞におけるSTINGと2本鎖DNAに由来するISDとの複合体の検出を試みた.hTERT-BJ1細胞およびマウス胎仔線維芽細胞に末端ビオチンラベルを施した2本鎖ISDを導入したのち,紫外線の照射あるいはDSS試薬により架橋固定を行った.細胞の溶解をへてプルダウンアッセイを行い,イムノブロット法により内在性のSTINGの検出を試みたところ,ISDを導入した細胞にのみSTINGの発現が検出された.また,STINGを欠損したマウス胎仔線維芽細胞を使用した同じ実験からも,検出されたバンドがSTINGに特異的であることが立証された.つぎに,STINGの各種の欠損変異体を作製し,293T細胞に発現させたのち,2本鎖DNAに由来するISDによりプルダウンを行うことにより複合体の形成にかかわるSTINGの責任領域を決定した.その結果,STINGの細胞質領域であるC末端側(181~379アミノ酸残基),とくに,242~290アミノ酸残基の領域がDNAとの複合体の形成に重要であることが示唆された.さらに,242~290アミノ酸残基の領域の異種間の相同性アミノ酸部位の変異体を用いた解析から,少なくとも,245番目のチロシン残基と268番目のロイシン残基がDNAとの複合体の形成,インターフェロンの産生誘導活性,ならびに,STINGの細胞内局在の変化のすべてに重要であることが示された.
STINGとDNAとの複合体の形成に及ぼすほかのDNAセンサー候補タンパク質の影響についても検討した.2本鎖DNAに由来するISDを用いたDNAプルダウンアッセイの結果から,STINGとDNAとの複合体の形成はIFI16ならびにDDX41のRNAi法によるノックダウンの影響をうけないことが示された.このことから,間接的ではあるがIFI16およびDDX41は2本鎖ISDの認識プロセスには関与していない可能性が示唆された.また,IFI16ならびにDDX41のhTERT-BJ1細胞におけるノックダウンは,2本鎖DNAに由来するISDの刺激にともなうインターフェロンの産生誘導や,種々のDNAウイルスの感染にともなうSTINGの細胞内局在の変化に影響を及ぼさなかったことから,IFI16およびDDX41のDNA成分に依存的な自然免疫シグナル経路(STINGに依存した自然免疫の誘導経路)への関与は低いものと考察された.
3.in vitroにおけるSTINGと2本鎖DNAとの複合体の形成
STINGはDNAとの複合体の形成において宿主に由来するなんらかのタンパク質を必要とするのだろうか? 大腸菌において発現精製したSTINGを用いて,in vitroにおいて2本鎖DNAに由来するISDによるDNAプルダウンアッセイを行った.その結果,精製されたSTINGは2本鎖ISDによりプルダウンされることが示されたことから,少なくとも,STINGは細胞に由来するほかのタンパク質なしでもDNAと複合体を形成しうることが示された.一方,表面プラズモン共鳴法を用いた分子間相互作用の解析からは,STINGと2本鎖DNAに由来するISDとの複合体の形成において13.7μMという結合解離定数が得られた.さらに,18塩基対あるいは30塩基対の短鎖のDNAを用いた蛍光分極アッセイからも,STINGと2本鎖DNAとの複合体の形成が観察された.
4.セカンドメッセンジャーに対するSTINGの応答性
これまで,セカンドメッセンジャーであるサイクリックdi-GMPが骨髄に由来するマクロファージ細胞や樹状細胞に対しTBK1-IRF3経路に依存的にインターフェロンの産生を誘導することが報告されていた5).その作用機序はながらく明らかにされていなかったが,近年,このサイクリックdi-GMPがSTINGと結合することによりインターフェロン誘導性のリガンドとして機能することが報告された6).今回,ビオチンラベルを施したサイクリックdi-GMPを用いて,hTERT-BJ1細胞,マウス胎仔線維芽細胞,および,マウスマクロファージ細胞株Raw264.7に対するプルダウンアッセイを行ったが,内在性のSTINGの検出は認められなかった.さらに,筆者らの用いた評価系では,サイクリックdi-GMPの細胞への導入にともなうインターフェロンの産生誘導やSTINGの細胞内局在の変化も認めなかった.これらの結果より,サイクリックdi-GMPによる自然免疫応答には細胞種について特異性のともなう可能性が示唆されたが,今後,DNAリガンドとの作用機序の相違点について検討が必要であると思われた.
おわりに
ここ10年ほどの自然免疫学の進展にはめざましいものがあり,病原微生物の初期感染における生体防御機構の理解が急速に深まっている.STINGは当初の発見より,Toll様受容体に対するMyD88,ならびに,RIG-IやMDA5に対するIPS-1のように,シグナル伝達系におけるアダプタータンパク質としての役割が示唆されていた.しかしながら,この論文で明らかにされたように,微生物に由来するDNA成分に対する直接的なセンサータンパク質としても機能する可能性が示唆された(図1).一方で,STINGは単純ヘルペスウイルスなどDNAウイルスのみならず,RNAウイルスである水疱性口内炎ウイルスの感染防御にも寄与することが報告されている1).RNAウイルスの感染に対するSTINGの役割には不明な点が多く残されているが,STINGはRNAウイルスも含めた広範なウイルスの感染に対する重要な生体防御タンパク質であることが示唆された.さらに,STINGはDNA成分の感知にともない小胞体膜から核膜の周辺領域へとダイナミックな局在変化を示すが,その詳細な分子機序は明らかにされていない.今後,免疫学的な解析のみならず,細胞生物学的な視点からも考察する必要があると思われる.また,STINGは,アポトーシス細胞に由来する自己DNA成分にも反応し過剰な炎症性応答を惹起する要因にもなりうることから,STINGに依存的なシグナル伝達経路の制御は自己免疫性疾患の改善に寄与することが期待される.
文 献
- Ishikawa, H. & Barber, G. N.: STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature, 455, 674-678 (2008)[PubMed]
- Ishikawa, H., Ma, Z. & Barber, G. N.: STING regulates intracellular DNA-mediated, type I interferon-dependent innate immunity. Nature, 461, 788-792 (2009)[PubMed]
- Christophe, J. D. & Ishii, K. J.: Nucleic acid sensing at the interface between innate and adaptive immunity in vaccination. Nat. Rev. Immunol., 12, 479-491 (2012)[PubMed]
- Ahn, J., Gutman, D., Saijo, S. et al.: STING manifests self DNA-dependent inflammatory disease. Proc. Natl. Acad. Sci. USA, 109, 19386-19391 (2012)[PubMed]
- McWhirter, S. M., Barbalat, R., Monroe, K. M. et al.: A host type I interferon response is induced by cytosolic sensing of the bacterial second messenger cyclic-di-GMP. J. Exp. Med., 206, 1899-1911 (2009)[PubMed]
- Burdette, D. L., Monroe, K. M., Troha-S, K. et al.: STING is a direct innate immune sensor of cyclic di-GMP. Nature, 478, 515-518 (2011)[PubMed]
著者プロフィール
略歴:2002年 千葉工業大学大学院工学研究科 修了,同年 大阪大学微生物病研究所 研究員,2005年 同 助教を経て,2011年より米国Miami大学Miller School of MedicineにてResearch associate-II.
研究テーマ:ウイルス感染による自然免疫の誘導.
抱負:病原微生物に対する宿主の防御機構の全貌の解明に貢献し,治療法や予防法の開発につなげたい.
Glen N. Barber
米国Miami大学Miller School of MedicineにてProfessor.
© 2013 阿部隆之・Glen N. Barber Licensed under CC 表示 2.1 日本