イネ白葉枯病菌のもつエフェクタータンパク質の標的であるOsRLCK185はキチン受容体に直接にリン酸化されイネの免疫を誘導する
山口公志・川崎 努
(近畿大学農学部 バイオサイエンス学科植物分子遺伝学研究室)
email:山口公志,川崎 努
DOI: 10.7875/first.author.2013.035
A receptor-like cytoplasmic kinase targeted by a plant pathogen effector is directly phosphorylated by the chitin receptor and mediates rice immunity.
Koji Yamaguchi, Kenta Yamada, Kazuya Ishikawa, Satomi Yoshimura, Nagao Hayashi, Kouhei Uchihashi, Nobuaki Ishihama, Mitsuko Kishi-Kaboshi, Akira Takahashi, Seiji Tsuge, Hirokazu Ochiai, Yasuomi Tada, Ko Shimamoto, Hirofumi Yoshioka, Tsutomu Kawasaki
Cell Host & Microbe, 13, 347-357 (2013)
植物は病原微生物の感染にともないその構成成分を細胞膜にある受容体を介して感知しその侵入を認識する.そのシグナルはMAPキナーゼカスケードを活性化し,結果として,細胞壁の強化や抗菌性物質の産生などさまざまなタイプの免疫機構が発動される.しかし,受容体からのシグナルがどのようにしてMAPキナーゼカスケードへと伝達されるのかはまったく不明であった.今回,筆者らは,イネ白葉枯病菌のもつイネの免疫経路を阻害するエフェクタータンパク質Xoo1488の解析から,その標的タンパク質OsRLCK185を同定した.OsRLCK185は病原微生物の構成成分であるキチンを認識する受容体OsCERK1と相互作用し,キチンを認識したOsCERK1は直接にOsRLCK185をリン酸化することが明らかになった.さらに,OsRLCK185発現抑制イネではキチンにより誘導されるMAPキナーゼの活性化の顕著な低下が検出された.このことから,OsRLCK185は受容体とMAPキナーゼとのあいだをつなぐ重要なタンパク質であることが示唆された.また,Xoo1488はOsCERK1によるOsRLCK185のリン酸化を阻害することによりイネの免疫応答を阻害していることも明らかとなった.
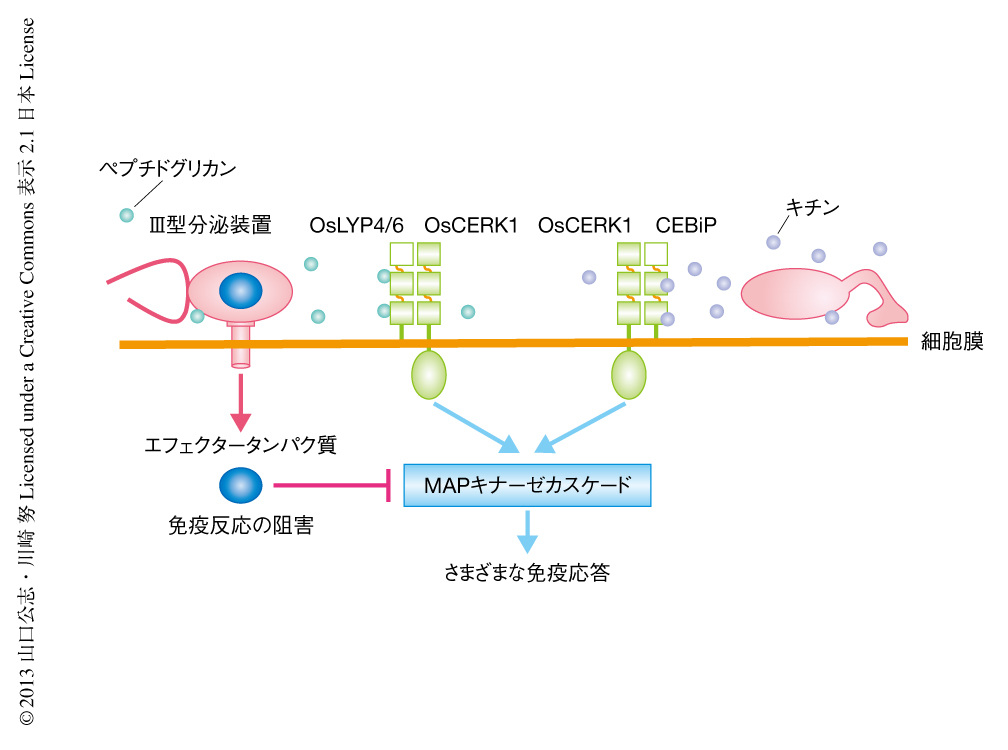
植物は病原微生物を構成する多様な分子(pathogen-associated molecular pattern:PAMP,病原細菌関連分子パターン)を認識し防御応答を誘導する能力をもつ1,2)(図1).真菌の細胞壁の構成多糖でありこの病原細菌関連分子パターンのひとつであるキチンは,細胞外にキチン結合ドメインをもつ受容体CEBiPにより認識される.CEBiPはリガンドに依存的に共役受容体であるOsCERK1と複合体を形成し,細胞内にキナーゼドメインをもつOsCERK1が細胞内へシグナルを伝達する3).その下流では,MAPキナーゼカスケードの活性化や活性酸素の産生などが誘導され,最終的に,パターン誘導性免疫(pattern-triggered immunity:PTI)とよばれる防御関連遺伝子の発現や抗菌性物質の合成などをともなう多様な防御応答反応が誘導される4).さらに,OsCERK1は細菌の細胞壁の構成成分であるペプチドグリカンと結合するOsLYP4およびOsLYP6と協調してペプチドグリカンの受容およびシグナル伝達にかかわっていることも示唆されている5).一方,病原微生物は進化の過程において植物のパターン誘導性免疫を打破するため,これを抑制することのできるエフェクタータンパク質と,このエフェクタータンパク質を植物の細胞へと注入するための装置であるIII型分泌装置を獲得している(図1).これらを獲得した病原微生物は効果的にパターン誘導性免疫を抑制することにより宿主への感染を可能にしたと考えられる.そのため,植物への病害が確認されている病原微生物は効果的なエフェクタータンパク質をもつ可能性が高い.このようなことから,エフェクタータンパク質はパターン誘導性免疫におけるシグナル伝達において重要なはたらきをする宿主のタンパク質を阻害することにより,植物の免疫機構を効率的に阻害していると考えられる.そこで,筆者らは,イネの重要な病害である白葉枯病をひき起こすイネ白葉枯病菌のもつエフェクタータンパク質Xoo1488を利用し,植物免疫の阻害機構を理解するとともに,イネにおける新規の免疫タンパク質の同定をめざした6).
イネ白葉枯病菌のもつエフェクタータンパク質のひとつであるXoo1488は,282アミノ酸残基からなる機能未知のタンパク質である.Xoo1488には既知のタンパク質との相同性はなく,一部のXanthomonas属において相同性を示すタンパク質が検出されている.Xoo1488がイネの免疫を抑制するかどうかを検討するためXoo1488を発現した形質転換イネを作製し,イネ白葉枯病菌に対する抵抗性を検定した.その結果,通常のイネと比較して,Xoo1488発現イネでは抵抗性の低下が確認された.このことから,Xoo1488はイネの免疫経路を抑制していることが示唆された.
さらに,Xoo1488のパターン誘導性免疫に対する抑制効果を確認するため,Xoo1488発現イネ培養細胞を用い,ペプチドグリカンおよびキチンにより誘導される防御遺伝子の発現を解析した.その結果,ペプチドグリカンあるいはキチンにより誘導される防御応答遺伝子の発現はXoo1488発現イネ培養細胞において顕著に低下していた.このことは,Xoo1488がキチンやペプチドグリカンにより誘導されるパターン誘導性免疫の誘導を阻害していることを示唆した.
酵母ツーハイブリッド法を利用してXoo1488が標的とするイネのタンパク質を網羅的に探索した.その結果,膜貫通ドメインをもたないプロテインキナーゼであるイネの受容体様細胞質キナーゼファミリー(RLCKファミリー)に属するタンパク質OsRLCK185を同定した.OsRLCK185は耐病性などのシグナル伝達経路に関与するRLCKファミリーのメンバーが含まれるRLCK VIIサブファミリーに属していた7).そこで,イネのパターン誘導性免疫におけるシグナル伝達経路にこのOsRLCK185が関与しているかどうかを検討した.OsRLCK185発現抑制イネ培養細胞を用い,キチンあるいはペプチドグリカンを処理した際に誘導される遺伝子の発現解析を行った.その結果,OsRLCK185発現抑制イネ培養細胞における遺伝子発現の誘導は野生株より顕著に低下していた.さらに,キチンを処理したときの活性酸素種の産生に関しても,OsRLCK185発現抑制イネ培養細胞では低下していることがわかった.以上の結果から,OsRLCK185はイネのパターン誘導性免疫におけるシグナル伝達経路を正に制御するタンパク質であることが示唆された.
OsRLCK185は細胞膜に局在しキチンなどにより誘導されるパターン誘導性免疫におけるシグナル伝達経路に関与していることから,病原細菌関連分子パターンを認識する受容体であるOsCERK1との関係性に着目した.免疫沈降法や2分子蛍光相補(bimolecular fluorescence complementation:BiFC法)などを用いた相互作用解析の結果,OsRLCK185は細胞膜においてOsCERK1と相互作用していることが明らかになった.一般的に,RLCKはリン酸化による活性制御をうけるため,OsRLCK185がキチンに応答してリン酸化修飾されるかどうかを検討した.その結果,イネ培養細胞においてキチン処理後5分をピークとしたOsRLCK185のリン酸化が検出された.OsCERK1は細胞内にキナーゼドメインをもつことから,OsCERK1はOsRLCK185を直接にリン酸化するかどうかを検証した.その結果,in vitroにおいてOsCERK1はOsRLCK185を直接にリン酸化することが明らかになった.
これまでイネにおいて,キチンによりMAPキナーゼであるOsMPK3,OsMPK4,OsMPK6の活性化が生じること,また,そのシグナル経路はOsMPK3およびOsMPK6のかかわる経路と,OsMPK4のかかわる経路の2つに大別されることが報告されている8).キチンに応答したOsRLCK185のリン酸化とMAPキナーゼの活性化を比較したところ,OsRLCK185のリン酸化はMAPキナーゼの活性化に先行して生じることが明らかになった.
OsRLCK185発現抑制イネ培養細胞を用いて,キチンにより誘導されるMAPキナーゼの活性化を経時的に解析した.通常,OsMPK3およびOsMPK6はキチン処理後5~15分で活性化するのに対し,OsRLCK185発現抑制イネ培養細胞ではこれらのMAPキナーゼの活性化が顕著に抑制されていた.一方で,OsRLCK185発現抑制イネ培養細胞におけるOsMPK4の活性化は野生株と同様であった.さらに,Xoo1488発現イネ培養細胞を用いて同様の解析を行った結果,さきの結果と同様に,OsMPK3およびOsMPK6の活性化のみが抑制されていることが明らかになった.以上の結果から,OsRLCK185はOsMPK3およびOsMPK6の上流に位置することが示唆された.
Xoo1488によるOsRLCK185を介したパターン誘導性免疫におけるシグナル阻害の機構を明らかにするため,Xoo1488発現イネ培養細胞においてキチンに応答したOsRLCK185のリン酸化のレベルを解析したところ顕著に抑制されていた.つぎに,Xoo1488がOsCERK1からのOsRLCK185へのリン酸化に影響をあたえているかどうかを検討した.in vitroの実験系において解析したところ,Xoo1488の存在下ではOsCERK1によるOsRLCK185へのリン酸化は阻害された.このことから,Xoo1488はOsCERK1からのOsRLCK185へのリン酸化を阻害し,OsRLCK185の活性化を抑制することによりイネのパターン誘導性免疫を阻害すると考えられた.
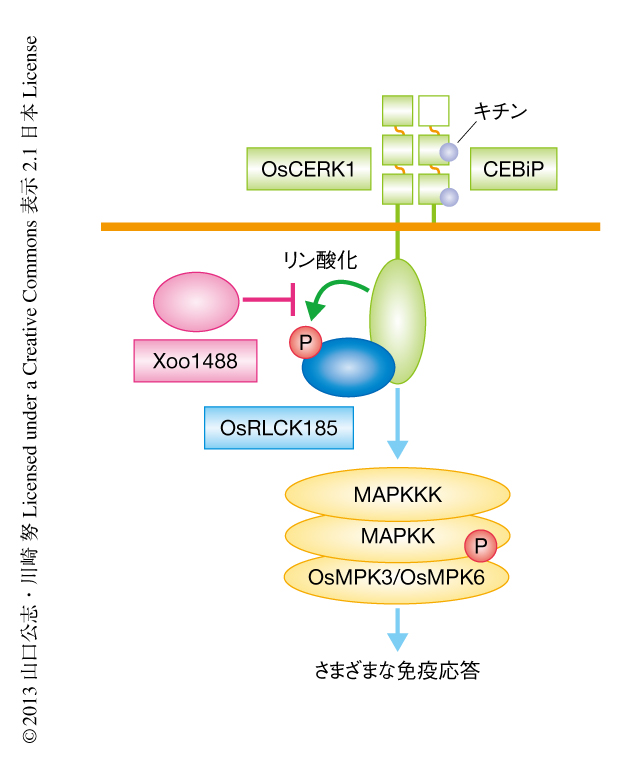
この研究において,筆者らは,病原微生物を認識する受容体が感染シグナルを細胞内に伝達し免疫反応を誘導する分子機構を明らかにした(図2).リガンドに依存して活性化したOsCERK1は,その複合体に含まれているOsRLCK185を直接にリン酸化しこれを活性化すること,OsRLCK185はMAPキナーゼの上流に位置しMAPキナーゼカスケードを正に制御することが示唆された.一方で,イネ白葉枯病菌のもつエフェクタータンパク質であるXoo1488は,OsCERK1によるOsRLCK185の活性化を直接に阻害することによりイネのパターン誘導性免疫を阻害し,感染の成立に有利な環境をつくりだしていることが明らかになった.
免疫反応だけでなく形態形成などさまざまな植物の生体反応において,リガンドを認識した受容体の下流においてMAPキナーゼの活性化が誘導されることが知られている.しかしこれまで,受容体とMAPキナーゼとをつなぐタンパク質は報告されていなかった.この研究により,OsRLCK185は受容体とMAPキナーゼとをつなぐタンパク質である可能性の高いことが明らかになった.今後,OsRLCK185による詳細な制御機構の解析,また,下流タンパク質の探索を進めることにより,このシグナル伝達系の謎をひも解けるのではないかと期待している.
略歴:2007年 東北大学大学院生命科学研究科博士課程 修了,同年 奈良先端科学技術大学院大学 博士研究員を経て,2010年より近畿大学農学部 博士研究員.
研究テーマ:植物の免疫シグナルネットワーク.
抱負:今回の発見を糧にし,新しい研究の花を咲かせたい.
川崎 努(Tsutomu Kawasaki)
近畿大学農学部 教授.
研究室URL:http://kawasakirice.web.fc2.com/index.html
© 2013 山口公志・川崎 努 Licensed under CC 表示 2.1 日本
(近畿大学農学部 バイオサイエンス学科植物分子遺伝学研究室)
email:山口公志,川崎 努
DOI: 10.7875/first.author.2013.035
A receptor-like cytoplasmic kinase targeted by a plant pathogen effector is directly phosphorylated by the chitin receptor and mediates rice immunity.
Koji Yamaguchi, Kenta Yamada, Kazuya Ishikawa, Satomi Yoshimura, Nagao Hayashi, Kouhei Uchihashi, Nobuaki Ishihama, Mitsuko Kishi-Kaboshi, Akira Takahashi, Seiji Tsuge, Hirokazu Ochiai, Yasuomi Tada, Ko Shimamoto, Hirofumi Yoshioka, Tsutomu Kawasaki
Cell Host & Microbe, 13, 347-357 (2013)
要 約
植物は病原微生物の感染にともないその構成成分を細胞膜にある受容体を介して感知しその侵入を認識する.そのシグナルはMAPキナーゼカスケードを活性化し,結果として,細胞壁の強化や抗菌性物質の産生などさまざまなタイプの免疫機構が発動される.しかし,受容体からのシグナルがどのようにしてMAPキナーゼカスケードへと伝達されるのかはまったく不明であった.今回,筆者らは,イネ白葉枯病菌のもつイネの免疫経路を阻害するエフェクタータンパク質Xoo1488の解析から,その標的タンパク質OsRLCK185を同定した.OsRLCK185は病原微生物の構成成分であるキチンを認識する受容体OsCERK1と相互作用し,キチンを認識したOsCERK1は直接にOsRLCK185をリン酸化することが明らかになった.さらに,OsRLCK185発現抑制イネではキチンにより誘導されるMAPキナーゼの活性化の顕著な低下が検出された.このことから,OsRLCK185は受容体とMAPキナーゼとのあいだをつなぐ重要なタンパク質であることが示唆された.また,Xoo1488はOsCERK1によるOsRLCK185のリン酸化を阻害することによりイネの免疫応答を阻害していることも明らかとなった.
はじめに
植物は病原微生物を構成する多様な分子(pathogen-associated molecular pattern:PAMP,病原細菌関連分子パターン)を認識し防御応答を誘導する能力をもつ1,2)(図1).真菌の細胞壁の構成多糖でありこの病原細菌関連分子パターンのひとつであるキチンは,細胞外にキチン結合ドメインをもつ受容体CEBiPにより認識される.CEBiPはリガンドに依存的に共役受容体であるOsCERK1と複合体を形成し,細胞内にキナーゼドメインをもつOsCERK1が細胞内へシグナルを伝達する3).その下流では,MAPキナーゼカスケードの活性化や活性酸素の産生などが誘導され,最終的に,パターン誘導性免疫(pattern-triggered immunity:PTI)とよばれる防御関連遺伝子の発現や抗菌性物質の合成などをともなう多様な防御応答反応が誘導される4).さらに,OsCERK1は細菌の細胞壁の構成成分であるペプチドグリカンと結合するOsLYP4およびOsLYP6と協調してペプチドグリカンの受容およびシグナル伝達にかかわっていることも示唆されている5).一方,病原微生物は進化の過程において植物のパターン誘導性免疫を打破するため,これを抑制することのできるエフェクタータンパク質と,このエフェクタータンパク質を植物の細胞へと注入するための装置であるIII型分泌装置を獲得している(図1).これらを獲得した病原微生物は効果的にパターン誘導性免疫を抑制することにより宿主への感染を可能にしたと考えられる.そのため,植物への病害が確認されている病原微生物は効果的なエフェクタータンパク質をもつ可能性が高い.このようなことから,エフェクタータンパク質はパターン誘導性免疫におけるシグナル伝達において重要なはたらきをする宿主のタンパク質を阻害することにより,植物の免疫機構を効率的に阻害していると考えられる.そこで,筆者らは,イネの重要な病害である白葉枯病をひき起こすイネ白葉枯病菌のもつエフェクタータンパク質Xoo1488を利用し,植物免疫の阻害機構を理解するとともに,イネにおける新規の免疫タンパク質の同定をめざした6).
1.Xoo1488はイネの免疫経路を阻害する
イネ白葉枯病菌のもつエフェクタータンパク質のひとつであるXoo1488は,282アミノ酸残基からなる機能未知のタンパク質である.Xoo1488には既知のタンパク質との相同性はなく,一部のXanthomonas属において相同性を示すタンパク質が検出されている.Xoo1488がイネの免疫を抑制するかどうかを検討するためXoo1488を発現した形質転換イネを作製し,イネ白葉枯病菌に対する抵抗性を検定した.その結果,通常のイネと比較して,Xoo1488発現イネでは抵抗性の低下が確認された.このことから,Xoo1488はイネの免疫経路を抑制していることが示唆された.
さらに,Xoo1488のパターン誘導性免疫に対する抑制効果を確認するため,Xoo1488発現イネ培養細胞を用い,ペプチドグリカンおよびキチンにより誘導される防御遺伝子の発現を解析した.その結果,ペプチドグリカンあるいはキチンにより誘導される防御応答遺伝子の発現はXoo1488発現イネ培養細胞において顕著に低下していた.このことは,Xoo1488がキチンやペプチドグリカンにより誘導されるパターン誘導性免疫の誘導を阻害していることを示唆した.
2.宿主におけるXoo1488の標的タンパク質OsRLCK185はイネの免疫経路を正に制御する
酵母ツーハイブリッド法を利用してXoo1488が標的とするイネのタンパク質を網羅的に探索した.その結果,膜貫通ドメインをもたないプロテインキナーゼであるイネの受容体様細胞質キナーゼファミリー(RLCKファミリー)に属するタンパク質OsRLCK185を同定した.OsRLCK185は耐病性などのシグナル伝達経路に関与するRLCKファミリーのメンバーが含まれるRLCK VIIサブファミリーに属していた7).そこで,イネのパターン誘導性免疫におけるシグナル伝達経路にこのOsRLCK185が関与しているかどうかを検討した.OsRLCK185発現抑制イネ培養細胞を用い,キチンあるいはペプチドグリカンを処理した際に誘導される遺伝子の発現解析を行った.その結果,OsRLCK185発現抑制イネ培養細胞における遺伝子発現の誘導は野生株より顕著に低下していた.さらに,キチンを処理したときの活性酸素種の産生に関しても,OsRLCK185発現抑制イネ培養細胞では低下していることがわかった.以上の結果から,OsRLCK185はイネのパターン誘導性免疫におけるシグナル伝達経路を正に制御するタンパク質であることが示唆された.
3.OsRLCK185はキチン受容体OsCERK1により直接にリン酸化される
OsRLCK185は細胞膜に局在しキチンなどにより誘導されるパターン誘導性免疫におけるシグナル伝達経路に関与していることから,病原細菌関連分子パターンを認識する受容体であるOsCERK1との関係性に着目した.免疫沈降法や2分子蛍光相補(bimolecular fluorescence complementation:BiFC法)などを用いた相互作用解析の結果,OsRLCK185は細胞膜においてOsCERK1と相互作用していることが明らかになった.一般的に,RLCKはリン酸化による活性制御をうけるため,OsRLCK185がキチンに応答してリン酸化修飾されるかどうかを検討した.その結果,イネ培養細胞においてキチン処理後5分をピークとしたOsRLCK185のリン酸化が検出された.OsCERK1は細胞内にキナーゼドメインをもつことから,OsCERK1はOsRLCK185を直接にリン酸化するかどうかを検証した.その結果,in vitroにおいてOsCERK1はOsRLCK185を直接にリン酸化することが明らかになった.
4.OsRLCK185はキチンにより活性化されるMAPキナーゼカスケードを正に制御する
これまでイネにおいて,キチンによりMAPキナーゼであるOsMPK3,OsMPK4,OsMPK6の活性化が生じること,また,そのシグナル経路はOsMPK3およびOsMPK6のかかわる経路と,OsMPK4のかかわる経路の2つに大別されることが報告されている8).キチンに応答したOsRLCK185のリン酸化とMAPキナーゼの活性化を比較したところ,OsRLCK185のリン酸化はMAPキナーゼの活性化に先行して生じることが明らかになった.
OsRLCK185発現抑制イネ培養細胞を用いて,キチンにより誘導されるMAPキナーゼの活性化を経時的に解析した.通常,OsMPK3およびOsMPK6はキチン処理後5~15分で活性化するのに対し,OsRLCK185発現抑制イネ培養細胞ではこれらのMAPキナーゼの活性化が顕著に抑制されていた.一方で,OsRLCK185発現抑制イネ培養細胞におけるOsMPK4の活性化は野生株と同様であった.さらに,Xoo1488発現イネ培養細胞を用いて同様の解析を行った結果,さきの結果と同様に,OsMPK3およびOsMPK6の活性化のみが抑制されていることが明らかになった.以上の結果から,OsRLCK185はOsMPK3およびOsMPK6の上流に位置することが示唆された.
5.Xoo1488はOsCERK1によるOsRLCK185のリン酸化を阻害する
Xoo1488によるOsRLCK185を介したパターン誘導性免疫におけるシグナル阻害の機構を明らかにするため,Xoo1488発現イネ培養細胞においてキチンに応答したOsRLCK185のリン酸化のレベルを解析したところ顕著に抑制されていた.つぎに,Xoo1488がOsCERK1からのOsRLCK185へのリン酸化に影響をあたえているかどうかを検討した.in vitroの実験系において解析したところ,Xoo1488の存在下ではOsCERK1によるOsRLCK185へのリン酸化は阻害された.このことから,Xoo1488はOsCERK1からのOsRLCK185へのリン酸化を阻害し,OsRLCK185の活性化を抑制することによりイネのパターン誘導性免疫を阻害すると考えられた.
おわりに
この研究において,筆者らは,病原微生物を認識する受容体が感染シグナルを細胞内に伝達し免疫反応を誘導する分子機構を明らかにした(図2).リガンドに依存して活性化したOsCERK1は,その複合体に含まれているOsRLCK185を直接にリン酸化しこれを活性化すること,OsRLCK185はMAPキナーゼの上流に位置しMAPキナーゼカスケードを正に制御することが示唆された.一方で,イネ白葉枯病菌のもつエフェクタータンパク質であるXoo1488は,OsCERK1によるOsRLCK185の活性化を直接に阻害することによりイネのパターン誘導性免疫を阻害し,感染の成立に有利な環境をつくりだしていることが明らかになった.
免疫反応だけでなく形態形成などさまざまな植物の生体反応において,リガンドを認識した受容体の下流においてMAPキナーゼの活性化が誘導されることが知られている.しかしこれまで,受容体とMAPキナーゼとをつなぐタンパク質は報告されていなかった.この研究により,OsRLCK185は受容体とMAPキナーゼとをつなぐタンパク質である可能性の高いことが明らかになった.今後,OsRLCK185による詳細な制御機構の解析,また,下流タンパク質の探索を進めることにより,このシグナル伝達系の謎をひも解けるのではないかと期待している.
文 献
- Jones, J. D. & Dangl, J. L.: The plant immune system. Nature, 444, 323-329 (2006)[PubMed]
- Segonzac, C. & Zipfel, C.: Activation of plant pattern-recognition receptors by bacteria. Curr. Opin. Microbiol., 14, 54-61 (2011)[PubMed]
- Shimizu, T., Nakano, T., Takamizawa, D. et al.: Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice. Plant J., 64, 204-214 (2010)[PubMed]
- Tena, G., Boudsocq, M. & Sheen, J.: Protein kinase signaling networks in plant innate immunity. Curr. Opin. Plant Biol., 14, 519-529 (2011)[PubMed]
- Liu, B., Li, J.F., Ao, Y. et al.: Lysin motif-containing proteins LYP4 and LYP6 play dual roles in peptidoglycan and chitin perception in rice innate immunity. Plant Cell, 24, 3406-3419 (2012)[PubMed]
- Furutani, A., Takaoka, M., Sanada, H. et al.: Identification of novel type III secretion effectors in Xanthomonas oryzae pv. oryzae. Mol. Plant Microbe Interact., 22, 96-106 (2009)[PubMed]
- Shiu, S. H., Karlowski, W. M., Pan, R. et al.: Comparative analysis of the receptor-like kinase family in Arabidopsis and rice. Plant Cell, 16, 1220-1234 (2004)[PubMed]
- Kishi-Kaboshi, M., Okada, K., Kurimoto, L. et al.: A rice fungal MAMP-responsive MAPK cascade regulates metabolic flow to antimicrobial metabolite synthesis. Plant J., 63, 599-612 (2010)[PubMed]
著者プロフィール
略歴:2007年 東北大学大学院生命科学研究科博士課程 修了,同年 奈良先端科学技術大学院大学 博士研究員を経て,2010年より近畿大学農学部 博士研究員.
研究テーマ:植物の免疫シグナルネットワーク.
抱負:今回の発見を糧にし,新しい研究の花を咲かせたい.
川崎 努(Tsutomu Kawasaki)
近畿大学農学部 教授.
研究室URL:http://kawasakirice.web.fc2.com/index.html
© 2013 山口公志・川崎 努 Licensed under CC 表示 2.1 日本