オートファゴソームは小胞体とミトコンドリアとの接触部位において形成される
濱﨑万穂・吉森 保
(大阪大学大学院医学系研究科 遺伝学教室)
email:吉森 保
DOI: 10.7875/first.author.2013.036
Autophagosomes form at ER-mitochondria contact sites.
Maho Hamasaki, Nobumichi Furuta, Atsushi Matsuda, Akiko Nezu, Akitsugu Yamamoto, Naonobu Fujita, Hiroko Oomori, Takeshi Noda, Tokuko Haraguchi, Yasushi Hiraoka, Atsuo Amano, Tamotsu Yoshimori
Nature, 495, 389-393 (2013)
オートファジーは厳密に制御された細胞内のバルク分解および再利用の系であり,細胞の恒常性維持において重要な役割を担っている.オートファジーは隔離膜の形成によりはじまり,これが細胞質やオルガネラの一部を包み込みながら伸長する.最後に隔離膜が閉じて二重膜にかこまれたオートファゴソームが形成され,そこにリソソームが融合すると包み込まれた内容物が分解される.オートファジーが発見されてから半世紀をへて,その生理的な役割の解明は大きく進んだが,オートファゴソーム膜の起源は不明のまま残されていた.最近では,オートファゴソーム膜がどこから生じるかについて,小胞体,ミトコンドリア,細胞膜など,諸説が並立し混沌とした状況にあった.今回,筆者らは,哺乳類細胞のオートファゴソームは小胞体とミトコンドリアとの接触部位において形成されることを明らかにした.オートファジーを誘導するとオートファゴソームの形成初期にはたらくAtg14が小胞体とミトコンドリアとの接触部位にドット状に集合した.隔離膜のマーカーであるAtg5を用いて動画を撮影することにより,その接触部位において実際にオートファゴソームの形成されるようすが明らかになった.飢餓条件において細胞を分画すると,Atg14はミトコンドリアに結合した小胞体膜と同一の画分にくることがわかった.小胞体とミトコンドリアとの接触部位を破壊するとAtg14のドット状の集合が阻害された.小胞体に存在するSNAREタンパク質stx17はAtg14と結合し,小胞体とミトコンドリアとの接触部位へと移動した.これらの結果は,オートファゴソームの形成において小胞体とミトコンドリアとの接触部位が重要であることを示しており,オルガネラの創生について新たな洞察が得られた.
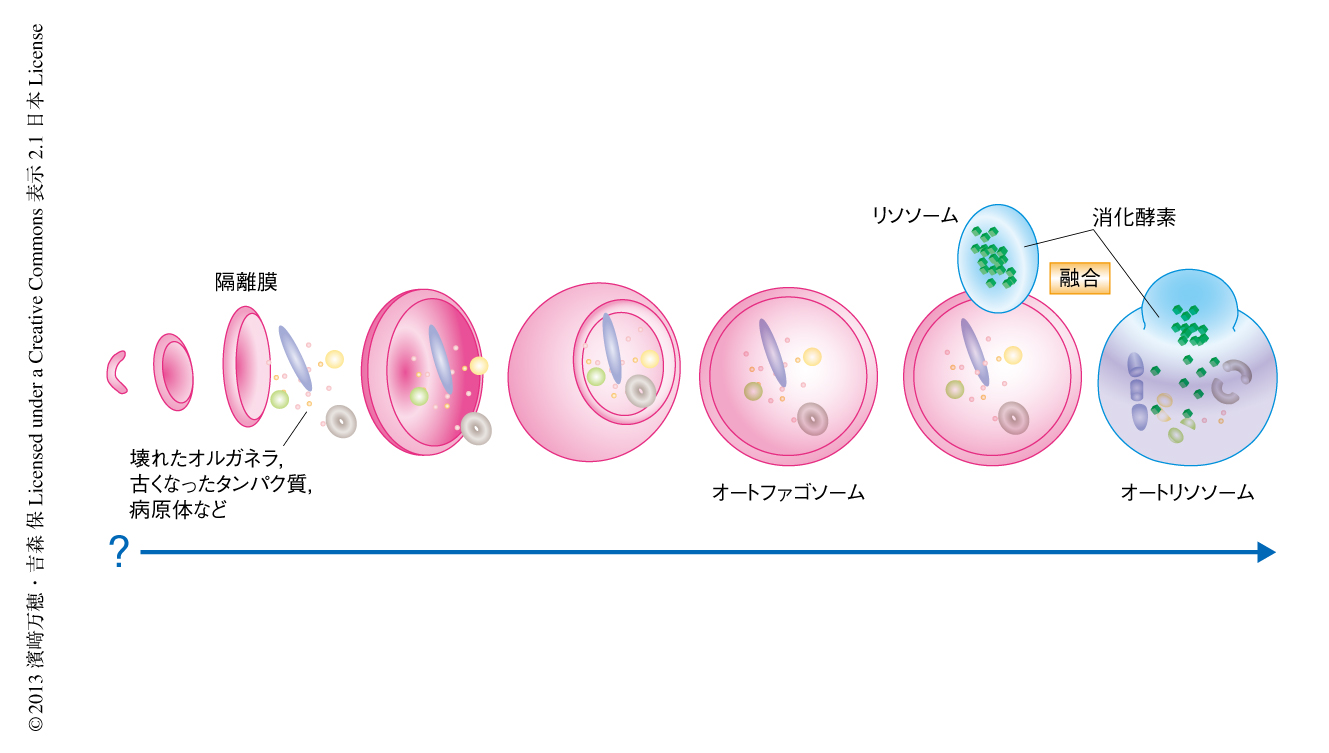
細胞は栄養飢餓におちいるとオートファジーにより細胞質やオルガネラの一部を分解および再利用し細胞の生存に必要なエネルギーやタンパク質を得る.さらには,オートファジーを使い老廃物や損傷したミトコンドリア,病原体,易凝集性タンパク質を除去しており,それにより神経変性疾患,がん,糖尿病,心不全,各種の炎症や感染症など,さまざまな疾患の発症を抑制していることが判明し大きな注目をあつめている.このように,機能的な意義の解明が進む一方,オートファジーのしくみについては不明な点が多い.オートファジーは膜動態をともなう複雑な過程である.まず,細胞質に忽然と扁平な膜小胞が現われ,それが伸張し(隔離膜とよぶ),直径約1μmの空間にあるものを包み込む(図1).5~10分で隔離膜の末端どうしが融合して閉鎖し,二重の膜をもつオートファゴソームとなる.そこにリソソームが融合してオートリソソームとなり,内膜と内容物が消化される.そののち,オートリソソームは消滅する.したがって,オートファゴソームは一過性に現われ消えるオルガネラであり,つねに存在するゴルジ体やミトコンドリアなどほかのオルガネラとは対照的である.では,いったい隔離膜はどこから生じるのか.この分野最大の謎は長年にわたり論争の的になってきた1).
筆者らは,この謎に対し小胞体がオートファゴソーム形成のプラットフォームであることを提唱してきた.筆者らが同定したAtg14(Atg14Lとも呼ばれる)は,オートファゴソーム膜の成分であるホスファチジルイノシトールトリスリン酸を生成するIII型ホスファチジルイノシトール3-キナーゼと複合体をつくりオートファゴソームの形成にはたらく2).Atg14は細胞質の可溶性タンパク質であるが小胞体膜にも結合しており,それがオートファゴソームの形成に必要であった3).Atg14は普段は小胞体膜に一様に分布しているが,飢餓などによりオートファジーが誘導されると小胞体においてドット状に集合し,そこでオートファゴソームが形成される.さらには,電子線トモグラフィーによる解析から小胞体膜の一部が隔離膜に寄り添うように密着していることや,小胞体膜と隔離膜とが細いチューブ状の膜によりつながっていることなどが明らかになった4).これらの結果は,オートファゴソームが生じる場として小胞体が機能していることを強く示唆する.ほかの複数のグループからこの小胞体起源説を支持する結果が報告される一方,米国のグループがオートファゴソームはミトコンドリア外膜から直接に生じるというミトコンドリア起源説を発表し5),この2つの説は真っ向から対立することになった.
小胞体とミトコンドリアのおのおのでオートファゴソームができるのであろうと述べる研究者もいるが,同じ機構がまったく異なる膜においてはたらくとは筆者らには俄には信じがたい.そこで,以前から知られている小胞体とミトコンドリアとの接触部位に着目した.もし,この接触部位でオートファゴソームが形成されるなら小胞体起源説とミトコンドリア起源説の両方を説明しうると考えたのである.小胞体とミトコンドリアが接触するのはごく限られた領域だが,そのような接触部位(接触点)は多数存在する.近年,小胞体とミトコンドリアとの接触部位には脂質の受け渡しなど生理機能のあることが明らかになりつつある.蛍光顕微鏡を用いて小胞体,ミトコンドリア,Atg14の三者の関係を観察したところ,小胞体とミトコンドリアの接触点に飢餓に依存的なAtg14のドット状の集合が多くみられた.このことは免疫電子顕微鏡法によっても確認され,飢餓条件においては小胞体とミトコンドリアとが隣接する隙間にAtg14がしばしば高密度に存在していた.
筆者らの予想は,俄然,現実味を帯びてきた.小胞体とミトコンドリアとの接触部位はスクロース密度勾配遠心法を用いた細胞分画によりミトコンドリア結合小胞体膜画分として抽出できるといわれている6).抽出したミトコンドリア結合小胞体膜画分をウェスタンブロット解析することにより,富栄養条件においてはおもにミクロソーム(= 小胞体)画分に回収されミトコンドリア結合小胞体膜画分には含まれないAtg14が,飢餓によりミトコンドリア結合小胞体膜画分に現われることが確認できた.英国のグループがみつけオメガソームと命名したオートファゴソーム形成の場となる小胞体の部位のマーカータンパク質DFCP1 7) も同様であった.なお,DFCP1は光学顕微鏡を用いても飢餓条件において小胞体とミトコンドリアとの接触部位に集まったAtg14と共局在することが観察される.
以上の結果は,オートファゴソームが小胞体とミトコンドリアとの接触部位において形成されることを示唆した.その直接の証拠を得るため,3つのオルガネラの同時動画撮影に挑んだ.細胞内のオルガネラについて3色の蛍光をシャッターを切り替えず同時にリアルタイムで観察した例はこれまで世界的にもなく,まず,スピニングホイル式共焦点レーザー顕微鏡に3つのCCDカメラを接続し同時撮影できるようにするという困難な作業からはじめ,奮闘の末,種々の問題を乗り越えてついに決定的瞬間をとらえることに成功した.オートファゴソームの形成はYFP-Atg5融合タンパク質により追跡した.Atg5は隔離膜に結合するタンパク質だが,隔離膜の末端が閉鎖してオートファゴソームが完成するとオートファゴソーム膜から離脱するので,形成の途中のオートファゴソームだけを観察できるという利点がある8).取得した動画には,小胞体とミトコンドリアがダイナミックに動きつつも接しつづけている箇所において,Atg5のドットが現われ大きくなり最後に消える,というオートファゴソーム形成の過程がみごとに映っていた.
網目状の複雑な構造をもち,かつ,激しく動く2つのオルガネラと,ドット状にしかみえないオートファゴソームが重なり合う映像を鮮明に得るにはデジタル画像処理が必要であった.その結果,映像の取得に成功しただけでなく,さまざまな定量解析も可能になった.ドット状のAtg5から小胞体およびミトコンドリアへの距離を調べると,Atg5のドットの98%が小胞体にあり,かつ,79%がミトコンドリアから0.88μmの範囲にあった.つまり,ほとんどのドットが小胞体とミトコンドリアとの接触部位に局在しているものと思われた.時間変化でみると,小胞体への距離(ほぼゼロ)は変化しない一方,ミトコンドリアへの距離は0~0.88μmの範囲で近づいたり遠ざかったりをくり返していることがわかった.理由は不明だが,小胞体とミトコンドリアとの接触にはサイクルが存在し,その場所では密着と少し離れることが交互に起こっているようだった.オートファゴソームは小胞体とミトコンドリアとの接触部位の小胞体側において形成されているように思われた.
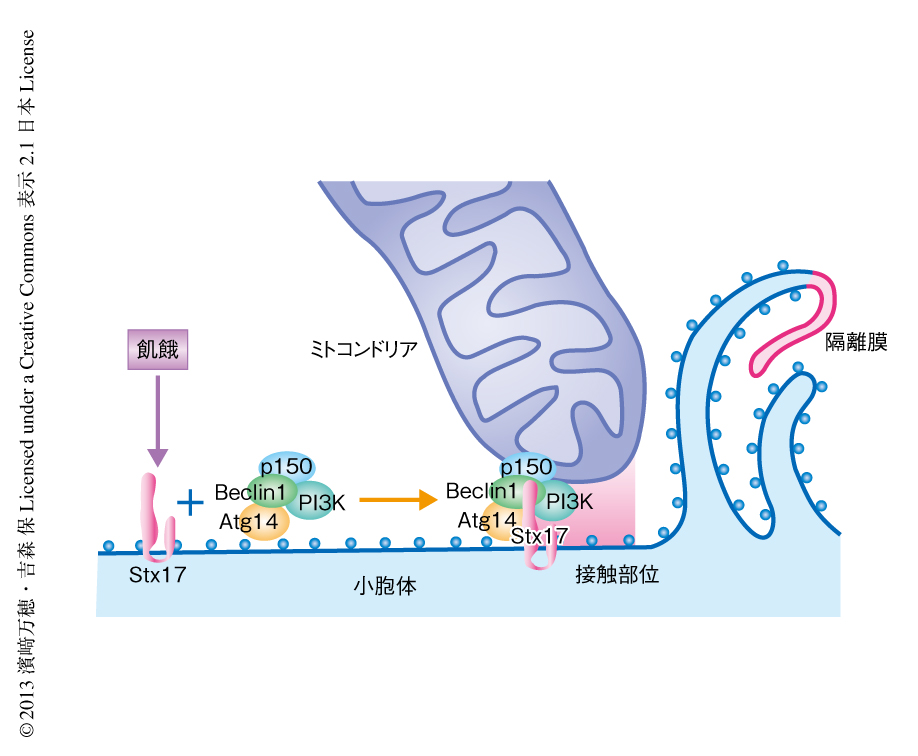
PACS-2とMFN2は小胞体とミトコンドリアとの接触部位の形成に必要なタンパク質であるといわれている9,10).PACS-2とMFN2をそれぞれノックダウンすると,飢餓条件におけるオートファゴソームの形成が抑制され,そのとき,Atg14のドット状の集合もみられなくなった.また,Atg14とDFCP1のミトコンドリア結合小胞体膜画分への移動も起こらなかった.この結果は,オートファゴソームの形成には小胞体とミトコンドリアとの接触部位が必要であるという考えを支持したが,接触部位の形成抑制による2次的な影響の可能性も残った.小胞体とミトコンドリアとの接触部位にAtg14が集まることが本当に重要なのかという問いと,どうやって集まるのかという疑問の両方への答えは,別の実験から得られた.小胞体に局在するSNAREタンパク質のなかにオートファジーにかかわるものがないかスクリーニングを行った.SNAREは膜融合を起こす膜タンパク質ファミリーなので,膜融合が複数のステップにおいて必要なオートファジーにおいてもはたらいている可能性が高い.その結果,小胞体に局在する複数のSNAREタンパク質のなかで機能未知のSyntaxin17(stx17)が11),オートファジーに必要であることが判明した.しかも,stx17も飢餓に依存的に小胞体とミトコンドリアとの接触部位にドット状に集合し,ミトコンドリア結合小胞体膜画分における含有量が増加した.stx17をノックダウンすると,Atg14はミトコンドリア結合小胞体膜画分に移行しなくなり,小胞体とミトコンドリアとの接触部位への集合も消失した.一方,Atg14のノックダウンあるいはノックアウトは,stx17のミトコンドリア結合小胞体膜画分への移行および小胞体とミトコンドリアとの接触部位への集合には影響しなかった.さらには,stx17とホスファチジルイノシトール3-キナーゼを含むAtg14複合体が飢餓に依存的に結合することが共沈降実験により示された.これらの結果から,stx17はAtg14の上流に位置し,飢餓などのオートファジー誘導シグナルが入力されるとAtg14-ホスファチジルイノシトール3-キナーゼ複合体と結合してともに小胞体とミトコンドリアとの接触部位へと移動し,そこでホスファチジルイノシトールトリスリン酸の局所濃度が上昇しオートファゴソームが形成される,というシナリオが考えられた(図2).
この研究により,オートファゴソームの小胞体起源説とミトコンドリア起源説のどちらもまちがいではなかったことが立証された.この両者は,同じ現象を違う側からみていたにすぎなかった.今回の成果は,小胞体とミトコンドリアとの接触部位の新たな機能を明らかにしただけではない.小胞体とミトコンドリアという出自のまったく異なる独立した2つのオルガネラが協働して第3のオルガネラを産むなどという予想外の過程の存在は,従来のオルガネラ像を塗り替え,細胞生物学にパラダイムシフトをもたらすものである.各種のオルガネラは,これまで考えられてきたよりダイナミックな相互作用をもちネットワークをかたちづくっているのかもしれない.
なぜオートファゴソームは小胞体とミトコンドリアとの接触部位でつくられるのだろうか? 興味深いことに,stx17のノックダウン細胞ではAtg14は小胞体とミトコンドリアとの接触部位に集合できないものの,小胞体の別の場所に集合しそこで隔離膜の形成が起こった.しかし,その隔離膜は閉じることができずオートファゴソームは完成しなかった.このことは,小胞体とミトコンドリアとの接触部位において隔離膜の閉鎖に必要な何かが供給されている可能性を示している.たとえば,ホスファチジルエタノールアミンは隔離膜の閉鎖に機能するタンパク質LC3と共有結合し12,13),これを隔離膜に局在化させる脂質だが,小胞体とミトコンドリアとの接触部位をとおしてミトコンドリアから小胞体へと移動すると考えられている.小胞体とミトコンドリアとの接触部位において隔離膜が形成されないと,ホスファチジルエタノールアミンの量が不十分で隔離膜の閉鎖に必要なLC3の分子数は確保できないのかもしれない.そのほかにも,stx17のSNAREとしての機能はどうかかわっているのかなど,今後,明らかにすべき課題は多い.なお,小胞体起源説,ミトコンドリア起源説のほか,オートファゴソームの細胞膜起源説をとなえる別のグループもいる.筆者らは,そのグループが隔離膜の前駆体と考える細胞膜に由来する小胞が,小胞体とミトコンドリアとの接触部位において成長しつつある隔離膜に融合し膜を供給しているのではないかと推測している.ともあれ,オートファジーにおける膜創生の問題はさらなる探求が必要である.
大阪大学大学院医学系研究科 助教.
吉森 保(Tamotsu Yoshimori)
略歴:大阪生まれだが東京都立竹早高校卒で,東京弁と大阪弁のバイリンガル.大阪大学大学院医学研究科博士課程 中退,関西医科大学 助手,ドイツEuropean Molecular Biology Laboratory研究員,基礎生物学研究所 助教授,国立遺伝学研究所 教授,大阪大学微生物病研究所 教授を経て,大阪大学大学院医学系研究科ならびに同 生命機能研究科 教授.るろーに人生.別名Prof A. Hill.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/yoshimori/
© 2013 濱﨑万穂・吉森 保 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 遺伝学教室)
email:吉森 保
DOI: 10.7875/first.author.2013.036
Autophagosomes form at ER-mitochondria contact sites.
Maho Hamasaki, Nobumichi Furuta, Atsushi Matsuda, Akiko Nezu, Akitsugu Yamamoto, Naonobu Fujita, Hiroko Oomori, Takeshi Noda, Tokuko Haraguchi, Yasushi Hiraoka, Atsuo Amano, Tamotsu Yoshimori
Nature, 495, 389-393 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
Atg14(Q6ZNE5), Atg5(Q9H1Y0), SNAREタンパク質stx17(P56962), Atg14L(Q6ZNE5), III型ホスファチジルイノシトール3-キナーゼ, DFCP1(Q9HBF4), PACS-2(Q86VP3), MFN2(O95140), SNARE, Syntaxin17(P56962), stx17(P56962), ホスファチジルイノシトール3-キナーゼ, LC3, PI3K
要 約
オートファジーは厳密に制御された細胞内のバルク分解および再利用の系であり,細胞の恒常性維持において重要な役割を担っている.オートファジーは隔離膜の形成によりはじまり,これが細胞質やオルガネラの一部を包み込みながら伸長する.最後に隔離膜が閉じて二重膜にかこまれたオートファゴソームが形成され,そこにリソソームが融合すると包み込まれた内容物が分解される.オートファジーが発見されてから半世紀をへて,その生理的な役割の解明は大きく進んだが,オートファゴソーム膜の起源は不明のまま残されていた.最近では,オートファゴソーム膜がどこから生じるかについて,小胞体,ミトコンドリア,細胞膜など,諸説が並立し混沌とした状況にあった.今回,筆者らは,哺乳類細胞のオートファゴソームは小胞体とミトコンドリアとの接触部位において形成されることを明らかにした.オートファジーを誘導するとオートファゴソームの形成初期にはたらくAtg14が小胞体とミトコンドリアとの接触部位にドット状に集合した.隔離膜のマーカーであるAtg5を用いて動画を撮影することにより,その接触部位において実際にオートファゴソームの形成されるようすが明らかになった.飢餓条件において細胞を分画すると,Atg14はミトコンドリアに結合した小胞体膜と同一の画分にくることがわかった.小胞体とミトコンドリアとの接触部位を破壊するとAtg14のドット状の集合が阻害された.小胞体に存在するSNAREタンパク質stx17はAtg14と結合し,小胞体とミトコンドリアとの接触部位へと移動した.これらの結果は,オートファゴソームの形成において小胞体とミトコンドリアとの接触部位が重要であることを示しており,オルガネラの創生について新たな洞察が得られた.
はじめに
細胞は栄養飢餓におちいるとオートファジーにより細胞質やオルガネラの一部を分解および再利用し細胞の生存に必要なエネルギーやタンパク質を得る.さらには,オートファジーを使い老廃物や損傷したミトコンドリア,病原体,易凝集性タンパク質を除去しており,それにより神経変性疾患,がん,糖尿病,心不全,各種の炎症や感染症など,さまざまな疾患の発症を抑制していることが判明し大きな注目をあつめている.このように,機能的な意義の解明が進む一方,オートファジーのしくみについては不明な点が多い.オートファジーは膜動態をともなう複雑な過程である.まず,細胞質に忽然と扁平な膜小胞が現われ,それが伸張し(隔離膜とよぶ),直径約1μmの空間にあるものを包み込む(図1).5~10分で隔離膜の末端どうしが融合して閉鎖し,二重の膜をもつオートファゴソームとなる.そこにリソソームが融合してオートリソソームとなり,内膜と内容物が消化される.そののち,オートリソソームは消滅する.したがって,オートファゴソームは一過性に現われ消えるオルガネラであり,つねに存在するゴルジ体やミトコンドリアなどほかのオルガネラとは対照的である.では,いったい隔離膜はどこから生じるのか.この分野最大の謎は長年にわたり論争の的になってきた1).
筆者らは,この謎に対し小胞体がオートファゴソーム形成のプラットフォームであることを提唱してきた.筆者らが同定したAtg14(Atg14Lとも呼ばれる)は,オートファゴソーム膜の成分であるホスファチジルイノシトールトリスリン酸を生成するIII型ホスファチジルイノシトール3-キナーゼと複合体をつくりオートファゴソームの形成にはたらく2).Atg14は細胞質の可溶性タンパク質であるが小胞体膜にも結合しており,それがオートファゴソームの形成に必要であった3).Atg14は普段は小胞体膜に一様に分布しているが,飢餓などによりオートファジーが誘導されると小胞体においてドット状に集合し,そこでオートファゴソームが形成される.さらには,電子線トモグラフィーによる解析から小胞体膜の一部が隔離膜に寄り添うように密着していることや,小胞体膜と隔離膜とが細いチューブ状の膜によりつながっていることなどが明らかになった4).これらの結果は,オートファゴソームが生じる場として小胞体が機能していることを強く示唆する.ほかの複数のグループからこの小胞体起源説を支持する結果が報告される一方,米国のグループがオートファゴソームはミトコンドリア外膜から直接に生じるというミトコンドリア起源説を発表し5),この2つの説は真っ向から対立することになった.
1.小胞体とミトコンドリアとの接触部位にオートファゴソームの形成に必要なタンパク質が集合する
小胞体とミトコンドリアのおのおのでオートファゴソームができるのであろうと述べる研究者もいるが,同じ機構がまったく異なる膜においてはたらくとは筆者らには俄には信じがたい.そこで,以前から知られている小胞体とミトコンドリアとの接触部位に着目した.もし,この接触部位でオートファゴソームが形成されるなら小胞体起源説とミトコンドリア起源説の両方を説明しうると考えたのである.小胞体とミトコンドリアが接触するのはごく限られた領域だが,そのような接触部位(接触点)は多数存在する.近年,小胞体とミトコンドリアとの接触部位には脂質の受け渡しなど生理機能のあることが明らかになりつつある.蛍光顕微鏡を用いて小胞体,ミトコンドリア,Atg14の三者の関係を観察したところ,小胞体とミトコンドリアの接触点に飢餓に依存的なAtg14のドット状の集合が多くみられた.このことは免疫電子顕微鏡法によっても確認され,飢餓条件においては小胞体とミトコンドリアとが隣接する隙間にAtg14がしばしば高密度に存在していた.
筆者らの予想は,俄然,現実味を帯びてきた.小胞体とミトコンドリアとの接触部位はスクロース密度勾配遠心法を用いた細胞分画によりミトコンドリア結合小胞体膜画分として抽出できるといわれている6).抽出したミトコンドリア結合小胞体膜画分をウェスタンブロット解析することにより,富栄養条件においてはおもにミクロソーム(= 小胞体)画分に回収されミトコンドリア結合小胞体膜画分には含まれないAtg14が,飢餓によりミトコンドリア結合小胞体膜画分に現われることが確認できた.英国のグループがみつけオメガソームと命名したオートファゴソーム形成の場となる小胞体の部位のマーカータンパク質DFCP1 7) も同様であった.なお,DFCP1は光学顕微鏡を用いても飢餓条件において小胞体とミトコンドリアとの接触部位に集まったAtg14と共局在することが観察される.
2.オートファゴソームは小胞体とミトコンドリアとの接触部位において形成される
以上の結果は,オートファゴソームが小胞体とミトコンドリアとの接触部位において形成されることを示唆した.その直接の証拠を得るため,3つのオルガネラの同時動画撮影に挑んだ.細胞内のオルガネラについて3色の蛍光をシャッターを切り替えず同時にリアルタイムで観察した例はこれまで世界的にもなく,まず,スピニングホイル式共焦点レーザー顕微鏡に3つのCCDカメラを接続し同時撮影できるようにするという困難な作業からはじめ,奮闘の末,種々の問題を乗り越えてついに決定的瞬間をとらえることに成功した.オートファゴソームの形成はYFP-Atg5融合タンパク質により追跡した.Atg5は隔離膜に結合するタンパク質だが,隔離膜の末端が閉鎖してオートファゴソームが完成するとオートファゴソーム膜から離脱するので,形成の途中のオートファゴソームだけを観察できるという利点がある8).取得した動画には,小胞体とミトコンドリアがダイナミックに動きつつも接しつづけている箇所において,Atg5のドットが現われ大きくなり最後に消える,というオートファゴソーム形成の過程がみごとに映っていた.
網目状の複雑な構造をもち,かつ,激しく動く2つのオルガネラと,ドット状にしかみえないオートファゴソームが重なり合う映像を鮮明に得るにはデジタル画像処理が必要であった.その結果,映像の取得に成功しただけでなく,さまざまな定量解析も可能になった.ドット状のAtg5から小胞体およびミトコンドリアへの距離を調べると,Atg5のドットの98%が小胞体にあり,かつ,79%がミトコンドリアから0.88μmの範囲にあった.つまり,ほとんどのドットが小胞体とミトコンドリアとの接触部位に局在しているものと思われた.時間変化でみると,小胞体への距離(ほぼゼロ)は変化しない一方,ミトコンドリアへの距離は0~0.88μmの範囲で近づいたり遠ざかったりをくり返していることがわかった.理由は不明だが,小胞体とミトコンドリアとの接触にはサイクルが存在し,その場所では密着と少し離れることが交互に起こっているようだった.オートファゴソームは小胞体とミトコンドリアとの接触部位の小胞体側において形成されているように思われた.
3.小胞体とミトコンドリアとの接触部位におけるオートファゴソーム形成の分子機構
PACS-2とMFN2は小胞体とミトコンドリアとの接触部位の形成に必要なタンパク質であるといわれている9,10).PACS-2とMFN2をそれぞれノックダウンすると,飢餓条件におけるオートファゴソームの形成が抑制され,そのとき,Atg14のドット状の集合もみられなくなった.また,Atg14とDFCP1のミトコンドリア結合小胞体膜画分への移動も起こらなかった.この結果は,オートファゴソームの形成には小胞体とミトコンドリアとの接触部位が必要であるという考えを支持したが,接触部位の形成抑制による2次的な影響の可能性も残った.小胞体とミトコンドリアとの接触部位にAtg14が集まることが本当に重要なのかという問いと,どうやって集まるのかという疑問の両方への答えは,別の実験から得られた.小胞体に局在するSNAREタンパク質のなかにオートファジーにかかわるものがないかスクリーニングを行った.SNAREは膜融合を起こす膜タンパク質ファミリーなので,膜融合が複数のステップにおいて必要なオートファジーにおいてもはたらいている可能性が高い.その結果,小胞体に局在する複数のSNAREタンパク質のなかで機能未知のSyntaxin17(stx17)が11),オートファジーに必要であることが判明した.しかも,stx17も飢餓に依存的に小胞体とミトコンドリアとの接触部位にドット状に集合し,ミトコンドリア結合小胞体膜画分における含有量が増加した.stx17をノックダウンすると,Atg14はミトコンドリア結合小胞体膜画分に移行しなくなり,小胞体とミトコンドリアとの接触部位への集合も消失した.一方,Atg14のノックダウンあるいはノックアウトは,stx17のミトコンドリア結合小胞体膜画分への移行および小胞体とミトコンドリアとの接触部位への集合には影響しなかった.さらには,stx17とホスファチジルイノシトール3-キナーゼを含むAtg14複合体が飢餓に依存的に結合することが共沈降実験により示された.これらの結果から,stx17はAtg14の上流に位置し,飢餓などのオートファジー誘導シグナルが入力されるとAtg14-ホスファチジルイノシトール3-キナーゼ複合体と結合してともに小胞体とミトコンドリアとの接触部位へと移動し,そこでホスファチジルイノシトールトリスリン酸の局所濃度が上昇しオートファゴソームが形成される,というシナリオが考えられた(図2).
おわりに
この研究により,オートファゴソームの小胞体起源説とミトコンドリア起源説のどちらもまちがいではなかったことが立証された.この両者は,同じ現象を違う側からみていたにすぎなかった.今回の成果は,小胞体とミトコンドリアとの接触部位の新たな機能を明らかにしただけではない.小胞体とミトコンドリアという出自のまったく異なる独立した2つのオルガネラが協働して第3のオルガネラを産むなどという予想外の過程の存在は,従来のオルガネラ像を塗り替え,細胞生物学にパラダイムシフトをもたらすものである.各種のオルガネラは,これまで考えられてきたよりダイナミックな相互作用をもちネットワークをかたちづくっているのかもしれない.
なぜオートファゴソームは小胞体とミトコンドリアとの接触部位でつくられるのだろうか? 興味深いことに,stx17のノックダウン細胞ではAtg14は小胞体とミトコンドリアとの接触部位に集合できないものの,小胞体の別の場所に集合しそこで隔離膜の形成が起こった.しかし,その隔離膜は閉じることができずオートファゴソームは完成しなかった.このことは,小胞体とミトコンドリアとの接触部位において隔離膜の閉鎖に必要な何かが供給されている可能性を示している.たとえば,ホスファチジルエタノールアミンは隔離膜の閉鎖に機能するタンパク質LC3と共有結合し12,13),これを隔離膜に局在化させる脂質だが,小胞体とミトコンドリアとの接触部位をとおしてミトコンドリアから小胞体へと移動すると考えられている.小胞体とミトコンドリアとの接触部位において隔離膜が形成されないと,ホスファチジルエタノールアミンの量が不十分で隔離膜の閉鎖に必要なLC3の分子数は確保できないのかもしれない.そのほかにも,stx17のSNAREとしての機能はどうかかわっているのかなど,今後,明らかにすべき課題は多い.なお,小胞体起源説,ミトコンドリア起源説のほか,オートファゴソームの細胞膜起源説をとなえる別のグループもいる.筆者らは,そのグループが隔離膜の前駆体と考える細胞膜に由来する小胞が,小胞体とミトコンドリアとの接触部位において成長しつつある隔離膜に融合し膜を供給しているのではないかと推測している.ともあれ,オートファジーにおける膜創生の問題はさらなる探求が必要である.
文 献
- Tooze, S. A. & Yoshimori, T.: The origin of the autophagosomal membrane. Nat. Cell Biol., 12, 831-835 (2010)[PubMed]
- Matsunaga, K., Saitoh, T., Tabata, K. et al.: Two Beclin 1-binding proteins, Atg14L and Rubicon, reciprocally regulate autophagy at different stages. Nat. Cell Biol., 11, 385-396 (2009)[PubMed]
- Matsunaga, K., Morita, E., Saitoh, T. et al.: Autophagy requires endoplasmic reticulum targeting of the PI3-kinase complex via Atg14L. J. Cell Biol., 190, 511-521 (2010)[PubMed]
- Hayashi-Nishino, M., Fujita, N., Noda, T. et al.: A subdomain of the endoplasmic reticulum forms a cradle for autophagosome formation. Nat. Cell Biol., 11, 1433-1437 (2009)[PubMed]
- Hailey, D. W., Rambold, A. S., Satpute-Krishnan, P. et al.: Mitochondria supply membranes for autophagosome biogenesis during starvation. Cell, 141, 656-667 (2010)[PubMed]
- Vance, J. E.: Phospholipid synthesis in a membrane fraction associated with mitochondria. J. Biol. Chem., 265, 7248-7256 (1990)[PubMed]
- Axe, E. L., Walker, S. A., Manifava, M. et al.: Autophagosome formation from membrane compartments enriched in phosphatidylinositol 3-phosphate and dynamically connected to the endoplasmic reticulum. J. Cell Biol., 182, 685-701 (2008)[PubMed]
- Mizushima, N., Yamamoto, A., Hatano, M. et al.: Dissection of autophagosome formation using Apg5-deficient mouse embryonic stem cells. J. Cell Biol., 152, 657-668 (2001)[PubMed]
- Simmen, T., Aslan, J. E., Blagoveshchenskaya, A. D. et al.: PACS-2 controls endoplasmic reticulum-mitochondria communication and Bid-mediated apoptosis. EMBO J., 24, 717-729 (2005)[PubMed]
- De Brito, O. M. & Scorrano, L.: Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature, 456, 605-610 (2008)[PubMed]
- Steegmaier, M., Oorschot, V., Klumperman, J. et al.: Syntaxin 17 is abundant in steroidogenic cells and implicated in smooth endoplasmic reticulum membrane dynamics. Mol. Biol. Cell, 11, 2719-2731 (2000)[PubMed]
- Kabeya, Y., Mizushima, N., Ueno, T. et al.: LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO J., 19, 5720-5728 (2000)[PubMed]
- Fujita, N., Hayashi-Nishino, M., Fukumoto, H. et al.: An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure. Mol. Biol. Cell, 19, 4651-4659 (2008)[PubMed]
著者プロフィール
大阪大学大学院医学系研究科 助教.
吉森 保(Tamotsu Yoshimori)
略歴:大阪生まれだが東京都立竹早高校卒で,東京弁と大阪弁のバイリンガル.大阪大学大学院医学研究科博士課程 中退,関西医科大学 助手,ドイツEuropean Molecular Biology Laboratory研究員,基礎生物学研究所 助教授,国立遺伝学研究所 教授,大阪大学微生物病研究所 教授を経て,大阪大学大学院医学系研究科ならびに同 生命機能研究科 教授.るろーに人生.別名Prof A. Hill.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/yoshimori/
© 2013 濱﨑万穂・吉森 保 Licensed under CC 表示 2.1 日本