がん化のおそれのないヒトiPS細胞からの自然免疫型T細胞の選択的な分化誘導と増幅
若尾 宏・藤田博美
(北海道大学大学院医学研究科 環境医学分野)
email:若尾 宏
DOI: 10.7875/first.author.2013.032
Expansion of functional human mucosal-associated invariant T cells via reprogramming to pluripotency and redifferentiation.
Hiroshi Wakao, Kazunori Yoshikiyo, Uichi Koshimizu, Tomoko Furukawa, Kei Enomoto, Tomomi Matsunaga, Tomofumi Tanaka, Yusuke Yasutomi, Takashi Yamada, Hisanori Minakami, Jyunji Tanaka, Atsushi Oda, Tomoyuki Sasaki, Rika Wakao, Olivier Lantz, Tadashi Udagawa, Yukie Sekiya, Kazue Higuchi, Nobuyuki Harada, Ken Nishimura, Manami Ohtaka, Mahito Nakanishi, Hiroyoshi Fujita
Cell Stem Cell, 12, 546-558 (2013)
ヒトにおいて豊富に存在する自然免疫型T細胞である粘膜関連インバリアントT細胞は,結核などの感染からの生体防御において重要な役割をはたしていると考えられる.粘膜関連インバリアントT細胞は各種の炎症性疾患や多発性硬化症などの自己免疫疾患に関与することが示唆されており,その健常あるいは病態における詳細な機能解析は,結核などの感染に対するより効果的なワクチンの開発や,自己免疫疾患に対する原因療法の開発に道を拓くものと思われる.しかし,粘膜関連インバリアントT細胞はほかのリンパ球とは異なりマウスでは希少であり,かつ,in vitroにおいては増殖しないためその解析は困難であった.筆者らは,粘膜関連インバリアントT細胞をいちどiPS細胞とし,ここから再分化させることによりその増幅を行った.iPS細胞化にはゲノムDNAを修飾しないセンダイウイルスを使用し,粘膜関連インバリアントT細胞への再分化においても遺伝子の強制発現をともなわない手法をとった.この成功により,ヒトiPS細胞を使用した細胞治療および再生医療の喫緊の具現化が期待される.
動物における免疫系の研究は,従来,マウスを主たる研究対象とし,遺伝子工学を駆使してノックアウトマウス,ノックインマウス,トランスジェニックマウスなどを作出することによりその詳細な解析が行われてきた.この傾向は現在もつづいており,今後も研究の主流であることは論を待たない.ヒトの疾患に対する創薬開発においてもマウスを使用した安全性および有効性の評価が行われており,マウスのモデル動物としての有用性に異をとなえるものはいない.一方,これだけ多様なマウス病態モデルが利用可能となった現在においても,ヒトにおける感染防御の分子機構の理解,自己免疫疾患の原因あるいは病因,免疫寛容の誘導の分子機序などについてはいまだ不明な点が多い.この理由を考えるとき,多くの免疫学者はヒトにおける免疫関連疾患は単一遺伝子変異によるものではなくいくつかの遺伝子の変異によるものと説明し,ときにはこれにくわえ環境因子がその一因であるむねを主張し,人々を説得しようとする.しかし,これは真実であろうか? この研究はこの単純な疑問からはじまった.
免疫反応にはT細胞,B細胞,樹状細胞,マクロファージなど,さまざまなリンパ球が関与するが,これらのうち,T細胞は以下の2種類に大別される.まず,適応免疫反応において重要な役割をはたす,CD4もしくはCD8をその細胞の表面に発現するいわゆる通常型のT細胞.これらのT細胞には多様な抗原に対応すべく,事実上,無限の可変領域(V)と結合領域(J)との組合せをもつT細胞受容体が存在する.これらのT細胞はペプチドを抗原として認識する.これに対し,そのT細胞受容体が多様性を示さず,T細胞受容体のV-Jの組合せが一義的に決定されているT細胞が存在し,これらは自然免疫型T細胞とよばれている.自然免疫型T細胞としては,これまで,ナチュラルキラーT細胞が人口に膾炙している.ナチュラルキラーT細胞はそのT細胞受容体α鎖がVα14-Jα18(マウス)あるいはVα24-Jα18(ヒト)であり,マウスに非常に多く,胸腺細胞の0.5~1.0%,肝臓単核球の20~50%をしめるが,末梢血や腸管粘膜固有層にはほとんど存在しない.ナチュラルキラーT細胞はMHC(major histocompatibility complex,主要組織適合遺伝子複合体)分子に類似したCD1dに提示された糖脂質を認識して多様なサイトカインを産生することにより,個体の免疫バランスの制御を図るとともに適応免疫系への橋渡しを行っていると考えられている1).この機能に注目して多くの研究者および企業がナチュラルキラーT細胞を標的にしたがんなど免疫疾患に対する創薬開発を進めてきた.しかし,ナチュラルキラーT細胞の存在割合はヒトの末梢血では0.01%以下であり,マウスにおいて報告されているようなサイトカインの産生による免疫制御機能をもつかどうかは不明である.
一方,ヒトにおいてナチュラルキラーT細胞と似た性質をもつ自然免疫型T細胞として,粘膜関連インバリアントT細胞(mucosal-associated invariant T cell)が存在する.粘膜関連インバリアントT細胞はもともと通常のCD4陽性T細胞もしくはCD8陽性T細胞に属さないT細胞で,そのT細胞受容体α鎖がVα7.2-Jα33(ヒト)あるいはVα19-Jα33(マウス)で一義的に決定されるT細胞として同定された2).このT細胞受容体の配列はナチュラルキラーT細胞の場合と同様に広く動物種をこえて保存されている.また,その分化,増殖,活性化はMR1(MHC-class I-related molecule 1)というタンパク質に依存しており,これもまた種をこえてその配列が高度に保存されている.粘膜関連インバリアントT細胞の機能は長いあいだ不明であったが,2010年,細菌の感染に対する生体防御反応に関与することが明らかにされた3).同年,ヒトにおいて結核菌に特異的に反応する非通常型CD8陽性T細胞として知られていたものは,実は粘膜関連インバリアントT細胞であることが明らかになった.粘膜関連インバリアントT細胞の特徴として,マウスでは非常に希少であるがヒトでは豊富であることがあげられる.粘膜関連インバリアントT細胞はヒトにおいて末梢血T細胞の1~10%,肝臓T細胞の20~50%,腸管粘膜固有層T細胞の5~20%をしめる4).また,粘膜関連インバリアントT細胞はほかのリンパ球と異なり,in vitroでは増殖させることができない.これは,ナチュラルキラーT細胞がそのアゴニストの添加により1000倍以上に増殖するのとは対照的である.さらに別の研究から,粘膜関連インバリアントT細胞と推定される細胞が多発性硬化症において罹患期間に比例して増えていることが報告されており,その発症との関連が示唆されている5,6).以上から,ヒトの粘膜関連インバリアントT細胞の健常あるいは病態における機能解析はこれまで未知であった自己免疫疾患の発症機構の解明,結核などの感染症に対するより効果的なワクチンや治療法の開発に道を拓くものと思われた.
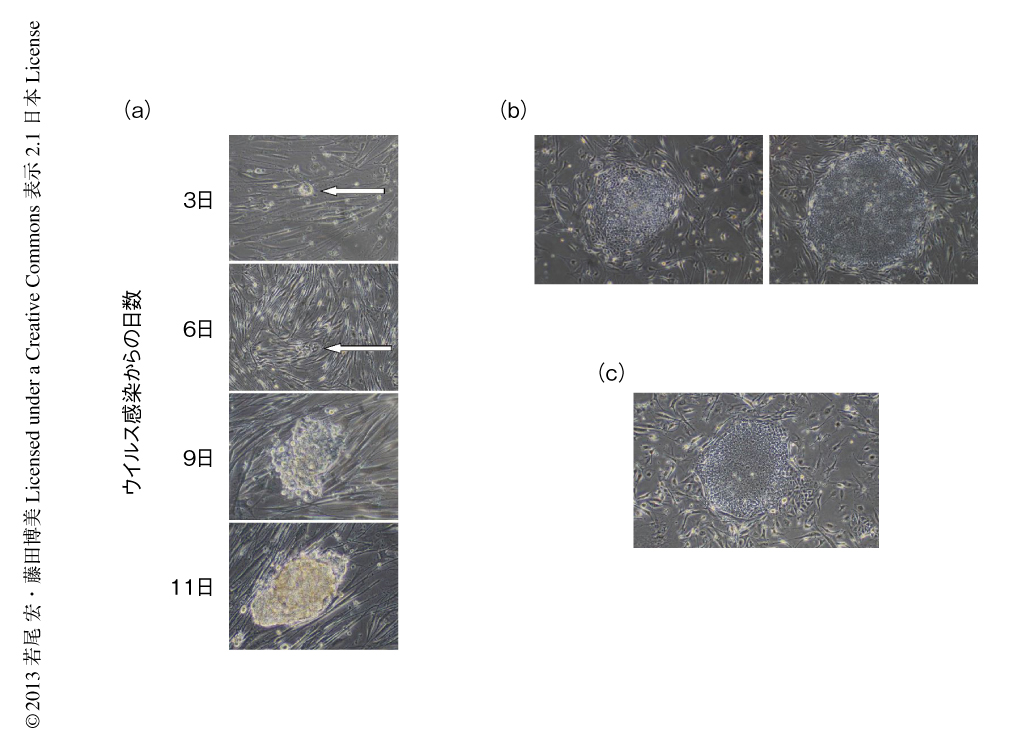
将来,粘膜関連インバリアントT細胞を細胞治療や再生医療などに資するため,iPS細胞化ならびに再分化において遺伝子修飾や強制発現をともなわない手法を採用した.まず,粘膜関連インバリアントT細胞を臍帯血から精製し,これに山中因子をもつセンダイウイルスを感染させ,iPS細胞化を行なった.感染ののち3日目にはiPS細胞のコロニーが検出され,3週間後にはヒトES細胞様のコロニーが形成された(図1).センダイウイルスは宿主のゲノムDNAに挿入されることも核を傷つけることもないので,得られたiPS細胞は理論上,がん化のおそれはない.得られたiPS細胞が粘膜関連インバリアントT細胞に由来することはT細胞受容体α鎖のV-Jの組合せをPCRにより確認することで,また,多能性をもつことはES細胞マーカーの発現,テロメラーゼ活性,OCT3/4遺伝子プロモーターおよびNANOG遺伝子プロモーターの脱メチル化,in vitroにおける胚葉体の形成を介した三胚葉の分化,免疫不全マウスへの移入によるテラトーマ形成能により確認した.また,得られた粘膜関連インバリアントT細胞に由来するiPS細胞は,ヒトのES細胞や繊維芽細胞に由来するiPS細胞とその遺伝子発現プロフィールがほぼ同一であった.
粘膜関連インバリアントT細胞への再分化の誘導はヒトES細胞からのT細胞の分化法に準じた.すなわち,粘膜関連インバリアントT細胞に由来するiPS細胞をOP9というフィーダー細胞の上で分化させ,ここからCD34陽性CD43陽性という血液幹細胞に類似した前駆細胞を精製し,つづいて,Notchリガンドを異所性に発現するOP9/DL1をフィーダー細胞として分化させた.OP9/DL1の上で30日間の分化誘導を行った結果,得られたリンパ球の98%以上が粘膜関連インバリアントT細胞であった.この再分化された粘膜関連インバリアントT細胞の表面抗原タンパク質を解析したところ,ヒトの末梢血に存在する粘膜関連インバリアントT細胞とは異なり,CD45RA,CD62L(ナイーブT細胞のマーカー),ならびに,T細胞エフェクタータンパク質であるCD95,サイトカインであるインターロイキン7の受容体,CXCR5やCCR6などのケモカイン受容体を発現していた.再分化された粘膜関連インバリアントT細胞の前駆細胞からの分化誘導における遺伝子発現プロフィールを時間をおって解析したところ,分化が進行するにつれその相関係数が臍帯血に由来する粘膜関連インバリアントT細胞に近づいていった.
粘膜関連インバリアントT細胞は細菌に感染したヒト単球を認識してインターフェロンγを産生する点で通常型のCD4陽性T細胞あるいはCD8陽性T細胞とは異なることから,この特性を確かめた.細菌に感染した単球と再分化された粘膜関連インバリアントT細胞とを共培養することにより,インターフェロンγ,TNFα,インターロイキン10,インターロイキン2,顆粒球単球コロニー刺激因子(GM-CSF),インターロイキン12,インターロイキン17,インターロイキン22などの多様なサイトカイン,および,Eotaxin,RANTESなどのケモカインの産生の増大が確認され,一部のサイトカインの産生はMR1に依存的であった.一方,再分化された粘膜関連インバリアントT細胞をホルボールエステルおよびイオノマイシンにより処理することにより,ヒトの末梢血に存在する粘膜関連インバリアントT細胞と同様にインターロイキン17とインターフェロンγの産生が細胞内染色により観察された.また,再分化された粘膜関連インバリアントT細胞は抗CD3刺激およびCD28刺激によりインターフェロンγを産生した.
再分化された粘膜関連インバリアントT細胞を免疫不全マウスへ移入したところ,骨髄,肝臓,脾臓,腸管上皮細胞間や腸管粘膜固有層に移行することが観察され,また,そのとき表面抗原タンパク質の発現プロフィールは大きく変化していた.とくに,in vitroにおいて作製された,再分化された粘膜関連インバリアントT細胞はナイーブ型であったのに対し,マウスへの移入によりメモリー型へと変換しており,おのおのの臓器への移入に必要なケモカイン受容体の発現も誘導されていた.とくに肝臓において,再分化された粘膜関連インバリアントT細胞は典型的なTh17細胞の表現型をもっていた.また,腸管粘膜固有層に由来する再分化された粘膜関連インバリアントT細胞を細菌に感染した単球と共培養したところ,臍帯血に由来する粘膜関連インバリアントT細胞と同様のサイトカインおよびケモカインの産生プロフィールを示した.このとき,マウスに移入するまえの再分化された粘膜関連インバリアントT細胞において観察されたケモカインIP-10およびMIGとインターフェロンγの発現は,感染に依存性を示したもののその絶対量は低下していた.これは,再分化された粘膜関連インバリアントT細胞がマウスにおいて成熟したことを示唆していた.
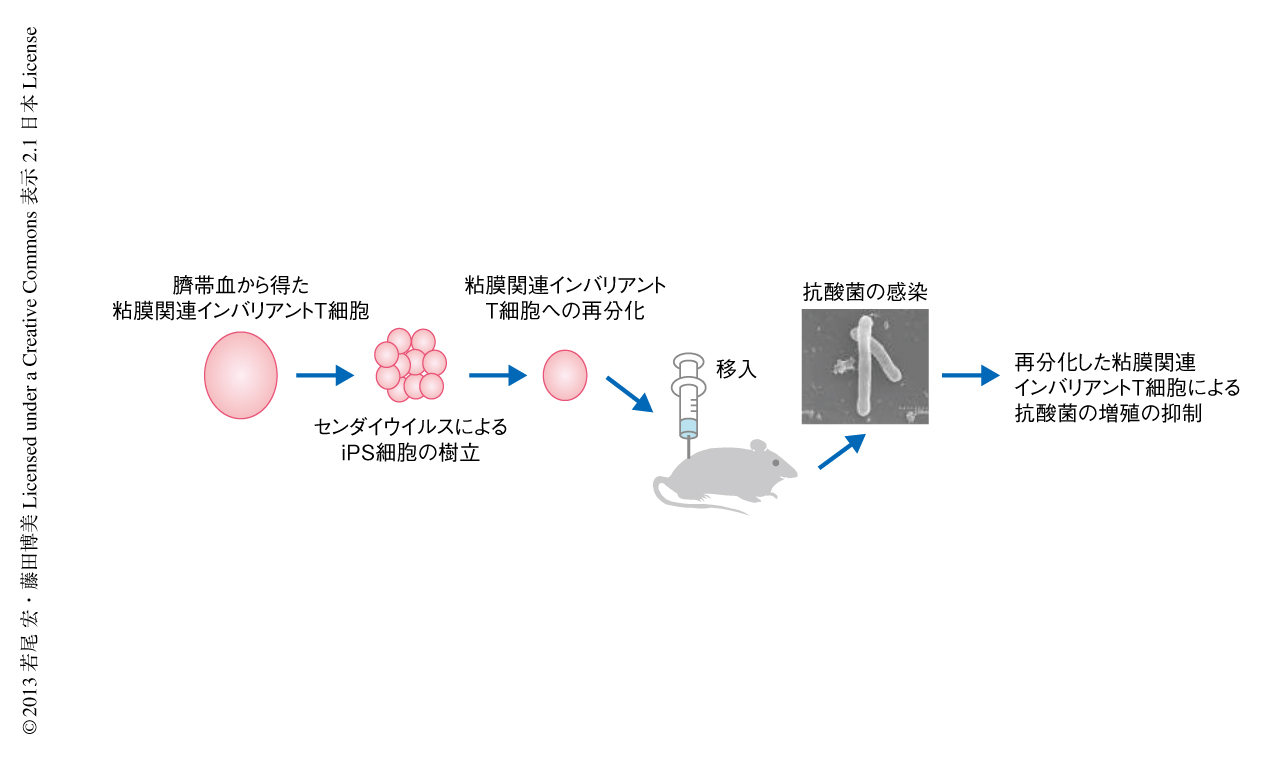
ここまで述べた実験結果から,再分化された粘膜関連インバリアントT細胞は生体に存在する粘膜関連インバリアントT細胞と同様に抗抗酸菌活性をもつものと推定された.これを確かめるため,免疫不全マウスにあらかじめ再分化された粘膜関連インバリアントT細胞を移入し,抗酸菌Mycobacteria abscessusを感染させて肝臓および脾臓における細菌の数を測定した.その結果,再分化された粘膜関連インバリアントT細胞を移入してない対照のマウスと比較して増殖は40~50%も抑制された.これに対して,あらかじめ樹状細胞を移入した免疫不全マウスでは増殖の抑制活性はみられなかった.この増殖抑制を担うタンパク質の同定を試みた.免疫不全マウスに再分化された粘膜関連インバリアントT細胞を移入してM. abscessusに感染させ血中に放出されるサイトカインを測定したところ,感染実験において観察されたTNFαあるいはインターフェロンγは検出されず,saposinファミリーであるgranulysinが同定された.また,in vitroにおける細菌感染実験を行なったところ,再分化された粘膜関連インバリアントT細胞からのgranulysinの放出が示唆された.以上の結果をまとめて示す(図2).
この報告における粘膜関連インバリアントT細胞のiPS細胞化において,この粘膜関連インバリアントT細胞は増殖していなかった.T細胞のiPS細胞化についてはすでに多数の報告があるが,いずれの場合もiPS細胞化には細胞の増殖が必要条件となっている7,8).これは,iPS細胞化に細胞増殖が必須ではないことを意味し,従前の常識をくつがえすものであった.さらに,臍帯血から精製した粘膜関連インバリアントT細胞は純度が80%前後であったにもかかわらず,iPS細胞化された細胞はほぼすべて粘膜関連インバリアントT細胞に由来した.これは,使用したセンダイウイルスベクターが粘膜関連インバリアントT細胞に対し指向性をもつことを示唆した.再分化された粘膜関連インバリアントT細胞のCD34陽性CD43陽性細胞からの分化誘導の効率は抗原に特異的な通常型のT細胞の場合と比べ非常に高かった.抗原に特異的なT細胞のiPS細胞化をへた再分化においては培養の途中で目的細胞を精製し抗原刺激を行って再び培養する必要があるが,再分化された粘膜関連インバリアントT細胞の場合,このような操作は必要ない7,8).これは,粘膜関連インバリアントT細胞が不変的なT細胞受容体の組合せをもつことに由来する.事実,不変的なT細胞受容体を発現するナチュラルキラーT細胞の場合も,ES細胞においてT細胞受容体α鎖の対立遺伝子座が遺伝子再構成ののちの配置をもつ場合には高効率の分化誘導が可能である9).これは,遺伝子再構成の完了した不変的なT細胞受容体の遺伝子座をもつiPS細胞など幹細胞からのT細胞の分化において,2次的な遺伝子再構成は起こらないことを示唆した.
再分化された粘膜関連インバリアントT細胞は細菌の感染など外部刺激により生体に存在する粘膜関連インバリアントT細胞と同じサイトカインを産生した.粘膜関連インバリアントT細胞がこれまで考えられているTh1型,Th17型,Th22型のサイトカインを産生する能力をもつことは,この細胞がこれまで知られていない新規のカテゴリーに属するT細胞であることを意味し,その多様なサイトカイン産生プロフィールから生体において免疫制御能をもつことが容易に想像された.さらに,再分化された粘膜関連インバリアントT細胞はin vitroにおける分化誘導の終了したときに,すでにTh17細胞への分化に関連する転写因子RORCを発現しており,Th17細胞に特有の表面抗原タンパク質をもつ.これは,これまで考えられていたように,ヘルパーT細胞の分化においてサイトカインなどの外部刺激によりナイーブ型から粘膜関連インバリアントT細胞が機能分化するのではなく,出生前からTh17細胞様の形質を獲得していることを意味した.粘膜関連インバリアントT細胞の活性化にはMR1からのシグナルが必要であるが,Toll様受容体やNOD様受容体には依存しない.これは,MR1を介する粘膜関連インバリアントT細胞の活性化には未知のシグナル伝達経路あるいはシグナル伝達タンパク質が存在することを意味する.抗抗酸菌活性におけるエフェクタータンパク質として考えられるgranulysinはヒトに特異的であり,マウスのゲノムにその相同遺伝子は存在しない.granulysinは細胞の膜構造を破壊し結核菌の脂質代謝を阻害することで細胞傷害活性および結核菌の破壊に寄与していると考えられている10).
粘膜関連インバリアントT細胞はヒトにおいて豊富な細胞であるが,これまで知られているいかなるT細胞刺激にも反応しないため,その健常あるいは病態における機能解析は困難をきわめていた.今回,そのiPS細胞化により,理論上,大量産生が可能となった.今後,この研究で得られた知見を奇貨として,マウスにはないヒトに特異的な感染防御機構および免疫恒常性の維持機構の解明および進展が期待される.
略歴:1990年 フランスLouis Pasteur大学大学院生命科学研究科博士課程 修了,スイスFriedrich Miescher Institute for Biomedical Research,米国DNAX Research Institute,東京大学分子細胞生物学研究所,ヘリックス研究所,千葉大学医学部,理化学研究所をへて,2006年 北海道大学大学院医学研究科 助手,2012年 同 准教授.
研究テーマ:ヒトの自然免疫型T細胞の機能解析.
関心事:ヒトのiPS細胞を使用した細胞治療および再生医療の具現化.
藤田 博美(Hiroyoshi Fujita)
北海道大学大学院医学研究科 教授.
研究室URL:http://www.hucc.hokudai.ac.jp/~d20504/
© 2013 若尾 宏・藤田博美 Licensed under CC 表示 2.1 日本
(北海道大学大学院医学研究科 環境医学分野)
email:若尾 宏
DOI: 10.7875/first.author.2013.032
Expansion of functional human mucosal-associated invariant T cells via reprogramming to pluripotency and redifferentiation.
Hiroshi Wakao, Kazunori Yoshikiyo, Uichi Koshimizu, Tomoko Furukawa, Kei Enomoto, Tomomi Matsunaga, Tomofumi Tanaka, Yusuke Yasutomi, Takashi Yamada, Hisanori Minakami, Jyunji Tanaka, Atsushi Oda, Tomoyuki Sasaki, Rika Wakao, Olivier Lantz, Tadashi Udagawa, Yukie Sekiya, Kazue Higuchi, Nobuyuki Harada, Ken Nishimura, Manami Ohtaka, Mahito Nakanishi, Hiroyoshi Fujita
Cell Stem Cell, 12, 546-558 (2013)
要 約
ヒトにおいて豊富に存在する自然免疫型T細胞である粘膜関連インバリアントT細胞は,結核などの感染からの生体防御において重要な役割をはたしていると考えられる.粘膜関連インバリアントT細胞は各種の炎症性疾患や多発性硬化症などの自己免疫疾患に関与することが示唆されており,その健常あるいは病態における詳細な機能解析は,結核などの感染に対するより効果的なワクチンの開発や,自己免疫疾患に対する原因療法の開発に道を拓くものと思われる.しかし,粘膜関連インバリアントT細胞はほかのリンパ球とは異なりマウスでは希少であり,かつ,in vitroにおいては増殖しないためその解析は困難であった.筆者らは,粘膜関連インバリアントT細胞をいちどiPS細胞とし,ここから再分化させることによりその増幅を行った.iPS細胞化にはゲノムDNAを修飾しないセンダイウイルスを使用し,粘膜関連インバリアントT細胞への再分化においても遺伝子の強制発現をともなわない手法をとった.この成功により,ヒトiPS細胞を使用した細胞治療および再生医療の喫緊の具現化が期待される.
はじめに
動物における免疫系の研究は,従来,マウスを主たる研究対象とし,遺伝子工学を駆使してノックアウトマウス,ノックインマウス,トランスジェニックマウスなどを作出することによりその詳細な解析が行われてきた.この傾向は現在もつづいており,今後も研究の主流であることは論を待たない.ヒトの疾患に対する創薬開発においてもマウスを使用した安全性および有効性の評価が行われており,マウスのモデル動物としての有用性に異をとなえるものはいない.一方,これだけ多様なマウス病態モデルが利用可能となった現在においても,ヒトにおける感染防御の分子機構の理解,自己免疫疾患の原因あるいは病因,免疫寛容の誘導の分子機序などについてはいまだ不明な点が多い.この理由を考えるとき,多くの免疫学者はヒトにおける免疫関連疾患は単一遺伝子変異によるものではなくいくつかの遺伝子の変異によるものと説明し,ときにはこれにくわえ環境因子がその一因であるむねを主張し,人々を説得しようとする.しかし,これは真実であろうか? この研究はこの単純な疑問からはじまった.
1.粘膜関連インバリアントT細胞とは?
免疫反応にはT細胞,B細胞,樹状細胞,マクロファージなど,さまざまなリンパ球が関与するが,これらのうち,T細胞は以下の2種類に大別される.まず,適応免疫反応において重要な役割をはたす,CD4もしくはCD8をその細胞の表面に発現するいわゆる通常型のT細胞.これらのT細胞には多様な抗原に対応すべく,事実上,無限の可変領域(V)と結合領域(J)との組合せをもつT細胞受容体が存在する.これらのT細胞はペプチドを抗原として認識する.これに対し,そのT細胞受容体が多様性を示さず,T細胞受容体のV-Jの組合せが一義的に決定されているT細胞が存在し,これらは自然免疫型T細胞とよばれている.自然免疫型T細胞としては,これまで,ナチュラルキラーT細胞が人口に膾炙している.ナチュラルキラーT細胞はそのT細胞受容体α鎖がVα14-Jα18(マウス)あるいはVα24-Jα18(ヒト)であり,マウスに非常に多く,胸腺細胞の0.5~1.0%,肝臓単核球の20~50%をしめるが,末梢血や腸管粘膜固有層にはほとんど存在しない.ナチュラルキラーT細胞はMHC(major histocompatibility complex,主要組織適合遺伝子複合体)分子に類似したCD1dに提示された糖脂質を認識して多様なサイトカインを産生することにより,個体の免疫バランスの制御を図るとともに適応免疫系への橋渡しを行っていると考えられている1).この機能に注目して多くの研究者および企業がナチュラルキラーT細胞を標的にしたがんなど免疫疾患に対する創薬開発を進めてきた.しかし,ナチュラルキラーT細胞の存在割合はヒトの末梢血では0.01%以下であり,マウスにおいて報告されているようなサイトカインの産生による免疫制御機能をもつかどうかは不明である.
一方,ヒトにおいてナチュラルキラーT細胞と似た性質をもつ自然免疫型T細胞として,粘膜関連インバリアントT細胞(mucosal-associated invariant T cell)が存在する.粘膜関連インバリアントT細胞はもともと通常のCD4陽性T細胞もしくはCD8陽性T細胞に属さないT細胞で,そのT細胞受容体α鎖がVα7.2-Jα33(ヒト)あるいはVα19-Jα33(マウス)で一義的に決定されるT細胞として同定された2).このT細胞受容体の配列はナチュラルキラーT細胞の場合と同様に広く動物種をこえて保存されている.また,その分化,増殖,活性化はMR1(MHC-class I-related molecule 1)というタンパク質に依存しており,これもまた種をこえてその配列が高度に保存されている.粘膜関連インバリアントT細胞の機能は長いあいだ不明であったが,2010年,細菌の感染に対する生体防御反応に関与することが明らかにされた3).同年,ヒトにおいて結核菌に特異的に反応する非通常型CD8陽性T細胞として知られていたものは,実は粘膜関連インバリアントT細胞であることが明らかになった.粘膜関連インバリアントT細胞の特徴として,マウスでは非常に希少であるがヒトでは豊富であることがあげられる.粘膜関連インバリアントT細胞はヒトにおいて末梢血T細胞の1~10%,肝臓T細胞の20~50%,腸管粘膜固有層T細胞の5~20%をしめる4).また,粘膜関連インバリアントT細胞はほかのリンパ球と異なり,in vitroでは増殖させることができない.これは,ナチュラルキラーT細胞がそのアゴニストの添加により1000倍以上に増殖するのとは対照的である.さらに別の研究から,粘膜関連インバリアントT細胞と推定される細胞が多発性硬化症において罹患期間に比例して増えていることが報告されており,その発症との関連が示唆されている5,6).以上から,ヒトの粘膜関連インバリアントT細胞の健常あるいは病態における機能解析はこれまで未知であった自己免疫疾患の発症機構の解明,結核などの感染症に対するより効果的なワクチンや治療法の開発に道を拓くものと思われた.
2.粘膜関連インバリアントT細胞に由来するiPS細胞の樹立
将来,粘膜関連インバリアントT細胞を細胞治療や再生医療などに資するため,iPS細胞化ならびに再分化において遺伝子修飾や強制発現をともなわない手法を採用した.まず,粘膜関連インバリアントT細胞を臍帯血から精製し,これに山中因子をもつセンダイウイルスを感染させ,iPS細胞化を行なった.感染ののち3日目にはiPS細胞のコロニーが検出され,3週間後にはヒトES細胞様のコロニーが形成された(図1).センダイウイルスは宿主のゲノムDNAに挿入されることも核を傷つけることもないので,得られたiPS細胞は理論上,がん化のおそれはない.得られたiPS細胞が粘膜関連インバリアントT細胞に由来することはT細胞受容体α鎖のV-Jの組合せをPCRにより確認することで,また,多能性をもつことはES細胞マーカーの発現,テロメラーゼ活性,OCT3/4遺伝子プロモーターおよびNANOG遺伝子プロモーターの脱メチル化,in vitroにおける胚葉体の形成を介した三胚葉の分化,免疫不全マウスへの移入によるテラトーマ形成能により確認した.また,得られた粘膜関連インバリアントT細胞に由来するiPS細胞は,ヒトのES細胞や繊維芽細胞に由来するiPS細胞とその遺伝子発現プロフィールがほぼ同一であった.
3.iPS細胞から粘膜関連インバリアントT細胞への再分化の誘導
粘膜関連インバリアントT細胞への再分化の誘導はヒトES細胞からのT細胞の分化法に準じた.すなわち,粘膜関連インバリアントT細胞に由来するiPS細胞をOP9というフィーダー細胞の上で分化させ,ここからCD34陽性CD43陽性という血液幹細胞に類似した前駆細胞を精製し,つづいて,Notchリガンドを異所性に発現するOP9/DL1をフィーダー細胞として分化させた.OP9/DL1の上で30日間の分化誘導を行った結果,得られたリンパ球の98%以上が粘膜関連インバリアントT細胞であった.この再分化された粘膜関連インバリアントT細胞の表面抗原タンパク質を解析したところ,ヒトの末梢血に存在する粘膜関連インバリアントT細胞とは異なり,CD45RA,CD62L(ナイーブT細胞のマーカー),ならびに,T細胞エフェクタータンパク質であるCD95,サイトカインであるインターロイキン7の受容体,CXCR5やCCR6などのケモカイン受容体を発現していた.再分化された粘膜関連インバリアントT細胞の前駆細胞からの分化誘導における遺伝子発現プロフィールを時間をおって解析したところ,分化が進行するにつれその相関係数が臍帯血に由来する粘膜関連インバリアントT細胞に近づいていった.
4.再分化された粘膜関連インバリアントT細胞の性状の解析
粘膜関連インバリアントT細胞は細菌に感染したヒト単球を認識してインターフェロンγを産生する点で通常型のCD4陽性T細胞あるいはCD8陽性T細胞とは異なることから,この特性を確かめた.細菌に感染した単球と再分化された粘膜関連インバリアントT細胞とを共培養することにより,インターフェロンγ,TNFα,インターロイキン10,インターロイキン2,顆粒球単球コロニー刺激因子(GM-CSF),インターロイキン12,インターロイキン17,インターロイキン22などの多様なサイトカイン,および,Eotaxin,RANTESなどのケモカインの産生の増大が確認され,一部のサイトカインの産生はMR1に依存的であった.一方,再分化された粘膜関連インバリアントT細胞をホルボールエステルおよびイオノマイシンにより処理することにより,ヒトの末梢血に存在する粘膜関連インバリアントT細胞と同様にインターロイキン17とインターフェロンγの産生が細胞内染色により観察された.また,再分化された粘膜関連インバリアントT細胞は抗CD3刺激およびCD28刺激によりインターフェロンγを産生した.
5.再分化された粘膜関連インバリアントT細胞は免疫不全マウスへの移入によりさまざまな臓器へ移行した
再分化された粘膜関連インバリアントT細胞を免疫不全マウスへ移入したところ,骨髄,肝臓,脾臓,腸管上皮細胞間や腸管粘膜固有層に移行することが観察され,また,そのとき表面抗原タンパク質の発現プロフィールは大きく変化していた.とくに,in vitroにおいて作製された,再分化された粘膜関連インバリアントT細胞はナイーブ型であったのに対し,マウスへの移入によりメモリー型へと変換しており,おのおのの臓器への移入に必要なケモカイン受容体の発現も誘導されていた.とくに肝臓において,再分化された粘膜関連インバリアントT細胞は典型的なTh17細胞の表現型をもっていた.また,腸管粘膜固有層に由来する再分化された粘膜関連インバリアントT細胞を細菌に感染した単球と共培養したところ,臍帯血に由来する粘膜関連インバリアントT細胞と同様のサイトカインおよびケモカインの産生プロフィールを示した.このとき,マウスに移入するまえの再分化された粘膜関連インバリアントT細胞において観察されたケモカインIP-10およびMIGとインターフェロンγの発現は,感染に依存性を示したもののその絶対量は低下していた.これは,再分化された粘膜関連インバリアントT細胞がマウスにおいて成熟したことを示唆していた.
6.再分化された粘膜関連インバリアントT細胞は抗抗酸菌活性をもつ
ここまで述べた実験結果から,再分化された粘膜関連インバリアントT細胞は生体に存在する粘膜関連インバリアントT細胞と同様に抗抗酸菌活性をもつものと推定された.これを確かめるため,免疫不全マウスにあらかじめ再分化された粘膜関連インバリアントT細胞を移入し,抗酸菌Mycobacteria abscessusを感染させて肝臓および脾臓における細菌の数を測定した.その結果,再分化された粘膜関連インバリアントT細胞を移入してない対照のマウスと比較して増殖は40~50%も抑制された.これに対して,あらかじめ樹状細胞を移入した免疫不全マウスでは増殖の抑制活性はみられなかった.この増殖抑制を担うタンパク質の同定を試みた.免疫不全マウスに再分化された粘膜関連インバリアントT細胞を移入してM. abscessusに感染させ血中に放出されるサイトカインを測定したところ,感染実験において観察されたTNFαあるいはインターフェロンγは検出されず,saposinファミリーであるgranulysinが同定された.また,in vitroにおける細菌感染実験を行なったところ,再分化された粘膜関連インバリアントT細胞からのgranulysinの放出が示唆された.以上の結果をまとめて示す(図2).
おわりに
この報告における粘膜関連インバリアントT細胞のiPS細胞化において,この粘膜関連インバリアントT細胞は増殖していなかった.T細胞のiPS細胞化についてはすでに多数の報告があるが,いずれの場合もiPS細胞化には細胞の増殖が必要条件となっている7,8).これは,iPS細胞化に細胞増殖が必須ではないことを意味し,従前の常識をくつがえすものであった.さらに,臍帯血から精製した粘膜関連インバリアントT細胞は純度が80%前後であったにもかかわらず,iPS細胞化された細胞はほぼすべて粘膜関連インバリアントT細胞に由来した.これは,使用したセンダイウイルスベクターが粘膜関連インバリアントT細胞に対し指向性をもつことを示唆した.再分化された粘膜関連インバリアントT細胞のCD34陽性CD43陽性細胞からの分化誘導の効率は抗原に特異的な通常型のT細胞の場合と比べ非常に高かった.抗原に特異的なT細胞のiPS細胞化をへた再分化においては培養の途中で目的細胞を精製し抗原刺激を行って再び培養する必要があるが,再分化された粘膜関連インバリアントT細胞の場合,このような操作は必要ない7,8).これは,粘膜関連インバリアントT細胞が不変的なT細胞受容体の組合せをもつことに由来する.事実,不変的なT細胞受容体を発現するナチュラルキラーT細胞の場合も,ES細胞においてT細胞受容体α鎖の対立遺伝子座が遺伝子再構成ののちの配置をもつ場合には高効率の分化誘導が可能である9).これは,遺伝子再構成の完了した不変的なT細胞受容体の遺伝子座をもつiPS細胞など幹細胞からのT細胞の分化において,2次的な遺伝子再構成は起こらないことを示唆した.
再分化された粘膜関連インバリアントT細胞は細菌の感染など外部刺激により生体に存在する粘膜関連インバリアントT細胞と同じサイトカインを産生した.粘膜関連インバリアントT細胞がこれまで考えられているTh1型,Th17型,Th22型のサイトカインを産生する能力をもつことは,この細胞がこれまで知られていない新規のカテゴリーに属するT細胞であることを意味し,その多様なサイトカイン産生プロフィールから生体において免疫制御能をもつことが容易に想像された.さらに,再分化された粘膜関連インバリアントT細胞はin vitroにおける分化誘導の終了したときに,すでにTh17細胞への分化に関連する転写因子RORCを発現しており,Th17細胞に特有の表面抗原タンパク質をもつ.これは,これまで考えられていたように,ヘルパーT細胞の分化においてサイトカインなどの外部刺激によりナイーブ型から粘膜関連インバリアントT細胞が機能分化するのではなく,出生前からTh17細胞様の形質を獲得していることを意味した.粘膜関連インバリアントT細胞の活性化にはMR1からのシグナルが必要であるが,Toll様受容体やNOD様受容体には依存しない.これは,MR1を介する粘膜関連インバリアントT細胞の活性化には未知のシグナル伝達経路あるいはシグナル伝達タンパク質が存在することを意味する.抗抗酸菌活性におけるエフェクタータンパク質として考えられるgranulysinはヒトに特異的であり,マウスのゲノムにその相同遺伝子は存在しない.granulysinは細胞の膜構造を破壊し結核菌の脂質代謝を阻害することで細胞傷害活性および結核菌の破壊に寄与していると考えられている10).
粘膜関連インバリアントT細胞はヒトにおいて豊富な細胞であるが,これまで知られているいかなるT細胞刺激にも反応しないため,その健常あるいは病態における機能解析は困難をきわめていた.今回,そのiPS細胞化により,理論上,大量産生が可能となった.今後,この研究で得られた知見を奇貨として,マウスにはないヒトに特異的な感染防御機構および免疫恒常性の維持機構の解明および進展が期待される.
文 献
- Bendelac, A., Savage, P. B. & Teyton, L.: The biology of NKT cells. Annu. Rev. Immunol., 25, 297-336 (2007)[PubMed]
- Tilloy, F., Treiner, E., Park, S. H. et al.: An invariant T cell receptor alpha chain defines a novel TAP-independent major histocompatibility complex class Ib-restricted α/β T cell subpopulation in mammals. J. Exp. Med., 189, 1907-1921 (1999)[PubMed]
- Le Bourhis, L., Martin, E., Peguillet, I. et al.: Antimicrobial activity of mucosal-associated invariant T cells. Nat. Immunol., 11, 701-708 (2010)[PubMed]
- Dusseaux, M., Martin, E., Serriari, N. et al.: Human MAIT cells are xenobiotic-resistant, tissue-targeted, CD161hi IL-17-secreting T cells. Blood, 117, 1250-1259 (2011)[PubMed]
- Annibali, V., Ristori, G., Angelini, D. F. et al.: CD161highCD8+T cells bear pathogenetic potential in multiple sclerosis. Brain, 134, 542-554 (2011)[PubMed]
- Walker, L. J., Kang, Y. H., Smith, M. O. et al.: Human MAIT and CD8αα cells develop from a pool of type-17 pre-committed CD8+ T cells. Blood, 119, 422-433 (2011)[PubMed]
- Nishimura, T., Kaneko, S., Kawana-Tachikawa, A. et al.: Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell, 12, 114-126 (2013)[PubMed] [新着論文レビュー]
- Vizcardo, R., Masuda, K., Yamada, D. et al.: Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8+ T cells. Cell Stem Cell, 12, 31-36 (2013)[PubMed]
- Wakao, H., Wakao, R., Sakata, S. et al.: In vitro induction of natural killer T cells from embryonic stem cells prepared using somatic cell nuclear transfer. FASEB J., 22, 2223-2231 (2008)[PubMed]
- Krensky, A. M. & Clayberger, C.: Biology and clinical relevance of granulysin. Tissue Antigens, 73, 193-198 (2009)[PubMed]
著者プロフィール
略歴:1990年 フランスLouis Pasteur大学大学院生命科学研究科博士課程 修了,スイスFriedrich Miescher Institute for Biomedical Research,米国DNAX Research Institute,東京大学分子細胞生物学研究所,ヘリックス研究所,千葉大学医学部,理化学研究所をへて,2006年 北海道大学大学院医学研究科 助手,2012年 同 准教授.
研究テーマ:ヒトの自然免疫型T細胞の機能解析.
関心事:ヒトのiPS細胞を使用した細胞治療および再生医療の具現化.
藤田 博美(Hiroyoshi Fujita)
北海道大学大学院医学研究科 教授.
研究室URL:http://www.hucc.hokudai.ac.jp/~d20504/
© 2013 若尾 宏・藤田博美 Licensed under CC 表示 2.1 日本