軸索間の相互作用によるシナプスタイリングの制御機構
水本 公大
(米国Stanford大学Department of Biology)
email:水本公大
DOI: 10.7875/first.author.2013.022
Interaxonal interaction defines tiled presynaptic innervation in C. elegans.
Kota Mizumoto, Kang Shen
Neuron, 77, 655-666 (2013)
ニューロンはとなりあうニューロンと細胞表層に局在するタンパク質を介して相互作用することにより,軸索や樹状突起の正確な投射パターンを形成している.一方で,これらのシグナルタンパク質や膜タンパク質がシナプスのパターン形成にどのように関与しているのかについて,その知見はかぎられている.今回,筆者らは,線虫の運動ニューロンにおいて観察される,となりあうニューロンに由来するシナプスが互いに重複しないよう配置される“シナプスタイリング”という現象に着目し,遺伝学的な解析から軸索のあいだの相互作用がこのシナプスタイリングに必須であり,軸索誘導タンパク質であるセマフォリンとその受容体であるプレキシンがこの相互作用を介在していることを見い出した.プレキシンは軸索間の相互作用に依存してシナプスタイリングの境界に局在し,その細胞質領域にあるGAPドメインに依存してシナプスの形成を抑制していることが示唆された.この研究により,軸索間の相互作用がシナプスのパターン形成に重要な機能をはたしていることが明らかになった.
ニューロンはその標的となる細胞とシナプスとよばれる構造を形成することにより情報伝達を行っている.一方で,ニューロンは軸索を伸長する過程において標的ではない多くの細胞とも接触しており,それらは多くの場合,同一の機能をもち同じサブタイプに属する別のニューロンの軸索である.近年,軸索のあいだの相互作用が軸索伸長のパターンに重要であるという報告がなされているが1),解像度の問題もあり,シナプスのパターン形成における軸索間の相互作用の役割については未知である.筆者らは,線虫(Caenorhabditis elegans)の運動ニューロンのうち,後方への運動のときに背側体壁筋の収縮を制御するDAニューロンを実験モデルとして用いて,シナプスのパターン形成における軸索間の相互作用の役割とその分子機構の解明を試みた.線虫の運動ニューロンは軸索の末端ではなく軸索にそってシナプスを形成するため,軸索の誘導とシナプスのパターン形成とを独立の現象として観察することが可能で,シナプスのパターン形成に関与するタンパク質の解析が容易である.
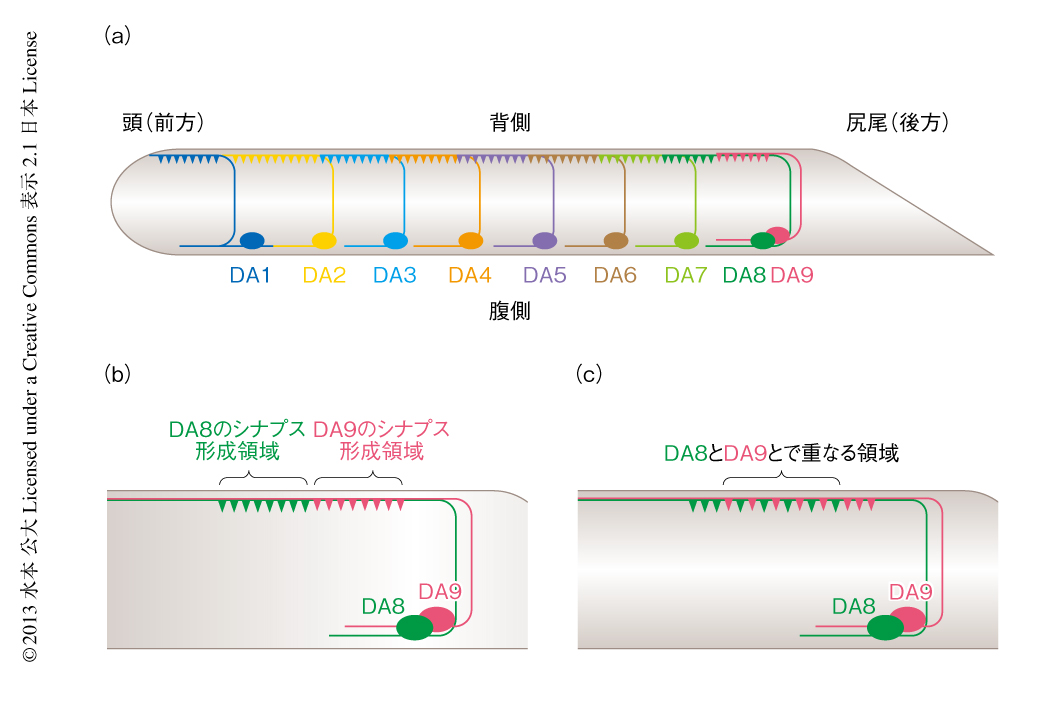
DAニューロンは腹側に細胞体があり,そこから腹側神経管に樹状突起を,背側神経管に軸索を伸長し,軸索にそって背側体壁筋とシナプスを形成する(図1a).DAニューロンは全部で9つあり,DA1からDA7までは前後軸にそってほぼ均等に配置されているが,最後方に位置するDA8ニューロンとDA9ニューロンは細胞体の位置あるいは樹状突起や軸索の伸長パターンがほぼ同一である.興味深いことに,おのおののDAニューロンの軸索は背側神経管の広範囲にわたり重複しているにもかかわらず,背側体壁筋の特定の領域のみにシナプスを形成し,となりあうDAニューロンのシナプス形成領域とは重複あるいはギャップをつくらない.筆者らは,この現象を“シナプスタイリング”(synapse tiling)と名づけ,その分子機構の解明を行うことにした.体壁筋においてタイル状に配置されたシナプスは,線虫がサイン曲線をかきながら前後方向に運動する際に,体壁筋を前後軸にそって順番に収縮させるため必要であると思われる.
軸索や樹状突起がそれ自体,あるいは,となりあうニューロンと重複しないタイリング現象はショウジョウバエやそのほかの高等生物でも報告されており2),最近では,大脳皮質においてCajal-Retzius細胞が細胞間コミュニケーションに依存して均等に配置されることが報告されている3).これらのタイリング現象は,ニューロンがかぎられた細胞を用いて情報処理を効率的に行うための機構であると考えられている.線虫においてシナプスタイリングの現象それ自体は40年前に報告されているが4),おのおののニューロンに由来するシナプスを区別することは電子顕微鏡によらないと困難なため,解析はされていなかった.今回,筆者らは,生体においてDA8ニューロンとDA9ニューロンのシナプスを異なる蛍光タンパク質により可視化した系統を作製し,シナプスタイリングの遺伝学的な解析を行った.
DA8ニューロンのシナプスをGFPで,DA9ニューロンのシナプスをmCherryで標識した系統を作製し,以前の電子顕微鏡による観察結果のとおり,DA8ニューロンとDA9ニューロンのシナプス形成領域に重複やギャップのないことを確認した(図1b).DA8ニューロンとDA9ニューロンとのシナプスタイリングはこの2つのニューロンの活性やシナプスの標的となる細胞である筋肉細胞に依存しなかったことから,このシナプスタイリングはDA8ニューロンとDA9ニューロンとのあいだの軸索間の相互作用に依存しているのではないかと考え,その可能性を軸索誘導における変異体を用いて検討した.TGFβ様タンパク質をコードするunc-129遺伝子の変異体では,およそ50%の個体においてDA8ニューロンあるいはDA9ニューロンの軸索が背側神経管に到達するまえに体軸の前方へと伸長するため,DA8ニューロンとDA9ニューロンの軸索のあいだに物理的な接触のない状況になる.このとき,DA8ニューロンとDA9ニューロンのシナプス形成領域には前後軸にそって大きく重複がみられた.一方で,同じ変異体においても軸索誘導に異常がみられない個体ではシナプスタイリングは正常であった.このことは,シナプスタイリングの境界の決定にはDA8ニューロンとDA9ニューロンとの軸索間の相互作用が必須であることを示唆していた.
シナプスタイリングにおける軸索間の相互作用を介在するタンパク質を同定するため,変異原であるエチルメタンスルホン酸(EMS)を用いた遺伝学的なスクリーニングを行った.その結果,哺乳類のプレキシンA4の線虫におけるホモログの変異体であるplx-1変異体を単離した.plx-1変異体においてDA8ニューロンとDA9ニューロンのシナプス形成領域には大きな重複がみられ,この重複領域ではこの2つのニューロンに由来するシナプスが混在していた(図1c).プレキシンのリガンドである細胞膜局在型セマフォリンの線虫における変異体であるsmp-1;smp-2変異体においても,plx-1変異体と同様にシナプスタイリングに異常が認められた.セマフォリンは高等生物における軸索誘導タンパク質であり,マウスやほかのモデル生物において,それらの変異体には軸索誘導に異常が観察される5).一方で,これまでの報告では,線虫においてセマフォリンあるいはプレキシンの変異体には軸索誘導に明確な異常は認められておらず,今回のシナプスタイリングの異常が線虫の神経系におけるはじめての表現型であった.近年,高等生物においてもセマフォリン-プレキシン経路はシナプスの形成を抑制することが報告されているが5),線虫における今回の発見は,セマフォリン-プレキシン経路の軸索誘導における機能は進化的にのちになり獲得されたことを示唆した.実際に,線虫においてはWnt経路やNetrin経路などの軸索誘導タンパク質における変異体の多くでシナプスパターンに異常のあることが報告されており6,7),これは多くの軸索誘導タンパク質に共通した進化なのかもしれない.
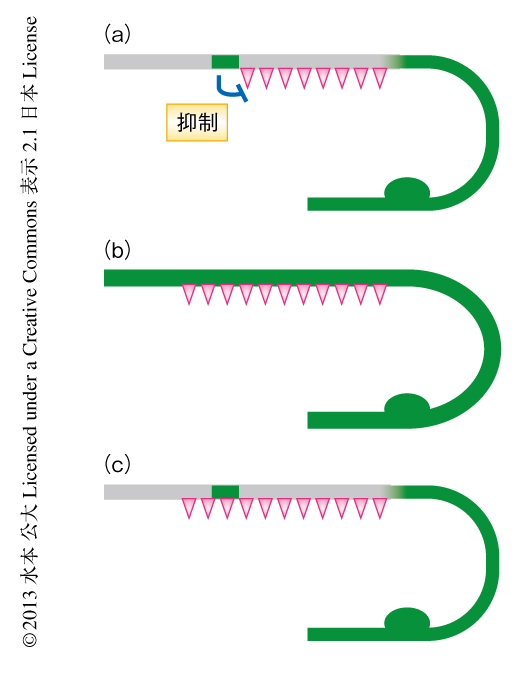
セマフォリンとプレキシンがどの細胞で機能しているかを調べるため,組織に特異的なプロモーターを用いた遺伝子回復実験を行った.通常,細胞膜型のリガンドであるセマフォリンとその受容体であるプレキシンは別の細胞で発現してトランスに機能する.しかし驚いたことに,シナプスタイリングにおいてはセマフォリン遺伝子およびプレキシン遺伝子をDA9ニューロンにおいて発現させることにより,セマフォリンの変異体およびプレキシンの変異体の表現型を回復させることができた.さらに,モザイク実験により,セマフォリンおよびプレキシンはDA9ニューロンにおいて必要十分であることが明らかになった.この結果から,セマフォリンとプレキシンが同一の細胞において機能し,DA8ニューロンにおいて機能する未同定のタンパク質と相互作用することにより,DA8ニューロンとDA9ニューロンとの相互作用を介在していると考えられた(図2).しかし一方で,この結果はセマフォリンやプレキシンと冗長的にはたらくタンパク質がDA8ニューロンに存在する可能性を否定しておらず,DA9ニューロンにおいて機能するセマフォリンとプレキシンが,どのようにしてDA8ニューロンとDA9ニューロンとの相互作用を介在しているかについてはさらなる解析が必要である.
プレキシンのDA9ニューロンにおける機能を明らかにするため,PLX-1とGFPとの融合タンパク質をDA9ニューロンに特異的なプロモーターにより発現させその細胞内局在を観察したところ,DA9ニューロンのシナプス形成領域の前側の先端,すなわち,DA8ニューロンとDA9ニューロンとのシナプスタイリングの境界に局在していた(図3a).プレキシンはシナプスが軸索に形成されないキネシンの変異体においても正常に局在していた.また,セマフォリン変異体やDA8ニューロンとDA9ニューロンとの接触が失われる軸索誘導の変異体では,プレキシンは軸索に一様に局在していたことから(図3b),プレキシンの軸索における局在パターンがシナプスのパターン形成に重要であることが示唆された.
プレキシンがDA9ニューロンにおいてシナプス形成領域の前側の境界に局在していたことから,プレキシンはシナプスタイリングの境界においてDA9ニューロンのシナプスの形成を抑制しているのではないかと考えた.プレキシンの細胞質領域には低分子量Gタンパク質に対するGAP(GTPase activating protein,GTPase活性化タンパク質)ドメインがあり,線虫のPLX-1にも高度に保存されたGAPドメインが存在する.GAP領域を含む細胞内領域を欠損させた変異型PLX-1や,哺乳類のプレキシンにおいてGAP活性に必須なアミノ酸残基に相当する部位に変異を導入した変異型PLX-1をDA9ニューロンに発現させても,plx-1変異体の表現型を回復することはできなかった.これらの変異型PLX-1は野生型と同じような局在パターンを示したが,シナプスのマーカーと相補的な局在パターンを示す野生型PLX-1とは異なり,GAP活性を失った変異型PLX-1はシナプスタイリングの境界の付近においてシナプスのマーカーとその局在が重複していた(図3c).これらのことから,PLX-1はDA9ニューロンのシナプス形成領域の前側に局在し,GAPドメインに依存的にシナプスの形成を抑制していると考えられた.GAPドメインは低分子量Gタンパク質の活性を抑制する機能をもつことから,plx-1変異体では低分子量Gタンパク質が高活性状態にあることが予想された.低分子量Gタンパク質のひとつRasの線虫におけるホモログ遺伝子let-60の恒常活性型変異体においてシナプスタイリングの異常が確認されたことから,実際に,plx-1変異体では低分子量Gタンパク質の活性化が起こっているものと推察された.
プレキシンはアクチン細胞骨格を介して軸索誘導を制御していることが報告されている.また近年,筆者らの研究室では,シナプスの形成にアクチンの集積が必要であることを見い出している8).そこで,シナプスタイリングにおいてプレキシンはアクチン骨格を介してシナプスパターンを制御しているのではないかと考えた.線虫において線維状アクチンのマーカーのひとつであるUtrophin-CHはシナプス形成領域の線維状アクチンを強く認識する.このマーカーをDA9ニューロンにおいて観察したところシナプス形成領域に強く局在していた.また,plx-1変異体を含むすべてのシナプスタイリングの変異体において,アクチン骨格は軸索の前方へと伸長していた.このことから,プレキシンはシナプスタイリングの境界においてDA9ニューロンのアクチン骨格を抑制することによりシナプス形成領域を制限していると考えられた(図2).
線虫はすべての細胞の運命が解明され,すべての神経の構造やシナプスパターンが電子顕微鏡レベルで解析されている唯一の生物である.さらに,線虫の運動(locomotion)は,サイン曲線をかきながら前に進むか後ろに下がるかの2つのパターンしかないが(米国North Carolina大学Chapel Hill校Goldstein研究室による動画を参照.URL:http://labs.bio.unc.edu/Goldstein/movies.html),それにもかかわらず,どのようにしてこの運動が達成されているのかについては明らかになっていない.習性(behaviour)レベルでの神経機能の解析はマウスをはじめ多くなされているが,運動に関しては関与している因子が多く,また,複雑な動きをする高等生物では解析は困難である.この研究では,線虫の運動において中核的な役割を担っていると考えられるシナプスタイリングに着目し,DA8ニューロンとDA9ニューロンとのシナプスタイリングをモデルとして軸索間の相互作用を制御するタンパク質としてプレキシンの同定に成功した.しかしながら,プレキシンがどのようにしてリガンドであるセマフォリンと同じ細胞で機能するのか,また,DA8ニューロンにおいては何がプレキシンと相互作用しているのか,など,未解明の部分が多く残されている.さらに,線虫においてシナプスタイリングはDAニューロンだけでなく,ほかのタイプの運動ニューロンにも観察されており,今後の線虫におけるシナプスタイリングの解析は軸索間の相互作用の分子機構のみならず,運動を理解する足がかりともなると考えている.
略歴:2007年 神戸大学大学院自然科学研究科 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2008年より米国Stanford大学 研究員.
研究テーマ:シナプスパターンを決定する分子機構.
関心事:自然界にあるきれいなパターンが好きで,花器官の形態から線虫の非対称細胞分裂,そして,気づけば神経に手を出していました.いまは“真の驚きはforward geneticsから”を信条に,シナプスパターンの形成機構の理解をとおして動物(線虫)がどうやってスムーズに動いているのかについて,自分なりに答えをだせたらと思っています.
© 2013 水本 公大 Licensed under CC 表示 2.1 日本
(米国Stanford大学Department of Biology)
email:水本公大
DOI: 10.7875/first.author.2013.022
Interaxonal interaction defines tiled presynaptic innervation in C. elegans.
Kota Mizumoto, Kang Shen
Neuron, 77, 655-666 (2013)
要 約
ニューロンはとなりあうニューロンと細胞表層に局在するタンパク質を介して相互作用することにより,軸索や樹状突起の正確な投射パターンを形成している.一方で,これらのシグナルタンパク質や膜タンパク質がシナプスのパターン形成にどのように関与しているのかについて,その知見はかぎられている.今回,筆者らは,線虫の運動ニューロンにおいて観察される,となりあうニューロンに由来するシナプスが互いに重複しないよう配置される“シナプスタイリング”という現象に着目し,遺伝学的な解析から軸索のあいだの相互作用がこのシナプスタイリングに必須であり,軸索誘導タンパク質であるセマフォリンとその受容体であるプレキシンがこの相互作用を介在していることを見い出した.プレキシンは軸索間の相互作用に依存してシナプスタイリングの境界に局在し,その細胞質領域にあるGAPドメインに依存してシナプスの形成を抑制していることが示唆された.この研究により,軸索間の相互作用がシナプスのパターン形成に重要な機能をはたしていることが明らかになった.
はじめに
ニューロンはその標的となる細胞とシナプスとよばれる構造を形成することにより情報伝達を行っている.一方で,ニューロンは軸索を伸長する過程において標的ではない多くの細胞とも接触しており,それらは多くの場合,同一の機能をもち同じサブタイプに属する別のニューロンの軸索である.近年,軸索のあいだの相互作用が軸索伸長のパターンに重要であるという報告がなされているが1),解像度の問題もあり,シナプスのパターン形成における軸索間の相互作用の役割については未知である.筆者らは,線虫(Caenorhabditis elegans)の運動ニューロンのうち,後方への運動のときに背側体壁筋の収縮を制御するDAニューロンを実験モデルとして用いて,シナプスのパターン形成における軸索間の相互作用の役割とその分子機構の解明を試みた.線虫の運動ニューロンは軸索の末端ではなく軸索にそってシナプスを形成するため,軸索の誘導とシナプスのパターン形成とを独立の現象として観察することが可能で,シナプスのパターン形成に関与するタンパク質の解析が容易である.
DAニューロンは腹側に細胞体があり,そこから腹側神経管に樹状突起を,背側神経管に軸索を伸長し,軸索にそって背側体壁筋とシナプスを形成する(図1a).DAニューロンは全部で9つあり,DA1からDA7までは前後軸にそってほぼ均等に配置されているが,最後方に位置するDA8ニューロンとDA9ニューロンは細胞体の位置あるいは樹状突起や軸索の伸長パターンがほぼ同一である.興味深いことに,おのおののDAニューロンの軸索は背側神経管の広範囲にわたり重複しているにもかかわらず,背側体壁筋の特定の領域のみにシナプスを形成し,となりあうDAニューロンのシナプス形成領域とは重複あるいはギャップをつくらない.筆者らは,この現象を“シナプスタイリング”(synapse tiling)と名づけ,その分子機構の解明を行うことにした.体壁筋においてタイル状に配置されたシナプスは,線虫がサイン曲線をかきながら前後方向に運動する際に,体壁筋を前後軸にそって順番に収縮させるため必要であると思われる.
軸索や樹状突起がそれ自体,あるいは,となりあうニューロンと重複しないタイリング現象はショウジョウバエやそのほかの高等生物でも報告されており2),最近では,大脳皮質においてCajal-Retzius細胞が細胞間コミュニケーションに依存して均等に配置されることが報告されている3).これらのタイリング現象は,ニューロンがかぎられた細胞を用いて情報処理を効率的に行うための機構であると考えられている.線虫においてシナプスタイリングの現象それ自体は40年前に報告されているが4),おのおののニューロンに由来するシナプスを区別することは電子顕微鏡によらないと困難なため,解析はされていなかった.今回,筆者らは,生体においてDA8ニューロンとDA9ニューロンのシナプスを異なる蛍光タンパク質により可視化した系統を作製し,シナプスタイリングの遺伝学的な解析を行った.
1.軸索のあいだの相互作用がシナプスタイリングに必須である
DA8ニューロンのシナプスをGFPで,DA9ニューロンのシナプスをmCherryで標識した系統を作製し,以前の電子顕微鏡による観察結果のとおり,DA8ニューロンとDA9ニューロンのシナプス形成領域に重複やギャップのないことを確認した(図1b).DA8ニューロンとDA9ニューロンとのシナプスタイリングはこの2つのニューロンの活性やシナプスの標的となる細胞である筋肉細胞に依存しなかったことから,このシナプスタイリングはDA8ニューロンとDA9ニューロンとのあいだの軸索間の相互作用に依存しているのではないかと考え,その可能性を軸索誘導における変異体を用いて検討した.TGFβ様タンパク質をコードするunc-129遺伝子の変異体では,およそ50%の個体においてDA8ニューロンあるいはDA9ニューロンの軸索が背側神経管に到達するまえに体軸の前方へと伸長するため,DA8ニューロンとDA9ニューロンの軸索のあいだに物理的な接触のない状況になる.このとき,DA8ニューロンとDA9ニューロンのシナプス形成領域には前後軸にそって大きく重複がみられた.一方で,同じ変異体においても軸索誘導に異常がみられない個体ではシナプスタイリングは正常であった.このことは,シナプスタイリングの境界の決定にはDA8ニューロンとDA9ニューロンとの軸索間の相互作用が必須であることを示唆していた.
2.シナプスタイリングはセマフォリンおよびプレキシンにより決定される
シナプスタイリングにおける軸索間の相互作用を介在するタンパク質を同定するため,変異原であるエチルメタンスルホン酸(EMS)を用いた遺伝学的なスクリーニングを行った.その結果,哺乳類のプレキシンA4の線虫におけるホモログの変異体であるplx-1変異体を単離した.plx-1変異体においてDA8ニューロンとDA9ニューロンのシナプス形成領域には大きな重複がみられ,この重複領域ではこの2つのニューロンに由来するシナプスが混在していた(図1c).プレキシンのリガンドである細胞膜局在型セマフォリンの線虫における変異体であるsmp-1;smp-2変異体においても,plx-1変異体と同様にシナプスタイリングに異常が認められた.セマフォリンは高等生物における軸索誘導タンパク質であり,マウスやほかのモデル生物において,それらの変異体には軸索誘導に異常が観察される5).一方で,これまでの報告では,線虫においてセマフォリンあるいはプレキシンの変異体には軸索誘導に明確な異常は認められておらず,今回のシナプスタイリングの異常が線虫の神経系におけるはじめての表現型であった.近年,高等生物においてもセマフォリン-プレキシン経路はシナプスの形成を抑制することが報告されているが5),線虫における今回の発見は,セマフォリン-プレキシン経路の軸索誘導における機能は進化的にのちになり獲得されたことを示唆した.実際に,線虫においてはWnt経路やNetrin経路などの軸索誘導タンパク質における変異体の多くでシナプスパターンに異常のあることが報告されており6,7),これは多くの軸索誘導タンパク質に共通した進化なのかもしれない.
3.シナプスタイリングにおいてセマフォリンとプレキシンとは同じ細胞で機能する
セマフォリンとプレキシンがどの細胞で機能しているかを調べるため,組織に特異的なプロモーターを用いた遺伝子回復実験を行った.通常,細胞膜型のリガンドであるセマフォリンとその受容体であるプレキシンは別の細胞で発現してトランスに機能する.しかし驚いたことに,シナプスタイリングにおいてはセマフォリン遺伝子およびプレキシン遺伝子をDA9ニューロンにおいて発現させることにより,セマフォリンの変異体およびプレキシンの変異体の表現型を回復させることができた.さらに,モザイク実験により,セマフォリンおよびプレキシンはDA9ニューロンにおいて必要十分であることが明らかになった.この結果から,セマフォリンとプレキシンが同一の細胞において機能し,DA8ニューロンにおいて機能する未同定のタンパク質と相互作用することにより,DA8ニューロンとDA9ニューロンとの相互作用を介在していると考えられた(図2).しかし一方で,この結果はセマフォリンやプレキシンと冗長的にはたらくタンパク質がDA8ニューロンに存在する可能性を否定しておらず,DA9ニューロンにおいて機能するセマフォリンとプレキシンが,どのようにしてDA8ニューロンとDA9ニューロンとの相互作用を介在しているかについてはさらなる解析が必要である.
4.プレキシンはシナプスタイリングにおける境界に局在する
プレキシンのDA9ニューロンにおける機能を明らかにするため,PLX-1とGFPとの融合タンパク質をDA9ニューロンに特異的なプロモーターにより発現させその細胞内局在を観察したところ,DA9ニューロンのシナプス形成領域の前側の先端,すなわち,DA8ニューロンとDA9ニューロンとのシナプスタイリングの境界に局在していた(図3a).プレキシンはシナプスが軸索に形成されないキネシンの変異体においても正常に局在していた.また,セマフォリン変異体やDA8ニューロンとDA9ニューロンとの接触が失われる軸索誘導の変異体では,プレキシンは軸索に一様に局在していたことから(図3b),プレキシンの軸索における局在パターンがシナプスのパターン形成に重要であることが示唆された.
5.プレキシンはGAPドメインを介してシナプスパターンを決定する
プレキシンがDA9ニューロンにおいてシナプス形成領域の前側の境界に局在していたことから,プレキシンはシナプスタイリングの境界においてDA9ニューロンのシナプスの形成を抑制しているのではないかと考えた.プレキシンの細胞質領域には低分子量Gタンパク質に対するGAP(GTPase activating protein,GTPase活性化タンパク質)ドメインがあり,線虫のPLX-1にも高度に保存されたGAPドメインが存在する.GAP領域を含む細胞内領域を欠損させた変異型PLX-1や,哺乳類のプレキシンにおいてGAP活性に必須なアミノ酸残基に相当する部位に変異を導入した変異型PLX-1をDA9ニューロンに発現させても,plx-1変異体の表現型を回復することはできなかった.これらの変異型PLX-1は野生型と同じような局在パターンを示したが,シナプスのマーカーと相補的な局在パターンを示す野生型PLX-1とは異なり,GAP活性を失った変異型PLX-1はシナプスタイリングの境界の付近においてシナプスのマーカーとその局在が重複していた(図3c).これらのことから,PLX-1はDA9ニューロンのシナプス形成領域の前側に局在し,GAPドメインに依存的にシナプスの形成を抑制していると考えられた.GAPドメインは低分子量Gタンパク質の活性を抑制する機能をもつことから,plx-1変異体では低分子量Gタンパク質が高活性状態にあることが予想された.低分子量Gタンパク質のひとつRasの線虫におけるホモログ遺伝子let-60の恒常活性型変異体においてシナプスタイリングの異常が確認されたことから,実際に,plx-1変異体では低分子量Gタンパク質の活性化が起こっているものと推察された.
6.プレキシンはアクチン骨格を介してシナプスの形成を抑制している
プレキシンはアクチン細胞骨格を介して軸索誘導を制御していることが報告されている.また近年,筆者らの研究室では,シナプスの形成にアクチンの集積が必要であることを見い出している8).そこで,シナプスタイリングにおいてプレキシンはアクチン骨格を介してシナプスパターンを制御しているのではないかと考えた.線虫において線維状アクチンのマーカーのひとつであるUtrophin-CHはシナプス形成領域の線維状アクチンを強く認識する.このマーカーをDA9ニューロンにおいて観察したところシナプス形成領域に強く局在していた.また,plx-1変異体を含むすべてのシナプスタイリングの変異体において,アクチン骨格は軸索の前方へと伸長していた.このことから,プレキシンはシナプスタイリングの境界においてDA9ニューロンのアクチン骨格を抑制することによりシナプス形成領域を制限していると考えられた(図2).
おわりに
線虫はすべての細胞の運命が解明され,すべての神経の構造やシナプスパターンが電子顕微鏡レベルで解析されている唯一の生物である.さらに,線虫の運動(locomotion)は,サイン曲線をかきながら前に進むか後ろに下がるかの2つのパターンしかないが(米国North Carolina大学Chapel Hill校Goldstein研究室による動画を参照.URL:http://labs.bio.unc.edu/Goldstein/movies.html),それにもかかわらず,どのようにしてこの運動が達成されているのかについては明らかになっていない.習性(behaviour)レベルでの神経機能の解析はマウスをはじめ多くなされているが,運動に関しては関与している因子が多く,また,複雑な動きをする高等生物では解析は困難である.この研究では,線虫の運動において中核的な役割を担っていると考えられるシナプスタイリングに着目し,DA8ニューロンとDA9ニューロンとのシナプスタイリングをモデルとして軸索間の相互作用を制御するタンパク質としてプレキシンの同定に成功した.しかしながら,プレキシンがどのようにしてリガンドであるセマフォリンと同じ細胞で機能するのか,また,DA8ニューロンにおいては何がプレキシンと相互作用しているのか,など,未解明の部分が多く残されている.さらに,線虫においてシナプスタイリングはDAニューロンだけでなく,ほかのタイプの運動ニューロンにも観察されており,今後の線虫におけるシナプスタイリングの解析は軸索間の相互作用の分子機構のみならず,運動を理解する足がかりともなると考えている.
文 献
- Imai, T. & Sakano, H.: Axon-axon interactions in neuronal circuit assembly: lessons from olfactory map formation. Eur. J. Neurosci., 34, 1647-1654 (2011)[PubMed]
- Grueber, W. B. & Sagasti, A.: Self-avoidance and tiling: Mechanisms of dendrite and axon spacing. Cold Spring Harb. Perspect. Biol., 2, a001750 (2010)[PubMed]
- Villar-Cervino, V., Molano-Mazon, M., Catchpole, T. et al.: Contact repulsion controls the dispersion and final distribution of cajal-retzius cells. Neuron, 77, 457-471 (2013)[PubMed]
- White, J. G., Southgate, E., Thomson, J. N. et al.: The structure of the ventral nerve cord of Caenorhabditis elegans. Philos. Trans. R. Soc. Lond. B Biol. Sci., 275, 327-348 (1976)[PubMed]
- Tran, T. S., Kolodkin, A. L. & Bharadwaj, R.: Semaphorin regulation of cellular morphology. Annu. Rev. Cell Dev. Biol., 23, 263-292 (2007)[PubMed]
- Klassen, M. P. & Shen, K.: Wnt signaling positions neuromuscular connectivity by inhibiting synapse formation in C. elegans. Cell, 130, 704-716 (2007)[PubMed]
- Poon, V. Y., Klassen, M. P. & Shen, K.: UNC-6/netrin and its receptor UNC-5 locally exclude presynaptic components from dendrites. Nature, 455, 669-773 (2008)[PubMed]
- Chia, P. H., Patel, M. R. & Shen, K.: NAB-1 instructs synapse assembly by linking adhesion molecules and F-actin to active zone proteins. Nat. Neurosci., 15, 234-242 (2012)[PubMed]
著者プロフィール
略歴:2007年 神戸大学大学院自然科学研究科 修了,同年 理化学研究所発生・再生科学総合研究センター 研究員を経て,2008年より米国Stanford大学 研究員.
研究テーマ:シナプスパターンを決定する分子機構.
関心事:自然界にあるきれいなパターンが好きで,花器官の形態から線虫の非対称細胞分裂,そして,気づけば神経に手を出していました.いまは“真の驚きはforward geneticsから”を信条に,シナプスパターンの形成機構の理解をとおして動物(線虫)がどうやってスムーズに動いているのかについて,自分なりに答えをだせたらと思っています.
© 2013 水本 公大 Licensed under CC 表示 2.1 日本