Wnt阻害タンパク質sFRP3は成体の海馬におけるニューロンの新生を神経活動に依存して制御している
北畠康司・Hongjun Song
(米国Johns Hopkins大学School of Medicine,Department of Neurology)
email:北畠康司
DOI: 10.7875/first.author.2013.021
Secreted frizzled-related protein 3 regulates activity-dependent adult hippocampal neurogenesis.
Mi-Hyeon Jang, Michael A. Bonaguidi, Yasuji Kitabatake, Jiaqi Sun, Juan Song, Eunchai Kang, Heechul Jun, Chun Zhong, Yijing Su, Junjie U. Guo, Marie Xun Wang, Kurt A. Sailor, Ju-Young Kim, Yuan Gao, Kimberly M. Christian, Guo-li Ming, Hongjun Song
Cell Stem Cell, 12, 215-223 (2013)
成体の海馬の歯状回においては新しいニューロンが生まれつづけ,脳の機能にさまざまな影響をあたえている.このニューロンの新生は周囲の神経回路からさまざまな刺激をうけることにより制御されているが,その分子機構はよくわかっていない.筆者らは,分泌性のWnt阻害タンパク質のひとつであるsFRP3は成体の海馬において強く発現し,ニューロンの新生を制御する重要なタンパク質であることを見い出した.sFRP3を欠損させることにより,海馬において静止期にある放射状グリア細胞が活性化されたとともに,新生したニューロンの成熟,樹状突起の伸長,シナプス棘突起の形成などが促進された.さらに注目すべきことに,神経活動によりひき起こされるニューロンの新生の活性化にはsFRP3の発現量の低下が必須であった.これらの結果は,sFRP3が海馬の歯状回におけるニューロンの新生を抑制的に制御しつつ,神経回路の活動性を伝達する重要なタンパク質であることを示しており,今後,その生理的な意義や病態との関連が注目される.
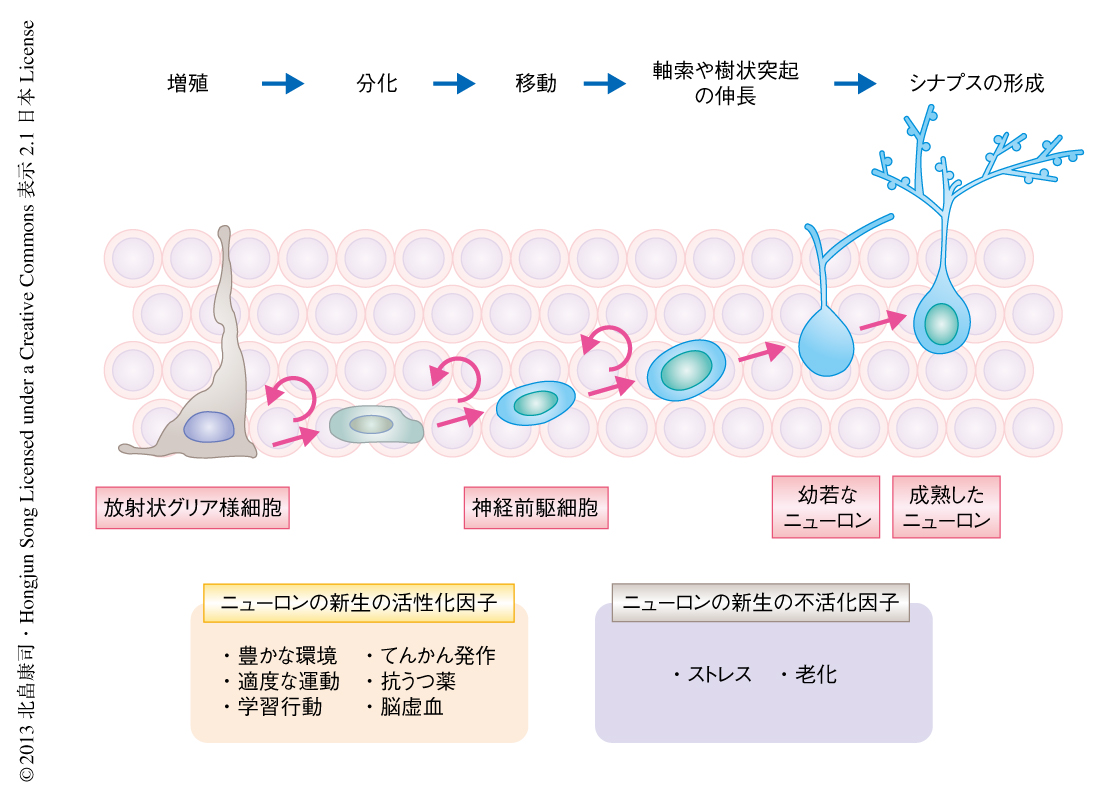
海馬の歯状回には神経幹細胞が存在し,成体においてもニューロンがつくられつづけている1).このニューロンの新生によりつねに新たな顆粒細胞がくわえられ,周囲の細胞と新たなシナプスが形成されることにより既存の神経回路の再構築が行われている(図1).また,刺激に反応しやすい幼若なニューロンの集団がつねにプールされることになり,生理的あるいは病的な刺激に対する反応性が変化する2).たとえば,海馬においてニューロンの新生を活性化させたマウスでは学習行動や記憶行動の上昇がみられ,逆に,これが抑制された状態のマウスでは抗うつ薬の投与による作用がみられなくなると報告されている3).
一方,このニューロンの新生がほかの組織における細胞の増殖と大きく異なる点は,周囲の環境(ニッチ)からさまざまなシグナルをうけダイナミックに制御されている点である.豊かな環境をあたえるあるいは適度な運動をさせるという生理的な刺激,あるいは,ストレスやてんかん発作などの病的な刺激がくわえられることにより,成体の海馬におけるニューロンの新生は大きく変化する.しかしながら,この周囲の神経回路からの刺激によりニューロンの新生が制御をうける詳細な分子機構についてはよくわかっていない.
Wnt経路は海馬においてニューロンの新生を制御する重要なシグナル伝達経路である4).筆者らは,成体におけるニューロンの新生への神経活動に依存した制御を担う重要なタンパク質として,分泌性のWnt阻害タンパク質のひとつであるsFRP3に注目した.そして,放射状グリア様細胞の静止状態からの活性化,ニューロンあるいはグリア細胞への分化,神経前駆細胞の増殖,ニューロンへの成熟,の各ステップにおいて,sFRP3のはたす役割について詳細に検討した.
海馬におけるニューロンの新生は神経回路の活動により制御をうけている.その分子機構と制御因子を調べるマウスモデルとして電気痙攣刺激を用いた.この電気痙攣刺激モデルでは,海馬の神経回路が電気的に活性化されることによりニューロンの新生が促進されることが報告されている5).電気痙攣刺激をあたえたマウスおよびあたえていないマウスの脳から海馬の歯状回を取り出し遺伝子発現解析を行ったところ,分泌性のWnt阻害タンパク質であるsFRP3が高いレベルで発現しており,かつ,電気痙攣刺激により強い発現抑制の起こることがわかった.電気痙攣刺激の1日後にはsFRP3の発現量は通常の約50%まで低下し,7日間かけて徐々にもとの値にまで回復した.ほかのWnt阻害タンパク質,すなわち,sFRP3を除くsFRP1~sFRP5,Dkk1~Dkk4,Wif1,Cer1などに関しては,Dkk3を除き,もとより歯状回に高い発現はみられず,また,Dkk3には電気痙攣刺激による発現量の変化は認められなかったことから,sFRP3に特異的な反応であることがわかった.また,歯状回における発現パターンを調べたところ,sFRP3は成熟した細胞により構成される顆粒細胞層に限局しており,神経幹細胞および幼若顆粒細胞が位置する顆粒細胞下層には認められなかった.すなわち,sFRP3の分泌は神経幹細胞あるいは新生したニューロンそれら自体による自律的な作用ではなく,これらをとりかこむ既存の顆粒細胞により行われていた.
Wnt経路は成体においてニューロンの新生を促進する重要なシグナル伝達経路である.すなわち,歯状回において新生したニューロンの周囲の成熟顆粒細胞は,活動性を上昇させるような刺激がくわわるとsFRP3の分泌を低下させ,Wnt経路の脱抑制作用を介しニューロンの新生を活性化しているのではないだろうか.この仮説を検証するため,sFRP3ノックアウトマウスを用いた解析を行った.sFRP3ノックアウトマウスは,発生の過程も含め,野生型マウスと比較して明らかな表現型の異常を呈さなかった.しかしながら,海馬におけるニューロンの新生をBrdU標識およびMCM2陽性細胞の計数により調べたところ,顆粒細胞下層における神経前駆細胞の増殖は野生型マウスに比較して有意に増加していることがわかった.また,sFRP3の欠損による神経前駆細胞の増殖の亢進は,長期的には成熟したニューロンの増加につながっていることも判明した.
成体の海馬の歯状回にはネスチン陽性かつグリア線維性酸性タンパク質陽性の放射状グリア細胞様の神経幹細胞が存在しており,非対称分裂により自己複製するとともに分化した神経前駆細胞を生み出している6).では,sFRP3の欠損は神経前駆細胞そのものに作用しその増殖を亢進させているのか,それとも,この放射状グリア様細胞を静止状態から活性化状態へと変化させ新たな神経前駆細胞への分化を促しているのか.タモキシフェンの投与により静止期にある放射状グリア様細胞をGFP標識しそののちの挙動をおうことのできるトランスジェニックマウス7) とsFRP3ノックアウトマウスとを掛け合わせ,sFRP3が放射状グリア様細胞にあたえる影響を調べたところ,sFRP3ノックアウトマウスの海馬の歯状回においては静止状態にある放射状グリア様細胞の数が減少し,代わりに,神経前駆細胞およびアストログリア細胞の数が増加していた.しかし,増加にかかわらずニューロンとグリア細胞との比率は変化しておらず,このことから,sFRP3は放射状グリア様細胞の静止状態と活性化状態との制御を行っているが,グリア細胞およびニューロンへの運命決定にはかかわっていないことがわかった.
新たに生まれた神経前駆細胞は成熟の過程をへるにしたがい,幼若なニューロンのマーカーであるDCXと成熟したニューロンのマーカーであるNeuNの発現パターンが変化していく.これらのマーカーを用いてsFRP3ノックアウトマウスにおけるニューロンの成熟の過程を調べたところ,幼若なニューロンの割合が減少し,成熟したニューロンの割合が増加していた.すなわち,sFRP3の欠損により,新生したニューロンの成熟が促進されることがわかった.さらに,樹状突起の長さと枝分かれの数,棘突起の数についても有意に増加しており,sFRP3はこれら樹状突起の成熟にも関与していることがわかった.また,sFRP3による抑制は細胞に自律的な作用ではないことも明らかになった.
ニューロンの新生の制御につながるsFRP3の発現の変化をひき起こすのは電気痙攣刺激にとどまらず,マウスに適度な運動を継続的に行わせることによりsFRP3の発現は徐々に低下し,また,ピロカルピンの投与による痙攣重積モデルマウスではsFRP3の発現量は急速に減少したのちより長期間にわたり抑制をうけた.このように,sFRP3の発現レベルは神経回路におけるさまざまな生理的あるいは病的な活性化により制御をうけていることがわかった.一方で,これまで述べてきたように,sFRP3は海馬におけるニューロンの新生において重要な制御タンパク質である.では,神経活動に依存したニューロンの新生の制御に重要なのは,sFRP3の“絶対的な発現レベル”だろうか.それとも,“発現量の変化”だろうか.
野生型マウスに電気痙攣刺激をあたえると,海馬において新生したニューロンの数は約1.7倍に増加した.sFRP3ノックアウトマウスではさきに述べたようにニューロンの新生は亢進していたが(野生型の約1.3倍),電気痙攣刺激をあたえてもその促進作用は約1.2倍にとどまった.しかも,新生したニューロンの数は,同じく電気痙攣刺激をあたえた野生型マウスよりむしろ少なかった.同様の結果は適度な運動を行わせたマウスにおいてもみられ,sFRP3ノックアウトマウスでは運動刺激によるニューロンの新生の効果は野生型マウスと比較して明らかに弱かった.また,樹状突起の伸長効果も認められなかった.逆に,組換えsFRP3を浸透圧ポンプにより歯状回へ注入しつづけたマウスでは,電気痙攣刺激によるニューロンの新生の促進作用はほぼ消失してしまった.これらの結果より,神経活動の活性化による海馬におけるニューロンの新生の制御においては,sFRP3の発現量の変化が重要であることがわかった.
成体の脳におけるニューロンの新生が発見されて以降,生物活動におけるその意義と重要性について多くの報告がなされている.しかしながら,神経回路における刺激をニューロンの新生へとつなぐタンパク質とその制御機構についてはよくわかっていなかった.
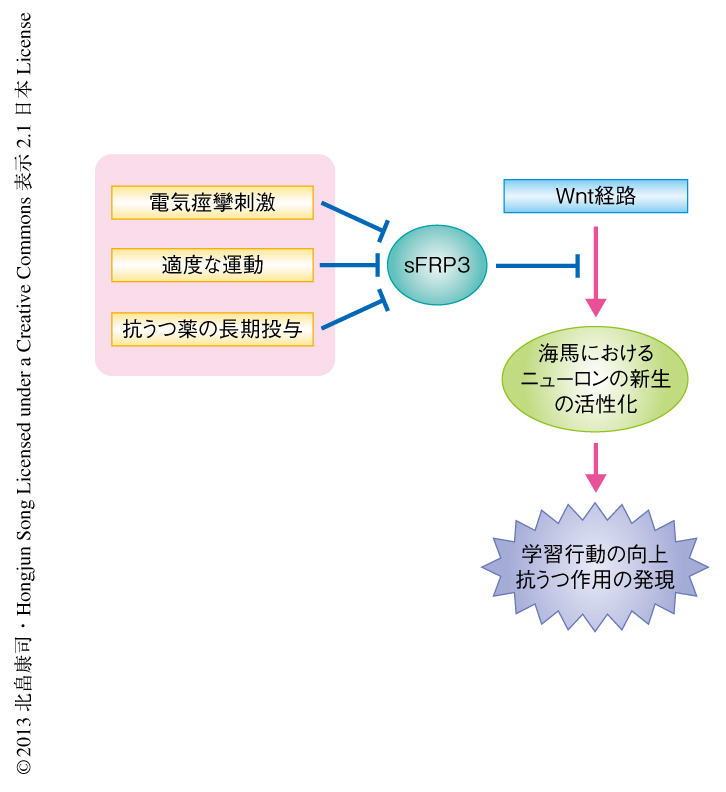
sFRP3は成体においてニューロンの新生を制御するためのセンサーでありエフェクターでもあった.筆者らは,この研究において,sFRP3の発現が神経活動に依存して厳密に制御され,種々の生理的あるいは病的なシグナルがその発現制御をとおしてニューロンの新生を制御していることを明らかにすることができた(図2).また一方で,sFRP3と抗うつ薬との相互作用についても注目し,抗うつ薬の長期にわたる投与が海馬においてsFRP3の発現量の低下をひき起こすことも同時に発見し報告した8).抗うつ薬は長期投与することによりsFRP3の発現の減少を介して海馬におけるニューロンの新生を活性化することで,その作用を発現するのではないだろうか.これらの結果は,sFRP3が抗うつ薬をはじめとしたさまざまな生理的あるいは病的なシグナルの作用点として重要な役割をはたしていることを示唆しており,高次脳機能の制御機構の解明および疾患の治療法の開発につながるものと考えられる.
略歴:2004年 京都大学大学院医学研究科博士課程 修了,同年 米国Johns Hopkins大学School of Medicine研究員,2008年より大阪大学医学系研究科 医員を経て,2009年より同 特任助教(現 助教).2010年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:遺伝子や染色体の異常が細胞にひき起こす病態機構.
関心事:実際の臨床での病態を高いレベルにおいて基礎研究と結びつけることをめざして研究を行っています.とくに,小児疾患における神経発達,血液異常,成長障害を個体および細胞の成長および発達の過程における異常としてとらえ,その病態機構の解明に取り組んでいます.
Hongjun Song
米国Johns Hopkins大学School of MedicineにてProfessor.
研究室URL:http://neuroscience.jhu.edu/HongjunSong.php
© 2013 北畠康司・Hongjun Song Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学School of Medicine,Department of Neurology)
email:北畠康司
DOI: 10.7875/first.author.2013.021
Secreted frizzled-related protein 3 regulates activity-dependent adult hippocampal neurogenesis.
Mi-Hyeon Jang, Michael A. Bonaguidi, Yasuji Kitabatake, Jiaqi Sun, Juan Song, Eunchai Kang, Heechul Jun, Chun Zhong, Yijing Su, Junjie U. Guo, Marie Xun Wang, Kurt A. Sailor, Ju-Young Kim, Yuan Gao, Kimberly M. Christian, Guo-li Ming, Hongjun Song
Cell Stem Cell, 12, 215-223 (2013)
要 約
成体の海馬の歯状回においては新しいニューロンが生まれつづけ,脳の機能にさまざまな影響をあたえている.このニューロンの新生は周囲の神経回路からさまざまな刺激をうけることにより制御されているが,その分子機構はよくわかっていない.筆者らは,分泌性のWnt阻害タンパク質のひとつであるsFRP3は成体の海馬において強く発現し,ニューロンの新生を制御する重要なタンパク質であることを見い出した.sFRP3を欠損させることにより,海馬において静止期にある放射状グリア細胞が活性化されたとともに,新生したニューロンの成熟,樹状突起の伸長,シナプス棘突起の形成などが促進された.さらに注目すべきことに,神経活動によりひき起こされるニューロンの新生の活性化にはsFRP3の発現量の低下が必須であった.これらの結果は,sFRP3が海馬の歯状回におけるニューロンの新生を抑制的に制御しつつ,神経回路の活動性を伝達する重要なタンパク質であることを示しており,今後,その生理的な意義や病態との関連が注目される.
はじめに
海馬の歯状回には神経幹細胞が存在し,成体においてもニューロンがつくられつづけている1).このニューロンの新生によりつねに新たな顆粒細胞がくわえられ,周囲の細胞と新たなシナプスが形成されることにより既存の神経回路の再構築が行われている(図1).また,刺激に反応しやすい幼若なニューロンの集団がつねにプールされることになり,生理的あるいは病的な刺激に対する反応性が変化する2).たとえば,海馬においてニューロンの新生を活性化させたマウスでは学習行動や記憶行動の上昇がみられ,逆に,これが抑制された状態のマウスでは抗うつ薬の投与による作用がみられなくなると報告されている3).
一方,このニューロンの新生がほかの組織における細胞の増殖と大きく異なる点は,周囲の環境(ニッチ)からさまざまなシグナルをうけダイナミックに制御されている点である.豊かな環境をあたえるあるいは適度な運動をさせるという生理的な刺激,あるいは,ストレスやてんかん発作などの病的な刺激がくわえられることにより,成体の海馬におけるニューロンの新生は大きく変化する.しかしながら,この周囲の神経回路からの刺激によりニューロンの新生が制御をうける詳細な分子機構についてはよくわかっていない.
Wnt経路は海馬においてニューロンの新生を制御する重要なシグナル伝達経路である4).筆者らは,成体におけるニューロンの新生への神経活動に依存した制御を担う重要なタンパク質として,分泌性のWnt阻害タンパク質のひとつであるsFRP3に注目した.そして,放射状グリア様細胞の静止状態からの活性化,ニューロンあるいはグリア細胞への分化,神経前駆細胞の増殖,ニューロンへの成熟,の各ステップにおいて,sFRP3のはたす役割について詳細に検討した.
1.sFRP3は歯状回において神経前駆細胞の増殖とニューロンの新生を抑制している
海馬におけるニューロンの新生は神経回路の活動により制御をうけている.その分子機構と制御因子を調べるマウスモデルとして電気痙攣刺激を用いた.この電気痙攣刺激モデルでは,海馬の神経回路が電気的に活性化されることによりニューロンの新生が促進されることが報告されている5).電気痙攣刺激をあたえたマウスおよびあたえていないマウスの脳から海馬の歯状回を取り出し遺伝子発現解析を行ったところ,分泌性のWnt阻害タンパク質であるsFRP3が高いレベルで発現しており,かつ,電気痙攣刺激により強い発現抑制の起こることがわかった.電気痙攣刺激の1日後にはsFRP3の発現量は通常の約50%まで低下し,7日間かけて徐々にもとの値にまで回復した.ほかのWnt阻害タンパク質,すなわち,sFRP3を除くsFRP1~sFRP5,Dkk1~Dkk4,Wif1,Cer1などに関しては,Dkk3を除き,もとより歯状回に高い発現はみられず,また,Dkk3には電気痙攣刺激による発現量の変化は認められなかったことから,sFRP3に特異的な反応であることがわかった.また,歯状回における発現パターンを調べたところ,sFRP3は成熟した細胞により構成される顆粒細胞層に限局しており,神経幹細胞および幼若顆粒細胞が位置する顆粒細胞下層には認められなかった.すなわち,sFRP3の分泌は神経幹細胞あるいは新生したニューロンそれら自体による自律的な作用ではなく,これらをとりかこむ既存の顆粒細胞により行われていた.
Wnt経路は成体においてニューロンの新生を促進する重要なシグナル伝達経路である.すなわち,歯状回において新生したニューロンの周囲の成熟顆粒細胞は,活動性を上昇させるような刺激がくわわるとsFRP3の分泌を低下させ,Wnt経路の脱抑制作用を介しニューロンの新生を活性化しているのではないだろうか.この仮説を検証するため,sFRP3ノックアウトマウスを用いた解析を行った.sFRP3ノックアウトマウスは,発生の過程も含め,野生型マウスと比較して明らかな表現型の異常を呈さなかった.しかしながら,海馬におけるニューロンの新生をBrdU標識およびMCM2陽性細胞の計数により調べたところ,顆粒細胞下層における神経前駆細胞の増殖は野生型マウスに比較して有意に増加していることがわかった.また,sFRP3の欠損による神経前駆細胞の増殖の亢進は,長期的には成熟したニューロンの増加につながっていることも判明した.
2.sFRP3は歯状回において放射状グリア様細胞の静止期からの活性化を制御している
成体の海馬の歯状回にはネスチン陽性かつグリア線維性酸性タンパク質陽性の放射状グリア細胞様の神経幹細胞が存在しており,非対称分裂により自己複製するとともに分化した神経前駆細胞を生み出している6).では,sFRP3の欠損は神経前駆細胞そのものに作用しその増殖を亢進させているのか,それとも,この放射状グリア様細胞を静止状態から活性化状態へと変化させ新たな神経前駆細胞への分化を促しているのか.タモキシフェンの投与により静止期にある放射状グリア様細胞をGFP標識しそののちの挙動をおうことのできるトランスジェニックマウス7) とsFRP3ノックアウトマウスとを掛け合わせ,sFRP3が放射状グリア様細胞にあたえる影響を調べたところ,sFRP3ノックアウトマウスの海馬の歯状回においては静止状態にある放射状グリア様細胞の数が減少し,代わりに,神経前駆細胞およびアストログリア細胞の数が増加していた.しかし,増加にかかわらずニューロンとグリア細胞との比率は変化しておらず,このことから,sFRP3は放射状グリア様細胞の静止状態と活性化状態との制御を行っているが,グリア細胞およびニューロンへの運命決定にはかかわっていないことがわかった.
3.sFRP3は新生したニューロンの成熟を抑制している
新たに生まれた神経前駆細胞は成熟の過程をへるにしたがい,幼若なニューロンのマーカーであるDCXと成熟したニューロンのマーカーであるNeuNの発現パターンが変化していく.これらのマーカーを用いてsFRP3ノックアウトマウスにおけるニューロンの成熟の過程を調べたところ,幼若なニューロンの割合が減少し,成熟したニューロンの割合が増加していた.すなわち,sFRP3の欠損により,新生したニューロンの成熟が促進されることがわかった.さらに,樹状突起の長さと枝分かれの数,棘突起の数についても有意に増加しており,sFRP3はこれら樹状突起の成熟にも関与していることがわかった.また,sFRP3による抑制は細胞に自律的な作用ではないことも明らかになった.
4.ニューロンの新生における神経活動に依存した制御にはsFRP3の発現量の変化が必要である
ニューロンの新生の制御につながるsFRP3の発現の変化をひき起こすのは電気痙攣刺激にとどまらず,マウスに適度な運動を継続的に行わせることによりsFRP3の発現は徐々に低下し,また,ピロカルピンの投与による痙攣重積モデルマウスではsFRP3の発現量は急速に減少したのちより長期間にわたり抑制をうけた.このように,sFRP3の発現レベルは神経回路におけるさまざまな生理的あるいは病的な活性化により制御をうけていることがわかった.一方で,これまで述べてきたように,sFRP3は海馬におけるニューロンの新生において重要な制御タンパク質である.では,神経活動に依存したニューロンの新生の制御に重要なのは,sFRP3の“絶対的な発現レベル”だろうか.それとも,“発現量の変化”だろうか.
野生型マウスに電気痙攣刺激をあたえると,海馬において新生したニューロンの数は約1.7倍に増加した.sFRP3ノックアウトマウスではさきに述べたようにニューロンの新生は亢進していたが(野生型の約1.3倍),電気痙攣刺激をあたえてもその促進作用は約1.2倍にとどまった.しかも,新生したニューロンの数は,同じく電気痙攣刺激をあたえた野生型マウスよりむしろ少なかった.同様の結果は適度な運動を行わせたマウスにおいてもみられ,sFRP3ノックアウトマウスでは運動刺激によるニューロンの新生の効果は野生型マウスと比較して明らかに弱かった.また,樹状突起の伸長効果も認められなかった.逆に,組換えsFRP3を浸透圧ポンプにより歯状回へ注入しつづけたマウスでは,電気痙攣刺激によるニューロンの新生の促進作用はほぼ消失してしまった.これらの結果より,神経活動の活性化による海馬におけるニューロンの新生の制御においては,sFRP3の発現量の変化が重要であることがわかった.
おわりに
成体の脳におけるニューロンの新生が発見されて以降,生物活動におけるその意義と重要性について多くの報告がなされている.しかしながら,神経回路における刺激をニューロンの新生へとつなぐタンパク質とその制御機構についてはよくわかっていなかった.
sFRP3は成体においてニューロンの新生を制御するためのセンサーでありエフェクターでもあった.筆者らは,この研究において,sFRP3の発現が神経活動に依存して厳密に制御され,種々の生理的あるいは病的なシグナルがその発現制御をとおしてニューロンの新生を制御していることを明らかにすることができた(図2).また一方で,sFRP3と抗うつ薬との相互作用についても注目し,抗うつ薬の長期にわたる投与が海馬においてsFRP3の発現量の低下をひき起こすことも同時に発見し報告した8).抗うつ薬は長期投与することによりsFRP3の発現の減少を介して海馬におけるニューロンの新生を活性化することで,その作用を発現するのではないだろうか.これらの結果は,sFRP3が抗うつ薬をはじめとしたさまざまな生理的あるいは病的なシグナルの作用点として重要な役割をはたしていることを示唆しており,高次脳機能の制御機構の解明および疾患の治療法の開発につながるものと考えられる.
文 献
- Ming, G. L. & Song, H.: Adult neurogenesis in the mammalian brain: significant answers and significant questions. Neuron, 70, 687-702 (2011)[PubMed]
- Kitabatake, Y., Sailor, K. A., Ming, G. L. et al.: Adult neurogenesis and hippocampal memory function: new cells, more plasticity, new memories? Neurosurg. Clin. N. Am., 18, 105-113 (2007)[PubMed]
- Sahay, A. & Hen, R.: Adult hippocampal neurogenesis in depression. Nat. Neurosci., 10, 1110-1115 (2007)[PubMed]
- Lie, D. C., Colamarino, S. A., Song, H. J. et al.: Wnt signalling regulates adult hippocampal neurogenesis. Nature, 437, 1370-1375 (2005)[PubMed]
- Madsen, T. M., Treschow, A., Bengzon, J. et al.: Increased neurogenesis in a model of electroconvulsive therapy. Biol. Psychiatry, 47, 1043-1049 (2000)[PubMed]
- Song, J., Zhong, C., Bonaguidi, M. A. et al.: Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision. Nature, 489, 150-154 (2012)[PubMed]
- Bonaguidi, M. A., Wheeler, M. A., Shapiro, J. S. et al.: In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell, 145, 1142-1155 (2011)[PubMed]
- Jang, M. H., Kitabatake, Y., Kang, E. et al.: Secreted frizzled-related protein 3 (sFRP3) regulates antidepressant responses in mice and humans. Mol. psychiatry, 18, 957-958 (2013)[PubMed]
著者プロフィール
略歴:2004年 京都大学大学院医学研究科博士課程 修了,同年 米国Johns Hopkins大学School of Medicine研究員,2008年より大阪大学医学系研究科 医員を経て,2009年より同 特任助教(現 助教).2010年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:遺伝子や染色体の異常が細胞にひき起こす病態機構.
関心事:実際の臨床での病態を高いレベルにおいて基礎研究と結びつけることをめざして研究を行っています.とくに,小児疾患における神経発達,血液異常,成長障害を個体および細胞の成長および発達の過程における異常としてとらえ,その病態機構の解明に取り組んでいます.
Hongjun Song
米国Johns Hopkins大学School of MedicineにてProfessor.
研究室URL:http://neuroscience.jhu.edu/HongjunSong.php
© 2013 北畠康司・Hongjun Song Licensed under CC 表示 2.1 日本