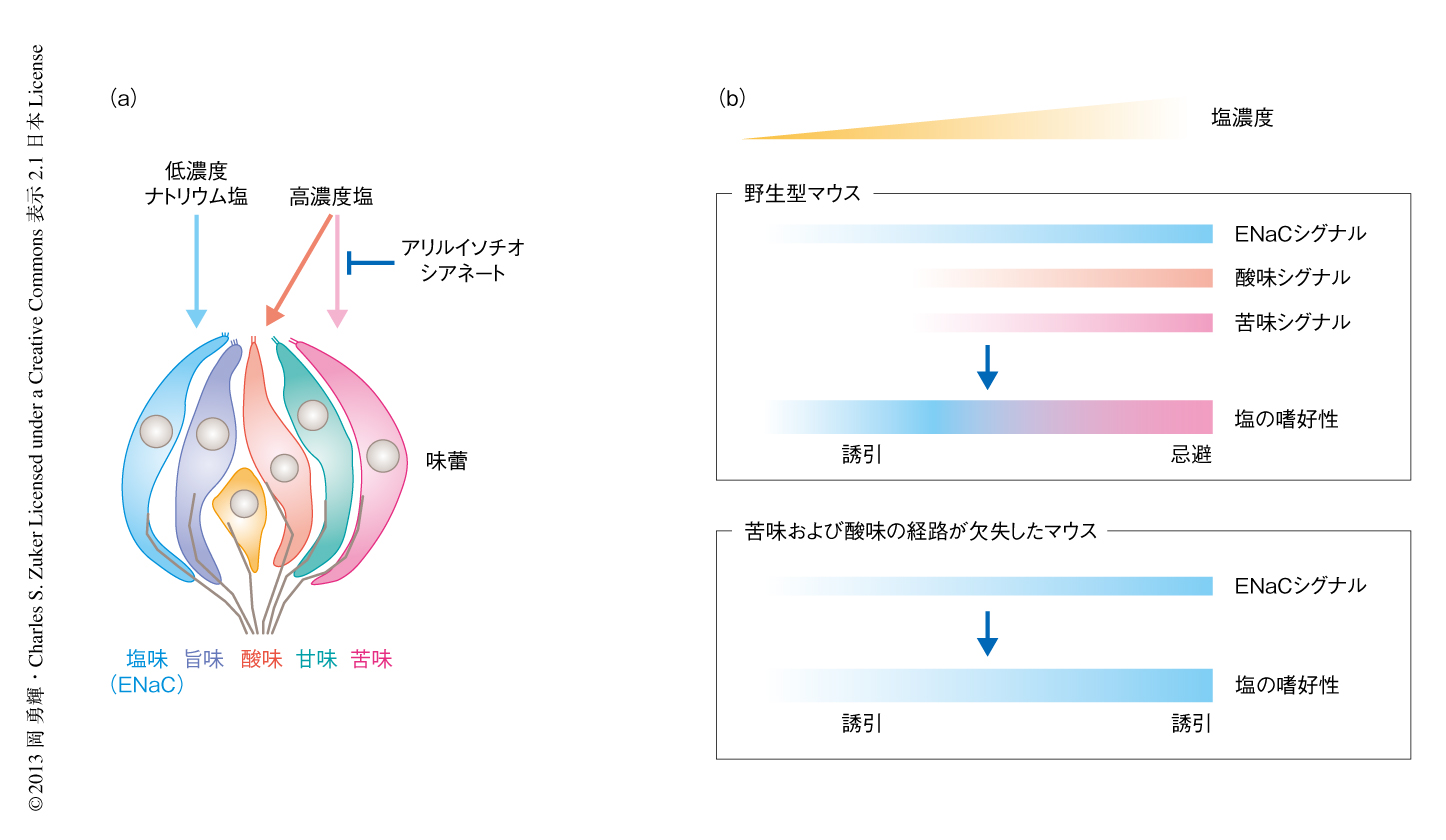
哺乳類の舌において高濃度の塩は苦味と酸味の2つの味覚経路により受容される
岡 勇輝・Charles S. Zuker
(米国Columbia大学Department of Biochemistry and Molecular Biophysics)
email:岡 勇輝
DOI: 10.7875/first.author.2013.023
High salt recruits aversive taste pathways.
Yuki Oka, Matthew Butnaru, Lars von Buchholtz, Nicholas J. P. Ryba, Charles S. Zuker
Nature, 494, 472-475 (2013)
すべての生物にとり塩は必須の栄養素であるが,過剰な摂取は逆に健康に有害となりうる.そのため,哺乳類の味覚は,低濃度の塩をよい味,また,高濃度の塩を不快な悪い味として脳に伝達することにより塩の摂取を調節している.しかし,これまで塩味の受容機構の全貌は明らかになっておらず,味覚において塩の摂取を制御する機構についても不明であった.この論文において,筆者らは,高濃度の塩はマウスの味蕾において苦味を受容する味細胞および酸味を受容する味細胞を刺激することを明らかにした.苦味および酸味の味覚経路を欠失したマウスにおいては,野生型マウスにおいて観察される高濃度の塩に対する味神経の応答および忌避行動が消失した.また,苦味および酸味の味覚経路を欠失したマウスは塩味に対し“よい味”の経路のみをもつため,野生型マウスが嫌悪を示すような高濃度のナトリウム塩に対しても高い嗜好性を示し,塩の異常な摂取行動がみられた.この研究の成果は,哺乳類の塩味受容機構を明らかにしたと同時に,われわれの感じる塩味を制御することにより,そのおいしさを変えずに心臓病や高血圧の一因となる塩の過剰な摂取を予防する方法の開発につながると期待される.
五感のひとつである味覚はわれわれにとり食べ物を楽しむ感覚であるが,もともとは食物にエネルギーやミネラルが含まれているか,また,有害な物質が含まれていないかを体内に入るまえに判断するためのセンサーである.ヒトをはじめとする多くの哺乳類は5種類の基本味,甘味,旨味,苦味,酸味,塩味をもつ.これまで,筆者らの研究室では,これらのうち塩味を除く4種類の基本味を受容する味細胞,また,それらに対する受容体の同定を行ってきた1,2).しかし,最後に残った塩味については,その受容機構の全貌は未解明であった.その大きな理由のひとつは,塩味がほかの基本味に比べ特殊であるからにほかならない.たとえば,甘味と旨味はそれぞれ糖類とアミノ酸の味であり,それらの摂取は動物にとり有益であるためつねにおいしい味と感じる.逆に,苦味と酸味は毒物や腐敗物など有害物質を知らせる味であり,その多寡にかかわらず動物に不快で嫌な味をひき起こす.しかし,塩味はその濃度によりこれら両方の性質を現わす.すなわち,低濃度の塩はおいしく感じる一方,同じ塩でも高濃度になると塩辛すぎてまずく感じるのである.これは,われわれが塩気のある食物を好むが,海水のような濃度の高い塩はまずく感じることからも理解できる.このため,塩味には複数の受容経路,すなわち,誘引経路(よい味)と忌避経路(悪い味)が存在すると考えられてきた.
近年,筆者らは,上皮性ナトリウムチャネル(ENaC:epithelial sodium channel)の主要なサブユニットENaCαを欠損したマウスでは,低濃度の塩に対する味神経の応答および誘引行動が消失することを示し,誘引性の“よい”塩味の受容は上皮性ナトリウムチャネルを発現する味細胞が担っていることを明らかにした3).しかし,これらのマウスにおいて高濃度の塩に対する忌避行動はまったく損なわれておらず,“悪い”味をひき起こす塩味の受容機構は未解明のままであった.
マウスにおいて電気生理学的な手法を用いて味神経の応答を測定すると,2種類の塩味に対する応答はその生理学的な性質により明確に区別することができる.上皮性ナトリウムチャネルに依存性のよい塩味に対する味神経の応答(低濃度塩応答)はナトリウム塩に特異的であり,3 mM程度の低い濃度からその応答が観察される.一方,上皮性ナトリウムチャネルに非依存性の忌避性の塩味応答(高濃度塩応答)は150 mM以上で顕著に観察され,ナトリウム塩やカリウム塩など多種の塩に非特異的な応答を示す4,5).もっとも重要な性質は,低濃度塩応答は上皮性ナトリウムチャネルの阻害剤であるアミロライドの存在下で完全に抑制される点である6,7).この阻害剤は長年にわたり低濃度塩と高濃度塩の味応答を区別する目的で利用され,低濃度塩の受容機構の解明に寄与してきた.そこで今度は,アミロライドに代わる,高濃度塩応答を抑制する阻害剤の探索を試みた.高濃度塩に対する味神経の応答を指標としてさまざまな物質をスクリーニングした結果,マスタードオイルの辛味成分であるアリルイソチオシアネートで舌を処理することにより,上皮性ナトリウムチャネル経路を介する低濃度塩応答にはまったく影響をあたえず,高濃度塩応答だけを有意に低下することを見い出した.しかし,アリルイソチオシアネートは濃度にかかわらず高濃度塩応答を最大で約50%のみ阻害し,アリルイソチオシアネートに非感受性の残存する高濃度塩応答がつねに観察された.これらの結果は,これまで1つの経路により受容されると考えられていた高濃度塩は,じつは,薬理学的な性質の異なる,アリルイソチオシアネートに感受性および非感受性の2つの経路を活性化することを示唆した.
興味深いことに,アリルイソチオシアネート処理は塩味応答の半分にくわえ,苦味応答を完全に抑制した.アリルイソチオシアネートが高濃度塩と苦味の両方の応答を阻害したことから,これらが味蕾において同一の味細胞(苦味細胞)により受容されている可能性が考えられた.そこで,苦味,甘味,旨味の受容に必須なタンパク質であるTRPM5チャネルおよびPLCb2を欠損したマウス8) を用いて味神経の応答を測定したところ,予想どおり,高濃度塩応答は野生型マウスに比べ有意に低下しており,また,残った応答はアリルイソチオシアネートに非感受性であった.さらに,PLCb2ノックアウトマウスの苦味細胞にのみPLCb2を発現させ機能を復元させると,高濃度塩応答とアリルイソチオシアネート感受性の両方が回復した.これらの結果より,アリルイソチオシアネート感受性の高濃度塩応答は苦味細胞により受容されていることが明らかになった.また,Ca2+イメージング法を用いて単一細胞レベルで味蕾における味応答を可視化したところ,GFPにより標識された苦味受容体を発現した味細胞は,確かに苦味物質と高濃度塩の両方により活性化されることが明らかになった.これら一連の結果より,苦味細胞が忌避性の高濃度塩の受容の一端を担っていることが示された.
残る高濃度塩の受容経路を明らかにするため,アリルイソチオシアネート非感受性の塩応答細胞の同定を試みた.TRPM5チャネルやPLCb2のノックアウトマウスなど苦味の味覚経路を欠失したマウスは苦味に対する忌避行動を示さない.しかし,これらのマウスは高濃度塩に対しては依然として野生型マウスとほぼ同じ程度の嫌悪を示した8).このことは,高濃度塩は苦味の味覚経路のほかにも忌避性の味覚経路を刺激することを示唆した.5つの基本味のうち,甘味,旨味,低濃度の塩味はすべて好ましい誘引性の味覚であることを考えると,残った忌避性の基本味である酸味に対する味覚経路がその候補として考えられた.そこで,酸味細胞が塩味の受容にかかわるかどうかを調べる目的で,酸味細胞に神経毒素である破傷風毒素αサブユニットを特異的に発現させ9),神経伝達を不活性化させたマウスを用いて味神経の高濃度塩に対する応答を調べた.その結果,これらのマウスにおいては,酸味に対する応答がほぼ完全に消失したのにくわえ,高濃度塩応答が野生型マウスと比較して有意に低下していた.また,それらの塩応答はアリルイソチオシアネート処理により完全に抑制されたことから,残った塩応答はすべて苦味細胞が担っていることが示唆された.これらの結果より,これまで酸の受容のみに特化していると考えられてきた酸味細胞が,意外にも,塩味の受容にもかかわっていることが明らかになった.そこで,今度は苦味の味覚経路と酸味の味覚経路の両方を欠失したマウスを用いて味神経の応答を測定したところ,低濃度のナトリウム塩に対する応答はまったく影響をうけていなかったが,高濃度塩に対する応答は完全に消失していた.このように遺伝学的な手法および薬理学的な手法を組み合わせることにより,哺乳類の味覚においては高濃度塩の情報すべてを苦味細胞と酸味細胞が受容していることが示された(図1a).
苦味の味覚経路および酸味の味覚経路を欠失したマウスは高濃度塩に対する味神経の応答を完全に消失したため,これら味神経の応答の変化が個体レベルでの塩の摂取行動にどのような影響をあたえるか嗜好性試験により検討した.野生型マウスは脱水状態では水に対して強い摂取行動を示すが,塩濃度が250 mMをこえる溶液に対してはその嗜好性が有意に低下し,海水と同じ程度のイオン強度である500 mM程度の塩溶液になると強い忌避行動を示すようになる.これに対し,苦味の味覚経路および酸味の味覚経路を欠失したマウスにおいて同様の実験を行ったところ,500 mMの塩溶液に対しても水と同じ程度の嗜好性を示し,積極的な摂取行動が観察された.ただし,苦味の味覚経路もしくは酸味の味覚経路のどちらか一方が残っている場合にはマウスは高濃度塩を忌避し,野生型マウスと同じ程度の嗜好性の低下を示した.これらの結果は,苦味の味覚経路と酸味の味覚経路は高濃度塩のセンサーとして独立にはたらいており,どちらか一方の味覚経路が機能していれば高濃度塩に対する忌避行動が起こるよう安全装置としてはたらいていることが示唆された.一方,塩としてナトリウム塩を用いた場合には忌避経路にくわえ上皮性ナトリウムチャネルに依存性の誘引経路が活性化されるため,個体としての塩の摂取量は誘引と忌避のバランスにより制御される.通常,脱塩状態の野生型マウスにナトリウム塩をあたえた場合,低濃度塩を好み高濃度塩を嫌うことで適切な量の塩の摂取を行う.しかし,苦味の味覚経路および酸味の味覚経路を欠失したマウスは高濃度塩に対しても低濃度よりさらに強い嗜好性を示し,野生型マウスと比較して過剰な塩の摂取を行った.これらの行動実験の結果から,動物の塩の摂取は3種類の味覚経路,すなわち,上皮性ナトリウムチャネルに依存性の誘引シグナル(よい塩味)と,苦味の味覚経路および酸味の味覚経路を介した忌避シグナル(悪い塩味)のバランスにより末梢レベルにおいて厳密に制御されており,どちらか一方の味覚経路が機能しないと個体としての塩の異常な摂取につながることが明らかになった(図1b).
今回,筆者らは,5つの基本味のなかで唯一その受容機構が不明であった塩味の受容に焦点をあて,その全貌を明らかにした.塩は生物に必須であると同時に有害ともなりうる.この生存に必須な問題に対し,生物は味覚を利用して,低濃度から活性化される1種類の誘引経路と高濃度から活性化される2種類の忌避経路を進化させてきたのは,非常に理にかなったシステムである.しかし今回,塩味の受容を解明したことにより,新たな未解決の問題もうかびあがった.たとえば,なぜ高濃度の塩はわれわれヒトにとり苦味プラス酸味とは感じられないのだろうか.このような知覚の問題を解決するには今後の研究が待たれるが,上皮性ナトリウムチャネル,そして,苦味細胞および酸味細胞のそれぞれに特異的な活性化や阻害剤を見い出すことができれば,これらの塩受容細胞がそれぞれ塩味の知覚にどのような影響をあたえるのかを知る手がかりになると思われる.このような研究をとおして,最終的には塩味の快,不快を自在に制御し,高血圧や心臓病の原因となりうる塩の過剰な摂取の問題について解決の糸口の得られることを期待したい.また,感覚という観点からは,末梢の舌で受け取られた感覚情報が高次のレベルでどう処理され,最終的に塩味という知覚,そして,塩摂取という行動を生み出すのかについても大きな興味がもたれる.
略歴:2007年 東京大学大学院新領域創成科学研究科 修了,同年 米国California大学San Diego校Postdoctral fellowを経て,2009年より米国Columbia大学Associate research scientist.
研究テーマ:塩味をはじめとした哺乳類の感覚系における情報処理.
抱負:われわれの五感は外界を感知するためのセンサーだが,その情報が脳においてどのように処理されているかを解き明かしていきたい.
Charles S. Zuker
米国Columbia大学Professor.
研究室URL:http://www.columbia.edu/cu/zukerlab/1/Zuker_Lab.html
© 2013 岡 勇輝・Charles S. Zuker Licensed under CC 表示 2.1 日本
(米国Columbia大学Department of Biochemistry and Molecular Biophysics)
email:岡 勇輝
DOI: 10.7875/first.author.2013.023
High salt recruits aversive taste pathways.
Yuki Oka, Matthew Butnaru, Lars von Buchholtz, Nicholas J. P. Ryba, Charles S. Zuker
Nature, 494, 472-475 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
上皮性ナトリウムチャネル, ENaC, epithelial sodium channel, ENaCα(Q61180), TRPM5(Q9JJH7), PLCb2(A3KGF7), 破傷風毒素αサブユニット(P04958)
要 約
すべての生物にとり塩は必須の栄養素であるが,過剰な摂取は逆に健康に有害となりうる.そのため,哺乳類の味覚は,低濃度の塩をよい味,また,高濃度の塩を不快な悪い味として脳に伝達することにより塩の摂取を調節している.しかし,これまで塩味の受容機構の全貌は明らかになっておらず,味覚において塩の摂取を制御する機構についても不明であった.この論文において,筆者らは,高濃度の塩はマウスの味蕾において苦味を受容する味細胞および酸味を受容する味細胞を刺激することを明らかにした.苦味および酸味の味覚経路を欠失したマウスにおいては,野生型マウスにおいて観察される高濃度の塩に対する味神経の応答および忌避行動が消失した.また,苦味および酸味の味覚経路を欠失したマウスは塩味に対し“よい味”の経路のみをもつため,野生型マウスが嫌悪を示すような高濃度のナトリウム塩に対しても高い嗜好性を示し,塩の異常な摂取行動がみられた.この研究の成果は,哺乳類の塩味受容機構を明らかにしたと同時に,われわれの感じる塩味を制御することにより,そのおいしさを変えずに心臓病や高血圧の一因となる塩の過剰な摂取を予防する方法の開発につながると期待される.
はじめに
五感のひとつである味覚はわれわれにとり食べ物を楽しむ感覚であるが,もともとは食物にエネルギーやミネラルが含まれているか,また,有害な物質が含まれていないかを体内に入るまえに判断するためのセンサーである.ヒトをはじめとする多くの哺乳類は5種類の基本味,甘味,旨味,苦味,酸味,塩味をもつ.これまで,筆者らの研究室では,これらのうち塩味を除く4種類の基本味を受容する味細胞,また,それらに対する受容体の同定を行ってきた1,2).しかし,最後に残った塩味については,その受容機構の全貌は未解明であった.その大きな理由のひとつは,塩味がほかの基本味に比べ特殊であるからにほかならない.たとえば,甘味と旨味はそれぞれ糖類とアミノ酸の味であり,それらの摂取は動物にとり有益であるためつねにおいしい味と感じる.逆に,苦味と酸味は毒物や腐敗物など有害物質を知らせる味であり,その多寡にかかわらず動物に不快で嫌な味をひき起こす.しかし,塩味はその濃度によりこれら両方の性質を現わす.すなわち,低濃度の塩はおいしく感じる一方,同じ塩でも高濃度になると塩辛すぎてまずく感じるのである.これは,われわれが塩気のある食物を好むが,海水のような濃度の高い塩はまずく感じることからも理解できる.このため,塩味には複数の受容経路,すなわち,誘引経路(よい味)と忌避経路(悪い味)が存在すると考えられてきた.
近年,筆者らは,上皮性ナトリウムチャネル(ENaC:epithelial sodium channel)の主要なサブユニットENaCαを欠損したマウスでは,低濃度の塩に対する味神経の応答および誘引行動が消失することを示し,誘引性の“よい”塩味の受容は上皮性ナトリウムチャネルを発現する味細胞が担っていることを明らかにした3).しかし,これらのマウスにおいて高濃度の塩に対する忌避行動はまったく損なわれておらず,“悪い”味をひき起こす塩味の受容機構は未解明のままであった.
1.忌避をひき起こす高濃度の塩は味蕾において2つの経路を刺激する
マウスにおいて電気生理学的な手法を用いて味神経の応答を測定すると,2種類の塩味に対する応答はその生理学的な性質により明確に区別することができる.上皮性ナトリウムチャネルに依存性のよい塩味に対する味神経の応答(低濃度塩応答)はナトリウム塩に特異的であり,3 mM程度の低い濃度からその応答が観察される.一方,上皮性ナトリウムチャネルに非依存性の忌避性の塩味応答(高濃度塩応答)は150 mM以上で顕著に観察され,ナトリウム塩やカリウム塩など多種の塩に非特異的な応答を示す4,5).もっとも重要な性質は,低濃度塩応答は上皮性ナトリウムチャネルの阻害剤であるアミロライドの存在下で完全に抑制される点である6,7).この阻害剤は長年にわたり低濃度塩と高濃度塩の味応答を区別する目的で利用され,低濃度塩の受容機構の解明に寄与してきた.そこで今度は,アミロライドに代わる,高濃度塩応答を抑制する阻害剤の探索を試みた.高濃度塩に対する味神経の応答を指標としてさまざまな物質をスクリーニングした結果,マスタードオイルの辛味成分であるアリルイソチオシアネートで舌を処理することにより,上皮性ナトリウムチャネル経路を介する低濃度塩応答にはまったく影響をあたえず,高濃度塩応答だけを有意に低下することを見い出した.しかし,アリルイソチオシアネートは濃度にかかわらず高濃度塩応答を最大で約50%のみ阻害し,アリルイソチオシアネートに非感受性の残存する高濃度塩応答がつねに観察された.これらの結果は,これまで1つの経路により受容されると考えられていた高濃度塩は,じつは,薬理学的な性質の異なる,アリルイソチオシアネートに感受性および非感受性の2つの経路を活性化することを示唆した.
2.苦味細胞は高濃度塩により活性化する
興味深いことに,アリルイソチオシアネート処理は塩味応答の半分にくわえ,苦味応答を完全に抑制した.アリルイソチオシアネートが高濃度塩と苦味の両方の応答を阻害したことから,これらが味蕾において同一の味細胞(苦味細胞)により受容されている可能性が考えられた.そこで,苦味,甘味,旨味の受容に必須なタンパク質であるTRPM5チャネルおよびPLCb2を欠損したマウス8) を用いて味神経の応答を測定したところ,予想どおり,高濃度塩応答は野生型マウスに比べ有意に低下しており,また,残った応答はアリルイソチオシアネートに非感受性であった.さらに,PLCb2ノックアウトマウスの苦味細胞にのみPLCb2を発現させ機能を復元させると,高濃度塩応答とアリルイソチオシアネート感受性の両方が回復した.これらの結果より,アリルイソチオシアネート感受性の高濃度塩応答は苦味細胞により受容されていることが明らかになった.また,Ca2+イメージング法を用いて単一細胞レベルで味蕾における味応答を可視化したところ,GFPにより標識された苦味受容体を発現した味細胞は,確かに苦味物質と高濃度塩の両方により活性化されることが明らかになった.これら一連の結果より,苦味細胞が忌避性の高濃度塩の受容の一端を担っていることが示された.
3.酸味細胞は酸味だけでなく塩味の受容にもかかわる
残る高濃度塩の受容経路を明らかにするため,アリルイソチオシアネート非感受性の塩応答細胞の同定を試みた.TRPM5チャネルやPLCb2のノックアウトマウスなど苦味の味覚経路を欠失したマウスは苦味に対する忌避行動を示さない.しかし,これらのマウスは高濃度塩に対しては依然として野生型マウスとほぼ同じ程度の嫌悪を示した8).このことは,高濃度塩は苦味の味覚経路のほかにも忌避性の味覚経路を刺激することを示唆した.5つの基本味のうち,甘味,旨味,低濃度の塩味はすべて好ましい誘引性の味覚であることを考えると,残った忌避性の基本味である酸味に対する味覚経路がその候補として考えられた.そこで,酸味細胞が塩味の受容にかかわるかどうかを調べる目的で,酸味細胞に神経毒素である破傷風毒素αサブユニットを特異的に発現させ9),神経伝達を不活性化させたマウスを用いて味神経の高濃度塩に対する応答を調べた.その結果,これらのマウスにおいては,酸味に対する応答がほぼ完全に消失したのにくわえ,高濃度塩応答が野生型マウスと比較して有意に低下していた.また,それらの塩応答はアリルイソチオシアネート処理により完全に抑制されたことから,残った塩応答はすべて苦味細胞が担っていることが示唆された.これらの結果より,これまで酸の受容のみに特化していると考えられてきた酸味細胞が,意外にも,塩味の受容にもかかわっていることが明らかになった.そこで,今度は苦味の味覚経路と酸味の味覚経路の両方を欠失したマウスを用いて味神経の応答を測定したところ,低濃度のナトリウム塩に対する応答はまったく影響をうけていなかったが,高濃度塩に対する応答は完全に消失していた.このように遺伝学的な手法および薬理学的な手法を組み合わせることにより,哺乳類の味覚においては高濃度塩の情報すべてを苦味細胞と酸味細胞が受容していることが示された(図1a).
4.苦味細胞および酸味細胞の活性化は動物の塩の摂取量を制御する
苦味の味覚経路および酸味の味覚経路を欠失したマウスは高濃度塩に対する味神経の応答を完全に消失したため,これら味神経の応答の変化が個体レベルでの塩の摂取行動にどのような影響をあたえるか嗜好性試験により検討した.野生型マウスは脱水状態では水に対して強い摂取行動を示すが,塩濃度が250 mMをこえる溶液に対してはその嗜好性が有意に低下し,海水と同じ程度のイオン強度である500 mM程度の塩溶液になると強い忌避行動を示すようになる.これに対し,苦味の味覚経路および酸味の味覚経路を欠失したマウスにおいて同様の実験を行ったところ,500 mMの塩溶液に対しても水と同じ程度の嗜好性を示し,積極的な摂取行動が観察された.ただし,苦味の味覚経路もしくは酸味の味覚経路のどちらか一方が残っている場合にはマウスは高濃度塩を忌避し,野生型マウスと同じ程度の嗜好性の低下を示した.これらの結果は,苦味の味覚経路と酸味の味覚経路は高濃度塩のセンサーとして独立にはたらいており,どちらか一方の味覚経路が機能していれば高濃度塩に対する忌避行動が起こるよう安全装置としてはたらいていることが示唆された.一方,塩としてナトリウム塩を用いた場合には忌避経路にくわえ上皮性ナトリウムチャネルに依存性の誘引経路が活性化されるため,個体としての塩の摂取量は誘引と忌避のバランスにより制御される.通常,脱塩状態の野生型マウスにナトリウム塩をあたえた場合,低濃度塩を好み高濃度塩を嫌うことで適切な量の塩の摂取を行う.しかし,苦味の味覚経路および酸味の味覚経路を欠失したマウスは高濃度塩に対しても低濃度よりさらに強い嗜好性を示し,野生型マウスと比較して過剰な塩の摂取を行った.これらの行動実験の結果から,動物の塩の摂取は3種類の味覚経路,すなわち,上皮性ナトリウムチャネルに依存性の誘引シグナル(よい塩味)と,苦味の味覚経路および酸味の味覚経路を介した忌避シグナル(悪い塩味)のバランスにより末梢レベルにおいて厳密に制御されており,どちらか一方の味覚経路が機能しないと個体としての塩の異常な摂取につながることが明らかになった(図1b).
おわりに
今回,筆者らは,5つの基本味のなかで唯一その受容機構が不明であった塩味の受容に焦点をあて,その全貌を明らかにした.塩は生物に必須であると同時に有害ともなりうる.この生存に必須な問題に対し,生物は味覚を利用して,低濃度から活性化される1種類の誘引経路と高濃度から活性化される2種類の忌避経路を進化させてきたのは,非常に理にかなったシステムである.しかし今回,塩味の受容を解明したことにより,新たな未解決の問題もうかびあがった.たとえば,なぜ高濃度の塩はわれわれヒトにとり苦味プラス酸味とは感じられないのだろうか.このような知覚の問題を解決するには今後の研究が待たれるが,上皮性ナトリウムチャネル,そして,苦味細胞および酸味細胞のそれぞれに特異的な活性化や阻害剤を見い出すことができれば,これらの塩受容細胞がそれぞれ塩味の知覚にどのような影響をあたえるのかを知る手がかりになると思われる.このような研究をとおして,最終的には塩味の快,不快を自在に制御し,高血圧や心臓病の原因となりうる塩の過剰な摂取の問題について解決の糸口の得られることを期待したい.また,感覚という観点からは,末梢の舌で受け取られた感覚情報が高次のレベルでどう処理され,最終的に塩味という知覚,そして,塩摂取という行動を生み出すのかについても大きな興味がもたれる.
文 献
- Chandrashekar, J., Hoon, M. A., Ryba, N. J. et al.: The receptors and cells for mammalian taste. Nature, 444, 288-294 (2006)[PubMed]
- Yarmolinsky, D. A., Zuker, C. S. & Ryba, N. J.: Common sense about taste: from mammals to insects. Cell, 139, 234-244 (2009)[PubMed]
- Chandrashekar, J., Kuhn, C., Oka, Y. et al.: The cells and peripheral representation of sodium taste in mice. Nature, 464, 297-301 (2010)[PubMed]
- Beauchamp, G. K., Bertino, M., Burke, D. et al.: Experimental sodium depletion and salt taste in normal human volunteers. Am. J. Clin. Nutr., 51, 881-889 (1990)[PubMed]
- Duncan, C. J.: Salt preferences of birds and mammals. Physiol. Zool., 35, 120-132 (1962)
- Heck, G. L., Mierson, S. & DeSimone, J. A.: Salt taste transduction occurs through an amiloride-sensitive sodium transport pathway. Science, 223, 403-405 (1984)[PubMed]
- Spector, A. C., Guagliardo, N. A. & St. John, S. J.: Amiloride disrupts NaCl versus KCl discrimination performance: implications for salt taste coding in rats. J. Neurosci., 16, 8115-8122 (1996)[PubMed]
- Zhang, Y., Hoon, M. A., Chandrashekar, J. et al.: Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways. Cell, 112, 293-301 (2003)[PubMed]
- Huang, A. L., Chen, X., Hoon, M. A. et al.: The cells and logic for mammalian sour taste detection. Nature, 442, 934-938 (2006)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院新領域創成科学研究科 修了,同年 米国California大学San Diego校Postdoctral fellowを経て,2009年より米国Columbia大学Associate research scientist.
研究テーマ:塩味をはじめとした哺乳類の感覚系における情報処理.
抱負:われわれの五感は外界を感知するためのセンサーだが,その情報が脳においてどのように処理されているかを解き明かしていきたい.
Charles S. Zuker
米国Columbia大学Professor.
研究室URL:http://www.columbia.edu/cu/zukerlab/1/Zuker_Lab.html
© 2013 岡 勇輝・Charles S. Zuker Licensed under CC 表示 2.1 日本