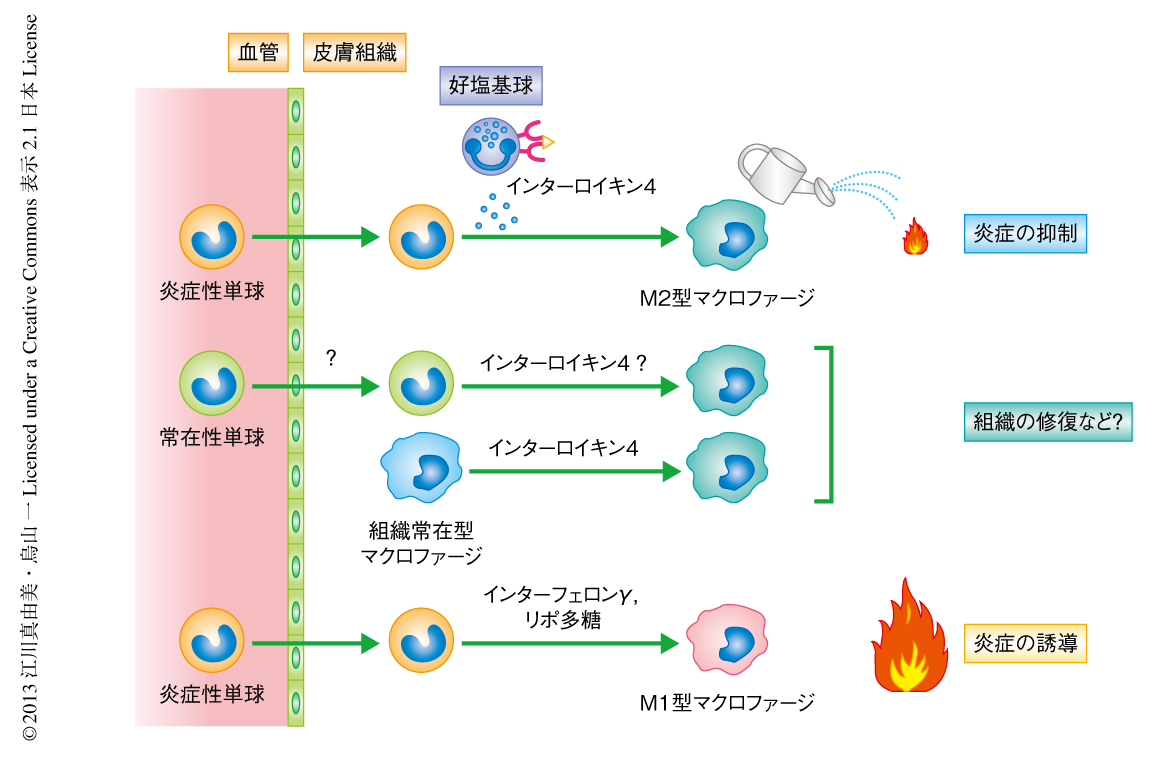
アレルギー性炎症の部位に浸潤した炎症性単球は好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化し炎症の抑制にはたらく
江川真由美・烏山 一
(東京医科歯科大学大学院医歯学総合研究科 免疫アレルギー学分野)
email:江川真由美,烏山 一
DOI: 10.7875/first.author.2013.019
Inflammatory monocytes recruited to allergic skin acquire an anti-inflammatory M2 phenotype via basophil-derived interleukin-4.
Mayumi Egawa, Kaori Mukai, Soichiro Yoshikawa, Misako Iki, Naofumi Mukaida, Yohei Kawano, Yoshiyuki Minegishi, Hajime Karasuyama
Immunity, 38, 570 -580 (2013)
炎症の誘導や制御にかかわる単球およびマクロファージには,それぞれ,その表現型によりいくつかのサブセットが存在する.マクロファージは単球から派生し分化するが,単球のサブセットとマクロファージのサブセットとのあいだの相関関係についてはほとんどわかっていない.この研究において,筆者らは,アレルギー性炎症の部位に炎症性単球と同じ表現型を示す多数のマクロファージが集積していることを見い出した.ところが予想に反して,CCR2ノックアウトマウスでは炎症性単球の浸潤はないにもかかわらず,アレルギー性炎症は悪化した.このCCR2ノックアウトマウスに正常マウスに由来する炎症性単球を移入すると過度の炎症は緩和したことから,炎症性単球は炎症を抑制する作用を示すことが判明した.この炎症を抑制する作用は,好塩基球が産生するインターロイキン4により炎症性単球がM2型マクロファージへと分化することに起因することがわかった.以上,アレルギー性炎症において,浸潤してきた炎症性単球は好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化し炎症を抑制する機能を獲得することが明らかになった.
アトピー性皮膚炎やぜんそく,花粉症などに代表されるアレルギー性疾患は,とくに先進諸国において患者数の増加が大きな問題となっている.アレルギーは,本来は反応するべきでない物質に対し生体が異常な免疫応答をしてしまうことが原因と考えられており,さまざまな免疫細胞が関与しているとされる.しかしながら,アレルギー性疾患の発症および悪化の分子機構にはいまだ不明な点が多く,さらに,その治療法も対症療法しかないため,根本的な治療にむけた病態の解明が望まれている.
筆者らは,以前の報告において,アトピー性皮膚炎にみられるような慢性的なアレルギー性炎症を解析するため,免疫グロブリンEを介したマウス慢性皮膚炎症モデルを用いて研究を行った1).このモデルは,免疫グロブリンEで感作したマウスの皮膚に免疫グロブリンEに対する抗原を投与することにより誘導するが,抗原の投与ののち3~4日をピークとする強い皮膚の腫脹がみられ,そののち,自然に炎症が消失するという特徴をもつ.この炎症には白血球の一種で非常に数の少ない好塩基球が,免疫グロブリンEと抗原による活性化を介し深くかかわっていることが明らかになっている.しかしながら,この皮膚の炎症が誘導される分子機構や,炎症が自然に消失する分子機構についてはほとんどわかっていない.
今回,筆者らは,この免疫グロブリンEを介したマウス慢性皮膚炎症モデルにおいて炎症の部位を詳細に解析した結果,炎症組織に浸潤している細胞のうち半数近くがLy-6C陽性CCR2陽性を示すマクロファージであることを見い出した.この表現型は炎症性単球と同じものであったため,このマクロファージは炎症性単球が分化したものであると推測された.単球は血中を循環している白血球の一種で,Ly-6C陽性CCR2陽性を示す炎症性単球と,Ly-6C陰性CCR2陰性を示す常在性単球の2種類のサブセットがあるとされている2).このCCR2というタンパク質は細胞の遊走にかかわるケモカインの受容体のひとつであり,炎症性単球はCCR2を介して骨髄から血中もしくは組織に浸潤することが知られている3,4).また,単球は組織に浸潤するとマクロファージへと分化するが,このマクロファージにもM1型とM2型の2種類のサブセットがある.これまで,炎症性単球はM1型マクロファージに,常在性単球はM2型マクロファージへと分化すると考えられてきた1,5-7).しかし近年では,もともと組織に存在するマクロファージが自己増殖し分化してM2型マクロファージになるという報告もあり8),単球のサブセットおよびマクロファージのサブセットとのあいだの分化経路や機能については混迷している.くわえて,アレルギー性炎症における単球およびマクロファージの分化や機能解析の研究はほとんど進んでいない.筆者らは,アレルギーにおけるこれらの細胞の分化経路や機能を解析することにより,アレルギーの発症機構や増悪あるいは緩和の分子機構の解明につながるのではないかと考えた.
免疫グロブリンEを介したマウス慢性皮膚炎症モデルの炎症の部位に浸潤していた細胞のうち,その半数近くはマクロファージがしめていた.このマクロファージはLy-6C陽性CCR2陽性を示し炎症性単球と表現型が類似していたことから,これらのマクロファージは炎症性単球が組織に浸潤し分化したものと考えられた.一方,炎症の部位に浸潤している細胞のうち,このモデルにおいて炎症の誘導に重要とされる好塩基球も,ケモカイン受容体であるCCR2を高発現していた.そのため,好塩基球と炎症性単球はCCR2を介して炎症の部位へと遊走し,炎症を誘導し悪化させるのではないかと考えた.そこで,CCR2ノックアウトマウスにおいて慢性皮膚炎症モデルを誘導したところ,予想に反して,皮膚の腫脹が悪化し遷延した.このとき炎症の部位に浸潤している細胞を解析したところ,マクロファージの数は対照となるマウスと比較して激減していたが,好塩基球や好中球などそのほかの炎症性細胞の数はむしろ増加していた.このことから,マウス慢性皮膚炎症モデルにおいて炎症性単球はCCR2に依存的に炎症の部位に浸潤するが,好塩基球はCCR2に非依存的に浸潤することが明らかになった.
なぜ,CCR2ノックアウトマウスにおいて炎症が悪化したのかを明らかにするため,正常マウスの炎症の部位に集積しているマクロファージについて,より詳細な解析を行った.その結果,6割近くがPD-L2というタンパク質を細胞の表面に発現していることが確認された.これまでの報告によると,マクロファージがM2型に分化した際には細胞の表面におけるPD-L2の発現は上昇するとされている9).そこで,マウス慢性皮膚炎症モデルにおいてマクロファージがM2型に分化しているかどうか確認するため,炎症を起こした皮膚からmRNAを調製し,M2型マクロファージの遺伝子マーカーとして知られるArg1遺伝子,Chi3l3遺伝子,Fizz1遺伝子の発現レベルを調べたところ,これらすべてに発現の上昇が認められた.さらに,炎症の部位のマクロファージをPD-L2の陽性と陰性とで分離し,同様にM2型マクロファージの遺伝子マーカーの発現レベルを調べたところ,PD-L2陽性のマクロファージにおいてそれらの発現は上昇していた.以上の結果から,炎症の部位に集積したマクロファージは炎症性単球とM2マクロファージの2つの表現型をあわせもつことが明らかになった.
マクロファージがM2型に分化するためには,インターロイキン4やインターロイキン10,インターロイキン13といったTh2型サイトカインが必要であることが知られている5,7).実際に,マウス慢性皮膚炎症モデルにおける炎症の部位においてもTh2型サイトカインが産生されているのかどうか調べるため,インターロイキン4,インターロイキン10,インターロイキン13のmRNAレベルにおける発現を確認したところ,インターロイキン4の発現のみが上昇していた.さらに,インターロイキン4の産生細胞を探るため,炎症の部位からおのおのの細胞を分離しインターロイキン4のmRNAレベルにおける発現を確認したところ,ほかの細胞と比較して,好塩基球がインターロイキン4を圧倒的に高発現していることが明らかになった.これにより,免疫グロブリンEを介したマウス慢性皮膚炎症モデルの炎症の部位においては,浸潤してきた炎症性単球は免疫グロブリンEと抗原により刺激された好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化する可能性が考えられた.そこで,この可能性をin vitroにおいて検証するため,好塩基球を刺激した際の上清と炎症性単球とを共培養した.その結果,好塩基球を刺激した際の上清と共培養した炎症性単球はM2型マクロファージへと分化することが認められた.この共培養の際,インターロイキン4の効果を打ち消すためインターロイキン4中和抗体をくわえておくと,M2型マクロファージには分化しないことも確認された.以上のことから,好塩基球の産生するインターロイキン4により炎症性単球はM2型マクロファージへと分化することが明らかになった.
炎症性単球からM2型マクロファージへの分化がin vivoにおいても起こりうるのかどうかを検証するため,マウスに炎症性単球を移入し,そののちの表現型の変化を確認した.慢性皮膚炎症モデルを誘導した正常マウスに炎症性単球を移入したのち炎症の部位を解析したところ,移入した炎症性単球が浸潤しているのが確認された.もともとの移入した炎症性単球はM2型マクロファージのマーカーであるPD-L2を発現していなかったが,移入ののち,炎症の部位に集積していた炎症性単球はPD-L2陽性に変化していた.このことから,in vivoにおいても炎症性単球がM2型マクロファージへと分化することが示された.このM2型マクロファージへの分化にインターロイキン4が関与しているのかどうか調べるため,インターロイキン4受容体ノックアウトマウスから炎症性単球を分離し,同様に,慢性皮膚炎症モデルを誘導した正常マウスへと移入した.移入した炎症性単球はインターロイキン4受容体をもたないため,炎症の部位に浸潤してもインターロイキン4の影響はうけない.その結果,インターロイキン4受容体ノックアウトマウスに由来する炎症性単球はPD-L2の発現が上昇せず,M2型マクロファージへと分化することはできなかった.さらに,インターロイキン4を産生する好塩基球の影響を調べるため,慢性皮膚炎症モデルを誘導したマウスに正常マウスに由来する炎症性単球を移入し,同時に,好塩基球を除去する操作を行った.これにより,移入した炎症性単球は好塩基球の影響をうけないと考えられる.その結果,移入した炎症性単球はM2型マクロファージへと分化することはできなかった.以上のことから,組織に浸潤した炎症性単球はインターロイキン4受容体を介して好塩基球の産生するインターロイキン4を受容し,M2型マクロファージへと分化することが示唆された(図1).
組織に浸潤した炎症性単球がどのような機能をもつのかを調べるため,CCR2ノックアウトマウスへの移入実験をおこなった.さきに述べた検討において,CCR2ノックアウトマウスでは炎症性単球は炎症の部位に浸潤しないことが確認されており,さらに,このノックアウトマウスでは炎症の悪化も示されていた.そこで,正常マウスから炎症性単球を分離しCCR2ノックアウトマウスへと移入することにより,炎症性単球が組織に浸潤することによる炎症への効果を確認できるのではないかと考えた.その結果,正常マウスの炎症性単球を移入したCCR2ノックアウトマウスでは,対照となるCCR2ノックアウトマウスと比較して,過度の皮膚の腫脹が緩和することが明らかになった.このことから,炎症性単球の組織への浸潤が炎症の緩和につながることが示唆された.さらに,この炎症性単球がM2型マクロファージへと分化することが炎症の緩和に重要であるのかどうかを確認するため,インターロイキン4受容体ノックアウトマウスから分離した炎症性単球をCCR2ノックアウトマウスに移入した.その結果,正常マウスに由来する炎症性単球を移入したCCR2ノックアウトマウスでは過度の皮膚の腫脹は緩和したのに対し,インターロイキン4受容体ノックアウトマウスに由来する炎症性単球の移入では皮膚の腫脹の緩和はみられなかった.以上の結果から,炎症性単球はアレルギー性炎症の部位に浸潤したのち,好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化し,炎症の緩和に関与することが明らかになった.
これまでの報告から考えられてきたM2型マクロファージへの分化経路には,常在性単球が分化する経路と,もともと組織に存在するマクロファージ(組織常在型マクロファージ)が自己増殖および活性化して分化する経路とがあった.今回の研究から,これまでM1型マクロファージに分化すると考えられてきた炎症性単球が,好塩基球の産生するインターロイキン4によりM2型マクロファージに分化するという新しい分化経路が判明した.さらに,炎症性単球から分化したM2型マクロファージはアレルギー性炎症を抑制する機能をもつことも明らかになった(図2).今後,炎症を起こすはずだった炎症性単球がむしろ炎症を抑制するM2型マクロファージに分化する分子機構,および,M2型マクロファージが炎症を抑制する分子機構を詳細に解析することにより,アレルギーをはじめとする炎症性疾患の発症,悪化,終焉の機序の解明につながることが期待される.
略歴:東京医科歯科大学大学院医歯学総合研究科博士課程 在学中.
研究テーマ:皮膚の慢性炎症における好塩基球の機能.
関心事:アレルギー炎症の発症機構,好塩基球とほかの細胞との相互関係.
烏山 一(Hajime Karasuyama)
東京医科歯科大学大学院医歯学総合研究科 教授.
研究室URL:http://immune-regulation.org/
© 2013 江川真由美・烏山 一 Licensed under CC 表示 2.1 日本
(東京医科歯科大学大学院医歯学総合研究科 免疫アレルギー学分野)
email:江川真由美,烏山 一
DOI: 10.7875/first.author.2013.019
Inflammatory monocytes recruited to allergic skin acquire an anti-inflammatory M2 phenotype via basophil-derived interleukin-4.
Mayumi Egawa, Kaori Mukai, Soichiro Yoshikawa, Misako Iki, Naofumi Mukaida, Yohei Kawano, Yoshiyuki Minegishi, Hajime Karasuyama
Immunity, 38, 570 -580 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
インターロイキン4(P07750), interleukin-4(P07750), CCR2(P51683), 免疫グロブリンE, Ly-6C(P0CW03), ケモカイン, ケモカイン受容体, PD-L2(Q9WUL5), Arg1(Q61176), Chi3l3(O35744), Fizz1(Q9EP95), インターロイキン10(P18893), インターロイキン13(P20109), サイトカイン
要 約
炎症の誘導や制御にかかわる単球およびマクロファージには,それぞれ,その表現型によりいくつかのサブセットが存在する.マクロファージは単球から派生し分化するが,単球のサブセットとマクロファージのサブセットとのあいだの相関関係についてはほとんどわかっていない.この研究において,筆者らは,アレルギー性炎症の部位に炎症性単球と同じ表現型を示す多数のマクロファージが集積していることを見い出した.ところが予想に反して,CCR2ノックアウトマウスでは炎症性単球の浸潤はないにもかかわらず,アレルギー性炎症は悪化した.このCCR2ノックアウトマウスに正常マウスに由来する炎症性単球を移入すると過度の炎症は緩和したことから,炎症性単球は炎症を抑制する作用を示すことが判明した.この炎症を抑制する作用は,好塩基球が産生するインターロイキン4により炎症性単球がM2型マクロファージへと分化することに起因することがわかった.以上,アレルギー性炎症において,浸潤してきた炎症性単球は好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化し炎症を抑制する機能を獲得することが明らかになった.
はじめに
アトピー性皮膚炎やぜんそく,花粉症などに代表されるアレルギー性疾患は,とくに先進諸国において患者数の増加が大きな問題となっている.アレルギーは,本来は反応するべきでない物質に対し生体が異常な免疫応答をしてしまうことが原因と考えられており,さまざまな免疫細胞が関与しているとされる.しかしながら,アレルギー性疾患の発症および悪化の分子機構にはいまだ不明な点が多く,さらに,その治療法も対症療法しかないため,根本的な治療にむけた病態の解明が望まれている.
筆者らは,以前の報告において,アトピー性皮膚炎にみられるような慢性的なアレルギー性炎症を解析するため,免疫グロブリンEを介したマウス慢性皮膚炎症モデルを用いて研究を行った1).このモデルは,免疫グロブリンEで感作したマウスの皮膚に免疫グロブリンEに対する抗原を投与することにより誘導するが,抗原の投与ののち3~4日をピークとする強い皮膚の腫脹がみられ,そののち,自然に炎症が消失するという特徴をもつ.この炎症には白血球の一種で非常に数の少ない好塩基球が,免疫グロブリンEと抗原による活性化を介し深くかかわっていることが明らかになっている.しかしながら,この皮膚の炎症が誘導される分子機構や,炎症が自然に消失する分子機構についてはほとんどわかっていない.
今回,筆者らは,この免疫グロブリンEを介したマウス慢性皮膚炎症モデルにおいて炎症の部位を詳細に解析した結果,炎症組織に浸潤している細胞のうち半数近くがLy-6C陽性CCR2陽性を示すマクロファージであることを見い出した.この表現型は炎症性単球と同じものであったため,このマクロファージは炎症性単球が分化したものであると推測された.単球は血中を循環している白血球の一種で,Ly-6C陽性CCR2陽性を示す炎症性単球と,Ly-6C陰性CCR2陰性を示す常在性単球の2種類のサブセットがあるとされている2).このCCR2というタンパク質は細胞の遊走にかかわるケモカインの受容体のひとつであり,炎症性単球はCCR2を介して骨髄から血中もしくは組織に浸潤することが知られている3,4).また,単球は組織に浸潤するとマクロファージへと分化するが,このマクロファージにもM1型とM2型の2種類のサブセットがある.これまで,炎症性単球はM1型マクロファージに,常在性単球はM2型マクロファージへと分化すると考えられてきた1,5-7).しかし近年では,もともと組織に存在するマクロファージが自己増殖し分化してM2型マクロファージになるという報告もあり8),単球のサブセットおよびマクロファージのサブセットとのあいだの分化経路や機能については混迷している.くわえて,アレルギー性炎症における単球およびマクロファージの分化や機能解析の研究はほとんど進んでいない.筆者らは,アレルギーにおけるこれらの細胞の分化経路や機能を解析することにより,アレルギーの発症機構や増悪あるいは緩和の分子機構の解明につながるのではないかと考えた.
1.炎症性単球が浸潤しないマウスではアレルギー性炎症は悪化する
免疫グロブリンEを介したマウス慢性皮膚炎症モデルの炎症の部位に浸潤していた細胞のうち,その半数近くはマクロファージがしめていた.このマクロファージはLy-6C陽性CCR2陽性を示し炎症性単球と表現型が類似していたことから,これらのマクロファージは炎症性単球が組織に浸潤し分化したものと考えられた.一方,炎症の部位に浸潤している細胞のうち,このモデルにおいて炎症の誘導に重要とされる好塩基球も,ケモカイン受容体であるCCR2を高発現していた.そのため,好塩基球と炎症性単球はCCR2を介して炎症の部位へと遊走し,炎症を誘導し悪化させるのではないかと考えた.そこで,CCR2ノックアウトマウスにおいて慢性皮膚炎症モデルを誘導したところ,予想に反して,皮膚の腫脹が悪化し遷延した.このとき炎症の部位に浸潤している細胞を解析したところ,マクロファージの数は対照となるマウスと比較して激減していたが,好塩基球や好中球などそのほかの炎症性細胞の数はむしろ増加していた.このことから,マウス慢性皮膚炎症モデルにおいて炎症性単球はCCR2に依存的に炎症の部位に浸潤するが,好塩基球はCCR2に非依存的に浸潤することが明らかになった.
2.アレルギー炎症の部位に集積したマクロファージは炎症性単球とM2型マクロファージの2つの表現型をもつ
なぜ,CCR2ノックアウトマウスにおいて炎症が悪化したのかを明らかにするため,正常マウスの炎症の部位に集積しているマクロファージについて,より詳細な解析を行った.その結果,6割近くがPD-L2というタンパク質を細胞の表面に発現していることが確認された.これまでの報告によると,マクロファージがM2型に分化した際には細胞の表面におけるPD-L2の発現は上昇するとされている9).そこで,マウス慢性皮膚炎症モデルにおいてマクロファージがM2型に分化しているかどうか確認するため,炎症を起こした皮膚からmRNAを調製し,M2型マクロファージの遺伝子マーカーとして知られるArg1遺伝子,Chi3l3遺伝子,Fizz1遺伝子の発現レベルを調べたところ,これらすべてに発現の上昇が認められた.さらに,炎症の部位のマクロファージをPD-L2の陽性と陰性とで分離し,同様にM2型マクロファージの遺伝子マーカーの発現レベルを調べたところ,PD-L2陽性のマクロファージにおいてそれらの発現は上昇していた.以上の結果から,炎症の部位に集積したマクロファージは炎症性単球とM2マクロファージの2つの表現型をあわせもつことが明らかになった.
3.炎症性単球は好塩基球が産生するインターロイキン4によりM2型マクロファージに分化する
マクロファージがM2型に分化するためには,インターロイキン4やインターロイキン10,インターロイキン13といったTh2型サイトカインが必要であることが知られている5,7).実際に,マウス慢性皮膚炎症モデルにおける炎症の部位においてもTh2型サイトカインが産生されているのかどうか調べるため,インターロイキン4,インターロイキン10,インターロイキン13のmRNAレベルにおける発現を確認したところ,インターロイキン4の発現のみが上昇していた.さらに,インターロイキン4の産生細胞を探るため,炎症の部位からおのおのの細胞を分離しインターロイキン4のmRNAレベルにおける発現を確認したところ,ほかの細胞と比較して,好塩基球がインターロイキン4を圧倒的に高発現していることが明らかになった.これにより,免疫グロブリンEを介したマウス慢性皮膚炎症モデルの炎症の部位においては,浸潤してきた炎症性単球は免疫グロブリンEと抗原により刺激された好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化する可能性が考えられた.そこで,この可能性をin vitroにおいて検証するため,好塩基球を刺激した際の上清と炎症性単球とを共培養した.その結果,好塩基球を刺激した際の上清と共培養した炎症性単球はM2型マクロファージへと分化することが認められた.この共培養の際,インターロイキン4の効果を打ち消すためインターロイキン4中和抗体をくわえておくと,M2型マクロファージには分化しないことも確認された.以上のことから,好塩基球の産生するインターロイキン4により炎症性単球はM2型マクロファージへと分化することが明らかになった.
4.組織に浸潤した炎症性単球はインターロイキン4受容体および好塩基球に依存的にM2型マクロファージに分化する
炎症性単球からM2型マクロファージへの分化がin vivoにおいても起こりうるのかどうかを検証するため,マウスに炎症性単球を移入し,そののちの表現型の変化を確認した.慢性皮膚炎症モデルを誘導した正常マウスに炎症性単球を移入したのち炎症の部位を解析したところ,移入した炎症性単球が浸潤しているのが確認された.もともとの移入した炎症性単球はM2型マクロファージのマーカーであるPD-L2を発現していなかったが,移入ののち,炎症の部位に集積していた炎症性単球はPD-L2陽性に変化していた.このことから,in vivoにおいても炎症性単球がM2型マクロファージへと分化することが示された.このM2型マクロファージへの分化にインターロイキン4が関与しているのかどうか調べるため,インターロイキン4受容体ノックアウトマウスから炎症性単球を分離し,同様に,慢性皮膚炎症モデルを誘導した正常マウスへと移入した.移入した炎症性単球はインターロイキン4受容体をもたないため,炎症の部位に浸潤してもインターロイキン4の影響はうけない.その結果,インターロイキン4受容体ノックアウトマウスに由来する炎症性単球はPD-L2の発現が上昇せず,M2型マクロファージへと分化することはできなかった.さらに,インターロイキン4を産生する好塩基球の影響を調べるため,慢性皮膚炎症モデルを誘導したマウスに正常マウスに由来する炎症性単球を移入し,同時に,好塩基球を除去する操作を行った.これにより,移入した炎症性単球は好塩基球の影響をうけないと考えられる.その結果,移入した炎症性単球はM2型マクロファージへと分化することはできなかった.以上のことから,組織に浸潤した炎症性単球はインターロイキン4受容体を介して好塩基球の産生するインターロイキン4を受容し,M2型マクロファージへと分化することが示唆された(図1).
5.組織に浸潤した炎症性単球はインターロイキン4受容体に依存的にアレルギー性炎症を緩和する
組織に浸潤した炎症性単球がどのような機能をもつのかを調べるため,CCR2ノックアウトマウスへの移入実験をおこなった.さきに述べた検討において,CCR2ノックアウトマウスでは炎症性単球は炎症の部位に浸潤しないことが確認されており,さらに,このノックアウトマウスでは炎症の悪化も示されていた.そこで,正常マウスから炎症性単球を分離しCCR2ノックアウトマウスへと移入することにより,炎症性単球が組織に浸潤することによる炎症への効果を確認できるのではないかと考えた.その結果,正常マウスの炎症性単球を移入したCCR2ノックアウトマウスでは,対照となるCCR2ノックアウトマウスと比較して,過度の皮膚の腫脹が緩和することが明らかになった.このことから,炎症性単球の組織への浸潤が炎症の緩和につながることが示唆された.さらに,この炎症性単球がM2型マクロファージへと分化することが炎症の緩和に重要であるのかどうかを確認するため,インターロイキン4受容体ノックアウトマウスから分離した炎症性単球をCCR2ノックアウトマウスに移入した.その結果,正常マウスに由来する炎症性単球を移入したCCR2ノックアウトマウスでは過度の皮膚の腫脹は緩和したのに対し,インターロイキン4受容体ノックアウトマウスに由来する炎症性単球の移入では皮膚の腫脹の緩和はみられなかった.以上の結果から,炎症性単球はアレルギー性炎症の部位に浸潤したのち,好塩基球の産生するインターロイキン4によりM2型マクロファージへと分化し,炎症の緩和に関与することが明らかになった.
おわりに
これまでの報告から考えられてきたM2型マクロファージへの分化経路には,常在性単球が分化する経路と,もともと組織に存在するマクロファージ(組織常在型マクロファージ)が自己増殖および活性化して分化する経路とがあった.今回の研究から,これまでM1型マクロファージに分化すると考えられてきた炎症性単球が,好塩基球の産生するインターロイキン4によりM2型マクロファージに分化するという新しい分化経路が判明した.さらに,炎症性単球から分化したM2型マクロファージはアレルギー性炎症を抑制する機能をもつことも明らかになった(図2).今後,炎症を起こすはずだった炎症性単球がむしろ炎症を抑制するM2型マクロファージに分化する分子機構,および,M2型マクロファージが炎症を抑制する分子機構を詳細に解析することにより,アレルギーをはじめとする炎症性疾患の発症,悪化,終焉の機序の解明につながることが期待される.
文 献
- Mukai, K., Matsuoka, K., Taya, C. et al.: Basophils play a critical role in the development of IgE-mediated chronic allergic inflammation independently of T cells and mast cells. Immunity, 23, 191-202 (2005)[PubMed]
- Auffray, C., Sieweke, M. H. & Geissmann, F.: Blood monocytes: development, heterogeneity, and relationship with dendritic cells. Annu. Rev. Immunol., 27, 669-692 (2009)[PubMed]
- Tsou, C. L., Peters, W., Si, Y. et al.: Critical roles for CCR2 and MCP-3 in monocyte mobilization from bone marrow and recruitment to inflammatory sites. J. Clin. Invest., 117, 902-909 (2007)[PubMed]
- Serbina, N. V. & Pamer, E. G.: Monocyte emigration from bone marrow during bacterial infection requires signals mediated by chemokine receptor CCR2. Nat. Immunol., 7, 311-317 (2006)[PubMed]
- Gordon, S. & Taylor, P. R.: Monocyte and macrophage heterogeneity. Nat. Rev. Immunol., 5, 953-964 (2005)[PubMed]
- Auffray, C., Fogg, D., Garfa, M. et al.: Monitoring of blood vessels and tissues by a population of monocytes with patrolling behavior. Science, 317, 666-670 (2007)[PubMed]
- Biswas S. K. & Mantovani, A.: Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm. Nat. Immunol., 11, 889-896 (2010)[PubMed]
- Jenkins, S. J., Ruckerl, D., Cook, P. C. et al.: Local macrophage proliferation, rather than recruitment from the blood, is a signature of TH2 inflammation. Science, 332, 1284-1288 (2011)[PubMed]
- Loke, P. & Allison, J. P.: PD-L1 and PD-L2 are differentially regulated by Th1 and Th2 cells. Proc. Natl. Acad. Sci. USA, 100, 5336-5341 (2003)[PubMed]
著者プロフィール
略歴:東京医科歯科大学大学院医歯学総合研究科博士課程 在学中.
研究テーマ:皮膚の慢性炎症における好塩基球の機能.
関心事:アレルギー炎症の発症機構,好塩基球とほかの細胞との相互関係.
烏山 一(Hajime Karasuyama)
東京医科歯科大学大学院医歯学総合研究科 教授.
研究室URL:http://immune-regulation.org/
© 2013 江川真由美・烏山 一 Licensed under CC 表示 2.1 日本