FBXL21は時計タンパク質CRYをユビキチン化修飾して安定化することにより概日時計を制御する
平野有沙・深田吉孝
(東京大学大学院理学系研究科 生物化学専攻)
email:深田吉孝
DOI: 10.7875/first.author.2013.018
FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of Cryptochromes.
Arisa Hirano, Kanae Yumimoto, Ryosuke Tsunematsu, Masaki Matsumoto, Masaaki Oyama, Hiroko Kozuka-Hata, Tomoki Nakagawa, Darin Lanjakornsiripan, Keiichi I. Nakayama, Yoshitaka Fukada
Cell, 152, 1106-1118 (2013)
多くの生物がもつ概日時計は,睡眠と覚醒のリズムをはじめ,さまざまな生理現象における約1日周期のサーカディアンリズムを制御する.概日時計の振動は時計遺伝子の転写と翻訳を介した負のフィードバックループからなる.哺乳類の場合,この振動のループを構成する時計タンパク質のうち,強力な転写抑制活性をもつCRY(CRY1およびCRY2)が概日時計の発振において中心的な役割をはたしている.これまで,Fボックス型ユビキチンリガーゼであるFBXL3は,CRY1とCRY2をユビキチン化することによりそれらの分解を促進することが知られていた.筆者らは,FBXL3ともっとも近縁でありながら機能未知であったFボックスタンパク質FBXL21に注目し,これがCRYをユビキチン化すること,その結果として,驚くべきことに,CRYを安定化することを見い出した.FBXL3およびFBXL21のノックアウトマウスの行動リズムを解析したところ,一部のFBXL3 FBXL21ダブルノックアウトマウスは恒暗条件においてしだいに行動リズムが不規則となり,そののちリズム性を失うという強い表現型を示した.さらに,FBXL21およびFBXL3の細胞内局在を調べたところ,FBXL21は細胞質に多く存在するのに対し,FBXL3は核に局在した.FBXL21は細胞質においてCRYを安定化しその蓄積を助けるが,FBXL3は核においてCRYの分解を促進することにより,CRYのタンパク質量の著しい変動が生まれると考えられた.つまり,FBXL21とFBXL3は互いに類似したFボックスタンパク質であるが,FBXL21がCRYを安定化するのに対して,FBXL3はCRYを分解し,これら両者の拮抗した作用が概日時計の安定した発振の維持に必要であることが明らかになった.
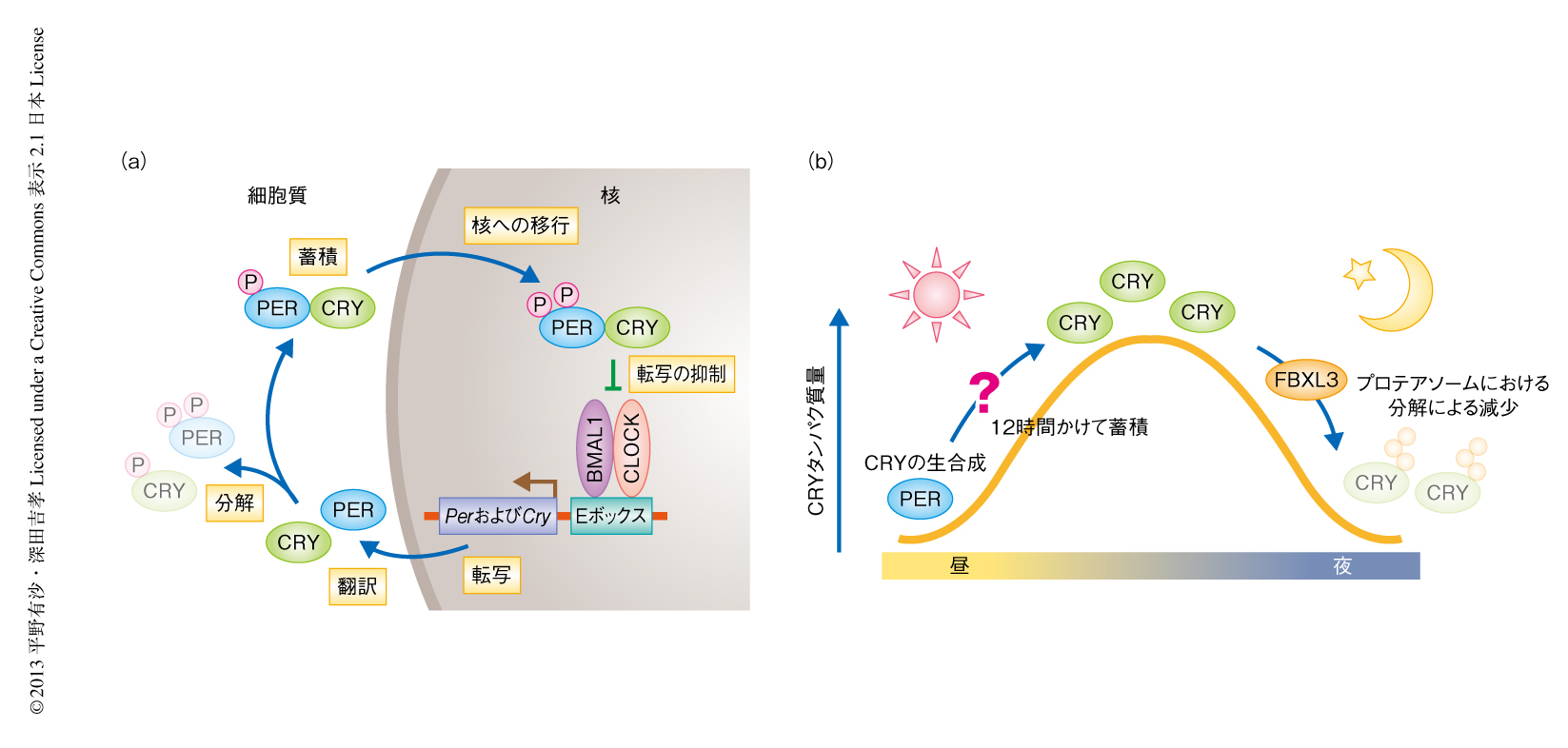
生物の睡眠と覚醒のリズムやホルモン分泌リズムなど,約1日周期の生理リズムのことをサーカディアンリズム(概日リズム)とよび,これらのリズムは生体に存在する概日時計により制御されている.哺乳類においては,時計遺伝子の転写と翻訳を介した負のフィードバックループが概日時計の分子的な骨格である1)(図1).時計タンパク質のなかでもCRY(CRY1およびCRY2)は強力な転写抑制活性をもち,概日時計の発振における中枢タンパク質として機能している.そのため,1日のはじまりにCRYがどのように発現して蓄積し,どのように減少して1日のサイクルを終えるのかというCRYの量的なダイナミクスを理解することは重要な課題である.筆者らは,これまでに,マウスのCRY2が細胞質において2段階のリン酸化をうけプロテアソームにおける分解へと導かれることを明らかにしてきた2,3).一方,CRY1とCRY2は核においてFボックス型ユビキチンリガーゼのひとつであるFBXL3によりユビキチン化修飾をうけプロテアソームにおいて分解される4-6).哺乳類にはFBXL3と近縁なタンパク質FBXL21が存在し,FBXL21とFBXL3のアミノ酸配列はきわめて高い相同性を示す7).FBXL21の概日時計への関与は示唆されているものの8),FBXL21が具体的に何をしているのか,その生理的な役割については謎のまま残されていた.
Fbxl3遺伝子とFbxl21遺伝子の概日時計における機能を明らかにするため,それぞれのノックアウトマウス,および,それらを掛け合わせたダブルノックアウトマウスの輪回し行動リズムを解析した.その結果,FBXL3ノックアウトマウスは恒暗条件において28時間というきわめて長い周期の行動リズムを示した.一方,FBXL21ノックアウトマウスには活動期の活動量のプロファイルに異常が観察されたものの,行動リズムの周期に大きな影響はみられなかった.ところが,FBXL3とFBXL21のダブルノックアウトマウスでは,FBXL3ノックアウトマウスにおいて観察された周期の延長が大きく緩和された.さらに重要なことに,一部のFBXL3 FBXL21ダブルノックアウトマウスは恒暗条件に移してから数週間のうちに行動リズムが消失するという顕著なリズム異常を示した.リズム性の強さの指標のひとつであるカイ2乗ピリオドグラムのQp値を算出したところ,FBXL3 FBXL21ダブルノックアウトマウスのみ日をおってQp値が低下していくことが判明した.つまり,FBXL3 FBXL21ダブルノックアウトマウスではきわめて長い期間にわたり振動を維持するという“概日時計のロバストネス”が失われていた.
マウスの行動リズムを支配する中枢時計は視床下部の視交差上核に存在するが,全身のほぼすべての細胞にも概日時計は内在しており,これらは末梢時計とよばれる.このことを利用すると,時計遺伝子のひとつであるBmal1遺伝子のプロモーターの下流にルシフェラーゼレポーター遺伝子を挿入したベクターを培養細胞に導入し,細胞のもつ概日時計を可視化することが可能となる.この方法を用い,FBXL21のノックダウンにより細胞のリズムは短周期化することを見い出した.つまり,Fbxl21遺伝子は概日時計の振動スピードを遅らせる方向に,一方,Fbxl3遺伝子は速める方向に,それぞれ概日時計を制御すると考えられた.さらに,Fbxl21遺伝子とFbxl3遺伝子とが協調的にはたらくことにより概日時計の安定な振動が維持されると結論した.FBXL21ノックアウトマウスから胎仔繊維芽細胞を調製してCRY1およびCRY2の発現リズムを調べたところ,FBXL21の欠損によりCRY1およびCRY2のタンパク質量は著しく減少し,変動の量的な振幅(最高レベルと最低レベルの差)も低下していた.しかし,Cry1遺伝子およびCry2遺伝子のmRNAレベルでの発現は野生型マウスから調製した胎仔繊維芽細胞に比べ上昇していたことから,FBXL21を欠損したマウス胎仔繊維芽細胞においてはCRYが不安定化しているのではないかと推測された.
FBXL21ノックアウトマウスやFBXL3とFBXL21のダブルノックアウトマウスの行動リズムに異常がもたらされる分子機構を明らかにするため,FBXL21がCRYを基質としてその安定性を制御する可能性を検証した.共免疫沈降実験により,CRY1とCRY2のいずれもがFBXL21と相互作用することが確認された.さらに,in vitroおよびin vivoにおけるユビキチン化アッセイにより,FBXL21はCRYのユビキチン化を促進することが明らかになった.興味深いことに,FBXL3はCRY1およびCRY2をプロテアソームにおける分解に導く一方,予想されたとおり,FBXL21はCRY1およびCRY2を安定化した.このような安定性の制御機構の違いは,FBXL21とFBXL3が付加するユビキチン鎖の結合様式の違いによるものではないかと考えた.ユビキチンのもつ7つのリジン残基のうち,48番目のリジン残基を介して形成されたユビキチン鎖の付加されたタンパク質はプロテアソームにリクルートされ分解されることが知られている.そこで,この48番目以外のリジン残基をすべてアルギニン残基に置換したユビキチン変異体を用いて実験を行った.野生型ユビキチンを用いた場合はFBXL3とFBXL21が同じ程度にCRY1のユビキチン化を促進したのに対し,このユビキチン変異体を用いるとFBXL3に比べFBXL21によるCRY1のユビキチン化の促進は大きく抑制された.つまり,FBXL3はプロテアソームの標的となる48番目のリジン残基を介して形成されたK48結合型ユビキチン鎖を伸長するのに対し,FBXL21はK48結合型とは異なる結合様式のユビキチン鎖をCRYに付加し,その安定化に寄与していることが判明した.
CRY1およびCRY2におけるユビキチン化部位を同定するため,細胞に発現させたCRYを精製し質量分析に供した.その結果,CRY1に3箇所,CRY2に5箇所のユビキチン化部位が同定された.そのうち,CRY1とCRY2のあいだで保存されていたリジン残基をアルギニン残基に置換し,この変異体がFBXL3とFBXL21による分解制御または安定化制御をうけるかどうか調べた.その結果,作製したCRY1変異体のうち107番目のリジン残基をアルギニン残基に置換したCRY1変異体のみはFBXL3により分解が促進されたが,FBXL21による安定化制御をうけないことが判明した.このことから,CRY1の107番目のリジン残基(CRY2では,125番目のリジン残基)がFBXL21による安定化において重要であること,FBXL21とFBXL3は互いに(少なくとも,1つは)異なるリジン残基をユビキチン化してCRYの安定性を制御していることが考えられた.
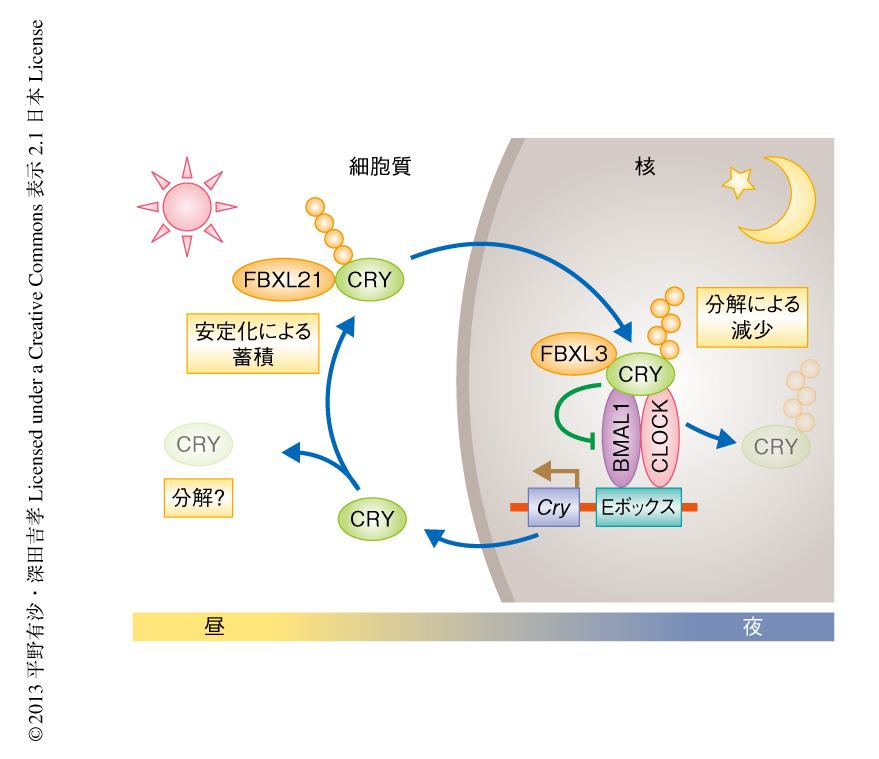
CRYが細胞のどこで,また,1日のどのタイミングでFBXL21とFBXL3によるユビキチン化制御をうけているかを明らかにするため,FBXL21およびFBXL3の細胞内局在を調べた.FBXL21とFBXL3のN末端側の領域は互いにアミノ酸配列の保存性が低く,また,FBXL3はこの領域に核移行シグナル様の配列をもつことを見い出した.そこで,細胞免疫染色法によりFBXL21とFBXL3の細胞内局在を解析したところ,予想どおり,FBXL3は核に限定的に局在し5),また,核移行シグナル様の配列に変異を導入したFBXL3変異体はおもに細胞質に局在した.一方で,FBXL21は細胞質に多く存在した.この結果をうけ,Fbxl21遺伝子の発現量の高いマウスの大脳の懸濁液から細胞質と核を分画し,FBXL21の欠損によるCRYのタンパク質量への影響を調べた.野生型マウスから得た懸濁液ではFBXL21の欠損により細胞質と核の両方においてCRY1とCRY2のタンパク質量は減少した.ところが,興味深いことに,FBXL3ノックアウトマウスから得た懸濁液ではFBXL21の欠損によるCRYのタンパク質量の減少は細胞質においてのみ観察された.つまり,FBXL21は細胞質においては,なんらかのCRY分解機構と拮抗してCRYを安定化していることが示唆された.
以上の結果から,FBXL21とFBXL3によるCRYのダイナミクスの形成モデルを提唱した(図2).つまり,昼の時間帯においてCRYのタンパク質量が増加していくタイミングでは,FBXL21はCRYの分解機構と拮抗することによりCRYを安定化してその蓄積を助ける.一方,夜の時間帯ではCRYは核において時計遺伝子の発現を抑制するが,この転写抑制のはたらきをおえたCRYはFBXL3による分解をうけて消失し,つぎの1日のサイクルがはじまる.このようなCRYのダイナミクスは概日時計の安定な振動の維持に必要不可欠である.
一般的に,Fボックス型ユビキチンリガーゼによりユビキチン化されたタンパク質はプロテアソームにおける分解をうける例が圧倒的に多く知られており,今回,筆者らが見い出したユビキチン化による安定化機構はきわめてまれである.哺乳類においては,唯一,β-TrCPがFBXW7と拮抗してc-Mycの安定化に寄与することが報告されているが,その生理的な意義は不明である9).筆者らの研究は,よく似た2つのFボックスタンパク質による“安定化”と“分解”という拮抗した作用が,マウスの行動リズムの制御という脳の高次機能においてはたす役割を明確に示した点で,強いインパクトをもつ.
この研究において,筆者らは,逆遺伝学を用いてFbxl21遺伝子の機能を明らかにしたが,ほぼ同時に,米国のグループは,順遺伝学にもとづき短周期の行動リズムを示したマウスがFbxl21遺伝子に点変異をもつことを明らかにした10).2つのグループが対照的な研究アプローチにより1つの遺伝子の概日時計における役割に到達したのは偶然であるが,これら2つの論文はCell誌に同時に掲載された.
なお,Cell誌Editorial Officeの誘いにより,筆者らは,FBXL3とFBXL21による概日時計の制御を2人の女性が時計の針を互いに逆方向から押し合っているようすになぞらえてデザインした.このイラストはCell掲載号の表紙を飾ったので,あわせてご覧いただければ幸いである.
略歴:2013年 東京大学大学院理学系研究科博士課程 修了.
研究テーマ:翻訳後修飾による概日時計の制御機構.
関心事:生体リズムはなぜ必要か?
深田 吉孝(Yoshitaka Fukada)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biochem.s.u-tokyo.ac.jp/fukada-lab/
© 2013 平野有沙・深田吉孝 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:深田吉孝
DOI: 10.7875/first.author.2013.018
FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of Cryptochromes.
Arisa Hirano, Kanae Yumimoto, Ryosuke Tsunematsu, Masaki Matsumoto, Masaaki Oyama, Hiroko Kozuka-Hata, Tomoki Nakagawa, Darin Lanjakornsiripan, Keiichi I. Nakayama, Yoshitaka Fukada
Cell, 152, 1106-1118 (2013)
要 約
多くの生物がもつ概日時計は,睡眠と覚醒のリズムをはじめ,さまざまな生理現象における約1日周期のサーカディアンリズムを制御する.概日時計の振動は時計遺伝子の転写と翻訳を介した負のフィードバックループからなる.哺乳類の場合,この振動のループを構成する時計タンパク質のうち,強力な転写抑制活性をもつCRY(CRY1およびCRY2)が概日時計の発振において中心的な役割をはたしている.これまで,Fボックス型ユビキチンリガーゼであるFBXL3は,CRY1とCRY2をユビキチン化することによりそれらの分解を促進することが知られていた.筆者らは,FBXL3ともっとも近縁でありながら機能未知であったFボックスタンパク質FBXL21に注目し,これがCRYをユビキチン化すること,その結果として,驚くべきことに,CRYを安定化することを見い出した.FBXL3およびFBXL21のノックアウトマウスの行動リズムを解析したところ,一部のFBXL3 FBXL21ダブルノックアウトマウスは恒暗条件においてしだいに行動リズムが不規則となり,そののちリズム性を失うという強い表現型を示した.さらに,FBXL21およびFBXL3の細胞内局在を調べたところ,FBXL21は細胞質に多く存在するのに対し,FBXL3は核に局在した.FBXL21は細胞質においてCRYを安定化しその蓄積を助けるが,FBXL3は核においてCRYの分解を促進することにより,CRYのタンパク質量の著しい変動が生まれると考えられた.つまり,FBXL21とFBXL3は互いに類似したFボックスタンパク質であるが,FBXL21がCRYを安定化するのに対して,FBXL3はCRYを分解し,これら両者の拮抗した作用が概日時計の安定した発振の維持に必要であることが明らかになった.
はじめに
生物の睡眠と覚醒のリズムやホルモン分泌リズムなど,約1日周期の生理リズムのことをサーカディアンリズム(概日リズム)とよび,これらのリズムは生体に存在する概日時計により制御されている.哺乳類においては,時計遺伝子の転写と翻訳を介した負のフィードバックループが概日時計の分子的な骨格である1)(図1).時計タンパク質のなかでもCRY(CRY1およびCRY2)は強力な転写抑制活性をもち,概日時計の発振における中枢タンパク質として機能している.そのため,1日のはじまりにCRYがどのように発現して蓄積し,どのように減少して1日のサイクルを終えるのかというCRYの量的なダイナミクスを理解することは重要な課題である.筆者らは,これまでに,マウスのCRY2が細胞質において2段階のリン酸化をうけプロテアソームにおける分解へと導かれることを明らかにしてきた2,3).一方,CRY1とCRY2は核においてFボックス型ユビキチンリガーゼのひとつであるFBXL3によりユビキチン化修飾をうけプロテアソームにおいて分解される4-6).哺乳類にはFBXL3と近縁なタンパク質FBXL21が存在し,FBXL21とFBXL3のアミノ酸配列はきわめて高い相同性を示す7).FBXL21の概日時計への関与は示唆されているものの8),FBXL21が具体的に何をしているのか,その生理的な役割については謎のまま残されていた.
1.行動リズムの制御におけるFbxl3遺伝子とFbxl21遺伝子の役割
Fbxl3遺伝子とFbxl21遺伝子の概日時計における機能を明らかにするため,それぞれのノックアウトマウス,および,それらを掛け合わせたダブルノックアウトマウスの輪回し行動リズムを解析した.その結果,FBXL3ノックアウトマウスは恒暗条件において28時間というきわめて長い周期の行動リズムを示した.一方,FBXL21ノックアウトマウスには活動期の活動量のプロファイルに異常が観察されたものの,行動リズムの周期に大きな影響はみられなかった.ところが,FBXL3とFBXL21のダブルノックアウトマウスでは,FBXL3ノックアウトマウスにおいて観察された周期の延長が大きく緩和された.さらに重要なことに,一部のFBXL3 FBXL21ダブルノックアウトマウスは恒暗条件に移してから数週間のうちに行動リズムが消失するという顕著なリズム異常を示した.リズム性の強さの指標のひとつであるカイ2乗ピリオドグラムのQp値を算出したところ,FBXL3 FBXL21ダブルノックアウトマウスのみ日をおってQp値が低下していくことが判明した.つまり,FBXL3 FBXL21ダブルノックアウトマウスではきわめて長い期間にわたり振動を維持するという“概日時計のロバストネス”が失われていた.
2.培養細胞におけるFbxl21遺伝子の機能
マウスの行動リズムを支配する中枢時計は視床下部の視交差上核に存在するが,全身のほぼすべての細胞にも概日時計は内在しており,これらは末梢時計とよばれる.このことを利用すると,時計遺伝子のひとつであるBmal1遺伝子のプロモーターの下流にルシフェラーゼレポーター遺伝子を挿入したベクターを培養細胞に導入し,細胞のもつ概日時計を可視化することが可能となる.この方法を用い,FBXL21のノックダウンにより細胞のリズムは短周期化することを見い出した.つまり,Fbxl21遺伝子は概日時計の振動スピードを遅らせる方向に,一方,Fbxl3遺伝子は速める方向に,それぞれ概日時計を制御すると考えられた.さらに,Fbxl21遺伝子とFbxl3遺伝子とが協調的にはたらくことにより概日時計の安定な振動が維持されると結論した.FBXL21ノックアウトマウスから胎仔繊維芽細胞を調製してCRY1およびCRY2の発現リズムを調べたところ,FBXL21の欠損によりCRY1およびCRY2のタンパク質量は著しく減少し,変動の量的な振幅(最高レベルと最低レベルの差)も低下していた.しかし,Cry1遺伝子およびCry2遺伝子のmRNAレベルでの発現は野生型マウスから調製した胎仔繊維芽細胞に比べ上昇していたことから,FBXL21を欠損したマウス胎仔繊維芽細胞においてはCRYが不安定化しているのではないかと推測された.
3.FBXL21はCRYをユビキチン化することにより安定化する
FBXL21ノックアウトマウスやFBXL3とFBXL21のダブルノックアウトマウスの行動リズムに異常がもたらされる分子機構を明らかにするため,FBXL21がCRYを基質としてその安定性を制御する可能性を検証した.共免疫沈降実験により,CRY1とCRY2のいずれもがFBXL21と相互作用することが確認された.さらに,in vitroおよびin vivoにおけるユビキチン化アッセイにより,FBXL21はCRYのユビキチン化を促進することが明らかになった.興味深いことに,FBXL3はCRY1およびCRY2をプロテアソームにおける分解に導く一方,予想されたとおり,FBXL21はCRY1およびCRY2を安定化した.このような安定性の制御機構の違いは,FBXL21とFBXL3が付加するユビキチン鎖の結合様式の違いによるものではないかと考えた.ユビキチンのもつ7つのリジン残基のうち,48番目のリジン残基を介して形成されたユビキチン鎖の付加されたタンパク質はプロテアソームにリクルートされ分解されることが知られている.そこで,この48番目以外のリジン残基をすべてアルギニン残基に置換したユビキチン変異体を用いて実験を行った.野生型ユビキチンを用いた場合はFBXL3とFBXL21が同じ程度にCRY1のユビキチン化を促進したのに対し,このユビキチン変異体を用いるとFBXL3に比べFBXL21によるCRY1のユビキチン化の促進は大きく抑制された.つまり,FBXL3はプロテアソームの標的となる48番目のリジン残基を介して形成されたK48結合型ユビキチン鎖を伸長するのに対し,FBXL21はK48結合型とは異なる結合様式のユビキチン鎖をCRYに付加し,その安定化に寄与していることが判明した.
4.FBXL21によるユビキチン化部位の同定
CRY1およびCRY2におけるユビキチン化部位を同定するため,細胞に発現させたCRYを精製し質量分析に供した.その結果,CRY1に3箇所,CRY2に5箇所のユビキチン化部位が同定された.そのうち,CRY1とCRY2のあいだで保存されていたリジン残基をアルギニン残基に置換し,この変異体がFBXL3とFBXL21による分解制御または安定化制御をうけるかどうか調べた.その結果,作製したCRY1変異体のうち107番目のリジン残基をアルギニン残基に置換したCRY1変異体のみはFBXL3により分解が促進されたが,FBXL21による安定化制御をうけないことが判明した.このことから,CRY1の107番目のリジン残基(CRY2では,125番目のリジン残基)がFBXL21による安定化において重要であること,FBXL21とFBXL3は互いに(少なくとも,1つは)異なるリジン残基をユビキチン化してCRYの安定性を制御していることが考えられた.
5.FBXL21は細胞質においてCRYを安定化しFBXL3は核においてCRYを分解する
CRYが細胞のどこで,また,1日のどのタイミングでFBXL21とFBXL3によるユビキチン化制御をうけているかを明らかにするため,FBXL21およびFBXL3の細胞内局在を調べた.FBXL21とFBXL3のN末端側の領域は互いにアミノ酸配列の保存性が低く,また,FBXL3はこの領域に核移行シグナル様の配列をもつことを見い出した.そこで,細胞免疫染色法によりFBXL21とFBXL3の細胞内局在を解析したところ,予想どおり,FBXL3は核に限定的に局在し5),また,核移行シグナル様の配列に変異を導入したFBXL3変異体はおもに細胞質に局在した.一方で,FBXL21は細胞質に多く存在した.この結果をうけ,Fbxl21遺伝子の発現量の高いマウスの大脳の懸濁液から細胞質と核を分画し,FBXL21の欠損によるCRYのタンパク質量への影響を調べた.野生型マウスから得た懸濁液ではFBXL21の欠損により細胞質と核の両方においてCRY1とCRY2のタンパク質量は減少した.ところが,興味深いことに,FBXL3ノックアウトマウスから得た懸濁液ではFBXL21の欠損によるCRYのタンパク質量の減少は細胞質においてのみ観察された.つまり,FBXL21は細胞質においては,なんらかのCRY分解機構と拮抗してCRYを安定化していることが示唆された.
以上の結果から,FBXL21とFBXL3によるCRYのダイナミクスの形成モデルを提唱した(図2).つまり,昼の時間帯においてCRYのタンパク質量が増加していくタイミングでは,FBXL21はCRYの分解機構と拮抗することによりCRYを安定化してその蓄積を助ける.一方,夜の時間帯ではCRYは核において時計遺伝子の発現を抑制するが,この転写抑制のはたらきをおえたCRYはFBXL3による分解をうけて消失し,つぎの1日のサイクルがはじまる.このようなCRYのダイナミクスは概日時計の安定な振動の維持に必要不可欠である.
おわりに
一般的に,Fボックス型ユビキチンリガーゼによりユビキチン化されたタンパク質はプロテアソームにおける分解をうける例が圧倒的に多く知られており,今回,筆者らが見い出したユビキチン化による安定化機構はきわめてまれである.哺乳類においては,唯一,β-TrCPがFBXW7と拮抗してc-Mycの安定化に寄与することが報告されているが,その生理的な意義は不明である9).筆者らの研究は,よく似た2つのFボックスタンパク質による“安定化”と“分解”という拮抗した作用が,マウスの行動リズムの制御という脳の高次機能においてはたす役割を明確に示した点で,強いインパクトをもつ.
この研究において,筆者らは,逆遺伝学を用いてFbxl21遺伝子の機能を明らかにしたが,ほぼ同時に,米国のグループは,順遺伝学にもとづき短周期の行動リズムを示したマウスがFbxl21遺伝子に点変異をもつことを明らかにした10).2つのグループが対照的な研究アプローチにより1つの遺伝子の概日時計における役割に到達したのは偶然であるが,これら2つの論文はCell誌に同時に掲載された.
なお,Cell誌Editorial Officeの誘いにより,筆者らは,FBXL3とFBXL21による概日時計の制御を2人の女性が時計の針を互いに逆方向から押し合っているようすになぞらえてデザインした.このイラストはCell掲載号の表紙を飾ったので,あわせてご覧いただければ幸いである.
文 献
- Reppert, S. M. & Weaver, D. R.: Coordination of circadian timing in mammals. Nature, 418, 935-941 (2002)[PubMed]
- Harada, Y., Sakai, M., Kurabayashi, N. et al.: Ser-557-phosphorylated mCRY2 is degraded upon synergistic phosphorylation by glycogen synthase kinase-3β. J. Biol. Chem., 280, 31714-31721 (2005)[PubMed]
- Kurabayashi, N., Hirota, T., Sakai, M. et al.: DYRK1A and glycogen synthase kinase 3β, a dual-kinase mechanism directing proteasomal degradation of CRY2 for circadian timekeeping. Mol. Cell. Biol., 30, 1757-1768 (2010)[PubMed]
- Siepka, S. M., Yoo, S. H., Park, J. et al.: Circadian mutant Overtime reveals F-box protein FBXL3 regulation of Cryptochrome and Period gene expression. Cell, 129, 1011-1023 (2007)[PubMed]
- Godinho, S. I., Maywood, E. S., Shaw, L. et al.: The after-hours mutant reveals a role for Fbxl3 in determining mammalian circadian period. Science, 316, 897-900 (2007)[PubMed]
- Busino, L., Bassermann, F., Maiolica, A. et al.: SCFFbxl3 controls the oscillation of the circadian clock by directing the degradation of Cryptochrome proteins. Science, 316, 900-904 (2007)[PubMed]
- Jin, J., Cardozo, T., Lovering, R. C. et al.: Systematic analysis and nomenclature of mammalian F-box proteins. Genes Dev., 18, 2573-2580 (2004)[PubMed]
- Dardente, H., Mendoza, J., Fustin, J. M. et al.: Implication of the F-Box protein FBXL21 in circadian pacemaker function in mammals. PLoS One, 3, e3530 (2008)[PubMed]
- Popov, N., Schulein, C., Jaenicke, L. A. et al.: Ubiquitylation of the amino terminus of Myc by SCFβ-TrCP antagonizes SCFFbw7-mediated turnover. Nat. Cell Biol., 12, 973-981 (2010)[PubMed]
- Yoo, S. -H., Mohawk, J. A., Siepka, S. M. et al.: Competing E3 ubiquitin ligases govern circadian periodicity by degradation of CRY in nucleus and cytoplasm. Cell, 152, 1091-1105 (2013)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院理学系研究科博士課程 修了.
研究テーマ:翻訳後修飾による概日時計の制御機構.
関心事:生体リズムはなぜ必要か?
深田 吉孝(Yoshitaka Fukada)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biochem.s.u-tokyo.ac.jp/fukada-lab/
© 2013 平野有沙・深田吉孝 Licensed under CC 表示 2.1 日本