核内受容体であるNr4aファミリーは胸腺における制御性T細胞への分化および免疫恒常性の維持において必須の役割を担う
関谷高史・吉村昭彦
(慶應義塾大学医学部 微生物学免疫学教室)
email:関谷高史
DOI: 10.7875/first.author.2013.011
Nr4a receptors are essential for thymic regulatory T cell development and immune homeostasis.
Takashi Sekiya, Ikkou Kashiwagi, Rei Yoshida, Tomohiro Fukaya, Rimpei Morita, Akihiro Kimura, Hiroshi Ichinose, Daniel Metzger, Pierre Chambon, Akihiko Yoshimura
Nature Immunology, 14,230-237 (2013)
胸腺におけるCD4陽性T細胞への分化において,自己抗原に対し親和性の高いT細胞受容体をもつ細胞クローンは負の選択によりアポトーシスによって除去されるか,免疫反応の抑制能をもつ制御性T細胞への分化が誘導される.この分子機構により,末梢においてT細胞により自己抗原や自己細胞が認識され攻撃されることは防がれており,免疫系の恒常性は維持されている.しかし,自己反応性をもつT細胞クローンに負の選択や制御性T細胞への分化の誘導される分子機構に関しては大部分が未解明であった.筆者らは,核内受容体スーパーファミリーに属するNr4aファミリーが胸腺における制御性T細胞への分化や負の選択において必須の役割を担っていることを見い出した.Nr4aファミリーはNr4a1,Nr4a2,Nr4a3より構成されるが,これらすべてをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製したところ,このマウスでは制御性T細胞はまったく分化せず,全身性の自己免疫疾患により生後3週間以内に死亡した.さらに,胸腺における分化の過程において,自己抗原に対する親和性の低いCD4陽性T細胞には負の選択や制御性T細胞への分化は誘導されないが,それらのT細胞においてNr4aファミリーを活性化させることにより負の選択や制御性T細胞への分化の誘導されることを見い出した.これらの研究成果から,Nr4aファミリーは胸腺におけるCD4陽性T細胞への分化において,自己抗原に対する親和性の強度にしたがった運命決定を担う必須のタンパク質であり,免疫恒常性の維持において中心的な役割を担っていることを見い出した.
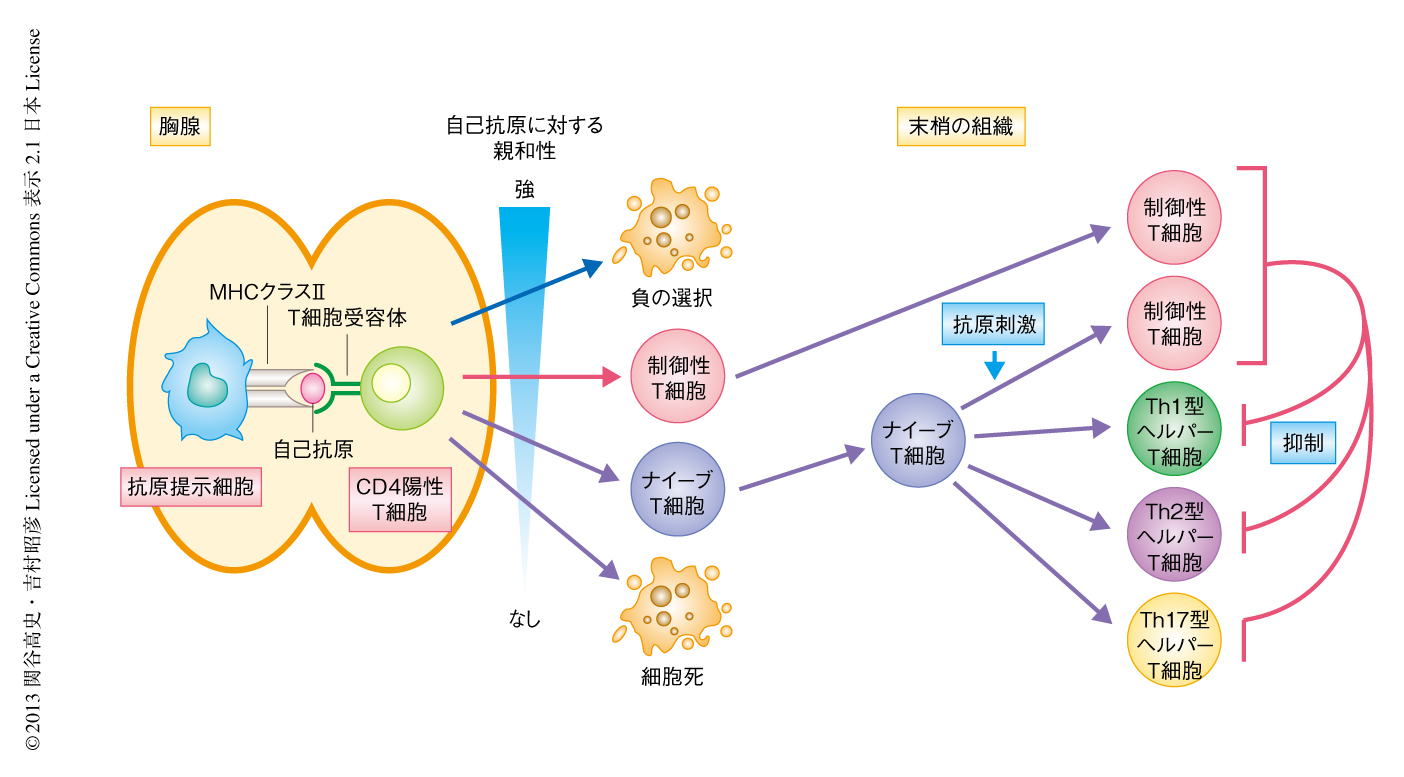
免疫系の恒常性は,病原体の排除を担う正の応答と,自己抗原や無害な外来抗原への過剰な応答を抑制する負の応答とのバランスの維持により担われている.CD4陽性T細胞は抗原の種類に応じた適切な免疫応答を作動することにより,そのバランスの維持において中心的な役割をはたしている.CD4陽性T細胞の適切な機能発現は,胸腺において正確な分化の過程をへることと,末梢で抗原を認識した際に適切に分化の誘導されることにより担われる.そのいずれか一方に異常が生じると,感染症のみならず自己免疫疾患やアレルギーを含めさまざまな疾患の引き金となる.まず,胸腺におけるCD4陽性T細胞への分化においては,MHCクラスII分子に提示された自己抗原に強く応答する細胞にはアポトーシスが誘導されるか(負の選択),または,免疫抑制性に機能する制御性T細胞(regulatory T cell:Treg)への分化が誘導される.これにより,自己反応性をもつT細胞の末梢における活性化が防がれている.一方,自己抗原と弱く反応する細胞はナイーブT細胞として末梢に出ていき外来抗原の侵入に備える.自己抗原とまったく反応しない細胞にもやはりアポトーシスが誘導される.このように,胸腺におけるCD4陽性T細胞の運命決定はおもに自己抗原への親和性の強度により担われ,免疫恒常性の維持の基盤となる(図1).胸腺において分化したナイーブT細胞は末梢に出ていき,病原体の種類に応じて異なったサブタイプのヘルパーT細胞に分化し,その排除にもっとも適した免疫応答を作動させる.一方,自己抗原や食餌抗原,共存細菌などの寛容性抗原に対しては制御性T細胞が誘導され,免疫系の恒常性は維持される(図1).
以上のように,CD4陽性T細胞は免疫応答を的確に制御し,免疫系のバランスの維持において中心的な役割をはたしている.とくに,制御性T細胞は負の応答において必須の役割を担っている1-3).しかし,胸腺において制御性T細胞の分化する分子機構については,その大部分が未解明であった.さきに述べたとおり,制御性T細胞は自己抗原に親和性をもつT細胞受容体をもつ前駆細胞から分化する4).T細胞受容体の下流のシグナル伝達の強い活性化により,制御性T細胞の分化における主要な転写因子として知られるFoxp3の発現が誘導されると考えられてきたが,それらを結ぶ分子機構は不明であった.筆者らは,さきに発表した研究において,核内受容体であるNr4a2がCD4陽性T細胞においてFoxp3の発現を強く誘導する機能をもつことを見い出していた5).さらに,核内受容体スーパーファミリーに属するNr4aファミリーのメンバーであるNr4a1,Nr4a2,Nr4a3は,すべてT細胞受容体への刺激により発現の誘導されることが,筆者らの研究を含め,明らかにされている6).そこで,筆者らは,Nr4aファミリーが胸腺での負の選択や制御性T細胞への分化において重要な役割を担っているのではないかと推測した.
筆者らがさきに発表した研究では,Nr4a2のみをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製し解析を行ったが,そのマウスでは制御性T細胞は正常に分化し,自己免疫疾患の発症もみられなかった.Nr4aファミリーのほかのメンバーであるNr4a1およびNr4a3による機能重複の可能性が考えられたので,まず,Nr4a1,Nr4a2,Nr4a3のすべてをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製し解析を行った.その結果,このマウスでは胸腺および末梢において制御性T細胞はほぼまったく存在しないことが明らかになった.さらに,このマウスではCD4陽性T細胞の著明な活性化および自己抗体価の上昇がみられ,肺および肝臓においてとくに激しい全身性の自己免疫疾患を発症し,生後3週間以内に死亡した.このマウスではインターロイキン4を産生するCD4陽性T細胞の割合の増加,また,免疫グロブリンEや免疫グロブリンG1のようなTh2型アイソタイプの抗体価の上昇がみられ,Th2型ヘルパーT細胞の機能が優位な炎症反応の生じていることが明らかになった.
Nr4aファミリーのメンバーすべてを欠損したトリプルノックアウトマウスでは制御性T細胞が分化しなくなり自己免疫疾患のひき起こされることが明らかになったが,つぎに,シングルノックアウトマウスおよびダブルノックアウトマウスを解析することによりそれぞれのメンバーの関与の度合いを解析した.その結果,それぞれのシングルノックアウトマウスには顕著な表現型は確認されなかった.さらに,Nr4a1 Nr4a2ダブルノックアウトマウスおよびNr4a2 Nr4a3ダブルノックアウトマウスにおいても制御性T細胞は分化し自己免疫疾患もみられなかったが,Nr4a1 Nr4a3ダブルノックアウトマウスには自己免疫疾患がみられ,制御性T細胞の分化の減弱も確認された.これらの結果は,Nr4aファミリーのメンバーのうちNr4a1とNr4a3の寄与の大きいことを示唆した.しかし,Nr4a1 Nr4a3ダブルノックアウトマウスは,メンバーすべてを欠損したトリプルノックアウトマウスと比較して,胸腺において有意に多くの制御性T細胞が分化し,さらに,生存日数も長いことが確認され,Nr4a2の寄与も明らかになった.
さきに述べたとおり,Nr4aファミリーのメンバーすべてを欠損したノックアウトマウスには激しい全身性の自己免疫疾患がひき起こされた.そのため,制御性T細胞の分化の異常はその二次的な影響である可能性も考えられた.そこで,骨髄移植により野生型の造血幹細胞とNr4aファミリーのメンバーすべてを欠損した造血幹細胞の混在するマウスを作製することにより,同一の個体において野生型のT細胞とNr4aファミリーのメンバーすべてを欠損したT細胞の分化を比較解析した.その結果,このマウスには野生型の造血幹細胞から分化した制御性T細胞が存在しており,自己免疫疾患は生じない一方,Nr4aファミリーのメンバーすべてを欠損した造血幹細胞から分化した制御性T細胞はまったく存在していなかった.これらの結果から,Nr4aファミリーはCD4陽性T細胞において内在的に制御性T細胞への分化に寄与することが確認された.
Nr4aファミリーが胸腺におけるT細胞への分化の過程において自己反応性をもつT細胞クローンに負の選択を誘導する機能をもつことは,過去の数々の研究により示唆されてきたが7-11),この研究でも,それを裏づける結果が得られた.Nr4aファミリーのメンバーすべてを欠損したノックアウトマウスは生後3週間以内にすべて死亡したが,その生存日数はFoxp3の失活変異により制御性T細胞のみを欠損するScurfyマウスにおいて報告されているものより短いものであった.このことは,自己反応性をもつT細胞のより多く生じていることが自己免疫疾患をより重症化に導いている可能性を,間接的ながら示唆していた.さきに述べた野生型の造血幹細胞とNr4aファミリーのメンバーすべてを欠損した造血幹細胞の混在するマウスでは,胸腺において野生型のT細胞よりNr4aファミリーのメンバーすべてを欠損したT細胞のほうが多く存在することが明らかになった.このことは,Nr4aファミリーのメンバーすべてを欠損したT細胞クローンのうち自己反応性をもつものが,負の選択をのがれていることを示唆していた.以上の結果から,Nr4aファミリーの負の選択における機能が裏づけられた.
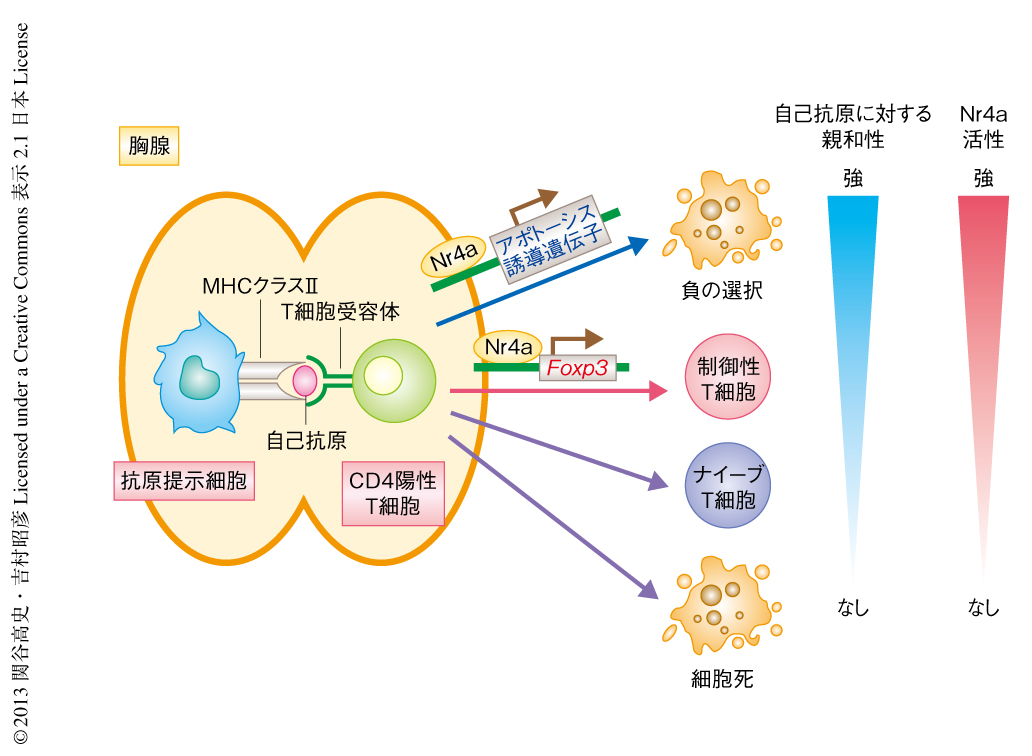
胸腺におけるCD4陽性T細胞への分化において,自己反応性をもつT細胞クローンには負の選択もしくは制御性T細胞への分化が誘導される.Nr4aファミリーがこの自己抗原に対する親和性の強度にしたがった運命決定を担うタンパク質であると考え,検証を試みた.OT-IIというT細胞受容体をもつCD4陽性T細胞は,ニワトリのオボアルブミンというタンパク質に由来する抗原を認識する.オボアルブミンに由来する抗原はマウスの体内には存在しない,すなわち,マウスにおける自己抗原ではないため,OT-IIをもつCD4陽性T細胞は制御性T細胞へと分化できないことが明らかになっている12).一方,マウスの体内においてオボアルブミンを発現させる,すなわち,自己抗原として存在させると,OT-IIをもつCD4陽性T細胞の大部分には負の選択もしくは制御性T細胞への分化が誘導される12).そこで,OT-IIをもつT細胞前駆細胞においてNr4aファミリーの活性を制御し,その運命を追跡した.その結果,Nr4aファミリーの活性のない状態では制御性T細胞はまったく分化しなかったが,Nr4aファミリーを活性化させた状態では制御性T細胞への分化が誘導されたことを示唆するFoxp3発現細胞の出現が確認された.Nr4aファミリーをさらに強く活性化すると,今度は細胞数の減少が確認され,負の選択の誘導が示唆された.これらの結果から,胸腺における自己抗原に対する親和性の強度にしたがったCD4陽性T細胞の運命決定において,Nr4aファミリーは必須のタンパク質として機能する可能性が強く示された(図2).
胸腺におけるCD4陽性T細胞への分化の過程において,その運命はおもに自己抗原に対する親和性の強度により決定され,免疫恒常性の維持における重要な基盤となる.しかし,それを制御する分子機構はその多くが未解明であった.この研究では,核内受容体スーパーファミリーに属するNr4aファミリーが必須のタンパク質として機能することを明らかにした.この発見により,長いあいだブラックボックスとされてきた自己抗原に対する親和性と細胞運命の決定とを結ぶ分子機構の大部分が明らかになったといえる.今後も,Nr4aファミリーの機能に着目した研究を進めることにより,胸腺におけるT細胞の分化を制御する分子機構の詳細が明らかになると考えられ,ひいては,炎症性疾患の発症機序の解明や治療法の開発にも結びつくものと期待される.
略歴:2004年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国Fox Chase Cancer Center博士研究員,2008年 慶應義塾大学医学部 博士研究員を経て,2010年 同 助教.
研究テーマ:CD4陽性T細胞の分化や機能発現を制御する分子機構の解明,および,それを人為的に制御する手法の確立.
関心事:生命科学全般.
吉村 昭彦(Akihiko Yoshimura)
慶應義塾大学医学部 教授.
研究室URL:http://new.immunoreg.jp/
© 2013 関谷高史・吉村昭彦 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 微生物学免疫学教室)
email:関谷高史
DOI: 10.7875/first.author.2013.011
Nr4a receptors are essential for thymic regulatory T cell development and immune homeostasis.
Takashi Sekiya, Ikkou Kashiwagi, Rei Yoshida, Tomohiro Fukaya, Rimpei Morita, Akihiro Kimura, Hiroshi Ichinose, Daniel Metzger, Pierre Chambon, Akihiko Yoshimura
Nature Immunology, 14,230-237 (2013)
要 約
胸腺におけるCD4陽性T細胞への分化において,自己抗原に対し親和性の高いT細胞受容体をもつ細胞クローンは負の選択によりアポトーシスによって除去されるか,免疫反応の抑制能をもつ制御性T細胞への分化が誘導される.この分子機構により,末梢においてT細胞により自己抗原や自己細胞が認識され攻撃されることは防がれており,免疫系の恒常性は維持されている.しかし,自己反応性をもつT細胞クローンに負の選択や制御性T細胞への分化の誘導される分子機構に関しては大部分が未解明であった.筆者らは,核内受容体スーパーファミリーに属するNr4aファミリーが胸腺における制御性T細胞への分化や負の選択において必須の役割を担っていることを見い出した.Nr4aファミリーはNr4a1,Nr4a2,Nr4a3より構成されるが,これらすべてをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製したところ,このマウスでは制御性T細胞はまったく分化せず,全身性の自己免疫疾患により生後3週間以内に死亡した.さらに,胸腺における分化の過程において,自己抗原に対する親和性の低いCD4陽性T細胞には負の選択や制御性T細胞への分化は誘導されないが,それらのT細胞においてNr4aファミリーを活性化させることにより負の選択や制御性T細胞への分化の誘導されることを見い出した.これらの研究成果から,Nr4aファミリーは胸腺におけるCD4陽性T細胞への分化において,自己抗原に対する親和性の強度にしたがった運命決定を担う必須のタンパク質であり,免疫恒常性の維持において中心的な役割を担っていることを見い出した.
はじめに
免疫系の恒常性は,病原体の排除を担う正の応答と,自己抗原や無害な外来抗原への過剰な応答を抑制する負の応答とのバランスの維持により担われている.CD4陽性T細胞は抗原の種類に応じた適切な免疫応答を作動することにより,そのバランスの維持において中心的な役割をはたしている.CD4陽性T細胞の適切な機能発現は,胸腺において正確な分化の過程をへることと,末梢で抗原を認識した際に適切に分化の誘導されることにより担われる.そのいずれか一方に異常が生じると,感染症のみならず自己免疫疾患やアレルギーを含めさまざまな疾患の引き金となる.まず,胸腺におけるCD4陽性T細胞への分化においては,MHCクラスII分子に提示された自己抗原に強く応答する細胞にはアポトーシスが誘導されるか(負の選択),または,免疫抑制性に機能する制御性T細胞(regulatory T cell:Treg)への分化が誘導される.これにより,自己反応性をもつT細胞の末梢における活性化が防がれている.一方,自己抗原と弱く反応する細胞はナイーブT細胞として末梢に出ていき外来抗原の侵入に備える.自己抗原とまったく反応しない細胞にもやはりアポトーシスが誘導される.このように,胸腺におけるCD4陽性T細胞の運命決定はおもに自己抗原への親和性の強度により担われ,免疫恒常性の維持の基盤となる(図1).胸腺において分化したナイーブT細胞は末梢に出ていき,病原体の種類に応じて異なったサブタイプのヘルパーT細胞に分化し,その排除にもっとも適した免疫応答を作動させる.一方,自己抗原や食餌抗原,共存細菌などの寛容性抗原に対しては制御性T細胞が誘導され,免疫系の恒常性は維持される(図1).
以上のように,CD4陽性T細胞は免疫応答を的確に制御し,免疫系のバランスの維持において中心的な役割をはたしている.とくに,制御性T細胞は負の応答において必須の役割を担っている1-3).しかし,胸腺において制御性T細胞の分化する分子機構については,その大部分が未解明であった.さきに述べたとおり,制御性T細胞は自己抗原に親和性をもつT細胞受容体をもつ前駆細胞から分化する4).T細胞受容体の下流のシグナル伝達の強い活性化により,制御性T細胞の分化における主要な転写因子として知られるFoxp3の発現が誘導されると考えられてきたが,それらを結ぶ分子機構は不明であった.筆者らは,さきに発表した研究において,核内受容体であるNr4a2がCD4陽性T細胞においてFoxp3の発現を強く誘導する機能をもつことを見い出していた5).さらに,核内受容体スーパーファミリーに属するNr4aファミリーのメンバーであるNr4a1,Nr4a2,Nr4a3は,すべてT細胞受容体への刺激により発現の誘導されることが,筆者らの研究を含め,明らかにされている6).そこで,筆者らは,Nr4aファミリーが胸腺での負の選択や制御性T細胞への分化において重要な役割を担っているのではないかと推測した.
1.Nr4aファミリーをすべて欠損させたマウスでは制御性T細胞は分化せず全身性の自己免疫疾患が発症する
筆者らがさきに発表した研究では,Nr4a2のみをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製し解析を行ったが,そのマウスでは制御性T細胞は正常に分化し,自己免疫疾患の発症もみられなかった.Nr4aファミリーのほかのメンバーであるNr4a1およびNr4a3による機能重複の可能性が考えられたので,まず,Nr4a1,Nr4a2,Nr4a3のすべてをT細胞において特異的に欠損させたコンディショナルノックアウトマウスを作製し解析を行った.その結果,このマウスでは胸腺および末梢において制御性T細胞はほぼまったく存在しないことが明らかになった.さらに,このマウスではCD4陽性T細胞の著明な活性化および自己抗体価の上昇がみられ,肺および肝臓においてとくに激しい全身性の自己免疫疾患を発症し,生後3週間以内に死亡した.このマウスではインターロイキン4を産生するCD4陽性T細胞の割合の増加,また,免疫グロブリンEや免疫グロブリンG1のようなTh2型アイソタイプの抗体価の上昇がみられ,Th2型ヘルパーT細胞の機能が優位な炎症反応の生じていることが明らかになった.
2.Nr4aファミリーのメンバーは胸腺における制御性T細胞への分化において相補的に寄与する
Nr4aファミリーのメンバーすべてを欠損したトリプルノックアウトマウスでは制御性T細胞が分化しなくなり自己免疫疾患のひき起こされることが明らかになったが,つぎに,シングルノックアウトマウスおよびダブルノックアウトマウスを解析することによりそれぞれのメンバーの関与の度合いを解析した.その結果,それぞれのシングルノックアウトマウスには顕著な表現型は確認されなかった.さらに,Nr4a1 Nr4a2ダブルノックアウトマウスおよびNr4a2 Nr4a3ダブルノックアウトマウスにおいても制御性T細胞は分化し自己免疫疾患もみられなかったが,Nr4a1 Nr4a3ダブルノックアウトマウスには自己免疫疾患がみられ,制御性T細胞の分化の減弱も確認された.これらの結果は,Nr4aファミリーのメンバーのうちNr4a1とNr4a3の寄与の大きいことを示唆した.しかし,Nr4a1 Nr4a3ダブルノックアウトマウスは,メンバーすべてを欠損したトリプルノックアウトマウスと比較して,胸腺において有意に多くの制御性T細胞が分化し,さらに,生存日数も長いことが確認され,Nr4a2の寄与も明らかになった.
3.Nr4aファミリーはCD4陽性T細胞において内在的に制御性T細胞への分化に機能する
さきに述べたとおり,Nr4aファミリーのメンバーすべてを欠損したノックアウトマウスには激しい全身性の自己免疫疾患がひき起こされた.そのため,制御性T細胞の分化の異常はその二次的な影響である可能性も考えられた.そこで,骨髄移植により野生型の造血幹細胞とNr4aファミリーのメンバーすべてを欠損した造血幹細胞の混在するマウスを作製することにより,同一の個体において野生型のT細胞とNr4aファミリーのメンバーすべてを欠損したT細胞の分化を比較解析した.その結果,このマウスには野生型の造血幹細胞から分化した制御性T細胞が存在しており,自己免疫疾患は生じない一方,Nr4aファミリーのメンバーすべてを欠損した造血幹細胞から分化した制御性T細胞はまったく存在していなかった.これらの結果から,Nr4aファミリーはCD4陽性T細胞において内在的に制御性T細胞への分化に寄与することが確認された.
4.Nr4aファミリーは負の選択に機能する
Nr4aファミリーが胸腺におけるT細胞への分化の過程において自己反応性をもつT細胞クローンに負の選択を誘導する機能をもつことは,過去の数々の研究により示唆されてきたが7-11),この研究でも,それを裏づける結果が得られた.Nr4aファミリーのメンバーすべてを欠損したノックアウトマウスは生後3週間以内にすべて死亡したが,その生存日数はFoxp3の失活変異により制御性T細胞のみを欠損するScurfyマウスにおいて報告されているものより短いものであった.このことは,自己反応性をもつT細胞のより多く生じていることが自己免疫疾患をより重症化に導いている可能性を,間接的ながら示唆していた.さきに述べた野生型の造血幹細胞とNr4aファミリーのメンバーすべてを欠損した造血幹細胞の混在するマウスでは,胸腺において野生型のT細胞よりNr4aファミリーのメンバーすべてを欠損したT細胞のほうが多く存在することが明らかになった.このことは,Nr4aファミリーのメンバーすべてを欠損したT細胞クローンのうち自己反応性をもつものが,負の選択をのがれていることを示唆していた.以上の結果から,Nr4aファミリーの負の選択における機能が裏づけられた.
5.Nr4aファミリーは自己反応性の強度に応じたCD4陽性T細胞の運命決定を担う
胸腺におけるCD4陽性T細胞への分化において,自己反応性をもつT細胞クローンには負の選択もしくは制御性T細胞への分化が誘導される.Nr4aファミリーがこの自己抗原に対する親和性の強度にしたがった運命決定を担うタンパク質であると考え,検証を試みた.OT-IIというT細胞受容体をもつCD4陽性T細胞は,ニワトリのオボアルブミンというタンパク質に由来する抗原を認識する.オボアルブミンに由来する抗原はマウスの体内には存在しない,すなわち,マウスにおける自己抗原ではないため,OT-IIをもつCD4陽性T細胞は制御性T細胞へと分化できないことが明らかになっている12).一方,マウスの体内においてオボアルブミンを発現させる,すなわち,自己抗原として存在させると,OT-IIをもつCD4陽性T細胞の大部分には負の選択もしくは制御性T細胞への分化が誘導される12).そこで,OT-IIをもつT細胞前駆細胞においてNr4aファミリーの活性を制御し,その運命を追跡した.その結果,Nr4aファミリーの活性のない状態では制御性T細胞はまったく分化しなかったが,Nr4aファミリーを活性化させた状態では制御性T細胞への分化が誘導されたことを示唆するFoxp3発現細胞の出現が確認された.Nr4aファミリーをさらに強く活性化すると,今度は細胞数の減少が確認され,負の選択の誘導が示唆された.これらの結果から,胸腺における自己抗原に対する親和性の強度にしたがったCD4陽性T細胞の運命決定において,Nr4aファミリーは必須のタンパク質として機能する可能性が強く示された(図2).
おわりに
胸腺におけるCD4陽性T細胞への分化の過程において,その運命はおもに自己抗原に対する親和性の強度により決定され,免疫恒常性の維持における重要な基盤となる.しかし,それを制御する分子機構はその多くが未解明であった.この研究では,核内受容体スーパーファミリーに属するNr4aファミリーが必須のタンパク質として機能することを明らかにした.この発見により,長いあいだブラックボックスとされてきた自己抗原に対する親和性と細胞運命の決定とを結ぶ分子機構の大部分が明らかになったといえる.今後も,Nr4aファミリーの機能に着目した研究を進めることにより,胸腺におけるT細胞の分化を制御する分子機構の詳細が明らかになると考えられ,ひいては,炎症性疾患の発症機序の解明や治療法の開発にも結びつくものと期待される.
文 献
- Fontenot, J. D., Gavin, M. A. & Rudensky, A. Y.: Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol., 4, 330-336 (2003)[PubMed]
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Khattri, R., Cox, T., Yasayko, S. A. et al.: An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat. Immunol., 4, 337-342 (2003)[PubMed]
- Stritesky, G. L., Jameson, S. C. & Hogquist, K. A.: Selection of self-reactive T cells in the thymus. Annu. Rev. Immunol., 30, 95-114 (2012)[PubMed]
- Sekiya, T., Kashiwagi, I., Inoue, N. et al.: The nuclear orphan receptor Nr4a2 induces Foxp3 and regulates differentiation of CD4+ T cells. Nat. Commun., 2, 269 (2011)[PubMed]
- Cheng, L. E., Chan, F. K., Cado, D. et al.: Functional redundancy of the Nur77 and Nor-1 orphan steroid receptors in T-cell apoptosis. EMBO J., 16, 1865-1875 (1997)[PubMed]
- Moran, A. E., Holzapfel, K. L., Xing, Y. et al.: T cell receptor signal strength in Treg and iNKT cell development demonstrated by a novel fluorescent reporter mouse. J. Exp. Med., 208, 1279-1289 (2011)[PubMed]
- Baldwin, T. A. & Hogquist, K. A.: Transcriptional analysis of clonal deletion in vivo. J. Immunol., 179, 837-844 (2007)[PubMed]
- Fassett, M. S., Jiang, W., D'Alise, A. M. et al.: Nuclear receptor Nr4a1 modulates both regulatory T-cell (Treg) differentiation and clonal deletion. Proc. Natl. Acad. Sci. USA, 109, 3891-3896 (2012)[PubMed]
- Zhou, T., Cheng, J., Yang, P. et al.: Inhibition of Nur77/Nurr1 leads to inefficient clonal deletion of self-reactive T cells. J. Exp. Med., 183, 1879-1892 (1996)[PubMed]
- Calnan, B. J., Szychowski, S., Chan, F. K. et al.: A role for the orphan steroid receptor Nur77 in apoptosis accompanying antigen-induced negative selection. Immunity, 3, 273-282 (1995)[PubMed]
- Proietto, A. I., van Dommelen, S., Zhou, P. et al.: Dendritic cells in the thymus contribute to T-regulatory cell induction. Proc. Natl. Acad. Sci. USA, 105, 19869-19874 (2008)[PubMed]
著者プロフィール
略歴:2004年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国Fox Chase Cancer Center博士研究員,2008年 慶應義塾大学医学部 博士研究員を経て,2010年 同 助教.
研究テーマ:CD4陽性T細胞の分化や機能発現を制御する分子機構の解明,および,それを人為的に制御する手法の確立.
関心事:生命科学全般.
吉村 昭彦(Akihiko Yoshimura)
慶應義塾大学医学部 教授.
研究室URL:http://new.immunoreg.jp/
© 2013 関谷高史・吉村昭彦 Licensed under CC 表示 2.1 日本