iPS細胞への初期化と再分化の誘導により抗原特異的なT細胞を若返らせる
西村聡修・中内啓光
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:西村聡修,中内啓光
DOI: 10.7875/first.author.2013.009
Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation.
Toshinobu Nishimura, Shin Kaneko, Ai Kawana-Tachikawa, Yoko Tajima, Haruo Goto, Dayong Zhu, Kaori Nakayama-Hosoya, Shoichi Iriguchi, Yasushi Uemura, Takafumi Shimizu, Naoya Takayama, Daisuke Yamada, Ken Nishimura, Manami Ohtaka, Nobukazu Watanabe, Satoshi Takahashi, Aikichi Iwamoto, Haruhiko Koseki, Mahito Nakanishi, Koji Eto, Hiromitsu Nakauchi
Cell Stem Cell, 12, 114-126 (2013)
体外において増幅した患者自身の抗原特異的なT細胞を用いてがんや感染症を治療する試みは,T細胞のもつ抗原認識能と細胞傷害能を利用した効率的な治療法である反面,慢性疾患における何回もの抗原刺激,および,体外増幅の過程における抗原刺激によりT細胞が疲弊し老化して低機能状態におちいってしまうため,期待しているほどの治療効果を得られていないのが現状である.筆者らは,HIV-1患者の体内に存在していた疲弊し老化したCD8陽性細胞傷害性T細胞をiPS細胞に初期化し,そのiPS細胞から再びCD8陽性細胞傷害性T細胞を分化誘導することに成功した.この過程において,T細胞のもっていた抗原特異性を保持することも可能になり,初期化したiPS細胞から目的の抗原に反応する細胞傷害性T細胞を大量に得られるようになった.また,再分化の誘導により得られた細胞傷害性T細胞には増殖能の回復とテロメアの伸長が認められた.この研究の成果は,さまざまな病態に対し,iPS細胞の特性を活かして“抗原特異的なT細胞を若返らせて再生する”という,まったく新しい免疫細胞療法につながると期待される.
われわれのからだはさまざまなウイルスや細菌,寄生虫などの外敵およびがんなどから身を守る免疫系をもっており,そのなかでT細胞は主たる役割を担っている.T細胞はその表面にT細胞受容体を発現しており,これを用いて外来抗原およびがん抗原を認識する.ひとつのT細胞はある特定の抗原を認識するT細胞受容体を発現し,これによりT細胞の抗原特異性が形成されている.無限ともいえるほどさまざまなかたちをとる抗原を認識するため,さまざまなかたちのT細胞受容体が用意されており,それに比例して体内には膨大な種類のT細胞が存在している.慢性ウイルス感染症やがんの患者は異常な細胞を完全に駆逐できないため,特定のウイルスやがんに特異性をもつT細胞が何度も抗原を認識し活性化するという行動をくり返し,これらのT細胞は攻撃性や増殖性などが弱まった疲弊および老化した状態におちいっている.
近年,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の技術の開発により,体細胞をES細胞(embryonic stem cell,胚性幹細胞)とほぼ同等の能力をもつ多能性幹細胞に初期化することが可能になり,免疫拒絶の心配がなく1),さまざまな疾患により機能不良あるいは機能不全を起こした細胞や臓器を置き換えてしまう再生医療の実現に大きな期待がよせられている.細胞の幼若性という側面からiPS細胞をみると,iPS細胞は受精まもない細胞と同じ性質をもつため,細胞としてはきわめて若い状態にある.iPS細胞をつくることは,分化してしまった細胞に万能性をもたせることのみならず,このきわめて若い状態へと変化させることでもある.すなわち,iPS細胞からもういちどその由来となった細胞をつくりだすことができれば,それらは材料となった細胞からみて相対的に若い状態にあることが予想されていた.
今回,筆者らは,HIV-1抗原に特異的なT細胞からiPS細胞(T-iPS細胞と名づけた)を作製し,そのT-iPS細胞から再びT細胞を誘導することを試みた.この一連の操作により,疲弊し老化した状態にあるT細胞を抗原特異性を維持したまま若々しい状態へと回復させることができるのではないかと仮説をたて,研究に取り組んだ(図1).
慢性HIV-1感染症の患者の血液を採取し,そこからNef 2) に由来する抗原ペプチドNef-138-8(Class I HLAであるHLA-A24に提示される)に特異的なCD8陽性T細胞を分離しクローン化した.このT細胞をもとの由来となるT細胞としてのちの実験を行うにあたり,HLA-A24-Nef-138-8四量体への反応性,インターフェロンγなどサイトカインの産生能,細胞傷害能をもつ正常な細胞傷害性T細胞であること,を確認した.
つづいて,このT細胞をセンダイウイルスを用いた遺伝子導入法によりiPS細胞へと初期化した3).樹立されたiPS細胞は自己複製能や多分化能をもつES細胞と同等の性質を示した.また,遺伝子導入に用いたセンダイウイルスのRNAゲノムはiPS細胞となったのち細胞質から除去されていることを確認し,以後の過程における外来遺伝子の影響(腫瘍化を含む)を排除することが可能であることを確認した.
ヒト末梢血のほとんどすべてのT細胞はα鎖とβ鎖のヘテロ二量体からなるT細胞受容体を発現しており,α鎖およびβ鎖はTCRA遺伝子およびTCRB遺伝子によりコードされている.この2つの遺伝子は胸腺における発生段階において遺伝子再構成を起こし,それらは樹立されたiPS細胞がもとのT細胞に由来するかどうかをあとから知る指標ともなりうる.膨大な数のVセグメント,Dセグメント,Jセグメントとそれらの組合せにより形成されるT細胞受容体遺伝子の再構成を解析するため,縮重プライマーとマルチプレックスPCR法によるV(D)J結合領域の配列解析法を開発した4).この手法により,樹立されたiPS細胞のゲノムDNAにおけるT細胞受容体遺伝子の再構成を解析したところ,由来となったT細胞と同一の遺伝子再構成をもっていることがわかり,T-iPS細胞には由来となったT細胞と同じ抗原特異性の保持されることが明らかになった.
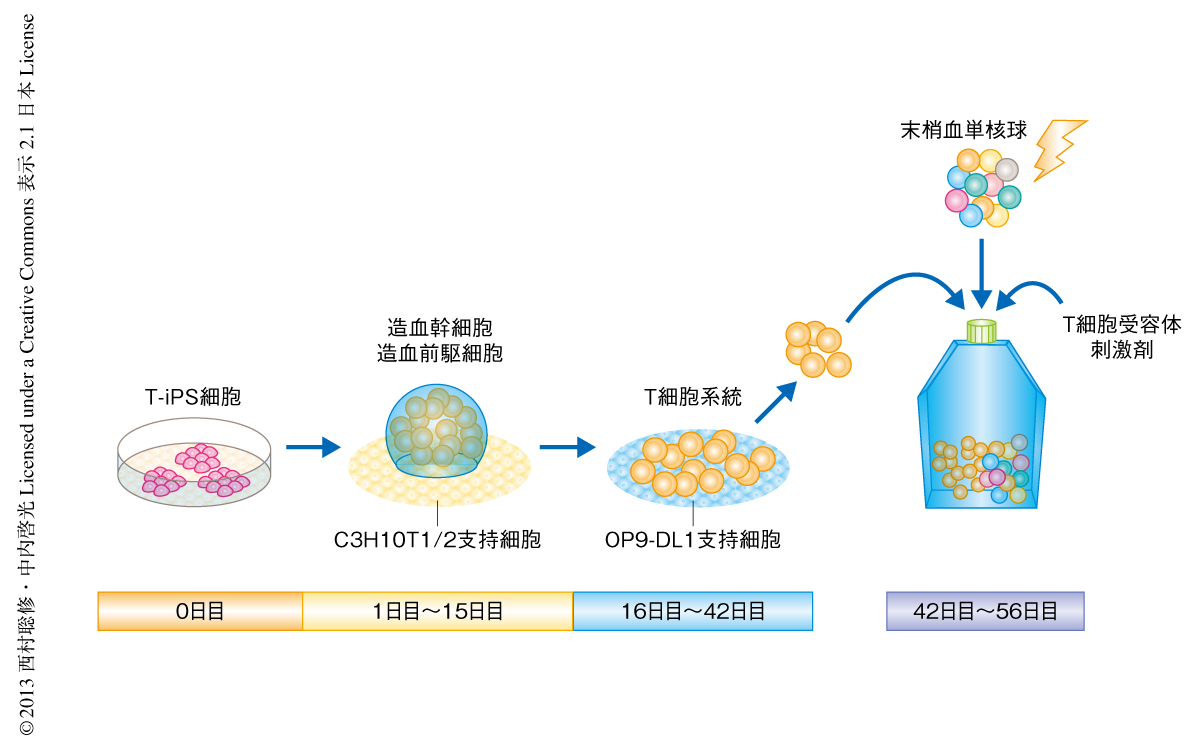
ES細胞およびiPS細胞はC3H10T1/2支持細胞との共培養により,CD34陽性の造血幹細胞および造血前駆細胞に分化誘導することが可能で5),つづいて,それら造血幹細胞および造血前駆細胞をOP9-DL1支持細胞と共培養することにより,T細胞系統へと分化誘導することが可能である6)(図2).ただし,この方法ではCD4陽性CD8陽性の段階までの細胞しか得られない.実際に,樹立されたT-iPS細胞を用いて同様の分化誘導を試みたところ,CD45陽性,CD38陽性,CD7陽性,CD5陽性,CD45RA陽性,CD3陽性,T細胞受容体α鎖β鎖ヘテロ二量体陽性など,各種のT細胞系統のマーカーを発現する細胞が得られた.しかし,一点のみ正常な胸腺細胞の発生とは異なっており,CD4陰性CD8陰性の段階の細胞においても完全なT細胞受容体α鎖β鎖ヘテロ二量体が発現していた.通常の胸腺細胞の発生では,CD4陰性CD8陰性の段階でTCRB遺伝子の再構成が,CD4陽性CD8陽性の段階でTCRA遺伝子の再構成が起こるが,T-iPS細胞から再分化した細胞はすでに完成したTCRA遺伝子およびTCRB遺伝子をもっているため,通常はT細胞受容体β鎖が発現しはじめるくらいの早い段階においても,完全なT細胞受容体α鎖β鎖ヘテロ二量体が発現してしまうものと考えられた.
さきに述べたとおり,CD4陰性CD8陰性の段階およびCD4陽性CD8陽性の段階の細胞でT細胞受容体遺伝子の再構成が起こる.それらのうち,TCRB遺伝子には正常な再構成が起こると発現したタンパク質からの負のフィードバック制御によりそれ以上の組換えを抑止するしくみがある.一方,TCRA遺伝子にはそのような制御機構は存在せず,いちど組換えの起こったあとから追加の組換えの起こる場合がある7).T-iPS細胞からの分化誘導系においても,再構成の行われたT細胞受容体遺伝子,とくに,TCRA遺伝子に追加の遺伝子再構成の起こる可能性が危惧された.実際に,CD4陰性CD8陰性の段階およびCD4陽性CD8陽性段階の細胞を分取しT細胞受容体遺伝子の再構成を解析したところ,予想どおり,CD4陽性CD8陽性の段階においてTCRA遺伝子に追加の組換えの起こることが明らかになった.この事象はT-iPS細胞の段階において保存されていた抗原特異性を変化させてしまうため不都合なことであった.
T細胞受容体α鎖β鎖ヘテロ二量体からのシグナルが遺伝子組換え酵素であるRAG1とRAG2の発現を消失させることが知られていたため8),これに習い,TCRA遺伝子において追加の再構成の起こりはじめるまえの段階の細胞にT細胞受容体からのシグナルを誘起させた.また,シグナルの誘起と同時にT細胞の標準的な培養系である末梢血単核球を支持細胞とした共培養法に切り替えたところ,OP9-DL1支持細胞との共培養法では得られなかった完熟段階であるCD4陰性CD8陽性細胞を誘導することに成功した(図2).マーカーの発現や遺伝子発現の解析により,これらCD4陰性CD8陽性細胞はCD8陽性T細胞とほとんど同一の性質をもつ細胞であることが明らかになった.再分化の誘導されたCD8陽性T細胞の発現するT細胞受容体の解析を行ったところ,追加の再構成の起こることなく,樹立されたT-iPS細胞および由来となったT細胞と同一の配列であることが明らかになった.
再分化の誘導されたCD8陽性T細胞の機能解析を行うにあたり,HLA-A24-Nef-138-8四量体への結合能を解析したところ反応性を保持していることが確認された.つづいて,HLA-A24に提示されるNef以外の抗原ペプチドを陰性対照とし,また,抗原提示細胞としてHLA-A24を発現する不死化B細胞を用いて,再分化の誘導されたCD8陽性T細胞の抗原特異的な機能解析を行った.リソソーム膜およびエンドソーム膜に存在するCD107aの表面への一時的な露出を指標とした脱顆粒の検証,ELISPOT法によるインターフェロンγの産生と放出の検証,51Crリリース法による細胞傷害能の検証のすべてにおいて,陰性対照において反応はみられず,Nef-138-8に特異的にT細胞の機能を発揮することが示された.
T-iPS細胞を介することにより,由来となったT細胞と再分化の誘導されたCD8陽性T細胞とに幼若性の違いがあるかどうかを検証した.幼若性の指標のひとつであるテロメアの長さを測定したところ,再分化の誘導されたCD8陽性T細胞はより長いテロメアをもっていることが確認され,これはiPS細胞のもつ高いテロメラーゼ活性によるものであると考えられた9).メモリーT細胞は長いテロメアをもつものほど高いメモリー機能を発揮する.再分化の誘導されたCD8陽性T細胞も,CCR7陽性,CD27陽性,CD28陽性というメモリーT細胞のマーカーを発現しており,よいメモリーT細胞と考えられた.実際に,再分化の誘導されたCD8陽性T細胞の増殖性を検証したところ,由来となったT細胞と比較して10~100倍も高い増殖性が示された.
6 cmディッシュ1枚分に相当する3×105個のT-iPS細胞からは,OP9-DL1支持細胞との共培養の段階までに105個程度のT細胞系統しか得ることができなかったが,末梢血単核球との共培養法および増殖率をもとにした推定では,完熟した再分化の誘導されたCD8陽性T細胞を108~109個のレベルまで増やすことが可能であると思われた.また,スタートのT-iPS細胞の量および全体の培養スケールを数倍にすることも容易であることから,成人ひとりに数回の輸血注入を行う細胞量としては十分であると考えられた.
筆者らは,この研究により,特定の抗原を認識し攻撃する細胞傷害性T細胞を若返らせる手法の基礎が確立されたものと考えている.再分化の誘導された細胞傷害性T細胞が患者の体内において機能するのか,さらには,よりよい機能を発揮するのかどうかは,これからの検証の待たれる部分ではあるが,この手法が慢性感染症やがん10) に対する画期的な治療法を提供する可能性も大いに期待できる.また,若返った細胞傷害性T細胞は自家移植のみならずHLAの適合する別の患者にも注入することが可能であると考えられるため,さまざまな疾患に対する抗原特異的なT-iPS細胞バンクによる,すばやい免疫療法も実現するものと期待している.
略歴:2012年 東京大学大学院新領域創成科学研究科博士課程 修了,同年より東京大学医科学研究所 研究員.
研究テーマ:iPS細胞からの血球細胞の分化誘導および再生医療への応用.
関心事:美味しい梅干しを通販で買うこと.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2013 西村聡修・中内啓光 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 幹細胞治療研究センター幹細胞治療分野)
email:西村聡修,中内啓光
DOI: 10.7875/first.author.2013.009
Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation.
Toshinobu Nishimura, Shin Kaneko, Ai Kawana-Tachikawa, Yoko Tajima, Haruo Goto, Dayong Zhu, Kaori Nakayama-Hosoya, Shoichi Iriguchi, Yasushi Uemura, Takafumi Shimizu, Naoya Takayama, Daisuke Yamada, Ken Nishimura, Manami Ohtaka, Nobukazu Watanabe, Satoshi Takahashi, Aikichi Iwamoto, Haruhiko Koseki, Mahito Nakanishi, Koji Eto, Hiromitsu Nakauchi
Cell Stem Cell, 12, 114-126 (2013)
要 約
体外において増幅した患者自身の抗原特異的なT細胞を用いてがんや感染症を治療する試みは,T細胞のもつ抗原認識能と細胞傷害能を利用した効率的な治療法である反面,慢性疾患における何回もの抗原刺激,および,体外増幅の過程における抗原刺激によりT細胞が疲弊し老化して低機能状態におちいってしまうため,期待しているほどの治療効果を得られていないのが現状である.筆者らは,HIV-1患者の体内に存在していた疲弊し老化したCD8陽性細胞傷害性T細胞をiPS細胞に初期化し,そのiPS細胞から再びCD8陽性細胞傷害性T細胞を分化誘導することに成功した.この過程において,T細胞のもっていた抗原特異性を保持することも可能になり,初期化したiPS細胞から目的の抗原に反応する細胞傷害性T細胞を大量に得られるようになった.また,再分化の誘導により得られた細胞傷害性T細胞には増殖能の回復とテロメアの伸長が認められた.この研究の成果は,さまざまな病態に対し,iPS細胞の特性を活かして“抗原特異的なT細胞を若返らせて再生する”という,まったく新しい免疫細胞療法につながると期待される.
はじめに
われわれのからだはさまざまなウイルスや細菌,寄生虫などの外敵およびがんなどから身を守る免疫系をもっており,そのなかでT細胞は主たる役割を担っている.T細胞はその表面にT細胞受容体を発現しており,これを用いて外来抗原およびがん抗原を認識する.ひとつのT細胞はある特定の抗原を認識するT細胞受容体を発現し,これによりT細胞の抗原特異性が形成されている.無限ともいえるほどさまざまなかたちをとる抗原を認識するため,さまざまなかたちのT細胞受容体が用意されており,それに比例して体内には膨大な種類のT細胞が存在している.慢性ウイルス感染症やがんの患者は異常な細胞を完全に駆逐できないため,特定のウイルスやがんに特異性をもつT細胞が何度も抗原を認識し活性化するという行動をくり返し,これらのT細胞は攻撃性や増殖性などが弱まった疲弊および老化した状態におちいっている.
近年,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の技術の開発により,体細胞をES細胞(embryonic stem cell,胚性幹細胞)とほぼ同等の能力をもつ多能性幹細胞に初期化することが可能になり,免疫拒絶の心配がなく1),さまざまな疾患により機能不良あるいは機能不全を起こした細胞や臓器を置き換えてしまう再生医療の実現に大きな期待がよせられている.細胞の幼若性という側面からiPS細胞をみると,iPS細胞は受精まもない細胞と同じ性質をもつため,細胞としてはきわめて若い状態にある.iPS細胞をつくることは,分化してしまった細胞に万能性をもたせることのみならず,このきわめて若い状態へと変化させることでもある.すなわち,iPS細胞からもういちどその由来となった細胞をつくりだすことができれば,それらは材料となった細胞からみて相対的に若い状態にあることが予想されていた.
今回,筆者らは,HIV-1抗原に特異的なT細胞からiPS細胞(T-iPS細胞と名づけた)を作製し,そのT-iPS細胞から再びT細胞を誘導することを試みた.この一連の操作により,疲弊し老化した状態にあるT細胞を抗原特異性を維持したまま若々しい状態へと回復させることができるのではないかと仮説をたて,研究に取り組んだ(図1).
1.HIV患者の末梢血からT-iPS細胞を樹立する
慢性HIV-1感染症の患者の血液を採取し,そこからNef 2) に由来する抗原ペプチドNef-138-8(Class I HLAであるHLA-A24に提示される)に特異的なCD8陽性T細胞を分離しクローン化した.このT細胞をもとの由来となるT細胞としてのちの実験を行うにあたり,HLA-A24-Nef-138-8四量体への反応性,インターフェロンγなどサイトカインの産生能,細胞傷害能をもつ正常な細胞傷害性T細胞であること,を確認した.
つづいて,このT細胞をセンダイウイルスを用いた遺伝子導入法によりiPS細胞へと初期化した3).樹立されたiPS細胞は自己複製能や多分化能をもつES細胞と同等の性質を示した.また,遺伝子導入に用いたセンダイウイルスのRNAゲノムはiPS細胞となったのち細胞質から除去されていることを確認し,以後の過程における外来遺伝子の影響(腫瘍化を含む)を排除することが可能であることを確認した.
2.樹立されたT-iPS細胞は組換えの起こったT細胞受容体遺伝子を保持している
ヒト末梢血のほとんどすべてのT細胞はα鎖とβ鎖のヘテロ二量体からなるT細胞受容体を発現しており,α鎖およびβ鎖はTCRA遺伝子およびTCRB遺伝子によりコードされている.この2つの遺伝子は胸腺における発生段階において遺伝子再構成を起こし,それらは樹立されたiPS細胞がもとのT細胞に由来するかどうかをあとから知る指標ともなりうる.膨大な数のVセグメント,Dセグメント,Jセグメントとそれらの組合せにより形成されるT細胞受容体遺伝子の再構成を解析するため,縮重プライマーとマルチプレックスPCR法によるV(D)J結合領域の配列解析法を開発した4).この手法により,樹立されたiPS細胞のゲノムDNAにおけるT細胞受容体遺伝子の再構成を解析したところ,由来となったT細胞と同一の遺伝子再構成をもっていることがわかり,T-iPS細胞には由来となったT細胞と同じ抗原特異性の保持されることが明らかになった.
3.再分化の誘導により得られたCD8陽性T細胞は起源となったT細胞と同一のT細胞受容体を発現する
ES細胞およびiPS細胞はC3H10T1/2支持細胞との共培養により,CD34陽性の造血幹細胞および造血前駆細胞に分化誘導することが可能で5),つづいて,それら造血幹細胞および造血前駆細胞をOP9-DL1支持細胞と共培養することにより,T細胞系統へと分化誘導することが可能である6)(図2).ただし,この方法ではCD4陽性CD8陽性の段階までの細胞しか得られない.実際に,樹立されたT-iPS細胞を用いて同様の分化誘導を試みたところ,CD45陽性,CD38陽性,CD7陽性,CD5陽性,CD45RA陽性,CD3陽性,T細胞受容体α鎖β鎖ヘテロ二量体陽性など,各種のT細胞系統のマーカーを発現する細胞が得られた.しかし,一点のみ正常な胸腺細胞の発生とは異なっており,CD4陰性CD8陰性の段階の細胞においても完全なT細胞受容体α鎖β鎖ヘテロ二量体が発現していた.通常の胸腺細胞の発生では,CD4陰性CD8陰性の段階でTCRB遺伝子の再構成が,CD4陽性CD8陽性の段階でTCRA遺伝子の再構成が起こるが,T-iPS細胞から再分化した細胞はすでに完成したTCRA遺伝子およびTCRB遺伝子をもっているため,通常はT細胞受容体β鎖が発現しはじめるくらいの早い段階においても,完全なT細胞受容体α鎖β鎖ヘテロ二量体が発現してしまうものと考えられた.
さきに述べたとおり,CD4陰性CD8陰性の段階およびCD4陽性CD8陽性の段階の細胞でT細胞受容体遺伝子の再構成が起こる.それらのうち,TCRB遺伝子には正常な再構成が起こると発現したタンパク質からの負のフィードバック制御によりそれ以上の組換えを抑止するしくみがある.一方,TCRA遺伝子にはそのような制御機構は存在せず,いちど組換えの起こったあとから追加の組換えの起こる場合がある7).T-iPS細胞からの分化誘導系においても,再構成の行われたT細胞受容体遺伝子,とくに,TCRA遺伝子に追加の遺伝子再構成の起こる可能性が危惧された.実際に,CD4陰性CD8陰性の段階およびCD4陽性CD8陽性段階の細胞を分取しT細胞受容体遺伝子の再構成を解析したところ,予想どおり,CD4陽性CD8陽性の段階においてTCRA遺伝子に追加の組換えの起こることが明らかになった.この事象はT-iPS細胞の段階において保存されていた抗原特異性を変化させてしまうため不都合なことであった.
T細胞受容体α鎖β鎖ヘテロ二量体からのシグナルが遺伝子組換え酵素であるRAG1とRAG2の発現を消失させることが知られていたため8),これに習い,TCRA遺伝子において追加の再構成の起こりはじめるまえの段階の細胞にT細胞受容体からのシグナルを誘起させた.また,シグナルの誘起と同時にT細胞の標準的な培養系である末梢血単核球を支持細胞とした共培養法に切り替えたところ,OP9-DL1支持細胞との共培養法では得られなかった完熟段階であるCD4陰性CD8陽性細胞を誘導することに成功した(図2).マーカーの発現や遺伝子発現の解析により,これらCD4陰性CD8陽性細胞はCD8陽性T細胞とほとんど同一の性質をもつ細胞であることが明らかになった.再分化の誘導されたCD8陽性T細胞の発現するT細胞受容体の解析を行ったところ,追加の再構成の起こることなく,樹立されたT-iPS細胞および由来となったT細胞と同一の配列であることが明らかになった.
4.再分化の誘導されたCD8陽性T細胞は抗原特異的なT細胞の機能を発揮する
再分化の誘導されたCD8陽性T細胞の機能解析を行うにあたり,HLA-A24-Nef-138-8四量体への結合能を解析したところ反応性を保持していることが確認された.つづいて,HLA-A24に提示されるNef以外の抗原ペプチドを陰性対照とし,また,抗原提示細胞としてHLA-A24を発現する不死化B細胞を用いて,再分化の誘導されたCD8陽性T細胞の抗原特異的な機能解析を行った.リソソーム膜およびエンドソーム膜に存在するCD107aの表面への一時的な露出を指標とした脱顆粒の検証,ELISPOT法によるインターフェロンγの産生と放出の検証,51Crリリース法による細胞傷害能の検証のすべてにおいて,陰性対照において反応はみられず,Nef-138-8に特異的にT細胞の機能を発揮することが示された.
5.再分化の誘導されたCD8陽性T細胞は幼若性を獲得している
T-iPS細胞を介することにより,由来となったT細胞と再分化の誘導されたCD8陽性T細胞とに幼若性の違いがあるかどうかを検証した.幼若性の指標のひとつであるテロメアの長さを測定したところ,再分化の誘導されたCD8陽性T細胞はより長いテロメアをもっていることが確認され,これはiPS細胞のもつ高いテロメラーゼ活性によるものであると考えられた9).メモリーT細胞は長いテロメアをもつものほど高いメモリー機能を発揮する.再分化の誘導されたCD8陽性T細胞も,CCR7陽性,CD27陽性,CD28陽性というメモリーT細胞のマーカーを発現しており,よいメモリーT細胞と考えられた.実際に,再分化の誘導されたCD8陽性T細胞の増殖性を検証したところ,由来となったT細胞と比較して10~100倍も高い増殖性が示された.
6 cmディッシュ1枚分に相当する3×105個のT-iPS細胞からは,OP9-DL1支持細胞との共培養の段階までに105個程度のT細胞系統しか得ることができなかったが,末梢血単核球との共培養法および増殖率をもとにした推定では,完熟した再分化の誘導されたCD8陽性T細胞を108~109個のレベルまで増やすことが可能であると思われた.また,スタートのT-iPS細胞の量および全体の培養スケールを数倍にすることも容易であることから,成人ひとりに数回の輸血注入を行う細胞量としては十分であると考えられた.
おわりに
筆者らは,この研究により,特定の抗原を認識し攻撃する細胞傷害性T細胞を若返らせる手法の基礎が確立されたものと考えている.再分化の誘導された細胞傷害性T細胞が患者の体内において機能するのか,さらには,よりよい機能を発揮するのかどうかは,これからの検証の待たれる部分ではあるが,この手法が慢性感染症やがん10) に対する画期的な治療法を提供する可能性も大いに期待できる.また,若返った細胞傷害性T細胞は自家移植のみならずHLAの適合する別の患者にも注入することが可能であると考えられるため,さまざまな疾患に対する抗原特異的なT-iPS細胞バンクによる,すばやい免疫療法も実現するものと期待している.
文 献
- Araki, R., Uda, M., Hoki, Y. et al.: Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells. Nature, 494, 100-104 (2013)[PubMed]
- Fujiwara, M., Tanuma, J., Koizumi, H. et al.: Different abilities of escape mutant-specific cytotoxic T cells to suppress replication of escape mutant and wild-type human immunodeficiency virus type 1 in new hosts. J. Virol., 82, 138-147 (2008)[PubMed]
- Nishimura, K., Sano, M., Ohtaka, M. et al.: Development of defective and persistent Sendai virus vector: a unique gene delivery/expression system ideal for cell reprogramming. J. Biol. Chem., 286, 4760-4771 (2011)[PubMed]
- van Dongen, J. J., Langerak, A. W., Bruggemann, M. et al.: Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia, 17, 2257-2317 (2003)[PubMed]
- Takayama, N., Nishikii, H., Usui ,J. et al.: Generation of functional platelets from human embryonic stem cells in vitro via ES-sacs, VEGF-promoted structures that concentrate hematopoietic progenitors. Blood, 111, 5298-5306 (2008)[PubMed]
- Timmermans, F., Velghe, I., Vanwalleghem, L. et al.: Generation of T cells from human embryonic stem cell-derived hematopoietic zones. J. Immunol., 182, 6879-6888 (2009)[PubMed]
- Krangel, M. S.: Mechanics of T cell receptor gene rearrangement. Curr. Opin. Immunol., 21, 133-139 (2009)[PubMed]
- Turka, L. A., Schatz, D. G., Oettinger, M. A. et al.: Thymocyte expression of RAG-1 and RAG-2: termination by T cell receptor cross-linking. Science, 253, 778-781 (1991)[PubMed]
- Marion, R. M., Strati, K., Li, H. et al.: Telomeres acquire embryonic stem cell characteristics in induced pluripotent stem cells. Cell Stem Cell, 4, 141-154 (2009)[PubMed]
- Vizcardo, R., Masuda, K., Yamada, D. et al.: Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8+ T cells. Cell Stem Cell, 12, 31-36 (2013)[PubMed]
著者プロフィール
略歴:2012年 東京大学大学院新領域創成科学研究科博士課程 修了,同年より東京大学医科学研究所 研究員.
研究テーマ:iPS細胞からの血球細胞の分化誘導および再生医療への応用.
関心事:美味しい梅干しを通販で買うこと.
中内 啓光(Hiromitsu Nakauchi)
東京大学医科学研究所 教授.
研究室URL:http://stemcell-u-tokyo.org/sct/
© 2013 西村聡修・中内啓光 Licensed under CC 表示 2.1 日本