持続的なインターロイキン7シグナルは生存シグナルではなく細胞死を誘導する
木村元子・Alfred Singer
(米国NIH National Cancer Institute,Experimental Immunology Branch)
email:木村元子
DOI: 10.7875/first.author.2013.008
IL-7 signaling must be intermittent, not continuous, during CD8+ T cell homeostasis to promote cell survival instead of cell death.
Motoko Y. Kimura, Leonid A. Pobezinsky, Terry I. Guinter, Julien Thomas, Anthony Adams, Jung-Hyun Park, Xuguang Tai, Alfred Singer
Nature Immunology, 14, 143-151 (2013)
ナイーブCD8陽性T細胞の生存の維持には,インターロイキン7(IL-7)シグナルと自己抗原に由来するT細胞受容体シグナル(ホメオスタティックT細胞受容体シグナル)の必要であることが知られているが,なぜこの2つのシグナルが必要なのか,その理由は不明である.この論文において,筆者らは,持続的なIL-7シグナルはCD8陽性T細胞の増殖およびインターフェロンγの産生を誘導し,インターフェロンγシグナルに依存的な細胞死を誘導することを明らかにした.ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することにより細胞死を防ぎ,CD8陽性T細胞の生存の維持をもたらすと考えられた.一方,機能的なT細胞受容体をもたないCD8陽性T細胞は十分なホメオスタティックT細胞受容体シグナルを受け取れず,結果として,持続的なIL-7シグナルを受け取り死にいたる可能性が示された.以上の結果より,ホメオスタティックT細胞受容体シグナルはIL-7シグナルの持続時間を制御することにより,機能的なT細胞受容体をもつCD8陽性T細胞の生存を促進していることが示唆された.
胸腺は自己のMHC分子に提示された自己ペプチドとゆるやかに反応できるT細胞受容体を発現したT細胞のみを選択し,これを分化成熟させ末梢へと送り出す.T細胞が分化成熟できるのは胸腺のなかだけであり,また,胸腺は年齢にともない萎縮することから,末梢へと送り出されたナイーブT細胞の生存の維持は生体における免疫系の構築の基盤となる.これまでの研究から,ナイーブCD8陽性T細胞の生存維持にはインターロイキン7(IL-7)シグナルと自己抗原に由来するT細胞受容体シグナル(ホメオスタティックT細胞受容体シグナル)の2つが重要であることが明らかにされていた1,2).IL-7シグナルはBcl2など抗アポトーシスタンパク質を誘導することから細胞の生存維持に重要であることは想像にかたくない.一方,なぜホメオスタティックT細胞受容体シグナルが細胞の生存に必要なのか,なぜIL-7シグナルだけでは細胞の生存維持に不十分なのかはわかっていなかった.
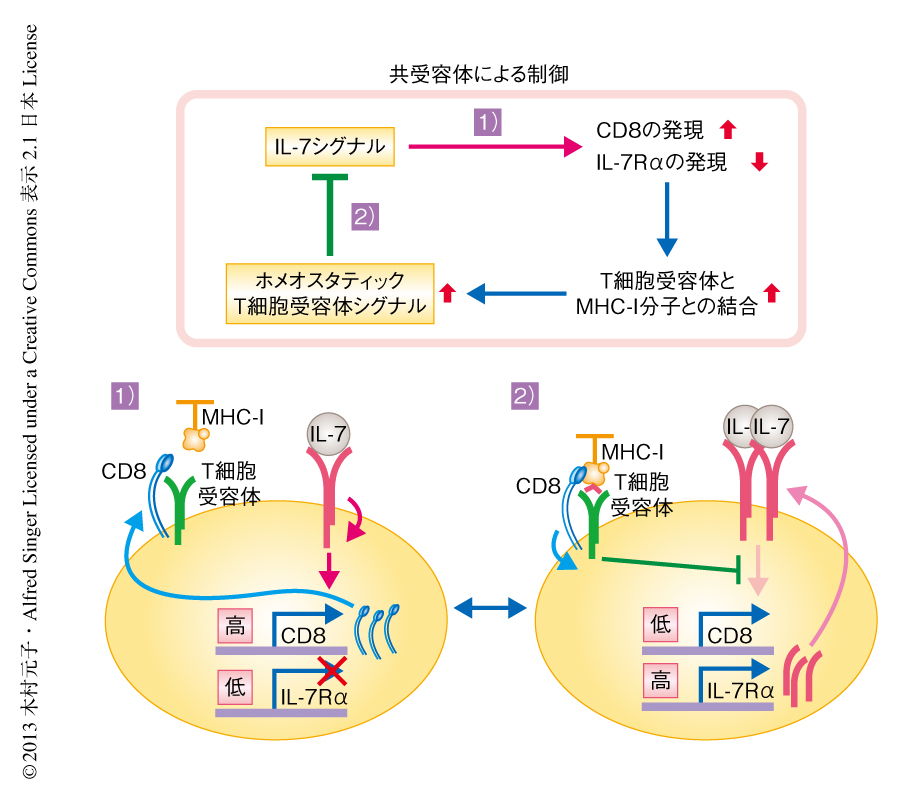
筆者らの以前の報告により3),IL-7シグナルとホメオスタティックT細胞受容体シグナルとが相互に制御しあっていることは明らかだった(図1).まず,IL-7シグナルは共受容体であるCD8の発現を誘導しT細胞受容体とMHC-I分子との結合を促進する.つづいて,T細胞受容体-CD8複合体とMHC-I分子との結合により誘導されたホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制する.IL-7シグナルの抑制はCD8の発現低下をもたらし,T細胞受容体-CD8複合体とMHC-I分子との結合は解除されて,細胞はふたたびIL-7シグナルを受け取るようになる.ナイーブCD8陽性T細胞はこの制御機構により,“断続的に”IL-7シグナルとホメオスタティックT細胞受容体シグナルを受け取り,生存維持するものと考えられる.
一方で,IL-7シグナルは非常にユニークな自己制御を行うことが知られている.すなわち,IL-7シグナルはIL-7Rαの発現を転写レベルにおいて抑制することにより,自らのシグナルを自己抑制している4).ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することから,IL-7シグナルにより低下したIL-7Rα発現の誘導および維持をもたらすことで,細胞がIL-7シグナルを受け取れるようにしているとも考えられた.
以上のことより,今回の論文では,ナイーブCD8陽性T細胞が“持続的に”IL-7シグナルを受け取るとしたらホメオスタティックT細胞受容体シグナルは不必要なのではないかという仮定のもと,実験を開始した.
ナイーブCD8陽性T細胞が持続的にIL-7シグナルを受け取るようにするため,IL-7シグナルに影響されずにIL-7Rαの発現を恒常的に維持できるコンストラクトを利用した.IL-7Rαの過剰な発現をさけるためIL-7Rαノックアウトマウスにこのコンストラクトを発現させたトランスジェニックマウスを作製したところ,細胞の表面におけるIL-7Rαの発現は野生型マウスとほぼ同じ程度であった.このIL-7RαトランスジェニックマウスのCD8陽性T細胞において,短時間(30分)のIL-7刺激によるStat5のリン酸化は野生型と同じ程度であったが,長期間(1週間)にわたるIL-7刺激ではStat5のリン酸化は高い状態を維持していることが確認された.このことから,このIL-7RαトランスジェニックマウスのCD8陽性T細胞は持続的にIL-7シグナルを伝達していることがわかった.
このIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞の生存維持にホメオスタティックT細胞受容体シグナルが必要かどうかを検討するため,リンパ球の減少しているホストマウスへの移入実験を行った.移入するCD8陽性T細胞はT細胞受容体のレパートリーの違いによる影響をなくすため,MHC-I拘束性のT細胞受容体トランスジェニックマウスに由来するものを用いた.野生型のCD8陽性T細胞はMHC-I分子の存在するC57BL/6ホストマウスにおいてリンパ球減少誘導増殖(lymphopenia-induced proliferation:LIP)により増殖し,MHC-I分子の存在しないβ2ミクログロブリンを欠損したホストマウスにおいてはホメオスタティックT細胞受容体シグナルが受け取れないため増殖せず細胞の生存もきわめて悪かった.一方,興味深いことに,IL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞は,MHC-I分子の存在しないホストマウスにおいても増殖することがわかった.しかしながら,ホメオスタティックT細胞受容体シグナルの存在しない状況においてその生存は依然として低かったことから,“持続的な”IL-7シグナルはリンパ球減少誘導増殖を誘導するには十分であるが,細胞の生存には不十分であることがわかった.
生存シグナルを担うはずのIL-7シグナルが持続的に伝達されているにもかかわらずCD8陽性T細胞の生存が不十分であるという事実にたいへん驚かされたことから,その分子機構を探るためin vitroにおける実験を試みた.IL-7Rαを恒常的に発現するトランスジェニックマウスから調製したナイーブCD8陽性T細胞をIL-7の存在下で培養したところ激しく増殖し,ほぼ90%が約2週間で死にいたることがわかった.また,この培養において,CD8陽性T細胞はインターフェロンγを産生していることが観察された.
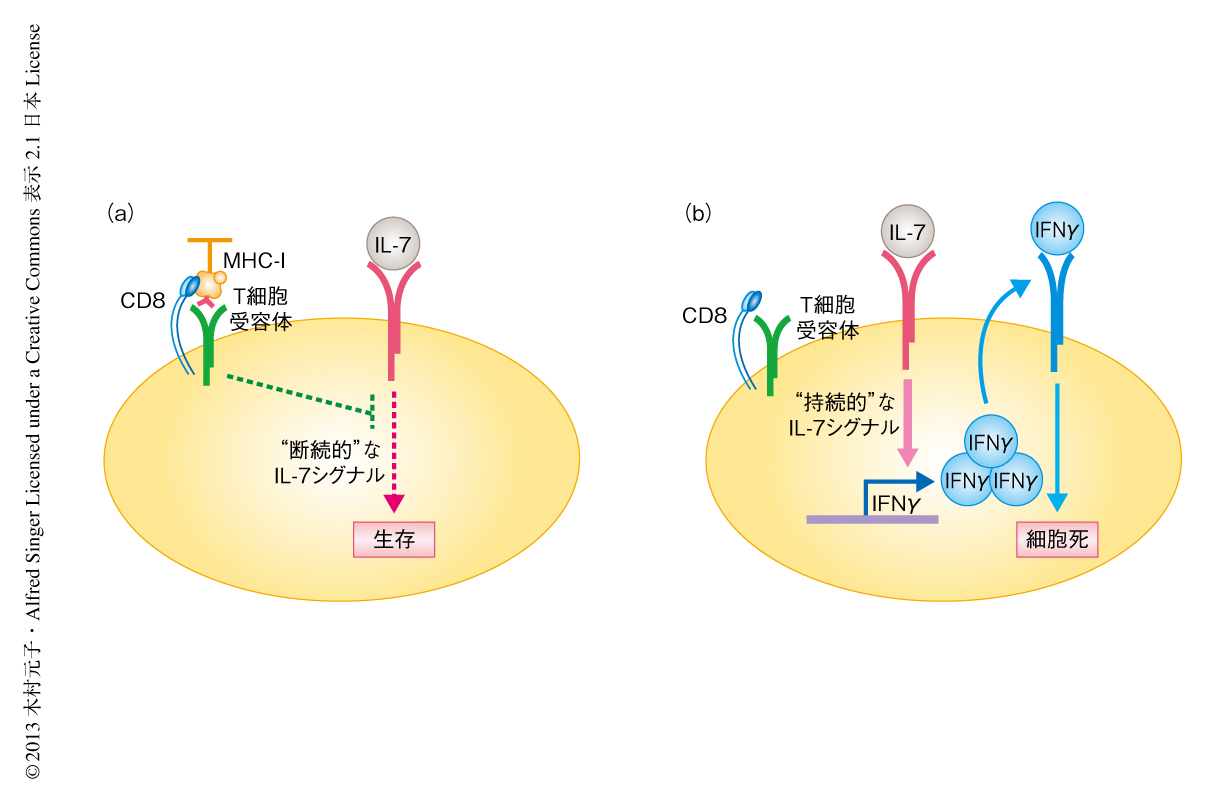
この細胞死が,本当にIL-7を持続的に受け取った結果もたらされたものなのかどうかを検討するため,ナイーブCD8陽性T細胞を断続的なIL-7シグナルのもとで培養することを試みた.IL-7Rαを恒常的に発現するトランスジェニックマウスから調製したナイーブCD8陽性T細胞を,IL-7存在下で14時間にわたり培養したのち,培養液で2回洗浄することによりIL-7を完全に除き,そののち10時間にわたりIL-7の非存在下で培養する,というサイクルを2~3週間くり返した.断続的なIL-7シグナルのもと培養することによりナイーブCD8陽性T細胞は増殖せず,インターフェロンγも産生せず,また,CD44低発現型のナイーブ表現型を維持することがわかった.この結果より,断続的なIL-7シグナルはナイーブCD8陽性T細胞に生存をもたらし,持続的なIL-7シグナルは死をもたらすことがわかった.そこで,持続的なIL-7シグナルによる細胞死をサイトカインに誘導される細胞死(cytokine-induced cell death:CICD)とよぶことにした.
サイトカインに誘導される細胞死の分子機構として2つの可能性を考えた.ひとつは,抗アポトーシスタンパク質の誘導が起こらないため細胞死の起こる可能性,もうひとつは,アポトーシスタンパク質が積極的に誘導されている可能性である.1つ目の可能性を検討するため,持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,抗アポトーシスタンパク質であるBcl2,BclxL,Mcl1の発現をウェスタンブロット法により検討した.その結果,いずれの抗アポトーシスタンパク質の発現にも低下はみられず,むしろ,高かったことから,抗アポトーシスタンパク質の発現低下による細胞死の可能性は否定された.
つぎに,2つ目の可能性を検討するため,エフェクターカスパーゼであるカスパーゼ3の発現を検討したところ,持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,活性型カスパーゼ3の顕著に誘導されていることが確認された.カスパーゼ3の活性化をもたらすシグナルを同定するため,2つの細胞死誘導経路について検討した.ひとつは,細胞死受容体を介する外因性の細胞死経路,すなわち,Fas-FasL依存的な経路,もうひとつは,内因性の細胞死経路であるミトコンドリア依存的な経路である.持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,FasLとFasにはともに顕著な発現の上昇がみられた.また,Bimの発現の上昇していることもわかった.そこで,Fasを欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスと,Bimを欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスをそれぞれ作製し,それらのナイーブCD8陽性T細胞がサイトカインに誘導される細胞死をまぬがれるかどうか検討した.その結果,いずれの場合においても若干は回復したものの依然として激しい細胞死が観察されたことより,これらFas-FasLならびにBimに依存的な細胞死経路は持続的なIL-7シグナルにより活性化されるものの,サイトカインに誘導される細胞死における主要な経路ではないと考えられた.
持続的なIL-7シグナルはインターフェロンγの産生を誘導することから,インターフェロンγがサイトカインに誘導される細胞死に関与している可能性について検討した.IL-7Rαを恒常的に発現するトランスジェニックマウスをインターフェロンγR1ノックアウトマウスと交配し,インターフェロンγシグナルを欠損しIL-7Rαを恒常的に発現するCD8陽性T細胞を作製した.驚くべきことに,このCD8陽性T細胞は持続的なIL-7シグナルによる活性型カスパーゼ3の産生を抑制し,サイトカインに誘導される細胞死を顕著に抑制することがわかった.また,インターフェロンγ欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞を用いて同様の実験を行ったところ,同じく,サイトカインに誘導される細胞死を顕著に抑制したことから,CD8陽性T細胞それ自体の産生するインターフェロンγにより細胞死の誘導されていることがわかった.さらに,インターフェロンγ欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞の培養系にインターフェロンγをくわえたところ,顕著な細胞死が観察されたことから,インターフェロンγシグナルがサイトカインに誘導される細胞死の引き金であると結論した.興味深いことに,インターフェロンγシグナルを抑制することにより死をまぬがれた細胞は,持続的にIL-7シグナルを受け取ることにより約2週間で100倍以上にも増殖することがわかった.
つづいて,in vivoにおけるモデルを用いて,インターフェロンγシグナルの抑制によるCD8陽性T細胞の生存に対する効果を検討した.IL-7Rαを恒常的に発現するMHC-I拘束性のT細胞受容体トランスジェニックマウスのCD8陽性T細胞を,MHC-I分子を欠損したリンパ球の減少しているホストマウスに移入し,抗インターフェロンγ抗体を1日おきに腹腔内投与した.細胞移入の14日後に解析したところ,細胞の生存に顕著な回復がみられた.この結果は,インターフェロンγシグナルを抑制することにより,CD8陽性T細胞はホメオスタティックT細胞受容体シグナルの存在しない状況においても増殖および生存できることを示唆した.
ホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制することは以前から報告されていたので3,5-7),in vivoにおいて,ホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制することによりインターフェロンγの発現誘導を阻止する可能性を検討した.この実験には8DP4マウスに由来するCD8陽性T細胞を利用した.8DP4マウスに由来するT細胞8) はMHC-II拘束性のT細胞受容体を発現したCD8陽性T細胞であり,また,β2ミクログロブリンを欠損していることからホメオスタティックT細胞受容体シグナルを受け取ることができない.事実,8DP4マウスに由来するCD8陽性T細胞におけるCD5の発現は低く,ホメオスタティックT細胞受容体シグナルを受け取っていないことが確認された.そこで,IL-7Rαを恒常的に発現する8DP4マウスに由来するCD8陽性T細胞におけるインターフェロンγmRNAの発現を調べたところ,対照となるCD8陽性T細胞より高いことがわかった.また,このインターフェロンγmRNAの発現上昇は,IL-7Rαを恒常的に発現するトランスジェニックマウスだけでなく,内在性のIL-7Rαを発現している8DP4マウスに由来するCD8陽性T細胞においても観察された.これより,in vivoにおいて,ホメオスタティックT細胞受容体シグナルはインターフェロンγの産生を抑制するようはたらいていることが示唆された.
つづいて,メスのHY抗原に特異的なT細胞受容体トランスジェニックマウスを利用して同様の実験を行った.HY抗原に特異的なT細胞受容体は,メスにおいて自己抗原に対するアフィニティの非常に弱いことが知られている2).CD8の細胞内ドメインをシグナル伝達強度の高いCD4の細胞内ドメインと置き換えることによりCD8シグナルの伝達強度を増強させたCD8.4マウス9) と,HY抗原に特異的なT細胞受容体トランスジェニックマウスとを交配することにより,in vivoにおいて,T細胞受容体シグナルの伝達強度の異なるHY抗原に特異的なCD8陽性T細胞とHY抗原に特異的なCD8.4 T細胞を作製した.HY抗原に特異的なCD8.4 T細胞はHY抗原に特異的なCD8陽性T細胞と比較してIL-7Rαを高く発現していたことから,強いホメオスタティックT細胞受容体シグナルの存在する状況ではIL-7シグナルは確かに抑制されていることが確認された.また,HY抗原に特異的なCD8.4 T細胞においてはインターフェロンγmRNAの発現の低下していることがわかった.以上の結果より,ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することによりインターフェロンγの産生を抑制していることが示唆された.
これまでの結果より,十分なホメオスタティックT細胞受容体シグナルを受け取れないCD8陽性T細胞は,結果として“持続的な”IL-7シグナルを受け取ることによりインターフェロンγの産生を誘導し死にいたると考えられた(図2).もしこの仮説が事実ならば,インターフェロンγノックアウトマウスにおいてホメオスタティックT細胞受容体シグナルを十分に受け取れないCD5低発現型の細胞は,サイトカインに誘導される細胞死をまぬがれ生体に蓄積すると考えられた.また,それら蓄積したCD5低発現型の細胞はCD44高発現型であると考えられた.この点を検証するため,インターフェロンγノックアウトマウスの脾臓のCD8陽性T細胞を解析したところ,CD44高発現型CD5低発現型の画分が顕著に増加していることが確認された.重要なことに,このCD44高発現型CD5低発現型CD8陽性T細胞の蓄積は胸腺ではみられず,また,脾臓のCD4陽性T細胞でもみられなかったことから,CD8陽性T細胞に特有の,末梢における恒常性の維持機構により生じたものと考えられた.
IL-7シグナルがin vivoにおける恒常性の維持にあたえる影響についてさらなる検討を行った.IL-7を恒常的に高発現するトランスジェニックマウスを用いてナイーブCD8陽性T細胞のT細胞受容体レパートリーに対する影響を検討した.仮説では,高濃度のIL-7の存在下ではナイーブCD8陽性T細胞の生存に,より強いホメオスタティックT細胞受容体シグナルが必要であると想定された.このトランスジェニックマウスの脾臓のCD8陽性T細胞を解析したところ,ホメオスタティックT細胞受容体シグナルの不十分なCD5低発現型の画分が消失し,ナイーブCD8陽性T細胞の全体でのCD5の発現の上昇していることがわかった.この結果は,強いIL-7シグナルの存在する状況では,より強いホメオスタティックT細胞受容体シグナルが細胞の生存に必要であることを示唆した.
今回の論文において,筆者らは,なぜナイーブCD8陽性T細胞の生存維持にIL-7シグナルとホメオスタティックT細胞受容体シグナルの2つのシグナルが必要なのかを説明する新しい仮説を提唱した.すなわち,“持続的な”IL-7シグナルはインターフェロンγに依存的な細胞死(サイトカインに誘導される細胞死)を誘導し,ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することにより,その細胞死を防いでいると考えた(図2).つまり,ホメオスタティックT細胞受容体シグナルはCD8陽性T細胞がIL-7シグナルを断続的に受け取れるよう制御することにより,細胞の生存を制御しているものと考えられた.ナイーブCD8陽性T細胞は共受容体による制御(図1)によりIL-7シグナルとT細胞受容体シグナルをともに断続的に受け取れるよう制御されているが,この制御は偶然の産物ではなく,CD8陽性T細胞の生存維持に必要不可欠なプロセスであることがわかった.この結果は,IL-7シグナルが機能的なT細胞受容体をもつ細胞の選択および維持に積極的にかかわっていることを示すものであり,サイトカインに誘導される細胞死の機構は適切なT細胞受容体レパートリーを生体において保つ役割を担っているものと考えられた.
略歴:2002年 千葉大学大学院医学研究科 修了,同年 同 助手,2006年 米国NIH National Cancer InstituteにてVisiting Fellowを経て,2011年より同Research Fellow.
研究テーマ:T細胞の胸腺における分化と,末梢における生存維持の機構.
関心事:ひとつの同じ(前駆)細胞が,シグナルの違い,もしくは,シグナルのキネティクスの違いにより,異なる運命を獲得するしくみ(細胞の運命決定)に興味があります.
Alfred Singer
米国NIH National Cancer InstituteにてBranch Chief.
© 2013 木村元子・Alfred Singer Licensed under CC 表示 2.1 日本
(米国NIH National Cancer Institute,Experimental Immunology Branch)
email:木村元子
DOI: 10.7875/first.author.2013.008
IL-7 signaling must be intermittent, not continuous, during CD8+ T cell homeostasis to promote cell survival instead of cell death.
Motoko Y. Kimura, Leonid A. Pobezinsky, Terry I. Guinter, Julien Thomas, Anthony Adams, Jung-Hyun Park, Xuguang Tai, Alfred Singer
Nature Immunology, 14, 143-151 (2013)
要 約
ナイーブCD8陽性T細胞の生存の維持には,インターロイキン7(IL-7)シグナルと自己抗原に由来するT細胞受容体シグナル(ホメオスタティックT細胞受容体シグナル)の必要であることが知られているが,なぜこの2つのシグナルが必要なのか,その理由は不明である.この論文において,筆者らは,持続的なIL-7シグナルはCD8陽性T細胞の増殖およびインターフェロンγの産生を誘導し,インターフェロンγシグナルに依存的な細胞死を誘導することを明らかにした.ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することにより細胞死を防ぎ,CD8陽性T細胞の生存の維持をもたらすと考えられた.一方,機能的なT細胞受容体をもたないCD8陽性T細胞は十分なホメオスタティックT細胞受容体シグナルを受け取れず,結果として,持続的なIL-7シグナルを受け取り死にいたる可能性が示された.以上の結果より,ホメオスタティックT細胞受容体シグナルはIL-7シグナルの持続時間を制御することにより,機能的なT細胞受容体をもつCD8陽性T細胞の生存を促進していることが示唆された.
はじめに
胸腺は自己のMHC分子に提示された自己ペプチドとゆるやかに反応できるT細胞受容体を発現したT細胞のみを選択し,これを分化成熟させ末梢へと送り出す.T細胞が分化成熟できるのは胸腺のなかだけであり,また,胸腺は年齢にともない萎縮することから,末梢へと送り出されたナイーブT細胞の生存の維持は生体における免疫系の構築の基盤となる.これまでの研究から,ナイーブCD8陽性T細胞の生存維持にはインターロイキン7(IL-7)シグナルと自己抗原に由来するT細胞受容体シグナル(ホメオスタティックT細胞受容体シグナル)の2つが重要であることが明らかにされていた1,2).IL-7シグナルはBcl2など抗アポトーシスタンパク質を誘導することから細胞の生存維持に重要であることは想像にかたくない.一方,なぜホメオスタティックT細胞受容体シグナルが細胞の生存に必要なのか,なぜIL-7シグナルだけでは細胞の生存維持に不十分なのかはわかっていなかった.
筆者らの以前の報告により3),IL-7シグナルとホメオスタティックT細胞受容体シグナルとが相互に制御しあっていることは明らかだった(図1).まず,IL-7シグナルは共受容体であるCD8の発現を誘導しT細胞受容体とMHC-I分子との結合を促進する.つづいて,T細胞受容体-CD8複合体とMHC-I分子との結合により誘導されたホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制する.IL-7シグナルの抑制はCD8の発現低下をもたらし,T細胞受容体-CD8複合体とMHC-I分子との結合は解除されて,細胞はふたたびIL-7シグナルを受け取るようになる.ナイーブCD8陽性T細胞はこの制御機構により,“断続的に”IL-7シグナルとホメオスタティックT細胞受容体シグナルを受け取り,生存維持するものと考えられる.
一方で,IL-7シグナルは非常にユニークな自己制御を行うことが知られている.すなわち,IL-7シグナルはIL-7Rαの発現を転写レベルにおいて抑制することにより,自らのシグナルを自己抑制している4).ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することから,IL-7シグナルにより低下したIL-7Rα発現の誘導および維持をもたらすことで,細胞がIL-7シグナルを受け取れるようにしているとも考えられた.
以上のことより,今回の論文では,ナイーブCD8陽性T細胞が“持続的に”IL-7シグナルを受け取るとしたらホメオスタティックT細胞受容体シグナルは不必要なのではないかという仮定のもと,実験を開始した.
1.“持続的な”IL-7シグナルによりもたらされる細胞の反応
ナイーブCD8陽性T細胞が持続的にIL-7シグナルを受け取るようにするため,IL-7シグナルに影響されずにIL-7Rαの発現を恒常的に維持できるコンストラクトを利用した.IL-7Rαの過剰な発現をさけるためIL-7Rαノックアウトマウスにこのコンストラクトを発現させたトランスジェニックマウスを作製したところ,細胞の表面におけるIL-7Rαの発現は野生型マウスとほぼ同じ程度であった.このIL-7RαトランスジェニックマウスのCD8陽性T細胞において,短時間(30分)のIL-7刺激によるStat5のリン酸化は野生型と同じ程度であったが,長期間(1週間)にわたるIL-7刺激ではStat5のリン酸化は高い状態を維持していることが確認された.このことから,このIL-7RαトランスジェニックマウスのCD8陽性T細胞は持続的にIL-7シグナルを伝達していることがわかった.
このIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞の生存維持にホメオスタティックT細胞受容体シグナルが必要かどうかを検討するため,リンパ球の減少しているホストマウスへの移入実験を行った.移入するCD8陽性T細胞はT細胞受容体のレパートリーの違いによる影響をなくすため,MHC-I拘束性のT細胞受容体トランスジェニックマウスに由来するものを用いた.野生型のCD8陽性T細胞はMHC-I分子の存在するC57BL/6ホストマウスにおいてリンパ球減少誘導増殖(lymphopenia-induced proliferation:LIP)により増殖し,MHC-I分子の存在しないβ2ミクログロブリンを欠損したホストマウスにおいてはホメオスタティックT細胞受容体シグナルが受け取れないため増殖せず細胞の生存もきわめて悪かった.一方,興味深いことに,IL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞は,MHC-I分子の存在しないホストマウスにおいても増殖することがわかった.しかしながら,ホメオスタティックT細胞受容体シグナルの存在しない状況においてその生存は依然として低かったことから,“持続的な”IL-7シグナルはリンパ球減少誘導増殖を誘導するには十分であるが,細胞の生存には不十分であることがわかった.
生存シグナルを担うはずのIL-7シグナルが持続的に伝達されているにもかかわらずCD8陽性T細胞の生存が不十分であるという事実にたいへん驚かされたことから,その分子機構を探るためin vitroにおける実験を試みた.IL-7Rαを恒常的に発現するトランスジェニックマウスから調製したナイーブCD8陽性T細胞をIL-7の存在下で培養したところ激しく増殖し,ほぼ90%が約2週間で死にいたることがわかった.また,この培養において,CD8陽性T細胞はインターフェロンγを産生していることが観察された.
2.IL-7シグナルはその持続時間によりもたらす効果が異なる
この細胞死が,本当にIL-7を持続的に受け取った結果もたらされたものなのかどうかを検討するため,ナイーブCD8陽性T細胞を断続的なIL-7シグナルのもとで培養することを試みた.IL-7Rαを恒常的に発現するトランスジェニックマウスから調製したナイーブCD8陽性T細胞を,IL-7存在下で14時間にわたり培養したのち,培養液で2回洗浄することによりIL-7を完全に除き,そののち10時間にわたりIL-7の非存在下で培養する,というサイクルを2~3週間くり返した.断続的なIL-7シグナルのもと培養することによりナイーブCD8陽性T細胞は増殖せず,インターフェロンγも産生せず,また,CD44低発現型のナイーブ表現型を維持することがわかった.この結果より,断続的なIL-7シグナルはナイーブCD8陽性T細胞に生存をもたらし,持続的なIL-7シグナルは死をもたらすことがわかった.そこで,持続的なIL-7シグナルによる細胞死をサイトカインに誘導される細胞死(cytokine-induced cell death:CICD)とよぶことにした.
3.持続的なIL-7シグナルは細胞死を誘導する
サイトカインに誘導される細胞死の分子機構として2つの可能性を考えた.ひとつは,抗アポトーシスタンパク質の誘導が起こらないため細胞死の起こる可能性,もうひとつは,アポトーシスタンパク質が積極的に誘導されている可能性である.1つ目の可能性を検討するため,持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,抗アポトーシスタンパク質であるBcl2,BclxL,Mcl1の発現をウェスタンブロット法により検討した.その結果,いずれの抗アポトーシスタンパク質の発現にも低下はみられず,むしろ,高かったことから,抗アポトーシスタンパク質の発現低下による細胞死の可能性は否定された.
つぎに,2つ目の可能性を検討するため,エフェクターカスパーゼであるカスパーゼ3の発現を検討したところ,持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,活性型カスパーゼ3の顕著に誘導されていることが確認された.カスパーゼ3の活性化をもたらすシグナルを同定するため,2つの細胞死誘導経路について検討した.ひとつは,細胞死受容体を介する外因性の細胞死経路,すなわち,Fas-FasL依存的な経路,もうひとつは,内因性の細胞死経路であるミトコンドリア依存的な経路である.持続的なIL-7シグナルのもと培養したCD8陽性T細胞において,FasLとFasにはともに顕著な発現の上昇がみられた.また,Bimの発現の上昇していることもわかった.そこで,Fasを欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスと,Bimを欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスをそれぞれ作製し,それらのナイーブCD8陽性T細胞がサイトカインに誘導される細胞死をまぬがれるかどうか検討した.その結果,いずれの場合においても若干は回復したものの依然として激しい細胞死が観察されたことより,これらFas-FasLならびにBimに依存的な細胞死経路は持続的なIL-7シグナルにより活性化されるものの,サイトカインに誘導される細胞死における主要な経路ではないと考えられた.
4.サイトカインに誘導される細胞死の引き金はインターフェロンγシグナルである
持続的なIL-7シグナルはインターフェロンγの産生を誘導することから,インターフェロンγがサイトカインに誘導される細胞死に関与している可能性について検討した.IL-7Rαを恒常的に発現するトランスジェニックマウスをインターフェロンγR1ノックアウトマウスと交配し,インターフェロンγシグナルを欠損しIL-7Rαを恒常的に発現するCD8陽性T細胞を作製した.驚くべきことに,このCD8陽性T細胞は持続的なIL-7シグナルによる活性型カスパーゼ3の産生を抑制し,サイトカインに誘導される細胞死を顕著に抑制することがわかった.また,インターフェロンγ欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞を用いて同様の実験を行ったところ,同じく,サイトカインに誘導される細胞死を顕著に抑制したことから,CD8陽性T細胞それ自体の産生するインターフェロンγにより細胞死の誘導されていることがわかった.さらに,インターフェロンγ欠損したIL-7Rαを恒常的に発現するトランスジェニックマウスのCD8陽性T細胞の培養系にインターフェロンγをくわえたところ,顕著な細胞死が観察されたことから,インターフェロンγシグナルがサイトカインに誘導される細胞死の引き金であると結論した.興味深いことに,インターフェロンγシグナルを抑制することにより死をまぬがれた細胞は,持続的にIL-7シグナルを受け取ることにより約2週間で100倍以上にも増殖することがわかった.
つづいて,in vivoにおけるモデルを用いて,インターフェロンγシグナルの抑制によるCD8陽性T細胞の生存に対する効果を検討した.IL-7Rαを恒常的に発現するMHC-I拘束性のT細胞受容体トランスジェニックマウスのCD8陽性T細胞を,MHC-I分子を欠損したリンパ球の減少しているホストマウスに移入し,抗インターフェロンγ抗体を1日おきに腹腔内投与した.細胞移入の14日後に解析したところ,細胞の生存に顕著な回復がみられた.この結果は,インターフェロンγシグナルを抑制することにより,CD8陽性T細胞はホメオスタティックT細胞受容体シグナルの存在しない状況においても増殖および生存できることを示唆した.
5.in vivoにおいてT細胞受容体シグナルはインターフェロンγの発現誘導を抑制する
ホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制することは以前から報告されていたので3,5-7),in vivoにおいて,ホメオスタティックT細胞受容体シグナルがIL-7シグナルを抑制することによりインターフェロンγの発現誘導を阻止する可能性を検討した.この実験には8DP4マウスに由来するCD8陽性T細胞を利用した.8DP4マウスに由来するT細胞8) はMHC-II拘束性のT細胞受容体を発現したCD8陽性T細胞であり,また,β2ミクログロブリンを欠損していることからホメオスタティックT細胞受容体シグナルを受け取ることができない.事実,8DP4マウスに由来するCD8陽性T細胞におけるCD5の発現は低く,ホメオスタティックT細胞受容体シグナルを受け取っていないことが確認された.そこで,IL-7Rαを恒常的に発現する8DP4マウスに由来するCD8陽性T細胞におけるインターフェロンγmRNAの発現を調べたところ,対照となるCD8陽性T細胞より高いことがわかった.また,このインターフェロンγmRNAの発現上昇は,IL-7Rαを恒常的に発現するトランスジェニックマウスだけでなく,内在性のIL-7Rαを発現している8DP4マウスに由来するCD8陽性T細胞においても観察された.これより,in vivoにおいて,ホメオスタティックT細胞受容体シグナルはインターフェロンγの産生を抑制するようはたらいていることが示唆された.
つづいて,メスのHY抗原に特異的なT細胞受容体トランスジェニックマウスを利用して同様の実験を行った.HY抗原に特異的なT細胞受容体は,メスにおいて自己抗原に対するアフィニティの非常に弱いことが知られている2).CD8の細胞内ドメインをシグナル伝達強度の高いCD4の細胞内ドメインと置き換えることによりCD8シグナルの伝達強度を増強させたCD8.4マウス9) と,HY抗原に特異的なT細胞受容体トランスジェニックマウスとを交配することにより,in vivoにおいて,T細胞受容体シグナルの伝達強度の異なるHY抗原に特異的なCD8陽性T細胞とHY抗原に特異的なCD8.4 T細胞を作製した.HY抗原に特異的なCD8.4 T細胞はHY抗原に特異的なCD8陽性T細胞と比較してIL-7Rαを高く発現していたことから,強いホメオスタティックT細胞受容体シグナルの存在する状況ではIL-7シグナルは確かに抑制されていることが確認された.また,HY抗原に特異的なCD8.4 T細胞においてはインターフェロンγmRNAの発現の低下していることがわかった.以上の結果より,ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することによりインターフェロンγの産生を抑制していることが示唆された.
6.細胞は強いIL-7シグナルの存在する状況では適切な強さのホメオスタティックT細胞受容体シグナルなしでは生存できない
これまでの結果より,十分なホメオスタティックT細胞受容体シグナルを受け取れないCD8陽性T細胞は,結果として“持続的な”IL-7シグナルを受け取ることによりインターフェロンγの産生を誘導し死にいたると考えられた(図2).もしこの仮説が事実ならば,インターフェロンγノックアウトマウスにおいてホメオスタティックT細胞受容体シグナルを十分に受け取れないCD5低発現型の細胞は,サイトカインに誘導される細胞死をまぬがれ生体に蓄積すると考えられた.また,それら蓄積したCD5低発現型の細胞はCD44高発現型であると考えられた.この点を検証するため,インターフェロンγノックアウトマウスの脾臓のCD8陽性T細胞を解析したところ,CD44高発現型CD5低発現型の画分が顕著に増加していることが確認された.重要なことに,このCD44高発現型CD5低発現型CD8陽性T細胞の蓄積は胸腺ではみられず,また,脾臓のCD4陽性T細胞でもみられなかったことから,CD8陽性T細胞に特有の,末梢における恒常性の維持機構により生じたものと考えられた.
IL-7シグナルがin vivoにおける恒常性の維持にあたえる影響についてさらなる検討を行った.IL-7を恒常的に高発現するトランスジェニックマウスを用いてナイーブCD8陽性T細胞のT細胞受容体レパートリーに対する影響を検討した.仮説では,高濃度のIL-7の存在下ではナイーブCD8陽性T細胞の生存に,より強いホメオスタティックT細胞受容体シグナルが必要であると想定された.このトランスジェニックマウスの脾臓のCD8陽性T細胞を解析したところ,ホメオスタティックT細胞受容体シグナルの不十分なCD5低発現型の画分が消失し,ナイーブCD8陽性T細胞の全体でのCD5の発現の上昇していることがわかった.この結果は,強いIL-7シグナルの存在する状況では,より強いホメオスタティックT細胞受容体シグナルが細胞の生存に必要であることを示唆した.
おわりに
今回の論文において,筆者らは,なぜナイーブCD8陽性T細胞の生存維持にIL-7シグナルとホメオスタティックT細胞受容体シグナルの2つのシグナルが必要なのかを説明する新しい仮説を提唱した.すなわち,“持続的な”IL-7シグナルはインターフェロンγに依存的な細胞死(サイトカインに誘導される細胞死)を誘導し,ホメオスタティックT細胞受容体シグナルはIL-7シグナルを抑制することにより,その細胞死を防いでいると考えた(図2).つまり,ホメオスタティックT細胞受容体シグナルはCD8陽性T細胞がIL-7シグナルを断続的に受け取れるよう制御することにより,細胞の生存を制御しているものと考えられた.ナイーブCD8陽性T細胞は共受容体による制御(図1)によりIL-7シグナルとT細胞受容体シグナルをともに断続的に受け取れるよう制御されているが,この制御は偶然の産物ではなく,CD8陽性T細胞の生存維持に必要不可欠なプロセスであることがわかった.この結果は,IL-7シグナルが機能的なT細胞受容体をもつ細胞の選択および維持に積極的にかかわっていることを示すものであり,サイトカインに誘導される細胞死の機構は適切なT細胞受容体レパートリーを生体において保つ役割を担っているものと考えられた.
文 献
- Takeda, K. & Jameson, S. C.: Naive T cell homeostasis: from awareness of space to a sence of place. Nat. Rev. Immunol., 9, 823-832 (2009)[PubMed]
- Sprent, J. & Surh, C. D.: Normal T cell homeostasis: the conversion of naive cells into memory-phenotype cells. Nat. Immunol., 12, 478-484 (2011)[PubMed]
- Park, J. H., Adoro, S., Lucas, P. J. et al.: ‘Coreceptor tuning’: cytokine signals transcriptionally tailor CD8 coreceptor expression to the self-specificity of the TCR. Nat. Immunol., 8, 1049-1059 (2007)[PubMed]
- Park, J. H., Yu, Q., Erman, B. et al.: Suppression of IL-7Rα transcription by IL-7 and other prosurvival cytokines: a novel mechanism for maximizing IL-7-dependent T cell survival. Immunity, 21, 289-302 (2004)[PubMed]
- Noguchi, M., Sarin, A., Aman, M. J. et al.: Functional cleavage of the common cytokine receptor γ chain (γc) by calpain. Proc. Natl. Acad. Sci. USA, 94, 11534-11539 (1997)[PubMed]
- Lee, I. H., Li, W. P., Hisert, K. B. et al.: Inhibition of interleukin 2 signaling and signal transducer and activator of transcription (STAT)5 activation during T cell receptor-mediated feedback inhibition of T cell expansion. J. Exp. Med., 190, 1263-1274 (1999)[PubMed]
- Zhu, J., Huang, H., Guo, L. et al.: Transient inhibition of interleukin 4 signaling by T cell receptor ligation. J. Exp. Med., 192, 1125-1134 (2000)[PubMed]
- Sarafova, S. D., Erman, B., Yu, Q. et al.: Modulation of coreceptor transcription durig positive selection dictates lineage fate independently of TCR/corecptor specificity. Immunity, 23, 75-87 (2005)[PubMed]
- Erman, B., Alag, A. S., Dahle, O. et al.: Coreceptor signal strength regulates positive selection but does not determine CD4/CD8 lineage choice in a physiologic in vivo model. J. Immunol., 177, 6613-6625 (2006)[PubMed]
著者プロフィール
略歴:2002年 千葉大学大学院医学研究科 修了,同年 同 助手,2006年 米国NIH National Cancer InstituteにてVisiting Fellowを経て,2011年より同Research Fellow.
研究テーマ:T細胞の胸腺における分化と,末梢における生存維持の機構.
関心事:ひとつの同じ(前駆)細胞が,シグナルの違い,もしくは,シグナルのキネティクスの違いにより,異なる運命を獲得するしくみ(細胞の運命決定)に興味があります.
Alfred Singer
米国NIH National Cancer InstituteにてBranch Chief.
© 2013 木村元子・Alfred Singer Licensed under CC 表示 2.1 日本