スフィンゴシン1-リン酸はSTAT3の恒常的な活性化により慢性腸炎と大腸炎関連腫瘍の発症とを結びつける
永橋昌幸・高部和明・Sarah Spiegel
(米国Virginia州立大学School of Medicine,Department of Biochemistry and Molecular Biology)
email:永橋昌幸
DOI: 10.7875/first.author.2013.006
Sphingosine-1-phosphate links persistent STAT3 activation, chronic intestinal inflammation, and development of colitis-associated cancer.
Jie Liang, Masayuki Nagahashi, Eugene Y. Kim, Kuzhuvelil B. Harikumar, Akimitsu Yamada, Wei-Ching Huang, Nitai C. Hait, Jeremy C. Allegood, Megan M.Price, Dorit Avni, Kazuaki Takabe, Tomasz Kordula, Sheldon Milstien, Sarah Spiegel
Cancer Cell, 23, 107-120 (2013)
炎症性腸疾患における持続的な炎症は大腸がんの発症リスクを増加させる.筆者らは,高発現したスフィンゴシンキナーゼSphK1により産生されたスフィンゴシン1-リン酸が,慢性腸炎と大腸炎関連腫瘍とを結びつける重要な因子であることを示した.もうひとつのスフィンゴシンキナーゼSphK2のノックアウトマウスではSphK1が高発現し,野生型マウスと比較して慢性炎症と大腸炎関連腫瘍が増悪した.スフィンゴシン1-リン酸はNF-κBにより制御されるインターロイキン6の産生,転写因子であるSTAT3の恒常的な活性化,そして,その結果として生じるスフィンゴシン1-リン酸1型受容体の高発現において欠かすことのできない役割を担っていた.一方,スフィンゴシン1-リン酸1型受容体の機能的なアンタゴニストであるFTY720は,SphK1とスフィンゴシン1-リン酸1型受容体の発現を減少させ,NF-κB-インターロイキン6-STAT3シグナル伝達系を抑制し,大腸炎の重症化を抑制するとともに大腸炎関連腫瘍を減少させた.この結果は,炎症性腸疾患および大腸炎関連腫瘍に対しFTY720が有用であることを示唆した.SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系はNF-κBとSTAT3の恒常的な活性化において重要な役割をはたしており,慢性腸炎と大腸炎関連腫瘍を結びつけていた.
慢性炎症とがんは明らかに関連していると考えられている.潰瘍性大腸炎などの持続的な炎症は大腸がんの発症のリスク因子であり,潰瘍性大腸炎を含む炎症性腸疾患とそれにともなう大腸炎関連腫瘍は,慢性炎症とがんとの関連を示す代表的な例である.わが国では,近年,潰瘍性大腸炎の患者数が爆発的に増加しており,2008年には10万人をこえた.現在,患者の増加にともない,潰瘍性大腸炎の長期罹患ののち発症する大腸炎関連腫瘍が大きな問題となっている.
慢性腸炎とがんに関する研究は,近年,ヒトの病態を再現するさまざまな動物モデルにより大きく前進し,とくに,炎症性サイトカインであるTNFαとインターロイキン6,それらの下流で機能する転写因子であるNF-κBとSTAT3が重要なはたらきをすることがわかってきた.発がん率の高い活動期の潰瘍性大腸炎においてTNFαとインターロイキン6の発現,および,NF-κBとSTAT3の活性に上昇がみられるなど,臨床的にもその重要性が認識されてきた.しかし,通常はNF-κBとSTAT3の活性化は負のフィードバックにより厳密に制限されており,大腸炎や大腸炎関連腫瘍にみられるようなNF-κBとSTAT3の恒常的な活性化がどのように維持されているのかは明らかにされていない.
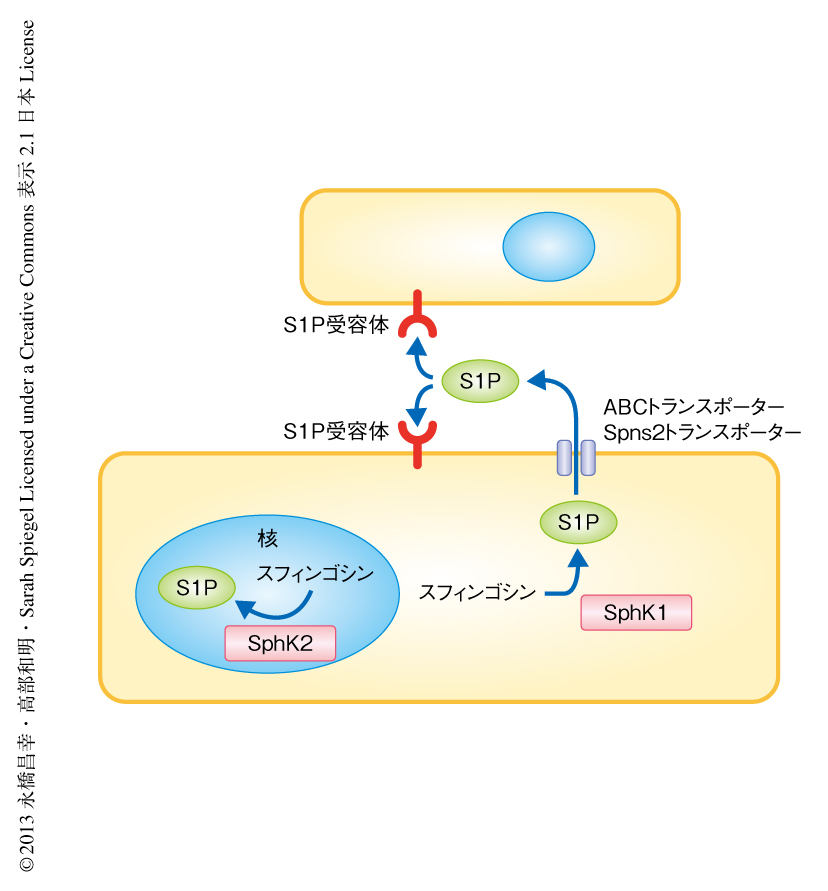
スフィンゴシン1-リン酸は多面的な生物活性をもつスフィンゴ脂質の代謝産物であり,さまざまな細胞に作用する脂質メディエーターとして炎症とがんに密接に関与している1).スフィンゴシン1-リン酸は細胞において2つのスフィンゴシンキナーゼ,SphK1とSphK2により産生されたのち2),ABCトランスポーター3) やSpns2トランスポーター4) を介し細胞の外へと輸送され5),細胞の表面に分布する5つの特異的なGタンパク質共役型受容体,スフィンゴシン1-リン酸1型受容体~スフィンゴシン1-リン酸5型受容体を介しシグナルを伝達する6)(図1).スフィンゴシン1-リン酸は細胞の増殖,細胞の浸潤,血管およびリンパ管の新生,リンパ球の輸送,サイトカインおよびケモカインの産生など,多くの細胞プロセスを制御している1-8).スフィンゴシン1-リン酸とSphK1はTNFαなどの炎症性サイトカインの発現を惹起する一方,TNFαはSphK1を活性化し細胞膜の近傍に移動させスフィンゴシン1-リン酸の産生を促進する9).興味深いことに,最近,スフィンゴシン1-リン酸1型受容体の発現とSTAT3の恒常的な活性化とのあいだには密接な関係のあることが報告された10).がん細胞や腫瘍に関連する免疫細胞においてSTAT3はスフィンゴシン1-リン酸1型受容体の発現を誘導し,また逆に,がん細胞や免疫細胞ではスフィンゴシン1-リン酸1型受容体の存在がSTAT3の恒常的な活性化と腫瘍の成長および転移に必要であることも明らかにされた10).しかし,スフィンゴシン1-リン酸1型受容体の唯一の内因性の活性化物質であるスフィンゴシン1-リン酸が,この分子機構にどのように関与しているかはいまだ不明である.
潰瘍性大腸炎や大腸がんの臨床検体においてSphK1の高発現がみられ,マウス大腸炎関連腫瘍モデルにおいてSphK1をノックアウトすると陰窩の形成異常およびがんの発症が減少することが報告された11).しかし,SphK1から産生されたスフィンゴシン1-リン酸が大腸炎関連腫瘍の発症あるいは進展を促進する分子機構はいまだ明らかにされていない.筆者らは,この論文において,SphK1の発現,スフィンゴシン1-リン酸の産生,そして,その結果として生じるスフィンゴシン1-リン酸1型受容体の活性化が,NF-κBとSTAT3の恒常的な活性化に必須の役割をはたし,慢性炎症と大腸炎関連腫瘍をひき起こすことを示した.
大腸炎関連腫瘍の発症におけるSphK2の関与を調べるため,野生型マウスとSphK2ノックアウトマウスに大腸に特異的な発がん物質であるアゾキシメタンを腹腔内投与し,つづいて,大腸起炎物質であるデキストラン硫酸ナトリウムを3サイクル服用させることにより慢性炎症を誘発して,大腸炎関連腫瘍マウスモデルとした.SphK1ノックアウトマウスにみられた腫瘍に対する抑制作用とは対照的に,SphK2ノックアウトマウスでは腫瘍の数,大きさ,腫瘍径の総和がいずれも有意に増加した.SphK2ノックアウトマウスでは高度な異形成をともなう腺腫が大幅に増加したのに対し,野生型マウスでは低度の異形性をともなう腺腫がほとんどであった.腫瘍の大きさへの影響と一致して,SphK2ノックアウトマウスではKi-67免疫染色により測定した細胞増殖も有意に増加していた.シクロオキシゲナーゼ2は炎症性メディエーターであるとともに発がんに関連することが知られているが,SphK2ノックアウトマウスではその増加が認められ,多くの炎症細胞において陽性を示した.
炎症は腫瘍の形成に決定的な役割を担うことから,SphK2ノックアウトマウスにおける腫瘍の増加は腸管炎症の増悪によるものかどうかを検証した.マウスに対し急性腸炎をひき起こすため5日間のデキストラン硫酸ナトリウムの投与を1サイクル行い,急性大腸炎マウスモデルとした.SphK2ノックアウトマウスはより重度の体重減少,血便の増加をともなう重症の腸炎を呈した.病理組織学的な解析では,陰窩構造の欠落と潰瘍,より高度の炎症細胞の浸潤をともなう大腸粘膜の障害を認めた.
スフィンゴシン1-リン酸はデキストラン硫酸ナトリウムによる大腸炎の発症に関与し,SphK1の欠損は大腸炎の増悪を軽減すると報告されている11).事実,急性大腸炎にともない野生型マウスにおいてスフィンゴシン1-リン酸の血中の濃度は上昇した.また,大腸炎関連腫瘍マウスモデルや急性大腸炎マウスモデルにおいて,SphK1とともにスフィンゴシン1-リン酸1型受容体も著しく高発現していることがわかった.一方で,炎症をともなわない正常な状態のSphK2ノックアウトマウスにおいてもSphK1とスフィンゴシン1-リン酸1型受容体は高発現していた.これは予想外の結果であったが,急性大腸炎や大腸炎関連腫瘍を悪化させる準備刺激になっていたものと考えられた.SphK2ノックアウトマウスでは血中および大腸におけるスフィンゴシン1-リン酸の濃度が正常な状態においても野生型マウスよりも高く,これはデキストラン硫酸ナトリウムの投与によりさらに上昇した.このとき,スフィンゴシン1-リン酸の代謝酵素であるスフィンゴシン1-リン酸ホスファターゼおよびスフィンゴシン1-リン酸リアーゼの活性に差はなかったことから,SphK2ノックアウトマウスにおけるスフィンゴシン1-リン酸の上昇と大腸炎の重症化はSphK1の高発現によるものと考えられた.
SphK2は多くの細胞において核に存在し,ヒストン脱アセチル化酵素であるHDAC1およびHDAC2を内因性に阻害する12).SphK2を取り除くと核におけるスフィンゴシン1-リン酸の濃度は低下し,結果的に,特異的な遺伝子の発現に影響をあたえる.一方,ヒストン脱アセチル化酵素により制御されている転写因子AP-1の構成タンパク質であるc-Junにより,SphK1をコードする遺伝子の転写は制御されていることが示唆されていた.この研究において,ヒストン脱アセチル化酵素の阻害剤はc-JunとSphK1の両方の発現を減少させること,SphK2ノックアウトマウスにおいてc-Junの増加していることが示された.このことから,SphK2の欠損によりスフィンゴシン1-リン酸によるヒストン脱アセチル化酵素の阻害がなくなり,c-Junとその標的遺伝子の産物であるSphK1の発現が上昇したものと考えられた.
大腸炎におけるNF-κBの活性化について調べた.炎症をともなわない正常な状態のSphK2ノックアウトマウスの大腸では,NF-κBのp65サブユニットのリン酸化や核への移行が認められ,NF-κBは恒常的に活性化されていた.このマウスにデキストラン硫酸ナトリウムの投与により大腸炎を起こすと,NF-κBの活性化はさらに増強され,これはSphK1やスフィンゴシン1-リン酸の増加とも相関していた.SphK2ノックアウトマウスではNF-κB活性の上昇にともない炎症性サイトカインであるインターロイキン6の血清における濃度と大腸粘膜からの分泌量が増加していた.インターロイキン6はSTAT3の活性化を介しはたらくが,正常な状態のSphK2ノックアウトマウスの大腸粘膜にはすでにリン酸化したSTAT3の核への集積が認められ,大腸炎を起こすことによりさらに上昇した.SphK2ノックアウトマウスの大腸粘膜にはスフィンゴシン1-リン酸1型受容体の高発現もみられ,これは大腸炎により劇的に増強した.このことは,STAT3はスフィンゴシン1-リン酸1型受容体の発現における直接的な因子タンパク質であるという見方とも一致した.SphK2ノックアウトマウスにおけるスフィンゴシン1-リン酸1型受容体の高発現は恒常的なものではなく,そのリガンドであるスフィンゴシン1-リン酸の産生の増加によるものと考えられた.
SphK2の欠損が大腸炎の重症化に影響を及ぼしているのは,骨髄に由来する炎症細胞か,それとも,腸管上皮細胞などの骨髄に由来しない細胞なのか,大腸炎のキープレイヤーであるインターロイキン6を供給する細胞を明らかにするため,マウスに放射線を照射したのち養子性の骨髄細胞の移入を行った.SphK2ノックアウトマウスの骨髄造血細胞を野生型マウスに移入したところ,急性大腸炎モデルにおいて体重の減少,炎症細胞の浸潤,大腸炎の重症度,STAT3およびp65のリン酸化は大幅に増悪した.逆に,野生型マウスの骨髄造血細胞をSphK2ノックアウトマウスに移入すると大腸炎は著明に軽減した.同様に,SphK2ノックアウトマウスの骨髄造血細胞を野生型マウスに移入したところ,野生型マウスからSphK2ノックアウトマウスに移入した場合,あるいは,野生型マウスから野生型マウスに移入した場合と比較して,大腸においてインターロイキン6の発現が上昇した.さらに,細胞におけるサイトカインの免疫染色およびフローサイトメトリー法により,マクロファージおよび樹状細胞がインターロイキン6のおもな産生細胞であることがわかった.これらの結果は,腸管上皮細胞ではなく,骨髄に由来する炎症細胞がインターロイキン6を介した炎症反応を助長していることを示した.
また,蛍光抗体法を用いてマクロファージとT細胞におけるインターロイキン6の発現を調べたところ,SphK2ノックアウトマウスの急性大腸炎モデルでは大腸粘膜に存在するマクロファージにインターロイキン6の高発現を認め,T細胞においてもインターロイキン6の弱い発現が認められた.さらに,SphK2ノックアウトマウスの大腸炎関連腫瘍モデルにおいても腫瘍に浸潤する炎症細胞としてマクロファージとT細胞の両方が増加しており,マクロファージではインターロイキン6が高発現し,T細胞でもインターロイキン6の弱い発現を認めた.以上より,腸管上皮細胞よりも骨髄性の細胞が大腸炎と大腸炎関連腫瘍を増悪させる担い手であることが示された.
スフィンゴシン1-リン酸1型受容体とSTAT3とは相互的に活性化しあいインターロイキン6の活性化と発現を亢進することから,急性大腸炎モデルにおいてスフィンゴシン1-リン酸1型受容体の機能を阻害しこれを介したシグナル伝達系を抑制することにより炎症を改善できないか検討した.スフィンゴシン1-リン酸の擬似物質として合成されたFTY720は,生体においてリン酸化されスフィンゴシン1-リン酸1型受容体の機能的なアンタゴニストとしてこれを細胞に内在化させることにより免疫系を制御する7).これまでの研究報告と同様に,FTY720による治療は野生型マウスの大腸炎を抑制した.これまで,SphK2がFTY720をリン酸化し活性化する生体における唯一の酵素であると報告されてきたが,予想外にも,FTY720はSphK2ノックアウトマウスにおいても大腸炎を有意に減少させた.さらに驚くべきことに,FTY720はSphK2ノックアウトマウスにおいても白血球の減少をもたらし,その血清および大腸からは,野生型マウスよりは低値であったものの,リン酸化FTY720が検出された.また,SphK2ノックアウトマウスにSphK1に特異的な阻害剤であるSK1-Iを腹腔内投与したところ,FTY720のリン酸化を有意に減少させたことから,SphK2にくわえSphK1も,生体においてFTY720をリン酸化していることが示唆された.
これまでも,FTY720はSphK1を阻害することが示唆されていたが,デキストラン硫酸ナトリウムにより誘発された野生型マウスの急性大腸炎において,FTY720の服用はSphK1の増加をほぼ完全に抑制した.また,SphK2ノックアウトマウスにおいてもSphK1の上昇を抑制した.急性大腸炎においてFTY720はSphK1の発現抑制に合致して血中および大腸におけるスフィンゴシン1-リン酸の濃度上昇を抑制した.
そこで,大腸炎と大腸炎関連腫瘍におけるNF-κB-インターロイキン6-STAT3シグナル伝達系に対し,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系に対する標的治療薬としてFTY720の効果を検討した.FTY720はSphK2ノックアウトマウスにおける急性大腸炎において,NF-κBのサブユニットであるp65の恒常的なリン酸化を減少させただけでなく,インターロイキン6およびスフィンゴシン1-リン酸1型受容体の発現とそれらの下流にあるSTAT3の活性化を抑制し,マクロファージの動員を劇的に抑制した.SphK1とスフィンゴシン1-リン酸1型受容体の過剰な発現を正常化させるFTY720が,免疫細胞の動員や炎症性サイトカイン,とくに,インターロイキン6やTNFαの過剰な産生を防ぎ,大腸炎や大腸炎関連腫瘍の重症化をもたらすNF-κBやSTAT3の活性化を抑制したことから,逆に,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系の重要性が認識された.
ここまでの結果は,FTY720がSphK1-スフィンゴシン1-リン酸シグナル伝達系により誘導された正のフィードバックループを抑制することにより大腸炎を緩和することを示唆した.そこで,FTY720の大腸炎関連腫瘍の発症と増悪に対する効果を解析した.FTY720の抗がん作用は,腫瘍発症の初期の段階において炎症を抑制することによるのか,それとも,腫瘍が発症したあとの進展を抑制することによるのかを明らかにするため,大腸炎関連腫瘍の誘発の最初から同時にFTY720を連日投与する予防兼治療モデルと,デキストラン硫酸ナトリウムの服用を終了し腫瘍を誘発したあとにFTY720の連日投与を開始する進行期治療モデルを用いた.予防兼治療モデルではFTY720は腫瘍の数,大きさ,腫瘍径を劇的に減少させた.また,FTY720は大腸炎関連腫瘍を増悪させるSphK2ノックアウトマウスにおいても非常に強い抗がん作用を示した.さらに,進行期治療モデルではFTY720はより遅い時期からより短い期間だけ投与されたのにもかかわらず,腫瘍の数,大きさ,腫瘍径を有意に減少させた.FTY720により治療を行ったSphK2ノックアウトマウスにおいてもこの進行期の治療は同じような効果をみせたが,統計学的な有意差にはいたらなかった.
FTY720のきわだった抗腫瘍作用に一致して,大腸炎関連腫瘍モデルについて予防兼治療モデルおよび進行期治療モデルの両方において,Ki-67免疫染色により測定した細胞増殖は減少し,かつ,陰窩の底部に限局していた.FTY720はin vitroにおいて数種のがん細胞に対し細胞増殖を阻害し,アポトーシスを増強して免疫不全マウスにおける異種移植腫瘍の増殖と転移を抑制すると報告されている.今回,FTY720は腫瘍が形成されたあとから投与しても大腸炎関連腫瘍の進展を阻害しており,免疫抑制とは別に,腫瘍細胞に対する細胞増殖の静止作用があるものと考えられた.
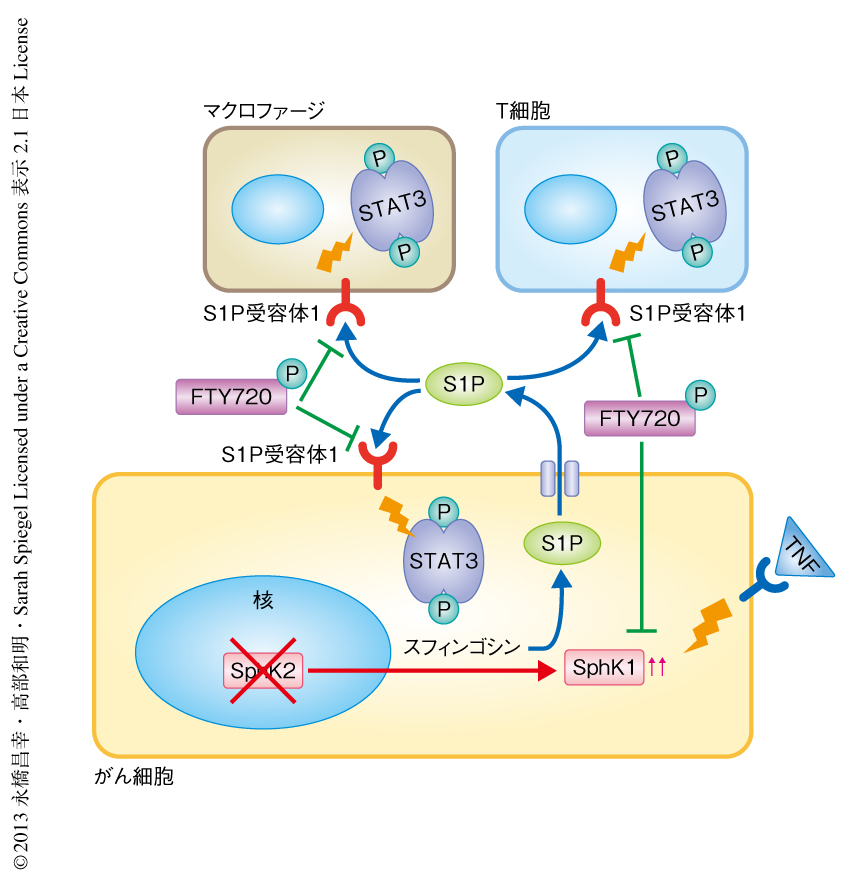
これらの結果をふまえ,STAT3の活性化に対するFTY720の効果を検証した.大腸炎関連腫瘍の発症において,STAT3は腸管上皮細胞の増殖や生存などにおいて決定的な役割をもつ.免疫染色による解析では,リン酸化STAT3(活性型)はSphK2ノックアウトマウスの大腸炎関連腫瘍において浸潤した炎症細胞により強く発現しており,また,腸管上皮細胞にも発現していた.FTY720による治療を行った進行期治療モデルにおいて,野生型マウスとSphK2ノックアウトマウスの腫瘍ではともに核においてリン酸化STAT3が減少し,細胞の浸潤とインターロイキン6の発現の著明な減少がみられた.同様に,腸管上皮細胞におけるリン酸化p65も減少した.また,大腸炎関連腫瘍モデルにおいて,進行期におけるFTY720による治療は,がん細胞,そして,わずかに浸潤した炎症細胞におけるSphK1の発現を劇的に抑制し,さらには,スフィンゴシン1-リン酸1型受容体の高発現も抑制した.以上より,FTY720はSphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系を阻害し,STAT3の恒常的な活性化を抑制して,腫瘍がすでに形成されたあとにおいてもその進展を抑制した(図2).
筆者らの研究結果は,大腸炎および大腸炎関連腫瘍において,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系がNF-κBとSTAT3の恒常的な活性化に重要な役割を担っていることを明らかにした.そして,このシグナル伝達系を阻害することが,炎症性腸疾患および大腸炎関連腫瘍の治療に有用である可能性が示唆された.
略歴:2008年 新潟大学大学院医歯学総合研究科博士課程 修了,2009年より米国Virginia州立大学School of MedicineにてResearch Fellow.
研究テーマ:スフィンゴシン1-リン酸と,がんの発症および進展.
抱負:病理学と分子生物学をとおしてがんを研究し,外科医としての経験を活かしてがん治療の向上に貢献したい.
高部 和明(Kazuaki Takabe)
米国Virginia州立大学School of MedicineにてAssistant Professor.
Sarah Spiegel
米国Virginia州立大学School of MedicineにてProfessor.
© 2013 永橋昌幸・高部和明・Sarah Spiegel Licensed under CC 表示 2.1 日本
(米国Virginia州立大学School of Medicine,Department of Biochemistry and Molecular Biology)
email:永橋昌幸
DOI: 10.7875/first.author.2013.006
Sphingosine-1-phosphate links persistent STAT3 activation, chronic intestinal inflammation, and development of colitis-associated cancer.
Jie Liang, Masayuki Nagahashi, Eugene Y. Kim, Kuzhuvelil B. Harikumar, Akimitsu Yamada, Wei-Ching Huang, Nitai C. Hait, Jeremy C. Allegood, Megan M.Price, Dorit Avni, Kazuaki Takabe, Tomasz Kordula, Sheldon Milstien, Sarah Spiegel
Cancer Cell, 23, 107-120 (2013)
要 約
炎症性腸疾患における持続的な炎症は大腸がんの発症リスクを増加させる.筆者らは,高発現したスフィンゴシンキナーゼSphK1により産生されたスフィンゴシン1-リン酸が,慢性腸炎と大腸炎関連腫瘍とを結びつける重要な因子であることを示した.もうひとつのスフィンゴシンキナーゼSphK2のノックアウトマウスではSphK1が高発現し,野生型マウスと比較して慢性炎症と大腸炎関連腫瘍が増悪した.スフィンゴシン1-リン酸はNF-κBにより制御されるインターロイキン6の産生,転写因子であるSTAT3の恒常的な活性化,そして,その結果として生じるスフィンゴシン1-リン酸1型受容体の高発現において欠かすことのできない役割を担っていた.一方,スフィンゴシン1-リン酸1型受容体の機能的なアンタゴニストであるFTY720は,SphK1とスフィンゴシン1-リン酸1型受容体の発現を減少させ,NF-κB-インターロイキン6-STAT3シグナル伝達系を抑制し,大腸炎の重症化を抑制するとともに大腸炎関連腫瘍を減少させた.この結果は,炎症性腸疾患および大腸炎関連腫瘍に対しFTY720が有用であることを示唆した.SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系はNF-κBとSTAT3の恒常的な活性化において重要な役割をはたしており,慢性腸炎と大腸炎関連腫瘍を結びつけていた.
はじめに
慢性炎症とがんは明らかに関連していると考えられている.潰瘍性大腸炎などの持続的な炎症は大腸がんの発症のリスク因子であり,潰瘍性大腸炎を含む炎症性腸疾患とそれにともなう大腸炎関連腫瘍は,慢性炎症とがんとの関連を示す代表的な例である.わが国では,近年,潰瘍性大腸炎の患者数が爆発的に増加しており,2008年には10万人をこえた.現在,患者の増加にともない,潰瘍性大腸炎の長期罹患ののち発症する大腸炎関連腫瘍が大きな問題となっている.
慢性腸炎とがんに関する研究は,近年,ヒトの病態を再現するさまざまな動物モデルにより大きく前進し,とくに,炎症性サイトカインであるTNFαとインターロイキン6,それらの下流で機能する転写因子であるNF-κBとSTAT3が重要なはたらきをすることがわかってきた.発がん率の高い活動期の潰瘍性大腸炎においてTNFαとインターロイキン6の発現,および,NF-κBとSTAT3の活性に上昇がみられるなど,臨床的にもその重要性が認識されてきた.しかし,通常はNF-κBとSTAT3の活性化は負のフィードバックにより厳密に制限されており,大腸炎や大腸炎関連腫瘍にみられるようなNF-κBとSTAT3の恒常的な活性化がどのように維持されているのかは明らかにされていない.
スフィンゴシン1-リン酸は多面的な生物活性をもつスフィンゴ脂質の代謝産物であり,さまざまな細胞に作用する脂質メディエーターとして炎症とがんに密接に関与している1).スフィンゴシン1-リン酸は細胞において2つのスフィンゴシンキナーゼ,SphK1とSphK2により産生されたのち2),ABCトランスポーター3) やSpns2トランスポーター4) を介し細胞の外へと輸送され5),細胞の表面に分布する5つの特異的なGタンパク質共役型受容体,スフィンゴシン1-リン酸1型受容体~スフィンゴシン1-リン酸5型受容体を介しシグナルを伝達する6)(図1).スフィンゴシン1-リン酸は細胞の増殖,細胞の浸潤,血管およびリンパ管の新生,リンパ球の輸送,サイトカインおよびケモカインの産生など,多くの細胞プロセスを制御している1-8).スフィンゴシン1-リン酸とSphK1はTNFαなどの炎症性サイトカインの発現を惹起する一方,TNFαはSphK1を活性化し細胞膜の近傍に移動させスフィンゴシン1-リン酸の産生を促進する9).興味深いことに,最近,スフィンゴシン1-リン酸1型受容体の発現とSTAT3の恒常的な活性化とのあいだには密接な関係のあることが報告された10).がん細胞や腫瘍に関連する免疫細胞においてSTAT3はスフィンゴシン1-リン酸1型受容体の発現を誘導し,また逆に,がん細胞や免疫細胞ではスフィンゴシン1-リン酸1型受容体の存在がSTAT3の恒常的な活性化と腫瘍の成長および転移に必要であることも明らかにされた10).しかし,スフィンゴシン1-リン酸1型受容体の唯一の内因性の活性化物質であるスフィンゴシン1-リン酸が,この分子機構にどのように関与しているかはいまだ不明である.
潰瘍性大腸炎や大腸がんの臨床検体においてSphK1の高発現がみられ,マウス大腸炎関連腫瘍モデルにおいてSphK1をノックアウトすると陰窩の形成異常およびがんの発症が減少することが報告された11).しかし,SphK1から産生されたスフィンゴシン1-リン酸が大腸炎関連腫瘍の発症あるいは進展を促進する分子機構はいまだ明らかにされていない.筆者らは,この論文において,SphK1の発現,スフィンゴシン1-リン酸の産生,そして,その結果として生じるスフィンゴシン1-リン酸1型受容体の活性化が,NF-κBとSTAT3の恒常的な活性化に必須の役割をはたし,慢性炎症と大腸炎関連腫瘍をひき起こすことを示した.
1.SphK2の欠損により大腸炎関連腫瘍の発症は増加する
大腸炎関連腫瘍の発症におけるSphK2の関与を調べるため,野生型マウスとSphK2ノックアウトマウスに大腸に特異的な発がん物質であるアゾキシメタンを腹腔内投与し,つづいて,大腸起炎物質であるデキストラン硫酸ナトリウムを3サイクル服用させることにより慢性炎症を誘発して,大腸炎関連腫瘍マウスモデルとした.SphK1ノックアウトマウスにみられた腫瘍に対する抑制作用とは対照的に,SphK2ノックアウトマウスでは腫瘍の数,大きさ,腫瘍径の総和がいずれも有意に増加した.SphK2ノックアウトマウスでは高度な異形成をともなう腺腫が大幅に増加したのに対し,野生型マウスでは低度の異形性をともなう腺腫がほとんどであった.腫瘍の大きさへの影響と一致して,SphK2ノックアウトマウスではKi-67免疫染色により測定した細胞増殖も有意に増加していた.シクロオキシゲナーゼ2は炎症性メディエーターであるとともに発がんに関連することが知られているが,SphK2ノックアウトマウスではその増加が認められ,多くの炎症細胞において陽性を示した.
2.SphK2ノックアウトマウスにおいて急性大腸炎は増悪する
炎症は腫瘍の形成に決定的な役割を担うことから,SphK2ノックアウトマウスにおける腫瘍の増加は腸管炎症の増悪によるものかどうかを検証した.マウスに対し急性腸炎をひき起こすため5日間のデキストラン硫酸ナトリウムの投与を1サイクル行い,急性大腸炎マウスモデルとした.SphK2ノックアウトマウスはより重度の体重減少,血便の増加をともなう重症の腸炎を呈した.病理組織学的な解析では,陰窩構造の欠落と潰瘍,より高度の炎症細胞の浸潤をともなう大腸粘膜の障害を認めた.
3.SphK2の欠損はSphK1の発現を亢進する
スフィンゴシン1-リン酸はデキストラン硫酸ナトリウムによる大腸炎の発症に関与し,SphK1の欠損は大腸炎の増悪を軽減すると報告されている11).事実,急性大腸炎にともない野生型マウスにおいてスフィンゴシン1-リン酸の血中の濃度は上昇した.また,大腸炎関連腫瘍マウスモデルや急性大腸炎マウスモデルにおいて,SphK1とともにスフィンゴシン1-リン酸1型受容体も著しく高発現していることがわかった.一方で,炎症をともなわない正常な状態のSphK2ノックアウトマウスにおいてもSphK1とスフィンゴシン1-リン酸1型受容体は高発現していた.これは予想外の結果であったが,急性大腸炎や大腸炎関連腫瘍を悪化させる準備刺激になっていたものと考えられた.SphK2ノックアウトマウスでは血中および大腸におけるスフィンゴシン1-リン酸の濃度が正常な状態においても野生型マウスよりも高く,これはデキストラン硫酸ナトリウムの投与によりさらに上昇した.このとき,スフィンゴシン1-リン酸の代謝酵素であるスフィンゴシン1-リン酸ホスファターゼおよびスフィンゴシン1-リン酸リアーゼの活性に差はなかったことから,SphK2ノックアウトマウスにおけるスフィンゴシン1-リン酸の上昇と大腸炎の重症化はSphK1の高発現によるものと考えられた.
SphK2は多くの細胞において核に存在し,ヒストン脱アセチル化酵素であるHDAC1およびHDAC2を内因性に阻害する12).SphK2を取り除くと核におけるスフィンゴシン1-リン酸の濃度は低下し,結果的に,特異的な遺伝子の発現に影響をあたえる.一方,ヒストン脱アセチル化酵素により制御されている転写因子AP-1の構成タンパク質であるc-Junにより,SphK1をコードする遺伝子の転写は制御されていることが示唆されていた.この研究において,ヒストン脱アセチル化酵素の阻害剤はc-JunとSphK1の両方の発現を減少させること,SphK2ノックアウトマウスにおいてc-Junの増加していることが示された.このことから,SphK2の欠損によりスフィンゴシン1-リン酸によるヒストン脱アセチル化酵素の阻害がなくなり,c-Junとその標的遺伝子の産物であるSphK1の発現が上昇したものと考えられた.
4.SphK2の欠損はNF-κBとSTAT3の恒常的な活性化を促す
大腸炎におけるNF-κBの活性化について調べた.炎症をともなわない正常な状態のSphK2ノックアウトマウスの大腸では,NF-κBのp65サブユニットのリン酸化や核への移行が認められ,NF-κBは恒常的に活性化されていた.このマウスにデキストラン硫酸ナトリウムの投与により大腸炎を起こすと,NF-κBの活性化はさらに増強され,これはSphK1やスフィンゴシン1-リン酸の増加とも相関していた.SphK2ノックアウトマウスではNF-κB活性の上昇にともない炎症性サイトカインであるインターロイキン6の血清における濃度と大腸粘膜からの分泌量が増加していた.インターロイキン6はSTAT3の活性化を介しはたらくが,正常な状態のSphK2ノックアウトマウスの大腸粘膜にはすでにリン酸化したSTAT3の核への集積が認められ,大腸炎を起こすことによりさらに上昇した.SphK2ノックアウトマウスの大腸粘膜にはスフィンゴシン1-リン酸1型受容体の高発現もみられ,これは大腸炎により劇的に増強した.このことは,STAT3はスフィンゴシン1-リン酸1型受容体の発現における直接的な因子タンパク質であるという見方とも一致した.SphK2ノックアウトマウスにおけるスフィンゴシン1-リン酸1型受容体の高発現は恒常的なものではなく,そのリガンドであるスフィンゴシン1-リン酸の産生の増加によるものと考えられた.
5.炎症細胞におけるSphK2の欠損は大腸炎の重症度に関与する
SphK2の欠損が大腸炎の重症化に影響を及ぼしているのは,骨髄に由来する炎症細胞か,それとも,腸管上皮細胞などの骨髄に由来しない細胞なのか,大腸炎のキープレイヤーであるインターロイキン6を供給する細胞を明らかにするため,マウスに放射線を照射したのち養子性の骨髄細胞の移入を行った.SphK2ノックアウトマウスの骨髄造血細胞を野生型マウスに移入したところ,急性大腸炎モデルにおいて体重の減少,炎症細胞の浸潤,大腸炎の重症度,STAT3およびp65のリン酸化は大幅に増悪した.逆に,野生型マウスの骨髄造血細胞をSphK2ノックアウトマウスに移入すると大腸炎は著明に軽減した.同様に,SphK2ノックアウトマウスの骨髄造血細胞を野生型マウスに移入したところ,野生型マウスからSphK2ノックアウトマウスに移入した場合,あるいは,野生型マウスから野生型マウスに移入した場合と比較して,大腸においてインターロイキン6の発現が上昇した.さらに,細胞におけるサイトカインの免疫染色およびフローサイトメトリー法により,マクロファージおよび樹状細胞がインターロイキン6のおもな産生細胞であることがわかった.これらの結果は,腸管上皮細胞ではなく,骨髄に由来する炎症細胞がインターロイキン6を介した炎症反応を助長していることを示した.
また,蛍光抗体法を用いてマクロファージとT細胞におけるインターロイキン6の発現を調べたところ,SphK2ノックアウトマウスの急性大腸炎モデルでは大腸粘膜に存在するマクロファージにインターロイキン6の高発現を認め,T細胞においてもインターロイキン6の弱い発現が認められた.さらに,SphK2ノックアウトマウスの大腸炎関連腫瘍モデルにおいても腫瘍に浸潤する炎症細胞としてマクロファージとT細胞の両方が増加しており,マクロファージではインターロイキン6が高発現し,T細胞でもインターロイキン6の弱い発現を認めた.以上より,腸管上皮細胞よりも骨髄性の細胞が大腸炎と大腸炎関連腫瘍を増悪させる担い手であることが示された.
6.スフィンゴシン1-リン酸1型受容体の機能的なアンタゴニストはSphK2ノックアウトマウスの大腸炎を軽減する
スフィンゴシン1-リン酸1型受容体とSTAT3とは相互的に活性化しあいインターロイキン6の活性化と発現を亢進することから,急性大腸炎モデルにおいてスフィンゴシン1-リン酸1型受容体の機能を阻害しこれを介したシグナル伝達系を抑制することにより炎症を改善できないか検討した.スフィンゴシン1-リン酸の擬似物質として合成されたFTY720は,生体においてリン酸化されスフィンゴシン1-リン酸1型受容体の機能的なアンタゴニストとしてこれを細胞に内在化させることにより免疫系を制御する7).これまでの研究報告と同様に,FTY720による治療は野生型マウスの大腸炎を抑制した.これまで,SphK2がFTY720をリン酸化し活性化する生体における唯一の酵素であると報告されてきたが,予想外にも,FTY720はSphK2ノックアウトマウスにおいても大腸炎を有意に減少させた.さらに驚くべきことに,FTY720はSphK2ノックアウトマウスにおいても白血球の減少をもたらし,その血清および大腸からは,野生型マウスよりは低値であったものの,リン酸化FTY720が検出された.また,SphK2ノックアウトマウスにSphK1に特異的な阻害剤であるSK1-Iを腹腔内投与したところ,FTY720のリン酸化を有意に減少させたことから,SphK2にくわえSphK1も,生体においてFTY720をリン酸化していることが示唆された.
7.FTY720はSphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系を抑制する
これまでも,FTY720はSphK1を阻害することが示唆されていたが,デキストラン硫酸ナトリウムにより誘発された野生型マウスの急性大腸炎において,FTY720の服用はSphK1の増加をほぼ完全に抑制した.また,SphK2ノックアウトマウスにおいてもSphK1の上昇を抑制した.急性大腸炎においてFTY720はSphK1の発現抑制に合致して血中および大腸におけるスフィンゴシン1-リン酸の濃度上昇を抑制した.
そこで,大腸炎と大腸炎関連腫瘍におけるNF-κB-インターロイキン6-STAT3シグナル伝達系に対し,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系に対する標的治療薬としてFTY720の効果を検討した.FTY720はSphK2ノックアウトマウスにおける急性大腸炎において,NF-κBのサブユニットであるp65の恒常的なリン酸化を減少させただけでなく,インターロイキン6およびスフィンゴシン1-リン酸1型受容体の発現とそれらの下流にあるSTAT3の活性化を抑制し,マクロファージの動員を劇的に抑制した.SphK1とスフィンゴシン1-リン酸1型受容体の過剰な発現を正常化させるFTY720が,免疫細胞の動員や炎症性サイトカイン,とくに,インターロイキン6やTNFαの過剰な産生を防ぎ,大腸炎や大腸炎関連腫瘍の重症化をもたらすNF-κBやSTAT3の活性化を抑制したことから,逆に,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系の重要性が認識された.
8.FTY720は大腸炎関連腫瘍の発症を抑制する
ここまでの結果は,FTY720がSphK1-スフィンゴシン1-リン酸シグナル伝達系により誘導された正のフィードバックループを抑制することにより大腸炎を緩和することを示唆した.そこで,FTY720の大腸炎関連腫瘍の発症と増悪に対する効果を解析した.FTY720の抗がん作用は,腫瘍発症の初期の段階において炎症を抑制することによるのか,それとも,腫瘍が発症したあとの進展を抑制することによるのかを明らかにするため,大腸炎関連腫瘍の誘発の最初から同時にFTY720を連日投与する予防兼治療モデルと,デキストラン硫酸ナトリウムの服用を終了し腫瘍を誘発したあとにFTY720の連日投与を開始する進行期治療モデルを用いた.予防兼治療モデルではFTY720は腫瘍の数,大きさ,腫瘍径を劇的に減少させた.また,FTY720は大腸炎関連腫瘍を増悪させるSphK2ノックアウトマウスにおいても非常に強い抗がん作用を示した.さらに,進行期治療モデルではFTY720はより遅い時期からより短い期間だけ投与されたのにもかかわらず,腫瘍の数,大きさ,腫瘍径を有意に減少させた.FTY720により治療を行ったSphK2ノックアウトマウスにおいてもこの進行期の治療は同じような効果をみせたが,統計学的な有意差にはいたらなかった.
FTY720のきわだった抗腫瘍作用に一致して,大腸炎関連腫瘍モデルについて予防兼治療モデルおよび進行期治療モデルの両方において,Ki-67免疫染色により測定した細胞増殖は減少し,かつ,陰窩の底部に限局していた.FTY720はin vitroにおいて数種のがん細胞に対し細胞増殖を阻害し,アポトーシスを増強して免疫不全マウスにおける異種移植腫瘍の増殖と転移を抑制すると報告されている.今回,FTY720は腫瘍が形成されたあとから投与しても大腸炎関連腫瘍の進展を阻害しており,免疫抑制とは別に,腫瘍細胞に対する細胞増殖の静止作用があるものと考えられた.
これらの結果をふまえ,STAT3の活性化に対するFTY720の効果を検証した.大腸炎関連腫瘍の発症において,STAT3は腸管上皮細胞の増殖や生存などにおいて決定的な役割をもつ.免疫染色による解析では,リン酸化STAT3(活性型)はSphK2ノックアウトマウスの大腸炎関連腫瘍において浸潤した炎症細胞により強く発現しており,また,腸管上皮細胞にも発現していた.FTY720による治療を行った進行期治療モデルにおいて,野生型マウスとSphK2ノックアウトマウスの腫瘍ではともに核においてリン酸化STAT3が減少し,細胞の浸潤とインターロイキン6の発現の著明な減少がみられた.同様に,腸管上皮細胞におけるリン酸化p65も減少した.また,大腸炎関連腫瘍モデルにおいて,進行期におけるFTY720による治療は,がん細胞,そして,わずかに浸潤した炎症細胞におけるSphK1の発現を劇的に抑制し,さらには,スフィンゴシン1-リン酸1型受容体の高発現も抑制した.以上より,FTY720はSphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系を阻害し,STAT3の恒常的な活性化を抑制して,腫瘍がすでに形成されたあとにおいてもその進展を抑制した(図2).
おわりに
筆者らの研究結果は,大腸炎および大腸炎関連腫瘍において,SphK1-スフィンゴシン1-リン酸-スフィンゴシン1-リン酸1型受容体シグナル伝達系がNF-κBとSTAT3の恒常的な活性化に重要な役割を担っていることを明らかにした.そして,このシグナル伝達系を阻害することが,炎症性腸疾患および大腸炎関連腫瘍の治療に有用である可能性が示唆された.
文 献
- Takabe, K., Paugh, S. W., Milstien, S. et al.: "Inside-out" signaling of sphingosine-1-phosphate: therapeutic targets. Pharmacol. Rev., 60, 181-195 (2008)[PubMed]
- Nagahashi, M., Ramachandran, S., Kim, E. Y. et al.: Sphingosine-1-phosphate produced by sphingosine kinase 1 promotes breast cancer progression by stimulating angiogenesis and lymphangiogenesis. Cancer Res., 72, 726-735 (2012)[PubMed]
- Takabe, K., Kim, R. H., Allegood, J. C. et al.: Estradiol induces export of sphingosine 1-phosphate from breast cancer cells via ABCC1 and ABCG2. J. Biol. Chem., 285, 10477-10486 (2010)[PubMed]
- Nagahashi, M., Kim, E. Y., Yamada, A. et al.: Spns2, a transporter of phosphorylated sphingoid bases, regulates their blood and lymph levels and the lymphatic network. FASEB J., 27, 1001-1011 (2013)[PubMed]
- Kim, R. H., Takabe, K., Milstien, S. et al.: Export and functions of sphingosine-1-phosphate. Biochim. Biophys. Acta, 1791, 692-696 (2009)[PubMed]
- Spiegel, S. & Milstien, S.: The outs and the ins of sphingosine-1-phosphate in immunity. Nat. Rev. Immunol., 11, 403-415 (2011)[PubMed]
- Nagahashi, M., Ramachandran, S., Rashid, O. M. et al.: Lymphangiogenesis: a new player in cancer progression. World J. Gastroenterol., 16, 4003-4012 (2010)[PubMed]
- Aoyagi, T., Nagahashi, M., Yamada A. et al.: The role of sphingosine-1-phosphate in breast cancer tumor-induced lymphangiogenesis. Lymphat. Res. Biol., 10, 97-106 (2012)[PubMed]
- Alvarez, S. E., Harikumar, K. B., Hait, N. C. et al.: Sphingosine-1-phosphate is a missing cofactor for the E3 ubiquitin ligase TRAF2. Nature, 465, 1084-1088 (2010)[PubMed]
- Lee, H., Deng, J., Kujawski, M. et al.: STAT3-induced S1PR1 expression is crucial for persistent STAT3 activation in tumors. Nat. Med., 16, 1421-1418 (2010)[PubMed]
- Kawamori, T., Kaneshiro, T., Okumura, M. et al.: Role for sphingosine kinase 1 in colon carcinogenesis. FASEB J., 23, 405-414 (2009)[PubMed]
- Hait, N. C., Allegood, J., Maceyka, M. et al.: Regulation of histone acetylation in the nucleus by sphingosine-1-phosphate. Science, 325, 1254-1257 (2009)[PubMed]
著者プロフィール
略歴:2008年 新潟大学大学院医歯学総合研究科博士課程 修了,2009年より米国Virginia州立大学School of MedicineにてResearch Fellow.
研究テーマ:スフィンゴシン1-リン酸と,がんの発症および進展.
抱負:病理学と分子生物学をとおしてがんを研究し,外科医としての経験を活かしてがん治療の向上に貢献したい.
高部 和明(Kazuaki Takabe)
米国Virginia州立大学School of MedicineにてAssistant Professor.
Sarah Spiegel
米国Virginia州立大学School of MedicineにてProfessor.
© 2013 永橋昌幸・高部和明・Sarah Spiegel Licensed under CC 表示 2.1 日本