骨芽細胞におけるインスリンシグナルは骨代謝とグルコース・エネルギー代謝を調節する
吉澤 達也
(米国Columbia大学College of Physicians and Surgeons,Department of Genetics and Development)
email:吉澤達也
DOI: 10.7875/first.author.2010.003
Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism.
Mathieu Ferron, Jianwen Wei, Tatsuya Yoshizawa, Andrea Del Fattore, Ronald A. DePinho, Anna Teti, Patricia Ducy, Gerard Karsenty
Cell, 142, 296-308 (2010)
筆者らの研究室は,骨を中心とした多臓器間ネットワークによる代謝制御作用について研究している.今回,骨芽細胞においてインスリンシグナルが骨代謝とグルコース・エネルギー代謝の両方を調節していることを明らかにした.その具体的なポイントとして,つぎの4つがあげられる.1)骨芽細胞におけるインスリンシグナルは骨ホルモンであるオステオカルシンを活性化することでグルコース・エネルギー代謝を調節する.2)骨芽細胞におけるインスリンシグナルは破骨細胞の骨吸収を促進させる.3)破骨細胞骨吸収窩エリアの酸性pH環境はオステオカルシンを活性化する.4)ヒトにおいても骨組織がグルコース代謝を調節している.
骨組織は,骨をつくる細胞である骨芽細胞と骨を壊す細胞である破骨細胞によって絶え間なくつくり替えられており,機械的な機能,造血機能,代謝機能をもつ,マルチタスクな組織である.さらに近年では,少なくとも2つのホルモン,FGF23とオステオカルシンとを分泌する内分泌器官であることも明らかになってきている1,2).
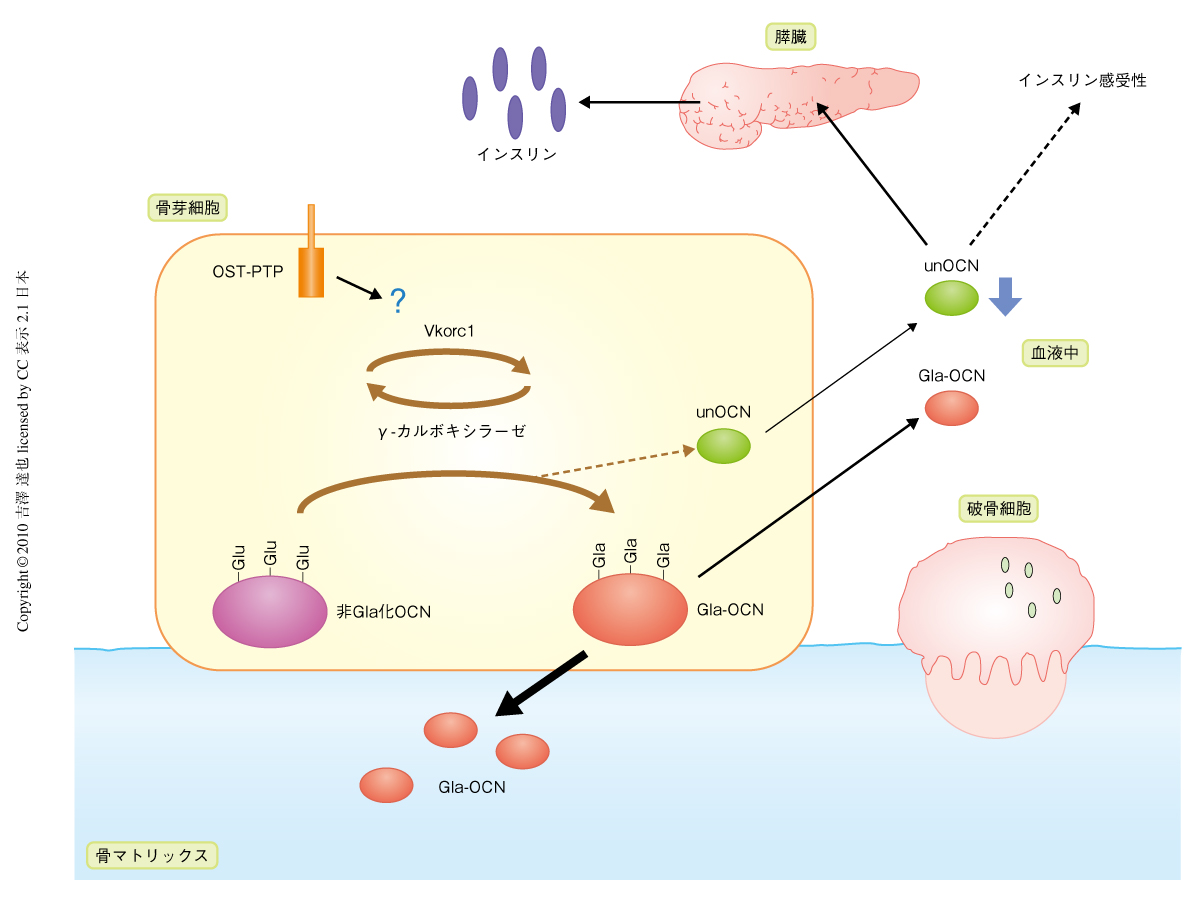
オステオカルシンは,骨芽細胞内で合成されたのち,γ-カルボキシラーゼによってカルボキシル化され,その大部分は骨基質として骨に埋め込まれるが,一部は血中に放出されている(図1).血中のオステオカルシンは,3つのグルタミン酸残基がすべてカルボキシル化されたものと,低カルボキシル化状態のものとの2つの形態で存在しており,最近,筆者らの研究室では,低カルボキシル化状態のオステオカルシンが膵臓におけるインスリンの合成・分泌と末梢組織のインスリン感受性とを促進することで,グルコース代謝を調節していることを明らかにした2,3)(図1).また,その分子機構は十分に明らかではないが,エネルギー代謝をも調節していることも明らかにした2).この研究では骨組織がオステオカルシンというホルモンを産生しグルコース・エネルギー代謝を調節するという新しい機構を発見したが,活性型とみなされた低カルボキシル化状態のオステオカルシンの由来とその活性調節については不明であった.従来は,骨芽細胞内でカルボキシル化をのがれたオステオカルシンが分泌されるものと考えられていたが,実際には,γカルボキシル化反応を調節する機構は明らかではなく,疑問が残っていた.また,カルボキシル化されたオステオカルシンを脱カルボキシル化する酵素は現在まで知られていない.
この研究と同時期に,筆者らは,チロシンホスファターゼであるOST-PTP(Esp遺伝子の産物)のホモノックアウトマウスでは血中の低カルボキシル化状態のオステオカルシンが増加しており,耐糖能とインスリン感受性とが増加していることを見いだした2).この表現型はオステオカルシンホモノックアウトマウスの表現型とは逆であり,OST-PTPホモノックアウト;オステオカルシンヘテロノックアウトマウスではOST-PTPホモノックアウトマウスの表現型が回復した.そこで,OST-PTPがオステオカルシンのカルボシキル化を制御する分子機構について検討した.まず,OST-PTPによる,オステオカルシン,γ-カルボキシラーゼ,および,ビタミンKエポキシドレダクターゼであるVkorc1(γ-カルボキシラーゼ反応にはビタミンKが必要であるが,そのビタミンKの再生回路に必須の酵素)(図1)のチロシンリン酸化の制御について検討したが,チロシンリン酸化は検出できなかった.また,これらの物理的な結合についても検出できなかった.つまり,OST-PTPがオステオカルシンのカルボキシル化を正に調節していることを発見したが,その機構は不明のままであった.
以上のこれまでの研究から生じた,新たな疑問は以下のとおりである.1)OST-PTPによるオステオカルシンのカルボキシル化の調節機構,2)オステオカルシンのシグナル伝達機構,3)低カルボキシル化状態のオステオカルシンの由来とその活性調節機構,4)骨組織がグルコース代謝を調節するという機構はヒトにも存在するのかどうか.
この新たな疑問を解決するため,筆者らは,骨芽細胞内でのOST-PTPの標的基質の探索を試みたが,チロシンホスファターゼの標的基質の探索はその特性から困難であり,思うような結果が得られずにいた.
内分泌系に一般的な制御機構として正負のフィードバック機構が知られている.そして,骨組織から分泌されたオステオカルシンは膵臓のインスリン合成・分泌を促進する.それならば,インスリンが骨組織を標的としてなんらかの作用をもつことは十分に考えられた.事実,インスリン受容体は骨芽細胞に多く発現しており,培養骨芽細胞へのインスリンの添加によって下流のシグナルタンパク質であるAKT,GSK3β,FoxO1,p70S6Kのリン酸化は増加した.
インスリン受容体は受容体型チロシンキナーゼであり,いくつかのチロシンホスファターゼによって負に制御されることが知られている.たとえば,PTP1Bは肝臓や筋肉の細胞でインスリン受容体を負に制御する重要なチロシンホスファターゼである.OST-PTPもチロシンホスファターゼファミリーに属することから,インスリン受容体がOST-PTPの標的基質である可能性が考えられた.実際に筆者らは,骨芽細胞内でインスリン受容体がOST-PTPに結合すること,OST-PTPがインスリン受容体を脱リン酸化すること,を証明することができた.また,OST-PTPノックアウト骨芽細胞ではインスリンシグナルが増加していた.これらの結果から,OST-PTPが調節するオステオカルシンのカルボキシル化において,インスリンシグナルがなんらかの役割をはたしている可能性が示唆された.
以上の理由から,筆者らは,骨芽細胞特異的なインスリン受容体ノックアウトマウスを作製し,その骨代謝およびグルコース・エネルギー代謝調節について解析することにした.
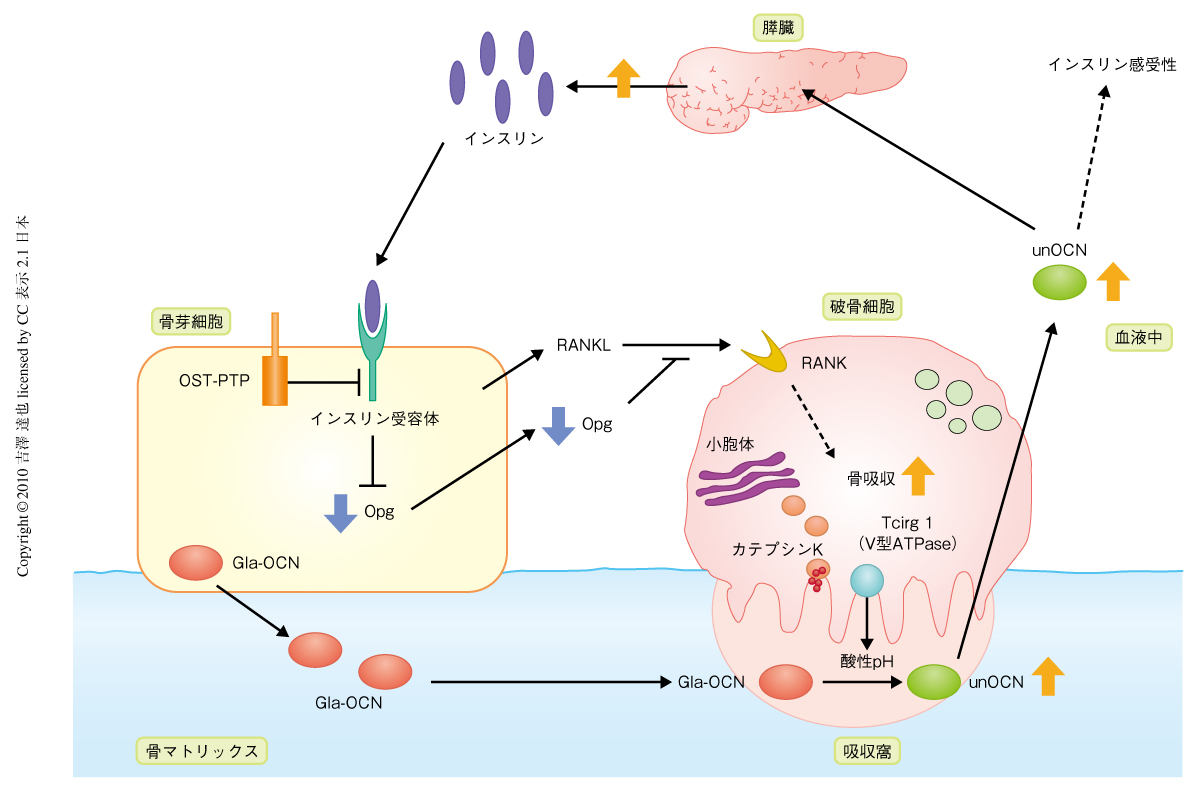
この骨芽細胞特異的インスリン受容体ノックアウトマウスを解析したところ,正常時血糖値が高く,血中インスリン濃度が低かった.さらに,耐糖能,インスリン感受性,グルコース応答性インスリン分泌,膵島の数と大きさ,膵臓β細胞の量と増殖能,エネルギー消費量,のすべてが低下していた.したがって,骨芽細胞のインスリンシグナルはグルコース・エネルギー代謝を調節していることが明らかとなった.つぎに,この表現型にオステオカルシンが関与しているかどうかを調べるため,オステオカルシンヘテロノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスを作製し解析したところ,骨芽細胞特異的インスリン受容体ホモノックアウトマウスやオステオカルシンホモノックアウトマウスと同様に,耐糖能,インスリン感受性,グルコース応答性インスリン分泌が低下したが,それぞれのヘテロノックアウトマウスでは変化はなかった.同様に,OST-PTPホモノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスではOST-PTPホモノックアウトマウスの表現型が回復した.さらに,これらマウスの血中オステオカルシンの状態を検討したところ,骨芽細胞特異的インスリン受容体ホモノックアウトマウスでは血中オステオカルシンの全体量に変化はないものの,低カルボキシル化状態のオステオカルシンの割合が低下していた.一方,OST-PTPホモノックアウトマウスでは低カルボキシル化状態のオステオカルシンの割合が増加していたが,OST-PTPホモノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスではこれが回復していた.これらの結果は,骨芽細胞のチロシンホスファターゼOST-PTPがインスリンシグナルを負に制御することで,オステオカルシンの活性化を低下させていることを強く示していた(図2).
骨形態計測により,骨芽細胞特異的インスリン受容体ホモノックアウトマウスでは骨量,骨形成速度,骨石灰化速度は低下していたが,骨芽細胞数,破骨細胞数に有意な差はないことがわかった.また,骨吸収のマーカーである血中CTx値は低下していた.つまり,骨芽細胞特異的インスリン受容体ホモノックアウトマウスは骨形成と骨吸収の低下による低回転型骨粗鬆症の状態であった.骨芽細胞のインスリンシグナルの骨吸収への影響を詳細に解析するため,骨芽細胞と破骨前駆細胞との共培養実験を行った.インスリン受容体ホモノックアウト骨芽細胞を用いた場合,形成された破骨細胞数に変化はなかったが,骨吸収窩エリアが低下していた.このとき,吸収に重要なタンパク質分解酵素カテプシンKとV型ATPaseであるTcirg1の発現低下が認められた.さらに,インスリン受容体ホモノックアウト骨芽細胞培養における遺伝子発現を調べたところ,破骨細胞の分化と機能に重要なRANKLのデコイ受容体であるOpgの発現が増加していた.以上から,骨芽細胞のインスリンシグナルはOpgの発現を低下させることで破骨細胞の吸収能を増加させていることがわかった(図2).
骨芽細胞のチロシンホスファターゼOST-PTPがインスリンシグナルを負に制御しオステオカルシンのカルボキシル化を増加させていることはわかったが,そのインスリンシグナルがオステオカルシンのカルボキシル化を低下させる機構については不明であった.そこで筆者らは,“酸性pH条件がタンパク質のγ-カルボキシグルタミン酸を脱カルボキシル化できる”という30年前の論文をみつけ4,5),破骨細胞における骨吸収時の酸性pH条件(骨吸収窩エリアはpH 4.5程度)がオステオカルシンを脱カルボキシル化するという仮説をたてた.まず,グルタミン酸残基がすべてカルボキシル化されたオステオカルシンをpH 4.5,37℃でインキュベーションし,脱カルボキシル化が起こるかどうか質量分析法で解析したところ,少なくとも13番目のグルタミン酸残基が脱カルボキシル化されることを見いだした.この生成された低カルボキシル化状態のオステオカルシンに活性があることは膵β細胞株のインスリン分泌試験により確認した.また,骨芽細胞を除いた骨切片上で破骨細胞を培養したとき,培養上清に低カルボキシル化状態のオステオカルシンが生成されることを明らかにした.さらに,骨吸収窩エリアの酸性化障害のため骨吸収の阻害されているTcirg1欠損マウスの頭頂骨器官培養上清では,膵β細胞株のインスリン分泌を促進できないことを証明した.つぎに,実際に,マウス個体内で骨吸収がグルコース代謝を調節しているかどうかを明らかにするため,Tcirg1欠損マウスを用いて検討した.予想どおり,Tcirg1欠損マウスでは血中の低カルボキシル化状態のオステオカルシンが低下しており,耐糖能も低下していた.また,高脂肪食負荷野生型マウスにRANKLを投与し骨吸収を促進させたところ,血中の低カルボキシル化状態のオステオカルシンが増加し耐糖能も回復した.以上の結果から,骨吸収は,グルタミン酸残基がすべてカルボキシル化されたオステオカルシンを脱カルボキシル化してグルコース代謝を調節するに十分であることが明らかになった(図2).
つぎに,骨芽細胞のインスリンシグナルが調節するグルコース代謝は骨吸収に依存的なのかどうかを検討するため,以下のマウスモデルを用いた3つの解析をした.1)インスリン受容体とTcirg1との複合ヘテロマウスの解析,2)OST-PTPホモノックアウトマウスからTcirg1対立遺伝子を1つ除いたマウスによる表現型回復の解析,3)OST-PTPホモノックアウトマウスへの骨吸収阻害薬であるビスホスホネート製剤の投与による表現型回復の解析.すべての結果は述べないが,これらの結果は,骨芽細胞のインスリンシグナルが調節するグルコース代謝は骨吸収に依存的であることを示していた(図2).
最近,ヒトのオステオカルシンとグルコース代謝の連関について臨床的な報告が集まりつつある.しかし,ヒトにおいてOST-PTPをコードするEsp遺伝子は偽遺伝子であることから,別のチロシンホスファターゼによってオステオカルシンが調節されている可能性がある.そこで,ヒト骨芽細胞を用いて解析した結果,少なくともチロシンホスファターゼのうちPTP1Bがインスリン受容体を負に制御しOpgの発現を促進していることが明らかとなった.つぎに,骨吸収が低下した患者では実際に血中の低カルボキシル化状態のオステオカルシンおよびグルコース代謝に異常があるかどうかを検討するため,遺伝性大理石骨病の患者を調べた.その結果,健常者に比べ大理石骨病の患者では血中の低カルボキシル化状態のオステオカルシン濃度が低く,インスリン濃度も低い傾向が認められた.これらの解析から,ヒトにおいても,オステオカルシンの活性化の少なくとも一部は骨吸収によって調節されていることが示された.
この筆者らの研究のポイントは,骨代謝とグルコース・エネルギー代謝が相互に影響しあうという概念においてひとつの機構を証明した点である.骨芽細胞のインスリンシグナルは骨芽細胞と破骨細胞との相互作用の調節を介してオステオカルシンを活性化する(図2).オステオカルシンは膵臓でインスリンの合成・分泌を促進することでグルコース代謝を制御する(図2).この正のフィードバックループの存在は,今後の骨代謝分野とグルコース・エネルギー代謝分野の双方の研究,とくに,臨床分野において重要だと思われる.事実,筆者らのマウスでの結果と同様に,ビスホスホネート製剤で治療中の骨粗鬆症の患者では絶食時血糖値が高いという報告や6),血中の低カルボキシル化状態のオステオカルシンが低いという報告がある7).しかし,ヒトの場合,遺伝的な背景も環境要因も異なるため,当然,すべてにおいてこの機構が優勢にあてはまるわけではないだろう.野生型マウスにおいてさえ,遺伝的背景を少し変えると低カルボキシル化状態のオステオカルシンの割合と耐糖能とが大きく変化する.今後の数多くの臨床研究が期待される.
筆者らは,新たに骨吸収経由でのオステオカルシンの活性化を証明したが,従来の説である骨芽細胞が分泌する低カルボキシル化状態のオステオカルシンについても考察してみる.筆者らがELISA法により検討しなおした結果,インスリン受容体ホモノックアウト骨芽細胞では培養上清中の低カルボキシル化状態のオステオカルシンに変化はなかった.しかし,野生型の培養骨芽細胞に抗凝固剤ワルファリン(Vkorc1を阻害することによってビタミンK依存性のγカルボキシル化反応を阻害する)を添加すると,培養上清中の低カルボキシル化状態のオステオカルシンは増加した8).同様に,マウスにワルファリンを投与するかビタミンK欠乏にするかしても,血中の低カルボキシル化状態のオステオカルシンは増加した.これらは生理的な状態ではないが,少なくとも,骨芽細胞内のγカルボキシル化反応を制御すれば低カルボキシル化状態のオステオカルシンの分泌を調節できることを示している.したがって,インスリンではないにしても,ほかのホルモンや刺激により骨芽細胞内のγカルボキシル化反応が阻害されることで,低カルボキシル化状態のオステオカルシンの分泌が促進される可能性は十分に考えられる.
最後に,オステオカルシンはどのような機構で機能を発揮するのかという疑問がまだ残っている.骨組織由来ホルモン“オステオカイン”としてのオステオカルシンの研究はまだはじまったばかりである.その受容体ばかりでなく,シグナル伝達経路さえみつかっていない.今後のオステオカルシンの生物学的な研究,ひいては,糖尿病・肥満の臨床応用にとって,その受容体の発見は最大の課題であろう.
略歴:1999年 農学博士(東京大学分子細胞生物学研究所,指導教官 加藤茂明教授),同年 新潟大学歯学部 助手を経て,2007年より米国Columbia大学 ポスドク研究員.
研究テーマ:骨を中心とした代謝制御作用.
関心事:2010年10月から熊本大学大学院生命科学研究部 病態生化学分野で研究するため,現在は熊本県での新しい研究と生活.
© 2010 吉澤 達也 Licensed under CC 表示 2.1 日本
(米国Columbia大学College of Physicians and Surgeons,Department of Genetics and Development)
email:吉澤達也
DOI: 10.7875/first.author.2010.003
Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism.
Mathieu Ferron, Jianwen Wei, Tatsuya Yoshizawa, Andrea Del Fattore, Ronald A. DePinho, Anna Teti, Patricia Ducy, Gerard Karsenty
Cell, 142, 296-308 (2010)
この論文に出現する遺伝子・タンパク質のUniprot ID
インスリン, Insulin, オステオカルシン(P86546), FGF23(Q9EPC2), γ-カルボキシラーゼ(Q9QYC7), チロシンホスファターゼ, OST-PTP(P70289), Esp(P70289), ビタミンKエポキシドレダクターゼ, Vkorc1(Q9CRC0), インスリン受容体, AKT, GSK3β(Q9WV60), FoxO1(Q9R1E0), p70S6K, PTP1B(P35821), 骨芽細胞特異的インスリン受容体(P15208), チロシンホスファターゼOST-PTP(P70289), カテプシンK(P55097), V型ATPase, Tcirg1(Q9JHF5), RANKL(O35235), Opg(O08712), OCN(P86546)
要 約
筆者らの研究室は,骨を中心とした多臓器間ネットワークによる代謝制御作用について研究している.今回,骨芽細胞においてインスリンシグナルが骨代謝とグルコース・エネルギー代謝の両方を調節していることを明らかにした.その具体的なポイントとして,つぎの4つがあげられる.1)骨芽細胞におけるインスリンシグナルは骨ホルモンであるオステオカルシンを活性化することでグルコース・エネルギー代謝を調節する.2)骨芽細胞におけるインスリンシグナルは破骨細胞の骨吸収を促進させる.3)破骨細胞骨吸収窩エリアの酸性pH環境はオステオカルシンを活性化する.4)ヒトにおいても骨組織がグルコース代謝を調節している.
はじめに
骨組織は,骨をつくる細胞である骨芽細胞と骨を壊す細胞である破骨細胞によって絶え間なくつくり替えられており,機械的な機能,造血機能,代謝機能をもつ,マルチタスクな組織である.さらに近年では,少なくとも2つのホルモン,FGF23とオステオカルシンとを分泌する内分泌器官であることも明らかになってきている1,2).
オステオカルシンは,骨芽細胞内で合成されたのち,γ-カルボキシラーゼによってカルボキシル化され,その大部分は骨基質として骨に埋め込まれるが,一部は血中に放出されている(図1).血中のオステオカルシンは,3つのグルタミン酸残基がすべてカルボキシル化されたものと,低カルボキシル化状態のものとの2つの形態で存在しており,最近,筆者らの研究室では,低カルボキシル化状態のオステオカルシンが膵臓におけるインスリンの合成・分泌と末梢組織のインスリン感受性とを促進することで,グルコース代謝を調節していることを明らかにした2,3)(図1).また,その分子機構は十分に明らかではないが,エネルギー代謝をも調節していることも明らかにした2).この研究では骨組織がオステオカルシンというホルモンを産生しグルコース・エネルギー代謝を調節するという新しい機構を発見したが,活性型とみなされた低カルボキシル化状態のオステオカルシンの由来とその活性調節については不明であった.従来は,骨芽細胞内でカルボキシル化をのがれたオステオカルシンが分泌されるものと考えられていたが,実際には,γカルボキシル化反応を調節する機構は明らかではなく,疑問が残っていた.また,カルボキシル化されたオステオカルシンを脱カルボキシル化する酵素は現在まで知られていない.
この研究と同時期に,筆者らは,チロシンホスファターゼであるOST-PTP(Esp遺伝子の産物)のホモノックアウトマウスでは血中の低カルボキシル化状態のオステオカルシンが増加しており,耐糖能とインスリン感受性とが増加していることを見いだした2).この表現型はオステオカルシンホモノックアウトマウスの表現型とは逆であり,OST-PTPホモノックアウト;オステオカルシンヘテロノックアウトマウスではOST-PTPホモノックアウトマウスの表現型が回復した.そこで,OST-PTPがオステオカルシンのカルボシキル化を制御する分子機構について検討した.まず,OST-PTPによる,オステオカルシン,γ-カルボキシラーゼ,および,ビタミンKエポキシドレダクターゼであるVkorc1(γ-カルボキシラーゼ反応にはビタミンKが必要であるが,そのビタミンKの再生回路に必須の酵素)(図1)のチロシンリン酸化の制御について検討したが,チロシンリン酸化は検出できなかった.また,これらの物理的な結合についても検出できなかった.つまり,OST-PTPがオステオカルシンのカルボキシル化を正に調節していることを発見したが,その機構は不明のままであった.
以上のこれまでの研究から生じた,新たな疑問は以下のとおりである.1)OST-PTPによるオステオカルシンのカルボキシル化の調節機構,2)オステオカルシンのシグナル伝達機構,3)低カルボキシル化状態のオステオカルシンの由来とその活性調節機構,4)骨組織がグルコース代謝を調節するという機構はヒトにも存在するのかどうか.
1.研究にいたった経緯
この新たな疑問を解決するため,筆者らは,骨芽細胞内でのOST-PTPの標的基質の探索を試みたが,チロシンホスファターゼの標的基質の探索はその特性から困難であり,思うような結果が得られずにいた.
内分泌系に一般的な制御機構として正負のフィードバック機構が知られている.そして,骨組織から分泌されたオステオカルシンは膵臓のインスリン合成・分泌を促進する.それならば,インスリンが骨組織を標的としてなんらかの作用をもつことは十分に考えられた.事実,インスリン受容体は骨芽細胞に多く発現しており,培養骨芽細胞へのインスリンの添加によって下流のシグナルタンパク質であるAKT,GSK3β,FoxO1,p70S6Kのリン酸化は増加した.
インスリン受容体は受容体型チロシンキナーゼであり,いくつかのチロシンホスファターゼによって負に制御されることが知られている.たとえば,PTP1Bは肝臓や筋肉の細胞でインスリン受容体を負に制御する重要なチロシンホスファターゼである.OST-PTPもチロシンホスファターゼファミリーに属することから,インスリン受容体がOST-PTPの標的基質である可能性が考えられた.実際に筆者らは,骨芽細胞内でインスリン受容体がOST-PTPに結合すること,OST-PTPがインスリン受容体を脱リン酸化すること,を証明することができた.また,OST-PTPノックアウト骨芽細胞ではインスリンシグナルが増加していた.これらの結果から,OST-PTPが調節するオステオカルシンのカルボキシル化において,インスリンシグナルがなんらかの役割をはたしている可能性が示唆された.
以上の理由から,筆者らは,骨芽細胞特異的なインスリン受容体ノックアウトマウスを作製し,その骨代謝およびグルコース・エネルギー代謝調節について解析することにした.
2.結果
この骨芽細胞特異的インスリン受容体ノックアウトマウスを解析したところ,正常時血糖値が高く,血中インスリン濃度が低かった.さらに,耐糖能,インスリン感受性,グルコース応答性インスリン分泌,膵島の数と大きさ,膵臓β細胞の量と増殖能,エネルギー消費量,のすべてが低下していた.したがって,骨芽細胞のインスリンシグナルはグルコース・エネルギー代謝を調節していることが明らかとなった.つぎに,この表現型にオステオカルシンが関与しているかどうかを調べるため,オステオカルシンヘテロノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスを作製し解析したところ,骨芽細胞特異的インスリン受容体ホモノックアウトマウスやオステオカルシンホモノックアウトマウスと同様に,耐糖能,インスリン感受性,グルコース応答性インスリン分泌が低下したが,それぞれのヘテロノックアウトマウスでは変化はなかった.同様に,OST-PTPホモノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスではOST-PTPホモノックアウトマウスの表現型が回復した.さらに,これらマウスの血中オステオカルシンの状態を検討したところ,骨芽細胞特異的インスリン受容体ホモノックアウトマウスでは血中オステオカルシンの全体量に変化はないものの,低カルボキシル化状態のオステオカルシンの割合が低下していた.一方,OST-PTPホモノックアウトマウスでは低カルボキシル化状態のオステオカルシンの割合が増加していたが,OST-PTPホモノックアウト;骨芽細胞特異的インスリン受容体ヘテロノックアウトマウスではこれが回復していた.これらの結果は,骨芽細胞のチロシンホスファターゼOST-PTPがインスリンシグナルを負に制御することで,オステオカルシンの活性化を低下させていることを強く示していた(図2).
骨形態計測により,骨芽細胞特異的インスリン受容体ホモノックアウトマウスでは骨量,骨形成速度,骨石灰化速度は低下していたが,骨芽細胞数,破骨細胞数に有意な差はないことがわかった.また,骨吸収のマーカーである血中CTx値は低下していた.つまり,骨芽細胞特異的インスリン受容体ホモノックアウトマウスは骨形成と骨吸収の低下による低回転型骨粗鬆症の状態であった.骨芽細胞のインスリンシグナルの骨吸収への影響を詳細に解析するため,骨芽細胞と破骨前駆細胞との共培養実験を行った.インスリン受容体ホモノックアウト骨芽細胞を用いた場合,形成された破骨細胞数に変化はなかったが,骨吸収窩エリアが低下していた.このとき,吸収に重要なタンパク質分解酵素カテプシンKとV型ATPaseであるTcirg1の発現低下が認められた.さらに,インスリン受容体ホモノックアウト骨芽細胞培養における遺伝子発現を調べたところ,破骨細胞の分化と機能に重要なRANKLのデコイ受容体であるOpgの発現が増加していた.以上から,骨芽細胞のインスリンシグナルはOpgの発現を低下させることで破骨細胞の吸収能を増加させていることがわかった(図2).
骨芽細胞のチロシンホスファターゼOST-PTPがインスリンシグナルを負に制御しオステオカルシンのカルボキシル化を増加させていることはわかったが,そのインスリンシグナルがオステオカルシンのカルボキシル化を低下させる機構については不明であった.そこで筆者らは,“酸性pH条件がタンパク質のγ-カルボキシグルタミン酸を脱カルボキシル化できる”という30年前の論文をみつけ4,5),破骨細胞における骨吸収時の酸性pH条件(骨吸収窩エリアはpH 4.5程度)がオステオカルシンを脱カルボキシル化するという仮説をたてた.まず,グルタミン酸残基がすべてカルボキシル化されたオステオカルシンをpH 4.5,37℃でインキュベーションし,脱カルボキシル化が起こるかどうか質量分析法で解析したところ,少なくとも13番目のグルタミン酸残基が脱カルボキシル化されることを見いだした.この生成された低カルボキシル化状態のオステオカルシンに活性があることは膵β細胞株のインスリン分泌試験により確認した.また,骨芽細胞を除いた骨切片上で破骨細胞を培養したとき,培養上清に低カルボキシル化状態のオステオカルシンが生成されることを明らかにした.さらに,骨吸収窩エリアの酸性化障害のため骨吸収の阻害されているTcirg1欠損マウスの頭頂骨器官培養上清では,膵β細胞株のインスリン分泌を促進できないことを証明した.つぎに,実際に,マウス個体内で骨吸収がグルコース代謝を調節しているかどうかを明らかにするため,Tcirg1欠損マウスを用いて検討した.予想どおり,Tcirg1欠損マウスでは血中の低カルボキシル化状態のオステオカルシンが低下しており,耐糖能も低下していた.また,高脂肪食負荷野生型マウスにRANKLを投与し骨吸収を促進させたところ,血中の低カルボキシル化状態のオステオカルシンが増加し耐糖能も回復した.以上の結果から,骨吸収は,グルタミン酸残基がすべてカルボキシル化されたオステオカルシンを脱カルボキシル化してグルコース代謝を調節するに十分であることが明らかになった(図2).
つぎに,骨芽細胞のインスリンシグナルが調節するグルコース代謝は骨吸収に依存的なのかどうかを検討するため,以下のマウスモデルを用いた3つの解析をした.1)インスリン受容体とTcirg1との複合ヘテロマウスの解析,2)OST-PTPホモノックアウトマウスからTcirg1対立遺伝子を1つ除いたマウスによる表現型回復の解析,3)OST-PTPホモノックアウトマウスへの骨吸収阻害薬であるビスホスホネート製剤の投与による表現型回復の解析.すべての結果は述べないが,これらの結果は,骨芽細胞のインスリンシグナルが調節するグルコース代謝は骨吸収に依存的であることを示していた(図2).
最近,ヒトのオステオカルシンとグルコース代謝の連関について臨床的な報告が集まりつつある.しかし,ヒトにおいてOST-PTPをコードするEsp遺伝子は偽遺伝子であることから,別のチロシンホスファターゼによってオステオカルシンが調節されている可能性がある.そこで,ヒト骨芽細胞を用いて解析した結果,少なくともチロシンホスファターゼのうちPTP1Bがインスリン受容体を負に制御しOpgの発現を促進していることが明らかとなった.つぎに,骨吸収が低下した患者では実際に血中の低カルボキシル化状態のオステオカルシンおよびグルコース代謝に異常があるかどうかを検討するため,遺伝性大理石骨病の患者を調べた.その結果,健常者に比べ大理石骨病の患者では血中の低カルボキシル化状態のオステオカルシン濃度が低く,インスリン濃度も低い傾向が認められた.これらの解析から,ヒトにおいても,オステオカルシンの活性化の少なくとも一部は骨吸収によって調節されていることが示された.
3.考察
この筆者らの研究のポイントは,骨代謝とグルコース・エネルギー代謝が相互に影響しあうという概念においてひとつの機構を証明した点である.骨芽細胞のインスリンシグナルは骨芽細胞と破骨細胞との相互作用の調節を介してオステオカルシンを活性化する(図2).オステオカルシンは膵臓でインスリンの合成・分泌を促進することでグルコース代謝を制御する(図2).この正のフィードバックループの存在は,今後の骨代謝分野とグルコース・エネルギー代謝分野の双方の研究,とくに,臨床分野において重要だと思われる.事実,筆者らのマウスでの結果と同様に,ビスホスホネート製剤で治療中の骨粗鬆症の患者では絶食時血糖値が高いという報告や6),血中の低カルボキシル化状態のオステオカルシンが低いという報告がある7).しかし,ヒトの場合,遺伝的な背景も環境要因も異なるため,当然,すべてにおいてこの機構が優勢にあてはまるわけではないだろう.野生型マウスにおいてさえ,遺伝的背景を少し変えると低カルボキシル化状態のオステオカルシンの割合と耐糖能とが大きく変化する.今後の数多くの臨床研究が期待される.
筆者らは,新たに骨吸収経由でのオステオカルシンの活性化を証明したが,従来の説である骨芽細胞が分泌する低カルボキシル化状態のオステオカルシンについても考察してみる.筆者らがELISA法により検討しなおした結果,インスリン受容体ホモノックアウト骨芽細胞では培養上清中の低カルボキシル化状態のオステオカルシンに変化はなかった.しかし,野生型の培養骨芽細胞に抗凝固剤ワルファリン(Vkorc1を阻害することによってビタミンK依存性のγカルボキシル化反応を阻害する)を添加すると,培養上清中の低カルボキシル化状態のオステオカルシンは増加した8).同様に,マウスにワルファリンを投与するかビタミンK欠乏にするかしても,血中の低カルボキシル化状態のオステオカルシンは増加した.これらは生理的な状態ではないが,少なくとも,骨芽細胞内のγカルボキシル化反応を制御すれば低カルボキシル化状態のオステオカルシンの分泌を調節できることを示している.したがって,インスリンではないにしても,ほかのホルモンや刺激により骨芽細胞内のγカルボキシル化反応が阻害されることで,低カルボキシル化状態のオステオカルシンの分泌が促進される可能性は十分に考えられる.
おわりに
最後に,オステオカルシンはどのような機構で機能を発揮するのかという疑問がまだ残っている.骨組織由来ホルモン“オステオカイン”としてのオステオカルシンの研究はまだはじまったばかりである.その受容体ばかりでなく,シグナル伝達経路さえみつかっていない.今後のオステオカルシンの生物学的な研究,ひいては,糖尿病・肥満の臨床応用にとって,その受容体の発見は最大の課題であろう.
文 献
- Fukumoto, S. & Martin, T. J.: Bone as an endocrine organ. Trends Endocrinol. Metab., 20, 230-236 (2009)[PubMed]
- Lee, N. K. et al.: Endocrine regulation of energy metabolism by the skeleton. Cell, 130, 456-469 (2007)[PubMed]
- Ferron, M. et al.: Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice. Proc. Natl. Acad. Sci. USA, 105, 5266-5270 (2008)[PubMed]
- Poser, J. W. & Price, P. A.: A method for decarboxylation of gamma-carboxyglutamic acid in proteins. Properties of the decarboxylated gamma-carboxyglutamic acid protein from calf bone. J. Biol. Chem., 254, 431-436 (1979)[PubMed]
- Engelke, J. A. et al.: Vitamin K-dependent carboxylase: utilization of decarboxylated bone Gla protein and matrix Gla protein as substrates. Biochim. Biophys. Acta, 1078, 31-34 (1991)[PubMed]
- Kaji, H. et al.: Analysis of factors affecting increase in bone mineral density at lumbar spine by bisphosphonate treatment in postmenopausal osteoporosis. J. Bone Miner. Metab., 27, 76-82 (2009)[PubMed]
- Kanazawa, I. et al.: Serum undercarboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus. Osteoporos Int., 22, 187-194 (2011)[PubMed]
- Ferron, M. et al.: An ELISA-based method to quantify osteocalcin carboxylation in mice. Biochem. Biophys. Res. Commun., 397, 691-696 (2010)[PubMed]
著者プロフィール
略歴:1999年 農学博士(東京大学分子細胞生物学研究所,指導教官 加藤茂明教授),同年 新潟大学歯学部 助手を経て,2007年より米国Columbia大学 ポスドク研究員.
研究テーマ:骨を中心とした代謝制御作用.
関心事:2010年10月から熊本大学大学院生命科学研究部 病態生化学分野で研究するため,現在は熊本県での新しい研究と生活.
© 2010 吉澤 達也 Licensed under CC 表示 2.1 日本