nNOSにより誘起される陽イオンチャネルTRPV1を介したCa2+シグナルは骨格筋の肥大を促進する
伊藤尚基・武田伸一
(国立精神・神経医療研究センター神経研究所 遺伝子疾患治療研究部)
email:伊藤尚基,武田伸一
DOI: 10.7875/first.author.2012.161
Activation of calcium signaling through Trpv1 by nNOS and peroxynitrite as a key trigger of skeletal muscle hypertrophy.
Naoki Ito, Urs T. Ruegg, Akira Kudo, Yuko Miyagoe-Suzuki, Shin'ichi Takeda
Nature Medicine, 19, 101-106 (2013)
加齢やさまざまな疾患にともなう骨格筋の萎縮は深刻な問題となっており,筋萎縮を促進するタンパク質分解経路の抑制,または,筋肥大を促進するタンパク質合成経路の活性化が,筋萎縮に対する治療戦略の中心となっている.この研究において,筆者らは,nNOSにより誘起されるCa2+シグナルが負荷に依存的な筋肥大を促進することを明らかにした.nNOSは負荷の開始直後に活性化され,nNOSノックアウトマウスでは負荷に依存的な筋肥大の進行が遅れていた.nNOSの活性化は,NOと活性酸素との反応物である過酸化亜硝酸の産生を促進し,陽イオンチャネルTRPV1を介した細胞内Ca2+濃度の上昇を誘起した.この細胞内Ca2+濃度の上昇によりタンパク質合成系を制御するmTORが活性化され筋肥大は促進された.興味深いことに,TRPV1のアゴニストであるカプサイシンを投与するだけでmTORは活性化し,筋肥大は促進され,脱負荷および除神経による筋萎縮は軽減された.この研究は,NOおよび過酸化亜硝酸,細胞内Ca2+濃度が骨格筋への負荷と細胞内シグナル経路の活性化とを結びつける重要な因子であることを明らかにし,TRPV1は筋萎縮の治療において新たな標的となることを示した.
骨格筋はそれ自体の活動状態に応じ環境に適した筋重量を維持している.運動,筋力トレーニング,リハビリテーションなどによりタンパク質合成経路が活性化されると筋肥大を生じ,逆に,寝たきりやギブス固定などにともなう筋の不動,また,がん,糖尿病,AIDSなどさまざまな疾患にともない,タンパク質分解経路が活性化されると筋萎縮を生じる.また近年,高齢化社会をむかえたわが国では,加齢にともなう筋萎縮(サルコペニア)は深刻な問題となっている.
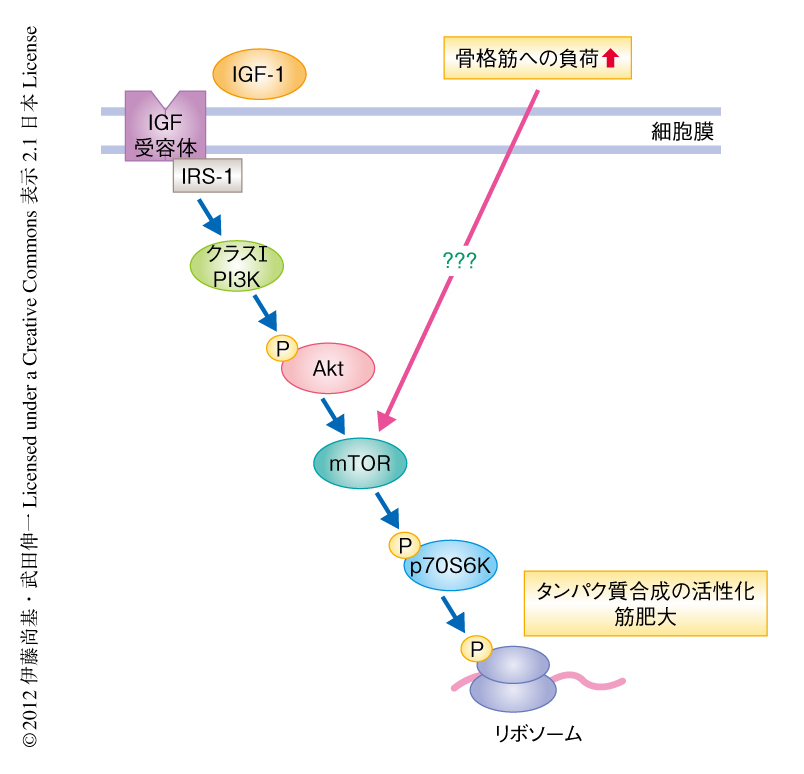
タンパク質合成経路を制御するmTORは細胞のサイズや加齢を含む多様な生命現象を制御しており,成長因子IGF-1によるAktの活性化を介したmTORの活性化は筋成長および筋肥大において非常に重要であると考えられている1).しかし近年,運動など骨格筋への負荷に対するmTORの活性化はAktに非依存的に起こることが明らかになり,負荷に依存的なmTORの活性化の機構は謎につつまれている2)(図1).負荷に依存的なmTORの活性化およびそののちに起こる筋肥大の分子機構を明らかにすることは,筋萎縮に対する新たな治療標的の発見にもつながる.
この研究において,筆者らは,骨格筋への負荷とmTORの活性化とを結びつける因子として,nNOS(neuronal nitric oxide synthase,神経型一酸化窒素合成酵素)の活性化,および,そののち起こる細胞内Ca2+濃度の制御に注目した.nNOSは骨格筋において細胞外基底膜と細胞内骨格とをつなぐジストロフィン複合体の構成タンパク質であり,nNOSにより産生されたNO(一酸化窒素)により血管の拡張や骨格筋幹細胞であるサテライト細胞の活性化などが制御されている3).また,NOは活性酸素と反応することにより過酸化亜硝酸(ONOO-)となり機能することがわかっており,NOおよび過酸化亜硝酸によりリアノジン受容体,L型Ca2+チャネル,TRPチャネルといったさまざまなチャネルが制御されている4).
nNOSの筋肥大における機能を明らかにするため,共働筋である腓腹筋,ヒラメ筋,足底筋のうち,腓腹筋およびヒラメ筋の腱を切除することにより足底筋に過剰な負荷(過負荷)をかける筋肥大誘導モデルを用いた.共働筋の切除から1週間のちの筋重量および筋線維の断面積を測定した結果,nNOSノックアウトマウスは筋重量および筋線維断面積の増加が野生型マウスと比べ顕著ではなかった.nNOSが筋肥大の過程のうち,いつ機能しているのか明らかにするため阻害剤の投与実験を行った.NOS阻害剤およびnNOS阻害剤を用いて投与期間の異なるマウスを比較した結果,共働筋の切除から数時間以内に産生されるnNOSによるNOの産生が重要であることがわかり,nNOSが筋肥大のかなり初期の現象に関与している可能性が示唆された.そこで,過負荷の開始から数時間におけるnNOSの活性を測定した.その結果,nNOSは過負荷の開始から3分以内に活性化され,その活性は過負荷の開始から1時間のちには定常レベルもしくはそれ以下にまで低下していた.このことから,nNOSは過負荷の直後に活性化され,過負荷の開始から1時間以内に産生されたNOがそののちの筋肥大において重要であることがわかった.
活性化されたnNOSによる筋肥大の促進機構を明らかにするため,NOと活性酸素との反応物である過酸化亜硝酸に注目した.過酸化亜硝酸は一般的には細胞にとり有毒なものと考えられているが,NOと同様に,生理的なレベルの過酸化亜硝酸は血管の拡張や細胞内Ca2+濃度の制御などにかかわり,細胞にとり有益な機能を発揮することが報告されている5).この過酸化亜硝酸の筋肥大への関与を調べるため,まず,NOと活性酸素との協働作用について検討した.nNOSノックアウトマウスの表現型はNO供与体を投与することにより回復するが,この効果は活性酸素を産生する酵素であるNOX4(NADPH oxidase 4)の阻害剤との共投与により抑制され,NOが筋肥大を促進するには同時にNOX4の活性が必要であることがわかった.より直接的に過酸化亜硝酸の筋肥大における関与を調べるため,過酸化亜硝酸の消去剤であるFeTPPSを投与したところ,nNOSノックアウトマウスと同じ程度に筋肥大は抑制された.このことから,NOと活性酸素の反応物である過酸化亜硝酸が筋肥大を促進することが示唆された.
産生されたNOおよび過酸化亜硝酸による筋肥大の促進機構を明らかにするため,負荷に依存的なmTORの活性化に注目した.その結果,過負荷の開始から3分後にはmTORの下流タンパク質であるp70S6Kはリン酸化されておりmTORは活性化していたが,nNOSノックアウトマウスおよび過酸化亜硝酸の消去剤FeTPPSを投与したマウスではその活性化は抑制されていた.これらの結果から,NOおよび過酸化亜硝酸は負荷に依存的なmTORの活性化を制御することにより筋肥大を促進することが示唆された.
NOおよび過酸化亜硝酸によるmTORの活性化機構を明らかにするため,NOおよび過酸化亜硝酸による細胞内Ca2+濃度の制御に注目した.Ca2+と結合することで蛍光を発するGCaMP2トランスジェニックマウスを用いたところ,過負荷の開始から3分後には細胞内Ca2+濃度は上昇することがわかった.NOおよび過酸化亜硝酸には細胞内Ca2+濃度を上昇させる作用があるのか,in vitroにおけるCa2+イメージング法を用いて検討した.その結果,NOおよび過酸化亜硝酸は筋小胞体からのCa2+の放出を促進することがわかった.また,細胞内Ca2+濃度を上昇させるタプシガルギンを投与した結果,過負荷をかけずともp70S6Kのリン酸化は亢進することがわかった.さらに,過負荷の開始から3分後に認められるp70S6Kのリン酸化は,細胞内Ca2+キレート剤であるBAPTA-AMの投与により抑制された.これらの結果から,過負荷に依存的なmTORの活性化は細胞内Ca2+濃度により制御されることがわかった.のちの筋肥大における細胞内Ca2+濃度の関与を検討した結果,共働筋の切除から1週間のちの筋重量の増加はBAPTA-AMの投与によりnNOSノックアウトマウスと同じ程度にまで抑制された.また,nNOSノックアウトマウスの表現型はNO供与体もしくはNOおよび過酸化亜硝酸の供与体の投与により回復するが,その効果はBAPTA-AMとの共投与により抑制された.これらの結果から,過負荷により産生されたNOおよび過酸化亜硝酸は細胞内Ca2+濃度を制御することによりmTORを活性化し,筋肥大を促進することがわかった.
NOおよび過酸化亜硝酸の標的となるチャネルを明らかにするため,まず,筋収縮を制御するリアノジン受容体およびジヒドロピリジン受容体に注目した.しかしながら,これらに対する阻害剤を用いてもNOおよび過酸化亜硝酸による細胞内Ca2+濃度の上昇,また,過負荷によるmTORの活性化およびのちの筋肥大は抑制されなかった.このことから,負荷に依存的なmTORの活性化を制御するCa2+と,筋収縮を制御するCa2+とは,異なるチャネルに由来すると考えられた.
つぎに,TRPチャネルファミリーに注目した.TRPチャネルは30ちかくのタンパク質からなるファミリーを形成しており,熱刺激,機械的な刺激,化学的な刺激あるいはpHなどにより活性化されCa2+を含む陽イオンを透過させる6).また,いくつかのTRPチャネルはNOにより活性化されることが報告されている7).これらのTRPチャネルのうち,どのチャネルにmTORを活性化させる作用があるかを検討するため,それぞれのチャネルに対するアゴニストを投与した.その結果,TRPV1のアゴニストであるカプサイシンによりp70S6Kのリン酸化が亢進した.カプサイシンによるp70S6Kのリン酸化はTRPV1ノックアウトマウスでは確認されず,また,細胞内Ca2+キレート剤であるBAPTA-AMとの共投与により抑制された.このことから,カプサイシンによるmTORの活性化はTRPV1および細胞内Ca2+濃度に依存的であることがわかった.NOおよび過酸化亜硝酸による細胞内Ca2+濃度の上昇におけるTRPV1の関与を検討するため,TRPV1ノックアウトマウスから筋サテライト細胞を調製しCa2+イメージング法を行った.その結果,TRPV1ノックアウトマウスに由来する筋管では細胞内Ca2+濃度の上昇は低減することがわかった.また,すでにTRPV1は骨格筋において筋小胞体に局在することが報告されている8).nNOSノックアウトマウスと同様に,TRPV1ノックアウトマウスでは過負荷による筋肥大が抑制されていた.また,カプサイシンの投与によりnNOSノックアウトマウスおよび過酸化亜硝酸の消去剤であるFeTPPSを投与したマウスの表現型は回復した.このことから,nNOSノックアウトマウスおよびFeTPPSを投与したマウスにおいて観察された筋肥大の抑制はTRPV1の活性化の異常に起因するものと考えられた.
過負荷およびトレッドミル運動によるmTORの活性化と,カプサイシンによるmTORの活性化とを比較した結果,カプサイシンによるmTORの活性化は,過負荷および運動に依存的な活性化と同等もしくはそれ以上のものであることがわかり,カプサイシンを投与することにより運動負荷と同様の効果が得られる可能性が示唆された.カプサイシンの投与のみで筋肥大が生じるかどうかを検討するため,カプサイシンを1日あたり2回,筋肉注射により投与した.その結果,1週間後にヒラメ筋,腓腹筋,足底筋の筋重量は約15%も上昇した.また,この効果はBAPTA-AMおよびmTORの阻害剤であるラパマイシンにより抑制され,TRPV1ノックアウトマウスでは認められなかった.このことから,カプサイシンによるTRPV1の活性化を介した細胞内Ca2+濃度の上昇,および,そののちのmTORの活性化は,筋肥大を十分に促進しうるものとわかった.また,カプサイシンの投与により筋重量だけでなく筋張力も増強された.最後に,TRPV1が筋萎縮の治療に対する標的となりうるかどうかを検討するため,後肢懸垂および除神経による筋萎縮の誘導モデルを用いた.2週間の筋萎縮の誘導中にカプサイシンを投与したところ,後肢懸垂および除神経により生じる筋萎縮は抑制できることがわかった.
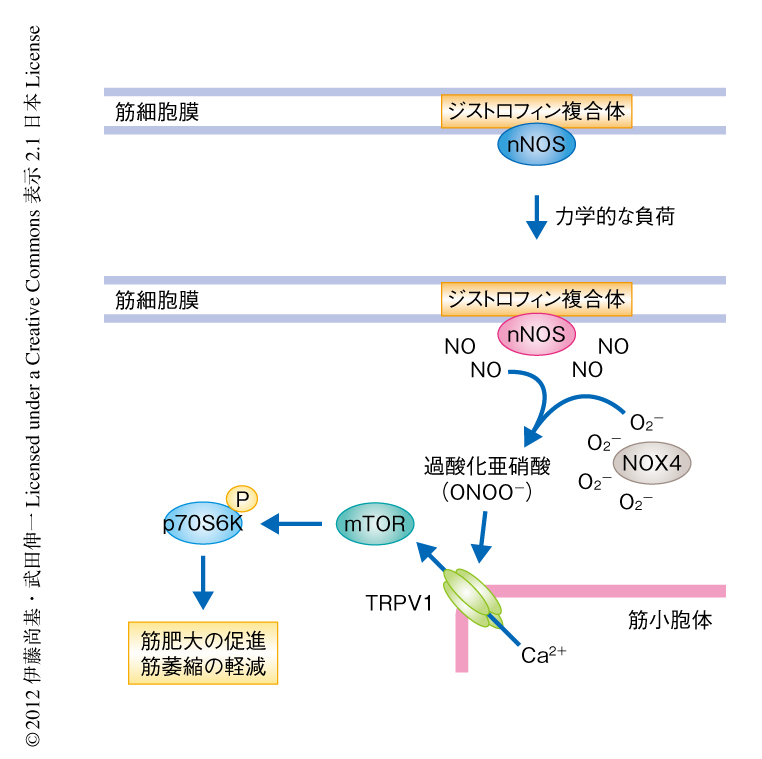
これらの結果から,力学的な負荷により活性化されたnNOSおよびそれにより生じたNOおよび過酸化亜硝酸は,TRPV1を介し細胞内Ca2+濃度を上昇させることによりmTORを活性化し,筋肥大を促進すると結論づけた.また,薬理学的にTRPV1を活性化するだけでmTORは活性化し,筋肥大が促進され,筋萎縮が軽減された(図2).
筆者らは,以前,骨格筋への脱負荷の際にnNOSが細胞膜から細胞質へと移行し,筋萎縮を促進することを報告している9).このことは,nNOSが筋肥大と筋萎縮という相反する生命現象を制御していることを意味しており,nNOSが負荷および脱負荷に依存的な骨格筋の可塑性制御に関与していることを示唆した.
IGF-1などの成長因子によるmTORの活性化と異なり,負荷に依存的なmTORの活性化はAktの活性化を介さない.実際,IGF-1に対するAktおよびmTORの応答はnNOSノックアウトマウスおよびTRPV1ノックアウトマウスにおいて通常どおりに起こった.このことから,IGF-1による筋成長と,負荷による細胞内Ca2+濃度に依存的な筋肥大は,一部は共通するものの異なる機構によるmTORの活性化を介していると考えられた.アミノ酸によるmTORの活性化に細胞内Ca2+濃度がかかわることが報告されているが10),細胞内Ca2+濃度とmTORとの関係にはいまだ未解明な部分が多い.今回,明らかになったnNOS,TRPV1,細胞内Ca2+濃度と筋肥大との関係は,筋の運動あるいは不動と細胞内シグナル経路の活性化とを結びつける新たな視点をもたらしたが,TRPV1はとくに神経系の細胞において痛み受容体として知られており,カプサイシンそのものを筋萎縮の治療薬として用いるのは現時点ではむずかしいと考えられる.今後,TRPV1以外のチャネルを解析することにより,より普遍的なCa2+-mTOR-筋肥大という経路を明らかにし,また,新たな筋萎縮の軽減予防薬の開発につながることが期待される.
略歴:東京工業大学大学院生命理工学研究科博士課程 在学中.
研究テーマ:nNOSおよび細胞内Ca2+濃度を主点とした筋肥大の促進機構.
関心事:あぁCa2+,君はどこから来て,これからどこへ行くの?
武田 伸一(Shin'ichi Takeda)
国立精神・神経医療研究センター神経研究所 部長.
研究室URL:http://www.ncnp.go.jp/nin/guide/r_dna2/index.html
© 2012 伊藤尚基・武田伸一 Licensed under CC 表示 2.1 日本
(国立精神・神経医療研究センター神経研究所 遺伝子疾患治療研究部)
email:伊藤尚基,武田伸一
DOI: 10.7875/first.author.2012.161
Activation of calcium signaling through Trpv1 by nNOS and peroxynitrite as a key trigger of skeletal muscle hypertrophy.
Naoki Ito, Urs T. Ruegg, Akira Kudo, Yuko Miyagoe-Suzuki, Shin'ichi Takeda
Nature Medicine, 19, 101-106 (2013)
要 約
加齢やさまざまな疾患にともなう骨格筋の萎縮は深刻な問題となっており,筋萎縮を促進するタンパク質分解経路の抑制,または,筋肥大を促進するタンパク質合成経路の活性化が,筋萎縮に対する治療戦略の中心となっている.この研究において,筆者らは,nNOSにより誘起されるCa2+シグナルが負荷に依存的な筋肥大を促進することを明らかにした.nNOSは負荷の開始直後に活性化され,nNOSノックアウトマウスでは負荷に依存的な筋肥大の進行が遅れていた.nNOSの活性化は,NOと活性酸素との反応物である過酸化亜硝酸の産生を促進し,陽イオンチャネルTRPV1を介した細胞内Ca2+濃度の上昇を誘起した.この細胞内Ca2+濃度の上昇によりタンパク質合成系を制御するmTORが活性化され筋肥大は促進された.興味深いことに,TRPV1のアゴニストであるカプサイシンを投与するだけでmTORは活性化し,筋肥大は促進され,脱負荷および除神経による筋萎縮は軽減された.この研究は,NOおよび過酸化亜硝酸,細胞内Ca2+濃度が骨格筋への負荷と細胞内シグナル経路の活性化とを結びつける重要な因子であることを明らかにし,TRPV1は筋萎縮の治療において新たな標的となることを示した.
はじめに
骨格筋はそれ自体の活動状態に応じ環境に適した筋重量を維持している.運動,筋力トレーニング,リハビリテーションなどによりタンパク質合成経路が活性化されると筋肥大を生じ,逆に,寝たきりやギブス固定などにともなう筋の不動,また,がん,糖尿病,AIDSなどさまざまな疾患にともない,タンパク質分解経路が活性化されると筋萎縮を生じる.また近年,高齢化社会をむかえたわが国では,加齢にともなう筋萎縮(サルコペニア)は深刻な問題となっている.
タンパク質合成経路を制御するmTORは細胞のサイズや加齢を含む多様な生命現象を制御しており,成長因子IGF-1によるAktの活性化を介したmTORの活性化は筋成長および筋肥大において非常に重要であると考えられている1).しかし近年,運動など骨格筋への負荷に対するmTORの活性化はAktに非依存的に起こることが明らかになり,負荷に依存的なmTORの活性化の機構は謎につつまれている2)(図1).負荷に依存的なmTORの活性化およびそののちに起こる筋肥大の分子機構を明らかにすることは,筋萎縮に対する新たな治療標的の発見にもつながる.
この研究において,筆者らは,骨格筋への負荷とmTORの活性化とを結びつける因子として,nNOS(neuronal nitric oxide synthase,神経型一酸化窒素合成酵素)の活性化,および,そののち起こる細胞内Ca2+濃度の制御に注目した.nNOSは骨格筋において細胞外基底膜と細胞内骨格とをつなぐジストロフィン複合体の構成タンパク質であり,nNOSにより産生されたNO(一酸化窒素)により血管の拡張や骨格筋幹細胞であるサテライト細胞の活性化などが制御されている3).また,NOは活性酸素と反応することにより過酸化亜硝酸(ONOO-)となり機能することがわかっており,NOおよび過酸化亜硝酸によりリアノジン受容体,L型Ca2+チャネル,TRPチャネルといったさまざまなチャネルが制御されている4).
1.過負荷の直後に活性化されるnNOSが筋肥大を促進する
nNOSの筋肥大における機能を明らかにするため,共働筋である腓腹筋,ヒラメ筋,足底筋のうち,腓腹筋およびヒラメ筋の腱を切除することにより足底筋に過剰な負荷(過負荷)をかける筋肥大誘導モデルを用いた.共働筋の切除から1週間のちの筋重量および筋線維の断面積を測定した結果,nNOSノックアウトマウスは筋重量および筋線維断面積の増加が野生型マウスと比べ顕著ではなかった.nNOSが筋肥大の過程のうち,いつ機能しているのか明らかにするため阻害剤の投与実験を行った.NOS阻害剤およびnNOS阻害剤を用いて投与期間の異なるマウスを比較した結果,共働筋の切除から数時間以内に産生されるnNOSによるNOの産生が重要であることがわかり,nNOSが筋肥大のかなり初期の現象に関与している可能性が示唆された.そこで,過負荷の開始から数時間におけるnNOSの活性を測定した.その結果,nNOSは過負荷の開始から3分以内に活性化され,その活性は過負荷の開始から1時間のちには定常レベルもしくはそれ以下にまで低下していた.このことから,nNOSは過負荷の直後に活性化され,過負荷の開始から1時間以内に産生されたNOがそののちの筋肥大において重要であることがわかった.
2.nNOSとNOX4との協働作用により産生された過酸化亜硝酸が筋肥大を促進する
活性化されたnNOSによる筋肥大の促進機構を明らかにするため,NOと活性酸素との反応物である過酸化亜硝酸に注目した.過酸化亜硝酸は一般的には細胞にとり有毒なものと考えられているが,NOと同様に,生理的なレベルの過酸化亜硝酸は血管の拡張や細胞内Ca2+濃度の制御などにかかわり,細胞にとり有益な機能を発揮することが報告されている5).この過酸化亜硝酸の筋肥大への関与を調べるため,まず,NOと活性酸素との協働作用について検討した.nNOSノックアウトマウスの表現型はNO供与体を投与することにより回復するが,この効果は活性酸素を産生する酵素であるNOX4(NADPH oxidase 4)の阻害剤との共投与により抑制され,NOが筋肥大を促進するには同時にNOX4の活性が必要であることがわかった.より直接的に過酸化亜硝酸の筋肥大における関与を調べるため,過酸化亜硝酸の消去剤であるFeTPPSを投与したところ,nNOSノックアウトマウスと同じ程度に筋肥大は抑制された.このことから,NOと活性酸素の反応物である過酸化亜硝酸が筋肥大を促進することが示唆された.
3.NOおよび過酸化亜硝酸は細胞内Ca2+濃度を制御することによりmTORを活性化し筋肥大を促進する
産生されたNOおよび過酸化亜硝酸による筋肥大の促進機構を明らかにするため,負荷に依存的なmTORの活性化に注目した.その結果,過負荷の開始から3分後にはmTORの下流タンパク質であるp70S6Kはリン酸化されておりmTORは活性化していたが,nNOSノックアウトマウスおよび過酸化亜硝酸の消去剤FeTPPSを投与したマウスではその活性化は抑制されていた.これらの結果から,NOおよび過酸化亜硝酸は負荷に依存的なmTORの活性化を制御することにより筋肥大を促進することが示唆された.
NOおよび過酸化亜硝酸によるmTORの活性化機構を明らかにするため,NOおよび過酸化亜硝酸による細胞内Ca2+濃度の制御に注目した.Ca2+と結合することで蛍光を発するGCaMP2トランスジェニックマウスを用いたところ,過負荷の開始から3分後には細胞内Ca2+濃度は上昇することがわかった.NOおよび過酸化亜硝酸には細胞内Ca2+濃度を上昇させる作用があるのか,in vitroにおけるCa2+イメージング法を用いて検討した.その結果,NOおよび過酸化亜硝酸は筋小胞体からのCa2+の放出を促進することがわかった.また,細胞内Ca2+濃度を上昇させるタプシガルギンを投与した結果,過負荷をかけずともp70S6Kのリン酸化は亢進することがわかった.さらに,過負荷の開始から3分後に認められるp70S6Kのリン酸化は,細胞内Ca2+キレート剤であるBAPTA-AMの投与により抑制された.これらの結果から,過負荷に依存的なmTORの活性化は細胞内Ca2+濃度により制御されることがわかった.のちの筋肥大における細胞内Ca2+濃度の関与を検討した結果,共働筋の切除から1週間のちの筋重量の増加はBAPTA-AMの投与によりnNOSノックアウトマウスと同じ程度にまで抑制された.また,nNOSノックアウトマウスの表現型はNO供与体もしくはNOおよび過酸化亜硝酸の供与体の投与により回復するが,その効果はBAPTA-AMとの共投与により抑制された.これらの結果から,過負荷により産生されたNOおよび過酸化亜硝酸は細胞内Ca2+濃度を制御することによりmTORを活性化し,筋肥大を促進することがわかった.
4.陽イオンチャネルTRPV1の活性化による細胞内Ca2+濃度の上昇により筋肥大が促進され筋萎縮は軽減される
NOおよび過酸化亜硝酸の標的となるチャネルを明らかにするため,まず,筋収縮を制御するリアノジン受容体およびジヒドロピリジン受容体に注目した.しかしながら,これらに対する阻害剤を用いてもNOおよび過酸化亜硝酸による細胞内Ca2+濃度の上昇,また,過負荷によるmTORの活性化およびのちの筋肥大は抑制されなかった.このことから,負荷に依存的なmTORの活性化を制御するCa2+と,筋収縮を制御するCa2+とは,異なるチャネルに由来すると考えられた.
つぎに,TRPチャネルファミリーに注目した.TRPチャネルは30ちかくのタンパク質からなるファミリーを形成しており,熱刺激,機械的な刺激,化学的な刺激あるいはpHなどにより活性化されCa2+を含む陽イオンを透過させる6).また,いくつかのTRPチャネルはNOにより活性化されることが報告されている7).これらのTRPチャネルのうち,どのチャネルにmTORを活性化させる作用があるかを検討するため,それぞれのチャネルに対するアゴニストを投与した.その結果,TRPV1のアゴニストであるカプサイシンによりp70S6Kのリン酸化が亢進した.カプサイシンによるp70S6Kのリン酸化はTRPV1ノックアウトマウスでは確認されず,また,細胞内Ca2+キレート剤であるBAPTA-AMとの共投与により抑制された.このことから,カプサイシンによるmTORの活性化はTRPV1および細胞内Ca2+濃度に依存的であることがわかった.NOおよび過酸化亜硝酸による細胞内Ca2+濃度の上昇におけるTRPV1の関与を検討するため,TRPV1ノックアウトマウスから筋サテライト細胞を調製しCa2+イメージング法を行った.その結果,TRPV1ノックアウトマウスに由来する筋管では細胞内Ca2+濃度の上昇は低減することがわかった.また,すでにTRPV1は骨格筋において筋小胞体に局在することが報告されている8).nNOSノックアウトマウスと同様に,TRPV1ノックアウトマウスでは過負荷による筋肥大が抑制されていた.また,カプサイシンの投与によりnNOSノックアウトマウスおよび過酸化亜硝酸の消去剤であるFeTPPSを投与したマウスの表現型は回復した.このことから,nNOSノックアウトマウスおよびFeTPPSを投与したマウスにおいて観察された筋肥大の抑制はTRPV1の活性化の異常に起因するものと考えられた.
過負荷およびトレッドミル運動によるmTORの活性化と,カプサイシンによるmTORの活性化とを比較した結果,カプサイシンによるmTORの活性化は,過負荷および運動に依存的な活性化と同等もしくはそれ以上のものであることがわかり,カプサイシンを投与することにより運動負荷と同様の効果が得られる可能性が示唆された.カプサイシンの投与のみで筋肥大が生じるかどうかを検討するため,カプサイシンを1日あたり2回,筋肉注射により投与した.その結果,1週間後にヒラメ筋,腓腹筋,足底筋の筋重量は約15%も上昇した.また,この効果はBAPTA-AMおよびmTORの阻害剤であるラパマイシンにより抑制され,TRPV1ノックアウトマウスでは認められなかった.このことから,カプサイシンによるTRPV1の活性化を介した細胞内Ca2+濃度の上昇,および,そののちのmTORの活性化は,筋肥大を十分に促進しうるものとわかった.また,カプサイシンの投与により筋重量だけでなく筋張力も増強された.最後に,TRPV1が筋萎縮の治療に対する標的となりうるかどうかを検討するため,後肢懸垂および除神経による筋萎縮の誘導モデルを用いた.2週間の筋萎縮の誘導中にカプサイシンを投与したところ,後肢懸垂および除神経により生じる筋萎縮は抑制できることがわかった.
これらの結果から,力学的な負荷により活性化されたnNOSおよびそれにより生じたNOおよび過酸化亜硝酸は,TRPV1を介し細胞内Ca2+濃度を上昇させることによりmTORを活性化し,筋肥大を促進すると結論づけた.また,薬理学的にTRPV1を活性化するだけでmTORは活性化し,筋肥大が促進され,筋萎縮が軽減された(図2).
おわりに
筆者らは,以前,骨格筋への脱負荷の際にnNOSが細胞膜から細胞質へと移行し,筋萎縮を促進することを報告している9).このことは,nNOSが筋肥大と筋萎縮という相反する生命現象を制御していることを意味しており,nNOSが負荷および脱負荷に依存的な骨格筋の可塑性制御に関与していることを示唆した.
IGF-1などの成長因子によるmTORの活性化と異なり,負荷に依存的なmTORの活性化はAktの活性化を介さない.実際,IGF-1に対するAktおよびmTORの応答はnNOSノックアウトマウスおよびTRPV1ノックアウトマウスにおいて通常どおりに起こった.このことから,IGF-1による筋成長と,負荷による細胞内Ca2+濃度に依存的な筋肥大は,一部は共通するものの異なる機構によるmTORの活性化を介していると考えられた.アミノ酸によるmTORの活性化に細胞内Ca2+濃度がかかわることが報告されているが10),細胞内Ca2+濃度とmTORとの関係にはいまだ未解明な部分が多い.今回,明らかになったnNOS,TRPV1,細胞内Ca2+濃度と筋肥大との関係は,筋の運動あるいは不動と細胞内シグナル経路の活性化とを結びつける新たな視点をもたらしたが,TRPV1はとくに神経系の細胞において痛み受容体として知られており,カプサイシンそのものを筋萎縮の治療薬として用いるのは現時点ではむずかしいと考えられる.今後,TRPV1以外のチャネルを解析することにより,より普遍的なCa2+-mTOR-筋肥大という経路を明らかにし,また,新たな筋萎縮の軽減予防薬の開発につながることが期待される.
文 献
- Rommel, C., Bodine, S. C., Clarke, B. A. et al.: Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI(3)K/Akt/GSK3 pathways. Nat. Cell Biol., 3, 1009-1013 (2001)[PubMed]
- Laplante, M. & Sabatini, D. M.: mTOR signaling in growth control and disease. Cell, 149, 274-293 (2012)[PubMed]
- Stamler, J. S. & Meissner, G.: Physiology of nitric oxide in skeletal muscle. Physiol. Rev., 81, 209-237 (2001)[PubMed]
- Trebak, M., Ginnan, R., Singer, H. A. et al.: Interplay between calcium and reactive oxygen/nitrogen species: an essential paradigm for vascular smooth muscle signaling. Antioxid. Redox Signal., 12, 657-674 (2010)[PubMed]
- Adachi, T., Weisbrod, R. M., Pimentel, D. R. et al.: S-Glutathiolation by peroxynitrite activates SERCA during arterial relaxation by nitric oxide. Nat. Med., 10, 1200-1207 (2004)[PubMed]
- Clapham, D. E.: TRP channels as cellular sensors. Nature, 426, 517-524 (2003)[PubMed]
- Yoshida, T., Inoue, R., Morii, T. et al.: Nitric oxide activates TRP channels by cysteine S-nitrosylation. Nat. Chem. Biol., 2, 596-607 (2006)[PubMed]
- Xin, H., Tanaka, H., Yamaguchi, M. et al.: Vanilloid receptor expressed in the sarcoplasmic reticulum of rat skeletal muscle. Biochem. Biophys. Res. Commun., 332, 756-762 (2005)[PubMed]
- Suzuki, N. Mothohashi, N. Uezumi, A. et al.: NO production results in suspension-induced muscle atrophy through dislocation of neuronal NOS. J. Clin. Invest., 117, 2468-2476 (2007)[PubMed]
- Gulati, P., Gaspers, L. D., Dann, S. G. et al.: Amino acids activate mTOR complex 1 via Ca2+/CaM signaling to hVps34. Cell Metab., 7, 456-465 (2008)[PubMed]
著者プロフィール
略歴:東京工業大学大学院生命理工学研究科博士課程 在学中.
研究テーマ:nNOSおよび細胞内Ca2+濃度を主点とした筋肥大の促進機構.
関心事:あぁCa2+,君はどこから来て,これからどこへ行くの?
武田 伸一(Shin'ichi Takeda)
国立精神・神経医療研究センター神経研究所 部長.
研究室URL:http://www.ncnp.go.jp/nin/guide/r_dna2/index.html
© 2012 伊藤尚基・武田伸一 Licensed under CC 表示 2.1 日本