KIF19Aは線毛の長さを制御する微小管の脱重合活性をもつキネシンである
丹羽伸介・廣川信隆
(東京大学大学院医学系研究科 分子構造・動態学講座)
email:廣川信隆
DOI: 10.7875/first.author.2012.159
KIF19A is a microtubule-depolymerizing kinesin for ciliary length control.
Shinsuke Niwa, Kazuo Nakajima, Harukata Miki, Yusuke Minato, Doudou Wang, Nobutaka Hirokawa
Developmental Cell, 23, 1167-1175 (2012)
哺乳類の細胞の表面には線毛とよばれる長さ5~10μmの突起が存在する.線毛の運動は,哺乳類では脳脊髄液の流れ,脳圧の維持,卵管における卵の輸送などを担っている.線毛の長さは細胞ごとに厳密に決まっており,なんらかの分子機構により制御されていると考えられている.これまでの研究により,単細胞生物においては線毛と相同な構造をもつ鞭毛の長さを制御するタンパク質がいくつかみつかっていたが,われわれヒトを含む哺乳類においては線毛の長さを制御する分子機構は不明であった.この研究において,筆者らは,線毛の先端に局在するモータータンパク質KIF19Aが微小管を脱重合することにより線毛の長さを制御していることを示した.ゲノム塩基配列にもとづきKIF19AをコードするcDNAを同定し,KIF19Aは新規のモータータンパク質であることを示した.また,KIF19Aノックアウトマウスを作製し,水頭症や雌性不妊のような線毛の異常にともなう表現型を呈することを示した.KIF19Aノックアウトマウスではさまざまな組織において線毛は1.5~3倍ほどの長さになっており,この長くなった線毛の運動には異常がみられた.精製したKIF19Aは,モーター活性だけでなく微小管をプラス端側から脱重合する活性をもち,線毛の細胞骨格である軸糸から新たに重合する微小管の長さを制御していた.これらの結果より,哺乳類において線毛の長さを制御する機構がはじめて明らかになり,その機構は哺乳類における生体の恒常性の維持に重要であることがわかった.
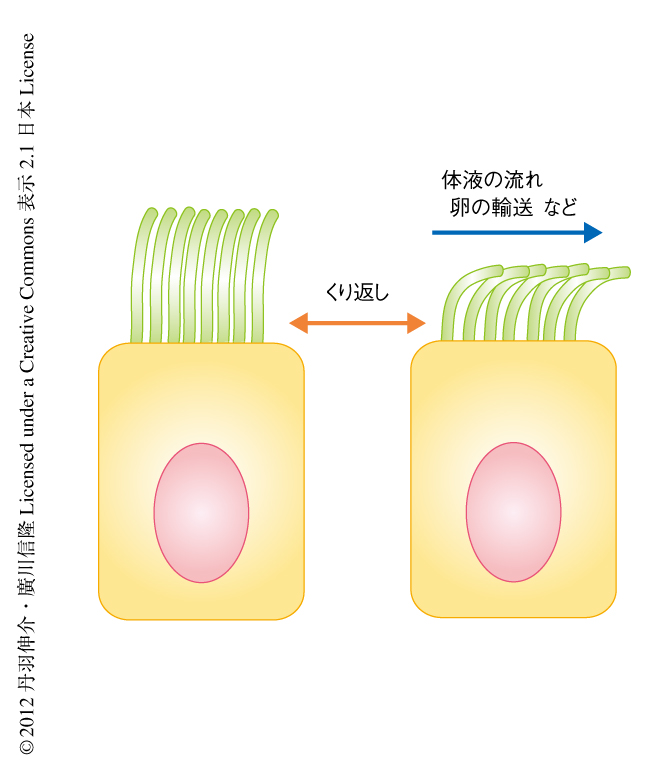
線毛は5~10μmほどの長さの,細胞の表面に生える“動く毛”であり1,2),脳室の上衣細胞,気管支,鼻腔,卵管など哺乳類の全身の細胞に存在している.脳室では線毛の運動が脳脊髄液の流れをつくりだすことにより脳圧を一定に保っている.気管支や鼻腔では線毛の運動により異物や痰の排除が行われている.卵管では線毛の運動により卵巣から子宮への卵子の輸送が行われる(図1).線毛の異常は脳圧の上昇による水頭症,異物を排除できないことによる気管支炎,卵管の閉塞による不妊症など,さまざまな疾患をひき起こす.線毛によりつくりだされる体液の流れは線毛の長さに依存するため,線毛には適切な長さがあると考えられてきた3).近年の研究により,線毛の形成や運動における分子機構は解明されてきたが,線毛はどのように適切な長さに保たれているのかは未解明であった1).
筆者らは,長年,キネシンスーパーファミリータンパク質(kinesin superfamily protein:KIF)に着目し研究を進めてきた4).もともと,キネシンは軸索輸送を担うモータータンパク質として発見されたが,筆者らの研究により,哺乳類は40種類以上のキネシンスーパーファミリー遺伝子をもち,それぞれのキネシンスーパーファミリータンパク質は軸索輸送だけでなく,線毛の形成,細胞分裂,細胞内輸送,ニューロンにおける軸索の長さの制御,シグナル伝達など,さまざまな役割をはたしていることが明らかになっている.さらに,筆者らによる分子遺伝学的な解析により,キネシンスーパーファミリータンパク質は体の左右非対称性の決定,記憶や学習の制御,脳における神経回路網の形成,活動に依存性のニューロンの生死の制御,末梢ニューロンの発生の制御,腫瘍の抑制など,思いもよらない重要な役割をもはたしていることが明らかになってきた4,5).今回,筆者らは,キネシンスーパーファミリータンパク質のひとつであるKIF19Aが線毛の先端に集積し,線毛の長さを制御する新規のモータータンパク質であることを示した.
以前に,筆者らは,KIF19AをコードするcDNA断片をクローニングした4).今回は,この情報をもとにバイオインフォマティクスと分子生物学的な手法を駆使し,KIF19Aをコードする全長のcDNAをクローニングした.この配列情報をもとにKIF19Aの抗体を作製しウェスタンブロッティング法により解析したところ,KIF19Aは気管支や卵管など線毛の存在する器官に多く発現していることがわかった.KIF19Aがモータータンパク質であるかどうかを調べるため,KIF19Aのもつモータードメインを大腸菌で発現させアフィニティクロマトグラフィーにより精製した.これをカバーガラスの表面に付着させ,ATPと蛍光標識した微小管をくわえたところ,微小管はおよそ20 nm/secの速度で動いた.このことから,KIF19Aはほかの多くのキネシンスーパーファミリータンパク質と同じく,試験管内において微小管モーターとしての活性をもつことがわかった.
生体におけるKIF19Aの機能を調べるためKIF19Aノックアウトマウスを作製した.KIF19Aノックアウトマウスは野生型マウスに比べ寿命が短く,雌性不妊の表現型があった.全身の組織の固定標本を作製し病理学的な解析をしたところ,KIF19Aノックアウトマウスでは脳室の膨張が起こっており,卵管には死んだ細胞塊を含む異物が観察された.これらの表現型はヒトの水頭症や卵管閉塞といわれる疾患に似ており,これらがKIF19Aノックアウトマウスの死亡率の高さや雌性不妊といった表現型の原因になっていると考えられた.
水頭症や雌性不妊などの表現型はしばしば線毛の異常によりひき起こされることが知られている.そこで,KIF19Aノックアウトマウスの線毛を観察したところ,線毛の長さは野生型マウスに比べ1.5倍~3倍ほど長くなっていることがわかった.この表現型は脳室の上衣細胞,気管支の上皮細胞,卵管の上皮細胞といった動く線毛をもつ全身の細胞において観察された.野生型マウス,KIF19Aヘテロノックアウトマウス,KIF19Aホモノックアウトマウスにおける線毛の長さの違いを卵管の上皮細胞において観察したところ,線毛の長さはホモ,ヘテロ,野生型の順に短くなっていた.このことから,線毛の長さはKIF19Aの発現量に依存して変化することが示唆された.
卵管においては単離してしばらくのあいだ,上皮細胞における線毛の運動を生きた状態で観察することができる.この系を用いて,野生型マウスとKIF19Aノックアウトマウスにおいて線毛の運動を観察した.野生型マウスの卵管では線毛が運動することにより水流がつくりだされていた一方で,KIF19Aノックアウトマウスの卵管では異常に長くなった線毛に運動の異常が起こっており適切な水流はみられなかった.以上の結果から,KIF19Aノックアウトマウスでは線毛が異常に長くなることにより線毛の運動による体液の流れがつくられなくなり,水頭症や雌性不妊といった表現型がひき起こされていると考えられた.
モータータンパク質であるKIF19Aのなくなることが,なぜ線毛の長さの異常に結びつくのだろうか? KIF19Aの抗体を用いることによりKIF19Aの局在を観察した.卵管の線毛は強いボルテックスなど機械的な刺激により単離することができる.生化学的な解析に十分な量の線毛を得るため,ブタの卵管から線毛を単離しウェスタンブロッティング法により解析したところ,KIF19Aは線毛に存在することがわかった.線毛におけるKIF19Aの局在を観察するため,蛍光抗体法により,卵管,気管支,単離した線毛,培養した脳室の上衣細胞を染色したところ,それらすべてにおいてKIF19Aのシグナルは線毛の先端にて検出された.これらの結果から,KIF19Aが線毛において直接になんらかのはたらきをすることにより線毛の長さを制御していることが示唆された.
クラミドモナスは古くから鞭毛や線毛の研究に用いられてきたすぐれたモデル生物である1-3).クラミドモナスの鞭毛の細胞骨格(軸糸)は,哺乳類の線毛の細胞骨格と同様に,9+2構造とよばれる微小管やダイニンからなる構造をつくる1).軸糸の微小管はプラス端側が線毛の先端側に位置している.クラミドモナスの軸糸に哺乳類から精製したチューブリンを混ぜると軸糸の先端から微小管が重合することは,古くから知られていた6).この系に精製したKIF19AのモータードメインとATPをくわえ観察した.興味深いことに,軸糸の先端から重合する微小管の長さは,くわえたKIF19Aのモータードメインの量に依存して変化することがわかった.モータードメインの混ぜる量を増やすと,それに応じて重合する微小管は短くなった.
新たに形成される微小管の長さは微小管の重合と脱重合との割合で決まる.これまでの研究により,いくつかのキネシンスーパーファミリータンパク質は微小管を脱重合する活性をもつことが知られている.そのことから,KIF19Aはモーター活性だけでなく,微小管を脱重合する活性ももつのではないかと考えた.この仮説にもとづき生化学的な実験を行ったところ,KIF19Aのモータードメインには確かにATP依存的に微小管を脱重合する活性のあることがわかった.蛍光標識によりプラス端とマイナス端とを区別できるようにした微小管において顕微鏡によりKIF19Aによる脱重合を観察したところ,KIF19Aは微小管のプラス端側において脱重合を促進することがわかった.これらの結果をまとめると,KIF19Aは線毛において軸糸の微小管の先端に直接に作用してその脱重合を促すことにより,その細胞骨格の形成にはたらきかけ線毛の長さを制御していると考えられた.
線毛の運動が体液の流れをつくりだす際には,線毛には適切な長さがある.そのため,なんらかの分子機構により線毛の長さは適切に維持されていると考えられてきた3).これはたとえば,風呂釜の湯を棒で混ぜることを考えてみるとわかりやすい.棒が短すぎると混ぜられないが,棒が長すぎても湯からうける抵抗が大きくなりうまく混ぜることはできなくなる.実際に,KIF19Aノックアウトマウスにおいてみられた異常に長くなった線毛は,水流をつくることができなくなっていた.
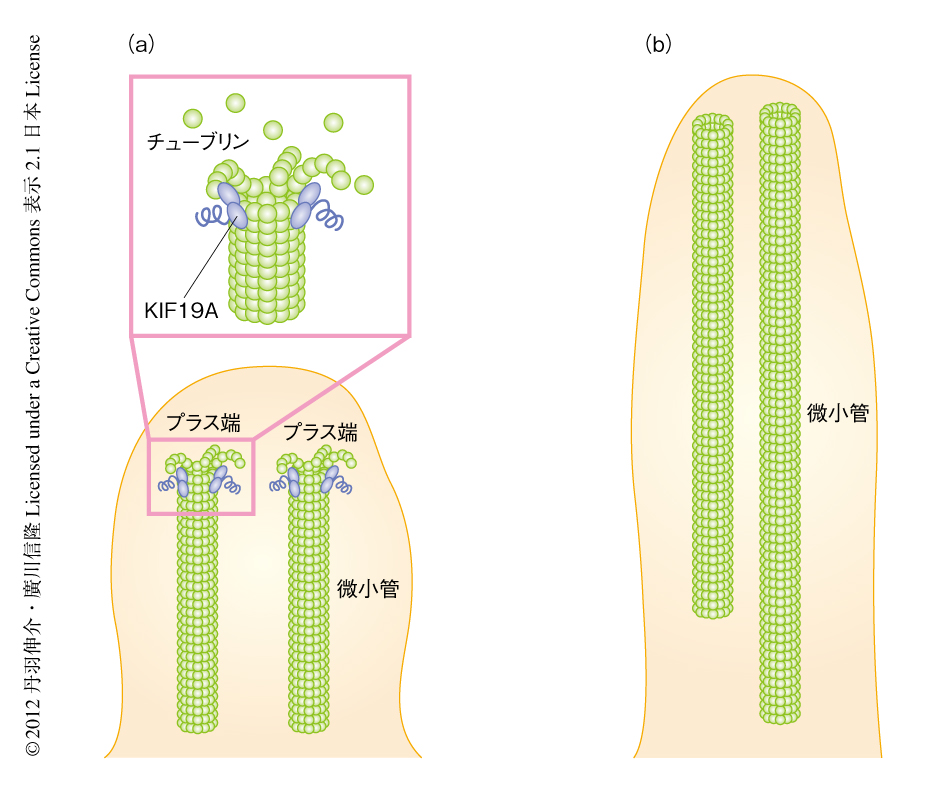
クラミドモナスのような単細胞生物ではいくつかのタンパク質が鞭毛の長さを制御していることが明らかにされている.なかでも,原虫のもつKinesin-13は微小管を脱重合する活性をもつキネシンの一種であり,哺乳類のKIF2のホモログである7).哺乳類におけるKIF2のノックアウトやノックダウンでは,ニューロンの軸索やその枝の長さ,また,細胞分裂のときの紡錘体の長さに影響はあるものの,線毛の長さに変化はみられない8,9).また,KIF19Aとは異なり,Kinesin-13やKIF2は微小管をプラス端側とマイナス端側から同じように脱重合する9,10).単細胞生物の鞭毛と哺乳類の線毛の細胞骨格の構造は非常に似ているにもかかわらず,長さを制御する分子機構は異なるのは興味深い.鞭毛や線毛に存在する微小管はプラス端側が先端をむいているので,その長さの制御のためにはKIF19Aのように微小管をプラス端側で脱重合するタンパク質のほうが効率がよい(図2).そのため,哺乳類ではこのような機構が進化したのかもしれない.
単細胞生物とは異なり,哺乳類においては遺伝学的なスクリーニングにより線毛の長さを制御するタンパク質を単離するのは非常に困難である.そのため,哺乳類の線毛の長さを制御する分子機構の実体はながらく不明であった.KIF19Aノックアウトマウスは,哺乳類においてはじめてみつかった線毛の長くなる変異体である.線毛の長さの制御機構の異常は,線毛の形成や運動の異常と同じように水頭症や雌性不妊などの表現型をひき起こした.したがって,線毛の形成や運動だけでなく,線毛の長さの制御機構もまた,われわれ哺乳類の健康や恒常性の維持に非常に重要な役割をはたしていると考えられる.今後は,KIF19Aの結合タンパク質や制御タンパク質などを単離することにより,哺乳類における線毛の長さを制御する分子機構の理解の深まることが期待される.また,線毛の長さの異常によりヒトの疾患がひき起こされるという報告もある11,12).これらの疾患にKIF19Aがかかわっているかどうかは非常に興味深い.
略歴:2007年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:キネシンスーパーファミリータンパク質の分子細胞生物学的および分子遺伝学的な研究.
抱負:一流の生命科学研究者になること.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
© 2012 丹羽伸介・廣川信隆 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 分子構造・動態学講座)
email:廣川信隆
DOI: 10.7875/first.author.2012.159
KIF19A is a microtubule-depolymerizing kinesin for ciliary length control.
Shinsuke Niwa, Kazuo Nakajima, Harukata Miki, Yusuke Minato, Doudou Wang, Nobutaka Hirokawa
Developmental Cell, 23, 1167-1175 (2012)
要 約
哺乳類の細胞の表面には線毛とよばれる長さ5~10μmの突起が存在する.線毛の運動は,哺乳類では脳脊髄液の流れ,脳圧の維持,卵管における卵の輸送などを担っている.線毛の長さは細胞ごとに厳密に決まっており,なんらかの分子機構により制御されていると考えられている.これまでの研究により,単細胞生物においては線毛と相同な構造をもつ鞭毛の長さを制御するタンパク質がいくつかみつかっていたが,われわれヒトを含む哺乳類においては線毛の長さを制御する分子機構は不明であった.この研究において,筆者らは,線毛の先端に局在するモータータンパク質KIF19Aが微小管を脱重合することにより線毛の長さを制御していることを示した.ゲノム塩基配列にもとづきKIF19AをコードするcDNAを同定し,KIF19Aは新規のモータータンパク質であることを示した.また,KIF19Aノックアウトマウスを作製し,水頭症や雌性不妊のような線毛の異常にともなう表現型を呈することを示した.KIF19Aノックアウトマウスではさまざまな組織において線毛は1.5~3倍ほどの長さになっており,この長くなった線毛の運動には異常がみられた.精製したKIF19Aは,モーター活性だけでなく微小管をプラス端側から脱重合する活性をもち,線毛の細胞骨格である軸糸から新たに重合する微小管の長さを制御していた.これらの結果より,哺乳類において線毛の長さを制御する機構がはじめて明らかになり,その機構は哺乳類における生体の恒常性の維持に重要であることがわかった.
はじめに
線毛は5~10μmほどの長さの,細胞の表面に生える“動く毛”であり1,2),脳室の上衣細胞,気管支,鼻腔,卵管など哺乳類の全身の細胞に存在している.脳室では線毛の運動が脳脊髄液の流れをつくりだすことにより脳圧を一定に保っている.気管支や鼻腔では線毛の運動により異物や痰の排除が行われている.卵管では線毛の運動により卵巣から子宮への卵子の輸送が行われる(図1).線毛の異常は脳圧の上昇による水頭症,異物を排除できないことによる気管支炎,卵管の閉塞による不妊症など,さまざまな疾患をひき起こす.線毛によりつくりだされる体液の流れは線毛の長さに依存するため,線毛には適切な長さがあると考えられてきた3).近年の研究により,線毛の形成や運動における分子機構は解明されてきたが,線毛はどのように適切な長さに保たれているのかは未解明であった1).
筆者らは,長年,キネシンスーパーファミリータンパク質(kinesin superfamily protein:KIF)に着目し研究を進めてきた4).もともと,キネシンは軸索輸送を担うモータータンパク質として発見されたが,筆者らの研究により,哺乳類は40種類以上のキネシンスーパーファミリー遺伝子をもち,それぞれのキネシンスーパーファミリータンパク質は軸索輸送だけでなく,線毛の形成,細胞分裂,細胞内輸送,ニューロンにおける軸索の長さの制御,シグナル伝達など,さまざまな役割をはたしていることが明らかになっている.さらに,筆者らによる分子遺伝学的な解析により,キネシンスーパーファミリータンパク質は体の左右非対称性の決定,記憶や学習の制御,脳における神経回路網の形成,活動に依存性のニューロンの生死の制御,末梢ニューロンの発生の制御,腫瘍の抑制など,思いもよらない重要な役割をもはたしていることが明らかになってきた4,5).今回,筆者らは,キネシンスーパーファミリータンパク質のひとつであるKIF19Aが線毛の先端に集積し,線毛の長さを制御する新規のモータータンパク質であることを示した.
1.KIF19Aは新規のモータータンパク質でありその異常は水頭症や不妊症をひき起こす
以前に,筆者らは,KIF19AをコードするcDNA断片をクローニングした4).今回は,この情報をもとにバイオインフォマティクスと分子生物学的な手法を駆使し,KIF19Aをコードする全長のcDNAをクローニングした.この配列情報をもとにKIF19Aの抗体を作製しウェスタンブロッティング法により解析したところ,KIF19Aは気管支や卵管など線毛の存在する器官に多く発現していることがわかった.KIF19Aがモータータンパク質であるかどうかを調べるため,KIF19Aのもつモータードメインを大腸菌で発現させアフィニティクロマトグラフィーにより精製した.これをカバーガラスの表面に付着させ,ATPと蛍光標識した微小管をくわえたところ,微小管はおよそ20 nm/secの速度で動いた.このことから,KIF19Aはほかの多くのキネシンスーパーファミリータンパク質と同じく,試験管内において微小管モーターとしての活性をもつことがわかった.
生体におけるKIF19Aの機能を調べるためKIF19Aノックアウトマウスを作製した.KIF19Aノックアウトマウスは野生型マウスに比べ寿命が短く,雌性不妊の表現型があった.全身の組織の固定標本を作製し病理学的な解析をしたところ,KIF19Aノックアウトマウスでは脳室の膨張が起こっており,卵管には死んだ細胞塊を含む異物が観察された.これらの表現型はヒトの水頭症や卵管閉塞といわれる疾患に似ており,これらがKIF19Aノックアウトマウスの死亡率の高さや雌性不妊といった表現型の原因になっていると考えられた.
2.KIF19Aノックアウトマウスでは繊毛が長くなっている
水頭症や雌性不妊などの表現型はしばしば線毛の異常によりひき起こされることが知られている.そこで,KIF19Aノックアウトマウスの線毛を観察したところ,線毛の長さは野生型マウスに比べ1.5倍~3倍ほど長くなっていることがわかった.この表現型は脳室の上衣細胞,気管支の上皮細胞,卵管の上皮細胞といった動く線毛をもつ全身の細胞において観察された.野生型マウス,KIF19Aヘテロノックアウトマウス,KIF19Aホモノックアウトマウスにおける線毛の長さの違いを卵管の上皮細胞において観察したところ,線毛の長さはホモ,ヘテロ,野生型の順に短くなっていた.このことから,線毛の長さはKIF19Aの発現量に依存して変化することが示唆された.
卵管においては単離してしばらくのあいだ,上皮細胞における線毛の運動を生きた状態で観察することができる.この系を用いて,野生型マウスとKIF19Aノックアウトマウスにおいて線毛の運動を観察した.野生型マウスの卵管では線毛が運動することにより水流がつくりだされていた一方で,KIF19Aノックアウトマウスの卵管では異常に長くなった線毛に運動の異常が起こっており適切な水流はみられなかった.以上の結果から,KIF19Aノックアウトマウスでは線毛が異常に長くなることにより線毛の運動による体液の流れがつくられなくなり,水頭症や雌性不妊といった表現型がひき起こされていると考えられた.
3.KIF19Aは線毛の先端に局在する
モータータンパク質であるKIF19Aのなくなることが,なぜ線毛の長さの異常に結びつくのだろうか? KIF19Aの抗体を用いることによりKIF19Aの局在を観察した.卵管の線毛は強いボルテックスなど機械的な刺激により単離することができる.生化学的な解析に十分な量の線毛を得るため,ブタの卵管から線毛を単離しウェスタンブロッティング法により解析したところ,KIF19Aは線毛に存在することがわかった.線毛におけるKIF19Aの局在を観察するため,蛍光抗体法により,卵管,気管支,単離した線毛,培養した脳室の上衣細胞を染色したところ,それらすべてにおいてKIF19Aのシグナルは線毛の先端にて検出された.これらの結果から,KIF19Aが線毛において直接になんらかのはたらきをすることにより線毛の長さを制御していることが示唆された.
4.KIF19Aは線毛において微小管を脱重合することによりその長さを制御する
クラミドモナスは古くから鞭毛や線毛の研究に用いられてきたすぐれたモデル生物である1-3).クラミドモナスの鞭毛の細胞骨格(軸糸)は,哺乳類の線毛の細胞骨格と同様に,9+2構造とよばれる微小管やダイニンからなる構造をつくる1).軸糸の微小管はプラス端側が線毛の先端側に位置している.クラミドモナスの軸糸に哺乳類から精製したチューブリンを混ぜると軸糸の先端から微小管が重合することは,古くから知られていた6).この系に精製したKIF19AのモータードメインとATPをくわえ観察した.興味深いことに,軸糸の先端から重合する微小管の長さは,くわえたKIF19Aのモータードメインの量に依存して変化することがわかった.モータードメインの混ぜる量を増やすと,それに応じて重合する微小管は短くなった.
新たに形成される微小管の長さは微小管の重合と脱重合との割合で決まる.これまでの研究により,いくつかのキネシンスーパーファミリータンパク質は微小管を脱重合する活性をもつことが知られている.そのことから,KIF19Aはモーター活性だけでなく,微小管を脱重合する活性ももつのではないかと考えた.この仮説にもとづき生化学的な実験を行ったところ,KIF19Aのモータードメインには確かにATP依存的に微小管を脱重合する活性のあることがわかった.蛍光標識によりプラス端とマイナス端とを区別できるようにした微小管において顕微鏡によりKIF19Aによる脱重合を観察したところ,KIF19Aは微小管のプラス端側において脱重合を促進することがわかった.これらの結果をまとめると,KIF19Aは線毛において軸糸の微小管の先端に直接に作用してその脱重合を促すことにより,その細胞骨格の形成にはたらきかけ線毛の長さを制御していると考えられた.
おわりに
線毛の運動が体液の流れをつくりだす際には,線毛には適切な長さがある.そのため,なんらかの分子機構により線毛の長さは適切に維持されていると考えられてきた3).これはたとえば,風呂釜の湯を棒で混ぜることを考えてみるとわかりやすい.棒が短すぎると混ぜられないが,棒が長すぎても湯からうける抵抗が大きくなりうまく混ぜることはできなくなる.実際に,KIF19Aノックアウトマウスにおいてみられた異常に長くなった線毛は,水流をつくることができなくなっていた.
クラミドモナスのような単細胞生物ではいくつかのタンパク質が鞭毛の長さを制御していることが明らかにされている.なかでも,原虫のもつKinesin-13は微小管を脱重合する活性をもつキネシンの一種であり,哺乳類のKIF2のホモログである7).哺乳類におけるKIF2のノックアウトやノックダウンでは,ニューロンの軸索やその枝の長さ,また,細胞分裂のときの紡錘体の長さに影響はあるものの,線毛の長さに変化はみられない8,9).また,KIF19Aとは異なり,Kinesin-13やKIF2は微小管をプラス端側とマイナス端側から同じように脱重合する9,10).単細胞生物の鞭毛と哺乳類の線毛の細胞骨格の構造は非常に似ているにもかかわらず,長さを制御する分子機構は異なるのは興味深い.鞭毛や線毛に存在する微小管はプラス端側が先端をむいているので,その長さの制御のためにはKIF19Aのように微小管をプラス端側で脱重合するタンパク質のほうが効率がよい(図2).そのため,哺乳類ではこのような機構が進化したのかもしれない.
単細胞生物とは異なり,哺乳類においては遺伝学的なスクリーニングにより線毛の長さを制御するタンパク質を単離するのは非常に困難である.そのため,哺乳類の線毛の長さを制御する分子機構の実体はながらく不明であった.KIF19Aノックアウトマウスは,哺乳類においてはじめてみつかった線毛の長くなる変異体である.線毛の長さの制御機構の異常は,線毛の形成や運動の異常と同じように水頭症や雌性不妊などの表現型をひき起こした.したがって,線毛の形成や運動だけでなく,線毛の長さの制御機構もまた,われわれ哺乳類の健康や恒常性の維持に非常に重要な役割をはたしていると考えられる.今後は,KIF19Aの結合タンパク質や制御タンパク質などを単離することにより,哺乳類における線毛の長さを制御する分子機構の理解の深まることが期待される.また,線毛の長さの異常によりヒトの疾患がひき起こされるという報告もある11,12).これらの疾患にKIF19Aがかかわっているかどうかは非常に興味深い.
文 献
- 神谷 律: 太古からの9+2構造:繊毛のふしぎ. 岩波書店 (2012)
- Rosenbaum, J. & Witman, G.: Intraflagellar transport. Nat. Rev. Mol. Cell Biol., 3, 813-825 (2002)[PubMed]
- Ishikawa, H. & Marshall, W. F.: Ciliogenesis: building the cell's antenna. Nat. Rev. Mol. Cell Biol., 12, 222-234 (2011)[PubMed]
- Hirokawa, N., Noda, Y., Tanaka, Y. et al.: Kinesin superfamily motor proteins and intracellular transport. Nat. Rev. Mol. Cell Biol., 10, 682-696 (2009)[PubMed]
- Hirokawa, N., Niwa, S. & Tanaka, Y.: Molecular motors in neurons: transport mechanism and roles in brain function, development, and disease. Neuron, 68, 610-638 (2010)[PubMed]
- Binder, L. I., Dentler, W. L. & Rosenbaum, J. L.: Assembly of chick brain tubulin onto flagellar microtubules from Chlamydomonas and sea urchin sperm. Proc. Natl. Acad. Sci. USA, 72, 1122-1126 (1975)[PubMed]
- Blaineau, C., Tessier, M., Dubessay, P. et al.: A novel microtubule-depolymerizing kinesin involved in length control of a eukaryotic flagellum. Curr. Biol., 17, 778-782 (2007)[PubMed]
- Homma, N., Takei, Y., Tanaka, Y. et al.: Kinesin superfamily protein 2A (KIF2A) functions in suppression of collateral branch extension. Cell, 114, 229-239 (2003)[PubMed]
- Howard, J. & Hyman, A.: Microtubule polymerases and depolymerases. Curr. Opin. Cell Biol., 19, 31-35 (2007)[PubMed]
- Hunter, A., Caplow, M., Coy, D. et al.: The kinesin-related protein MCAK is a microtubule depolymerase that forms an ATP-hydrolyzing complex at microtubule ends. Mol Cell, 11, 445-457 (2003)[PubMed]
- Niggemann, B., Muller, A., Nolte, A. et al.: Abnormal length of cilia-a cause of primary ciliary dyskinesia-a case report. Eur. J. Pediatr., 151, 73-75 (1992)[PubMed]
- Afzelius, B. A., Gargani, G. & Romano, C.: Abnormal length of cilia as a possible cause of defective mucociliary clearance. Eur. J. Respir. Dis., 66, 173-180 (1985)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:キネシンスーパーファミリータンパク質の分子細胞生物学的および分子遺伝学的な研究.
抱負:一流の生命科学研究者になること.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
© 2012 丹羽伸介・廣川信隆 Licensed under CC 表示 2.1 日本