メタボロミクスにより明らかにされたダイオキシンおよび食餌誘発性の脂肪肝炎に関与する炎症と代謝のカスケード
松原 勤・田中直樹
(米国NIH National Cancer Institute,Laboratory of Metabolism)
email:松原 勤
DOI: 10.7875/first.author.2012.153
Metabolomics identifies an inflammatory cascade involved in dioxin- and diet-induced steatohepatitis.
Tsutomu Matsubara, Naoki Tanaka, Kristopher W. Krausz, Soumen K. Manna, Dong Wook Kang, Erik R. Anderson, Hans Luecke, Andrew D. Patterson, Yatrik M. Shah, Frank J. Gonzalez
Cell Metabolism, 16, 634-644 (2012)
ダイオキシンは環境汚染物質のなかでもっとも毒性の高い物質のひとつであり,脂肪肝炎を誘発する.筆者らは,ダイオキシンのシグナルを伝達するAh受容体およびそのパートナータンパク質であるARNTについて,AhR受容体の全身ノックアウトマウス,肝実質細胞に特異的なARNTノックアウトマウス,腸管上皮系細胞に特異的なARNTノックアウトマウスにおけるメタボロミクス解析から,ダイオキシンの曝露により肝臓におけるCES3の発現低下,血清におけるアゼライン酸モノエステルの上昇とアゼライン酸の減少が生じることを明らかにした.肝臓におけるCES3の発現低下はAh受容体-ARNTシグナル伝達系の直接的な活性化ではなく,ダイオキシンにより刺激されたTGFβ-SMAD3シグナル伝達系およびインターロイキン6-STAT3シグナル伝達系により生じており,これらの変化は脂肪肝炎と関連していた.メチオニン・コリン欠乏食により誘発される脂肪肝炎でも同様に,肝臓におけるCES3の発現低下,血清におけるアゼライン酸モノエステルの上昇,TGFβシグナルの活性化が認められたが,単純性脂肪肝のモデルマウスではこれらの変化は認められなかった.ダイオキシンあるいはメチオニン・コリン欠乏食を投与したマウスの肝臓にCES3を強制発現させると,血清におけるアゼライン酸モノエステル/アゼライン酸比やTGFβの発現が低下し,脂肪肝炎,とくにメチオニン・コリン欠乏食により誘発される脂肪肝炎は緩和された.これらの結果より,血清におけるアゼライン酸の代謝産物の変化は脂肪肝炎を反映することが示され,CES3,TGFβ,脂肪肝炎の代謝的な関連の存在が示唆された.
環境汚染物質の多くはダイオキシン受容体であるAh受容体およびそのパートナータンパク質であるARNTを介し毒性を発現している.ダイオキシンのなかでも2,3,7,8-テトラクロロジベンゾ-p-ジオキシン(TCDD)はもっとも毒性が高く,その毒性の発現に関し幅広い研究が行われている1-3).近年,代謝や病態の新たな解析法としてメタボロミクスが使用されるようになり,さまざまな疾病バイオマーカーが発見されている4,5).ダイオキシンの曝露による血清における代謝産物の変化は以前にも報告されているが6),その変化とダイオキシンにより誘発される肝障害との関連やその分子機構は明確にされていない.この研究は,AhR受容体の全身ノックアウトマウス,肝実質細胞に特異的なARNTノックアウトマウス,腸管上皮系細胞に特異的なARNTノックアウトマウスにおけるメタボロミクス解析により,ダイオキシンにより誘発される肝障害,とくに,ダイオキシン誘発性の脂肪肝炎と血清代謝産物との関連およびその分子機序を明らかにした.
ダイオキシン誘発性の脂肪肝炎による血清代謝産物の変化を観察するため,マウスに溶媒,または,低用量(10μg/kg)あるいは高容量(200μg/kg)のダイオキシンを投与した.投与ののち血清を回収し,液体クロマトグラフィー-質量分析(UPLC-ESI-QTOFMS)により代謝産物を網羅的に解析した.得られた結果に対し偏最小2乗判別解析(PLS-DA)を行ったところ,対照とダイオキシンを投与した場合とで代謝産物に明確な違いが認められた.その違いを規定する代謝産物として,アゼライン酸および3種のアゼライン酸モノエステルが同定された.ダイオキシンの曝露ののち,アゼライン酸は用量依存的かつ時間依存的に減少し,アゼライン酸モノエステルは用量依存的かつ時間依存的に増加した.興味深いことに,現在,汎用されている肝障害マーカーであるアラニンアミノトランスフェラーゼおよびアスパラギン酸アミノトランスフェラーゼの上昇が観察されなかった低用量のダイオキシンの曝露ののちにも,アゼライン酸およびアゼライン酸モノエステルに変化が認められたことから,これらの代謝産物の変化はダイオキシンの曝露ののち早期にかつ鋭敏に起こると推定された.
肝臓におけるアゼライン酸モノエステルの加水分解活性がダイオキシンの曝露によりAh受容体およびARNTに依存して減弱したことから,肝臓に存在する加水分解酵素の低下がダイオキシンの曝露によるアゼライン酸モノエステルの上昇に関連すると予想した.この加水分解反応を担う酵素を同定するため,カルボキシエステラーゼをコードするCES1遺伝子~CES6遺伝子のmRNAの肝臓における発現レベルを調べたところ,CES3のみダイオキシンの用量依存的かつ時間依存的,Ah受容体およびARNTに依存的な減少が認められた.また,肝臓におけるCES3のタンパク質レベルでも同様な結果が観察された.さらに,HEK293細胞にCES3を過剰発現させるとアゼライン酸モノエステルの代謝活性の上昇が認められた.これらの結果より,CES3はアゼライン酸モノエステルの加水分解反応を触媒し,ダイオキシンの曝露による血清における代謝産物の変化に重要なタンパク質であると推定された.
初代培養肝細胞にダイオキシンを曝露してもCES3の発現減少が認められなかったことから,ほかのタンパク質が肝臓におけるCES3の発現減少を担っていると考えられた.ダイオキシンは炎症を誘発し,肝臓における炎症性サイトカインの活性化を刺激することが知られている.また,ダイオキシンの曝露はキサンチンデヒドロゲナーゼおよびNADPHオキシダーゼ2の発現を誘導することにより肝臓においてAh受容体およびARNTに依存して活性酸素種を増加させたことから,この酸化ストレスの影響により炎症性サイトカインが活性化すると推定された.そこで,炎症性サイトカインの肝臓における発現を調べると,TNFα,インターロイキン6,TGFβのmRNAレベルでの上昇が認められ,その上昇もAh受容体およびARNTに依存していた.また,インターロイキン6および活性型TGFβのタンパク質レベルでの有意な上昇が観察され,一方,TNFαのタンパク質レベルでの有意な上昇は認められなかった.初代培養肝細胞にインターロイキン6あるいはTGFβを添加するとCES3のmRNAレベルでの減少が認められ,インターロイキン6とTGFβをともに添加したときには単独での添加よりその減少の程度が顕著であった.レポーター遺伝子アッセイではCES3遺伝子の上流にインターロイキン6およびTGFβによる抑制的な制御領域を認め,クロマチン免疫沈降法によりインターロイキン6およびTGFβがその領域に結合することが明らかになった.
以上より,ダイオキシンにより活性化されたインターロイキン6およびTGFβが肝臓におけるCES3の発現を減弱していることが示唆された.興味深いことに,CES3遺伝子の発現を活性化するCEBPαの肝臓における発現は,ダイオキシンの曝露によりAh受容体およびARNTに依存して減少した.ダイオキシンの曝露は初代培養肝細胞においてCEBPαの発現を減弱しなかったが,TGFβの添加はその発現を減弱した.これらの結果より,TGFβはCEBPαの発現の減弱を介したCES3の発現抑制にも寄与していると示唆された.
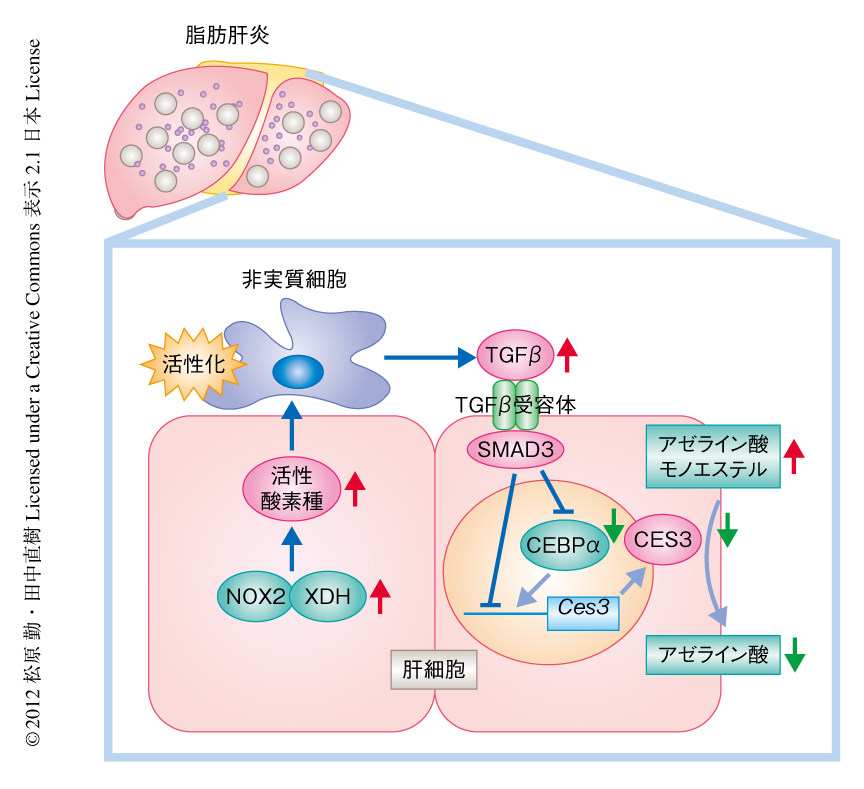
ダイオキシンの曝露は肝臓における脂肪の蓄積をAh受容体およびARNTに依存して亢進させた.そこで,2種類の肝臓における脂肪蓄積モデル,db/dbマウス(脂肪肝モデル)およびメチオニン・コリン欠乏食マウス(脂肪肝炎モデル)において血清におけるアゼライン酸モノエステル量を測定した.メチオニン・コリン欠乏食マウスでは対照のマウスに比べ,血清アゼライン酸モノエステル値の上昇,肝臓におけるCES3およびCEBPαの発現減弱,キサンチンデヒドロゲナーゼ,NADPHオキシダーゼ2,TGFβの発現増強が認められた.一方,単純性脂肪肝を呈するdb/dbマウスではこれらの変化は認められなかった.また,ダイオキシンにより誘発される脂肪肝炎マウスおよびメチオニン・コリン欠乏食により誘発される脂肪肝炎マウスの肝臓にCES3を強制発現させたところ,脂肪肝炎により上昇した血清におけるアゼライン酸モノエステル/アゼライン酸の比は著しく低下し,その比は肝臓におけるCES3の発現量と強い逆相関を呈した.また,CES3の強制発現はTGFβの発現を減弱させ,脂肪肝炎,とくに,メチオニン・コリン欠乏食による脂肪肝炎を緩和した.これらの結果より,血清におけるアゼライン酸代謝産物の変化は脂肪肝炎を反映することが示され,CES3およびTGFβ,脂肪肝炎の代謝的な関連の存在が示唆された(図1).
わが国における慢性肝炎の原因としては肝炎ウイルスの持続感染とアルコールが主要なものであったが,食生活の欧米化と飽食にともない非アルコール性脂肪肝炎が推定患者100万人と急増している.この非アルコール性脂肪肝炎は脂肪肝から誘発され,ウイルス性肝炎やアルコール性肝炎と同様に,線維化そして肝硬変へ進展しうる.現在のところ,肝硬変の特効薬および直接的な治療法がないため,脂肪肝,脂肪肝炎,肝線維化の早期治療を行うことで肝硬変を未然に防ぐことが命題である.この研究では,ダイオキシンが酸化ストレス,炎症性サイトカイン(とくに,TGFβ)を介しCES3の発現を低下させ,血清におけるアゼライン酸モノエステルを上昇させることを明らかにした.さらに,血清におけるアゼライン酸の代謝産物の変化は脂肪肝炎を反映しており,CES3およびTGFβと脂肪肝炎との関連が示唆された.今後のさらなる研究が必要であるが,この研究の成果は非アルコール性脂肪肝炎の正確な診断を実現する第一歩であると考えられた.
略歴:2007年 東北大学大学院薬学研究科博士課程 修了,同年 米国NIH National Cancer Institute博士研究員を経て,2012年より大阪市立大学大学院医学研究科 助教.
研究テーマ:脂肪性肝疾患における細胞間相互作用.
抱負:脂肪性肝疾患の微小環境における分子病態を明確にしたい.
田中 直樹(Naoki Tanaka)
米国NIH National Cancer Institute博士研究員.
© 2012 松原 勤・田中直樹 Licensed under CC 表示 2.1 日本
(米国NIH National Cancer Institute,Laboratory of Metabolism)
email:松原 勤
DOI: 10.7875/first.author.2012.153
Metabolomics identifies an inflammatory cascade involved in dioxin- and diet-induced steatohepatitis.
Tsutomu Matsubara, Naoki Tanaka, Kristopher W. Krausz, Soumen K. Manna, Dong Wook Kang, Erik R. Anderson, Hans Luecke, Andrew D. Patterson, Yatrik M. Shah, Frank J. Gonzalez
Cell Metabolism, 16, 634-644 (2012)
要 約
ダイオキシンは環境汚染物質のなかでもっとも毒性の高い物質のひとつであり,脂肪肝炎を誘発する.筆者らは,ダイオキシンのシグナルを伝達するAh受容体およびそのパートナータンパク質であるARNTについて,AhR受容体の全身ノックアウトマウス,肝実質細胞に特異的なARNTノックアウトマウス,腸管上皮系細胞に特異的なARNTノックアウトマウスにおけるメタボロミクス解析から,ダイオキシンの曝露により肝臓におけるCES3の発現低下,血清におけるアゼライン酸モノエステルの上昇とアゼライン酸の減少が生じることを明らかにした.肝臓におけるCES3の発現低下はAh受容体-ARNTシグナル伝達系の直接的な活性化ではなく,ダイオキシンにより刺激されたTGFβ-SMAD3シグナル伝達系およびインターロイキン6-STAT3シグナル伝達系により生じており,これらの変化は脂肪肝炎と関連していた.メチオニン・コリン欠乏食により誘発される脂肪肝炎でも同様に,肝臓におけるCES3の発現低下,血清におけるアゼライン酸モノエステルの上昇,TGFβシグナルの活性化が認められたが,単純性脂肪肝のモデルマウスではこれらの変化は認められなかった.ダイオキシンあるいはメチオニン・コリン欠乏食を投与したマウスの肝臓にCES3を強制発現させると,血清におけるアゼライン酸モノエステル/アゼライン酸比やTGFβの発現が低下し,脂肪肝炎,とくにメチオニン・コリン欠乏食により誘発される脂肪肝炎は緩和された.これらの結果より,血清におけるアゼライン酸の代謝産物の変化は脂肪肝炎を反映することが示され,CES3,TGFβ,脂肪肝炎の代謝的な関連の存在が示唆された.
はじめに
環境汚染物質の多くはダイオキシン受容体であるAh受容体およびそのパートナータンパク質であるARNTを介し毒性を発現している.ダイオキシンのなかでも2,3,7,8-テトラクロロジベンゾ-p-ジオキシン(TCDD)はもっとも毒性が高く,その毒性の発現に関し幅広い研究が行われている1-3).近年,代謝や病態の新たな解析法としてメタボロミクスが使用されるようになり,さまざまな疾病バイオマーカーが発見されている4,5).ダイオキシンの曝露による血清における代謝産物の変化は以前にも報告されているが6),その変化とダイオキシンにより誘発される肝障害との関連やその分子機構は明確にされていない.この研究は,AhR受容体の全身ノックアウトマウス,肝実質細胞に特異的なARNTノックアウトマウス,腸管上皮系細胞に特異的なARNTノックアウトマウスにおけるメタボロミクス解析により,ダイオキシンにより誘発される肝障害,とくに,ダイオキシン誘発性の脂肪肝炎と血清代謝産物との関連およびその分子機序を明らかにした.
1.ダイオキシンの曝露により血清アゼライン酸の代謝産物がAh受容体およびARNTに依存して変化する
ダイオキシン誘発性の脂肪肝炎による血清代謝産物の変化を観察するため,マウスに溶媒,または,低用量(10μg/kg)あるいは高容量(200μg/kg)のダイオキシンを投与した.投与ののち血清を回収し,液体クロマトグラフィー-質量分析(UPLC-ESI-QTOFMS)により代謝産物を網羅的に解析した.得られた結果に対し偏最小2乗判別解析(PLS-DA)を行ったところ,対照とダイオキシンを投与した場合とで代謝産物に明確な違いが認められた.その違いを規定する代謝産物として,アゼライン酸および3種のアゼライン酸モノエステルが同定された.ダイオキシンの曝露ののち,アゼライン酸は用量依存的かつ時間依存的に減少し,アゼライン酸モノエステルは用量依存的かつ時間依存的に増加した.興味深いことに,現在,汎用されている肝障害マーカーであるアラニンアミノトランスフェラーゼおよびアスパラギン酸アミノトランスフェラーゼの上昇が観察されなかった低用量のダイオキシンの曝露ののちにも,アゼライン酸およびアゼライン酸モノエステルに変化が認められたことから,これらの代謝産物の変化はダイオキシンの曝露ののち早期にかつ鋭敏に起こると推定された.
2.ダイオキシンの曝露は肝臓におけるCES3の発現とアゼライン酸モノエステルの加水分解活性をAh受容体およびARNTに依存して低下させる
肝臓におけるアゼライン酸モノエステルの加水分解活性がダイオキシンの曝露によりAh受容体およびARNTに依存して減弱したことから,肝臓に存在する加水分解酵素の低下がダイオキシンの曝露によるアゼライン酸モノエステルの上昇に関連すると予想した.この加水分解反応を担う酵素を同定するため,カルボキシエステラーゼをコードするCES1遺伝子~CES6遺伝子のmRNAの肝臓における発現レベルを調べたところ,CES3のみダイオキシンの用量依存的かつ時間依存的,Ah受容体およびARNTに依存的な減少が認められた.また,肝臓におけるCES3のタンパク質レベルでも同様な結果が観察された.さらに,HEK293細胞にCES3を過剰発現させるとアゼライン酸モノエステルの代謝活性の上昇が認められた.これらの結果より,CES3はアゼライン酸モノエステルの加水分解反応を触媒し,ダイオキシンの曝露による血清における代謝産物の変化に重要なタンパク質であると推定された.
3.ダイオキシンの曝露による肝臓におけるCES3の発現の減少はTGFβ-SMAD3シグナル伝達系およびインターロイキン6-STAT3シグナル伝達系を介している
初代培養肝細胞にダイオキシンを曝露してもCES3の発現減少が認められなかったことから,ほかのタンパク質が肝臓におけるCES3の発現減少を担っていると考えられた.ダイオキシンは炎症を誘発し,肝臓における炎症性サイトカインの活性化を刺激することが知られている.また,ダイオキシンの曝露はキサンチンデヒドロゲナーゼおよびNADPHオキシダーゼ2の発現を誘導することにより肝臓においてAh受容体およびARNTに依存して活性酸素種を増加させたことから,この酸化ストレスの影響により炎症性サイトカインが活性化すると推定された.そこで,炎症性サイトカインの肝臓における発現を調べると,TNFα,インターロイキン6,TGFβのmRNAレベルでの上昇が認められ,その上昇もAh受容体およびARNTに依存していた.また,インターロイキン6および活性型TGFβのタンパク質レベルでの有意な上昇が観察され,一方,TNFαのタンパク質レベルでの有意な上昇は認められなかった.初代培養肝細胞にインターロイキン6あるいはTGFβを添加するとCES3のmRNAレベルでの減少が認められ,インターロイキン6とTGFβをともに添加したときには単独での添加よりその減少の程度が顕著であった.レポーター遺伝子アッセイではCES3遺伝子の上流にインターロイキン6およびTGFβによる抑制的な制御領域を認め,クロマチン免疫沈降法によりインターロイキン6およびTGFβがその領域に結合することが明らかになった.
以上より,ダイオキシンにより活性化されたインターロイキン6およびTGFβが肝臓におけるCES3の発現を減弱していることが示唆された.興味深いことに,CES3遺伝子の発現を活性化するCEBPαの肝臓における発現は,ダイオキシンの曝露によりAh受容体およびARNTに依存して減少した.ダイオキシンの曝露は初代培養肝細胞においてCEBPαの発現を減弱しなかったが,TGFβの添加はその発現を減弱した.これらの結果より,TGFβはCEBPαの発現の減弱を介したCES3の発現抑制にも寄与していると示唆された.
4.血清アゼライン酸の代謝産物の変化は脂肪肝炎と関連する
ダイオキシンの曝露は肝臓における脂肪の蓄積をAh受容体およびARNTに依存して亢進させた.そこで,2種類の肝臓における脂肪蓄積モデル,db/dbマウス(脂肪肝モデル)およびメチオニン・コリン欠乏食マウス(脂肪肝炎モデル)において血清におけるアゼライン酸モノエステル量を測定した.メチオニン・コリン欠乏食マウスでは対照のマウスに比べ,血清アゼライン酸モノエステル値の上昇,肝臓におけるCES3およびCEBPαの発現減弱,キサンチンデヒドロゲナーゼ,NADPHオキシダーゼ2,TGFβの発現増強が認められた.一方,単純性脂肪肝を呈するdb/dbマウスではこれらの変化は認められなかった.また,ダイオキシンにより誘発される脂肪肝炎マウスおよびメチオニン・コリン欠乏食により誘発される脂肪肝炎マウスの肝臓にCES3を強制発現させたところ,脂肪肝炎により上昇した血清におけるアゼライン酸モノエステル/アゼライン酸の比は著しく低下し,その比は肝臓におけるCES3の発現量と強い逆相関を呈した.また,CES3の強制発現はTGFβの発現を減弱させ,脂肪肝炎,とくに,メチオニン・コリン欠乏食による脂肪肝炎を緩和した.これらの結果より,血清におけるアゼライン酸代謝産物の変化は脂肪肝炎を反映することが示され,CES3およびTGFβ,脂肪肝炎の代謝的な関連の存在が示唆された(図1).
おわりに
わが国における慢性肝炎の原因としては肝炎ウイルスの持続感染とアルコールが主要なものであったが,食生活の欧米化と飽食にともない非アルコール性脂肪肝炎が推定患者100万人と急増している.この非アルコール性脂肪肝炎は脂肪肝から誘発され,ウイルス性肝炎やアルコール性肝炎と同様に,線維化そして肝硬変へ進展しうる.現在のところ,肝硬変の特効薬および直接的な治療法がないため,脂肪肝,脂肪肝炎,肝線維化の早期治療を行うことで肝硬変を未然に防ぐことが命題である.この研究では,ダイオキシンが酸化ストレス,炎症性サイトカイン(とくに,TGFβ)を介しCES3の発現を低下させ,血清におけるアゼライン酸モノエステルを上昇させることを明らかにした.さらに,血清におけるアゼライン酸の代謝産物の変化は脂肪肝炎を反映しており,CES3およびTGFβと脂肪肝炎との関連が示唆された.今後のさらなる研究が必要であるが,この研究の成果は非アルコール性脂肪肝炎の正確な診断を実現する第一歩であると考えられた.
文 献
- Rifkind, A. B.: CYP1A in toxicity and in physiology with particular reference to CYP dependent arachidonic acid metabolism and other endogenous substrates. Drug Metab. Rev., 38:, 91-335 (2006)[PubMed]
- Thomae, T. L., Glover, E., Bradfield, C. A.: A maternal Ahr null genotype sensitizes embryos to chemical teratogenesis. J. Biol. Chem., 279, 30189-30194 (2004)[PubMed]
- Thurmond, T. S., Staples, J. E., Silverstone, A. E. et al.: The aryl hydrocarbon receptor has a role in the in vivo maturation of murine bone marrow B lymphocytes and their response to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Toxicol. Applied. Pharmacol., 165, 227-236 (2000)[PubMed]
- Matsubara, T., Tanaka, N., Patterson, A. D. et al.: Lithocholic acid disrupts phospholipid and sphingolipid homeostasis leading to cholestasis in mice. Hepatology, 53, 1282-1293 (2011)[PubMed]
- Tanaka, N., Matsubara, T., Krausz, K. W. et al.: Disruption of phospholipid and bile acid homeostasis in mice with nonalcoholic steatohepatitis. Hepatology, 56, 118-129 (2012)[PubMed]
- Lin, S., Yang, Z., Shen. et al.: LC/MS-based non-targeted metabolomics for the investigation of general toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin in C57BL/6J and DBA/2J mice. Int. J. Mass Spectrom., 301, 29-36 (2011)
著者プロフィール
略歴:2007年 東北大学大学院薬学研究科博士課程 修了,同年 米国NIH National Cancer Institute博士研究員を経て,2012年より大阪市立大学大学院医学研究科 助教.
研究テーマ:脂肪性肝疾患における細胞間相互作用.
抱負:脂肪性肝疾患の微小環境における分子病態を明確にしたい.
田中 直樹(Naoki Tanaka)
米国NIH National Cancer Institute博士研究員.
© 2012 松原 勤・田中直樹 Licensed under CC 表示 2.1 日本