膜電位感受性蛍光タンパク質による脳機能のイメージング
武藤弘樹・Thomas Knöpfel
(理化学研究所脳科学総合研究センター 神経回路ダイナミクス研究チーム)
email:武藤弘樹,Thomas Knöpfel
DOI: 10.7875/first.author.2010.006
Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins.
Walther Akemann, Hiroki Mutoh, Amélie Perron, Jean Rossier, Thomas Knöpfel
Nature Methods, 7, 643-649 (2010)
筆者らの研究室では,特定かつ複数の神経細胞における膜電位の変化を同時かつリアルタイムに観察するため,膜電位感受性蛍光タンパク質の開発と実験への応用を行っている.タンパク質をベースとしたセンサーは神経細胞へ遺伝的に導入することができるため,目的の神経細胞を非侵襲的に観察することができる.今回,大脳皮質体性感覚野に膜電位感受性蛍光タンパク質VSFP2を発現させることで,1本のヒゲを刺激することで生じる神経細胞の膜電位の変化を画像化することに成功した.このVSFP2を新たな光遺伝学的ツールとして用いることにより,脳機能の研究の飛躍的な進展に貢献することが期待される.さらには,神経科学だけでなく創薬スクリーニングの効率化も期待できるだろう.
われわれの脳では,いくつもの神経細胞が同時にコミュニケーションをとりあいさまざまな情報処理を行なっている.この脳内での情報処理を理解するためには,神経細胞どうしのコミュニケーションをリアルタイムで観察する必要がある.
従来から,神経細胞の活動を観察するのに,神経細胞の膜電位の変化や細胞内Ca2+濃度の変動を記録する手法がよく用いられている.膜電位の変化を記録する場合,微小電極法やパッチクランプ法などの電気生理学的な手法を用いれば,活動電位など約1ミリ秒の速い変化を正確に記録することはできるが,同時に記録できる神経細胞の数に限りがある.別な手法として,膜電位感受性色素をもちいることでも速い変化を記録することができるが,これは不特定多数の細胞を染色してしまうため,どの細胞から記録された変化なのか特定することは困難である.
一方,細胞内におけるCa2+濃度の変動の記録についてはさまざまな技術が発達している.とくに,蛍光タンパク質をベースとしたGCaMPなどのCa2+センサーを,遺伝子工学的な手法を用いて特定の神経細胞にのみ発現させた遺伝子改変動物は,さまざまな研究分野で使用されている1).しかしながら,Ca2+濃度の変動の多くは膜電位の変化に付随して生じるものであり,さらに,Ca2+の流入から流出・取り込みへとつづく一連の変動には時間を要するため,神経細胞のコミュニケーションをリアルタイムで観察するには反応速度が遅い.
これらの時空間解像度の問題を解決するため,筆者らの研究室では,蛍光タンパク質GFPをベースとした膜電位感受性蛍光タンパク質(voltage sensitive fluorescence protein:VSFP)の開発,および,機能の確認と実験への応用を行っている.
FlaSh 2),VSFP1 3),SPARC 4) などの初期の膜電位感受性蛍光タンパク質は,K+チャネルやNa+チャネルといった機能や構造などについて研究がよく行われていたイオンチャネルを用い,電位感受性領域の構造変化などを蛍光タンパク質の蛍光強度の変化としてとらえるものであった.しかしながら,これらのセンサーは発現ののちの細胞膜への移行が十分には起こらず細胞内のオルガネラやサイトゾルにとどまってしまう.このことは,バックグラウンドノイズの増加とシグナルの減少をひき起こしていた5).
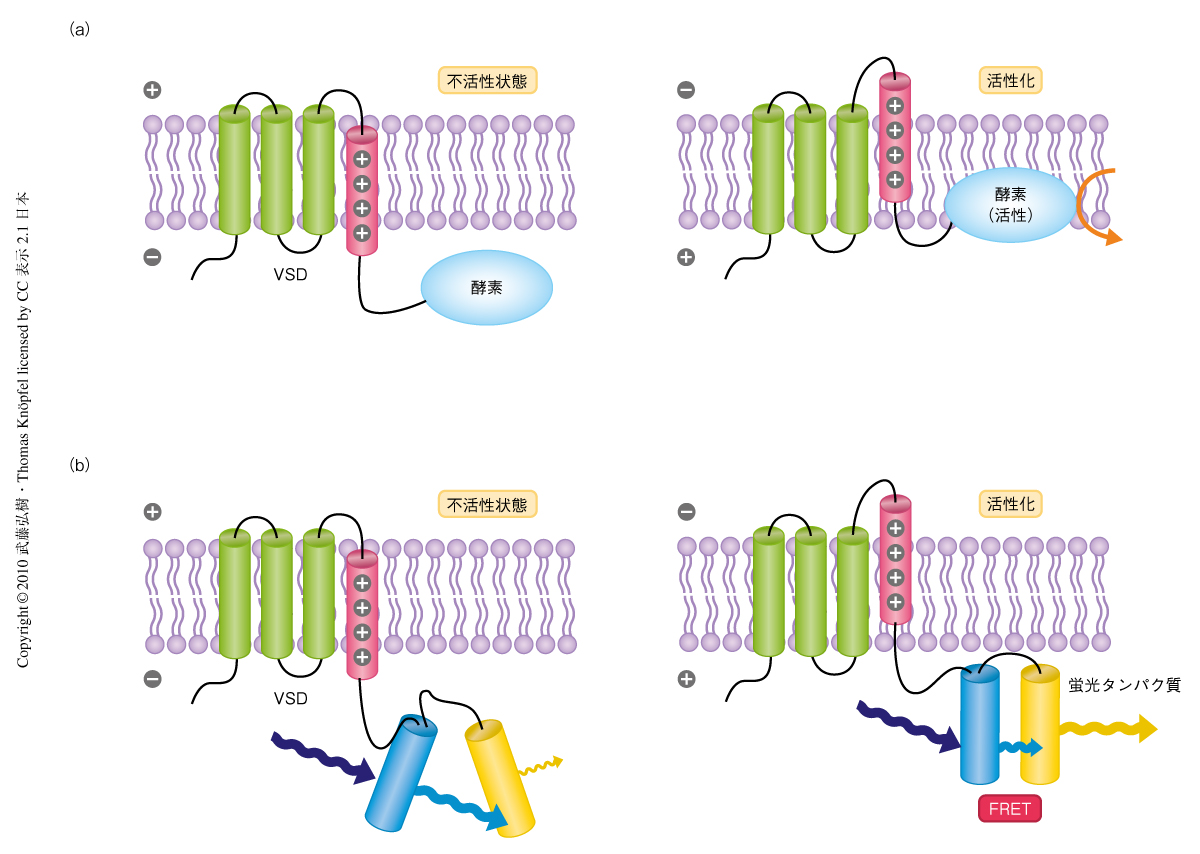
2005年,岡村康司らは,イオンチャネルと異なり電位感受性領域と酵素活性部位とで独立して機能する電位依存性酵素Ci-VSPを発見した6).このタンパク質は,イオンを通すためのポアを形成せず,膜電位の変化に応じて細胞内の酵素活性を調節するシンプルな構造であった(図1a).
筆者らの研究室では,このCi-VSPをベースに膜電位感受性蛍光タンパク質のさらなる改良を行った.神経細胞の活動を感知するのにCi-VSPの電位感受性領域を用い,酵素活性部位の代わりにGFPの改変型であるCFPとYFPの蛍光タンパク質のペアを付加した.この原型に改良を重ねることで,神経細胞が活動することで生じる膜電位の変化をFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)によって観察できる膜電位感受性蛍光タンパク質VSFP2の開発にいたった(図1b).培養細胞(PC12細胞)で行ったVSFP2の特徴と機能の確認実験では,センサーの細胞膜への移行が著しく改善されており,また,このことにより膜電位の変化により得られるシグナルの大幅な向上もみられた.さらに,神経細胞の活動を模した刺激をPC12細胞へあたえたところ,活動電位など神経細胞の電気的な活動をVSFP2の蛍光強度の変化として記録できることが実証された7).
VSFP2が機能的に神経細胞の活動を可視化できることが実証されたので,今回,実際の神経細胞に最新型の膜電位感受性蛍光タンパク質VSFP2.3 8) およびVSFP2.42を発現させ,in vitroとin vivoでの膜電位の変化の記録を行った.
まず,蛍光タンパク質のペアとして供与体に水色のCerulean,受容体に黄色のCitrineをもつVSFP2.3を海馬初代培養神経細胞に発現させたところ,VSFP2.3は細胞体と樹状突起を縁どるように細胞膜にきれいに発現することが確認された.これは,神経細胞の膜電位の変化を蛍光強度の変化へと正確に変換するための,膜電位感受性蛍光タンパク質の重要な性質である.また,パッチクランプ法による電位の変化とVSFP2.3の蛍光強度の変化とを同時に記録したところ,培養神経細胞が自発的に生じる活動電位をVSFP2.3の蛍光強度の変化としても記録できることがわかった.
つぎに,マウスの生体脳でVSFP2.3の機能確認を行うため,マウス胎仔(胎生15.5日)の側脳室にVSFP2.3を子宮内エレクトロポレーション法により遺伝子導入した.生後,成熟したマウスの大脳皮質の急性脳切片標本を作製したところ,おもに大脳皮質体性感覚野(いわゆる,バレル野付近)の第2層,第3層または第5層にある錐体細胞においてVSFP2.3の発現が観察された.これらVSFP2.3を発現している錐体細胞にパッチクランプ法と蛍光測定とを同時に行ったところ,VSFP2.3の蛍光強度の変化と膜電位の変化とが一致し,VSFP2.3がマウス生体脳の神経細胞で機能していることが確認された.
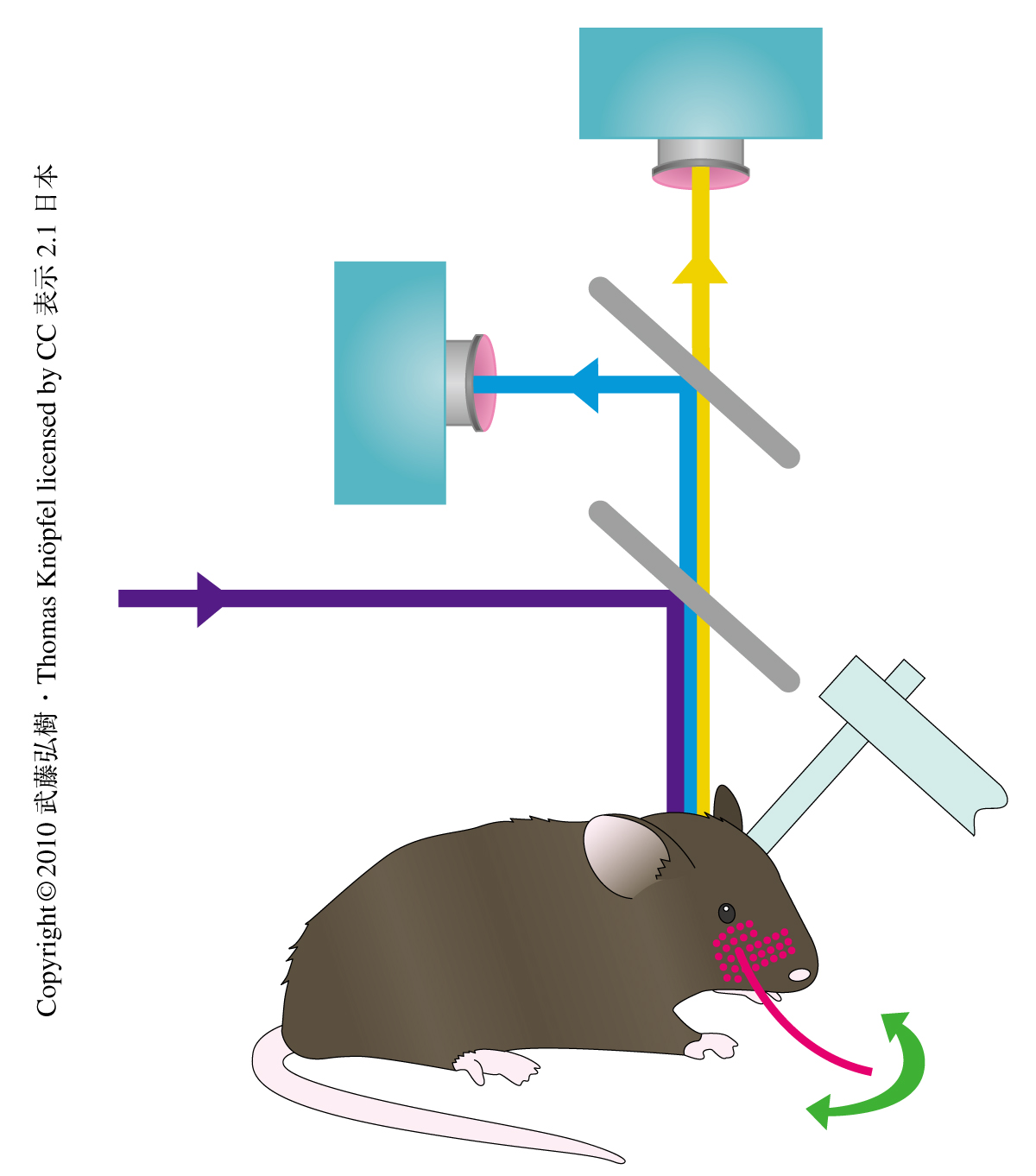
さらに,このマウスを用いて,ヒゲを刺激したときのバレル野の錐体細胞集団の活動をどのように記録できるのか,in vivoで検証してみた.VSFP2.3を発現させたマウスを麻酔で眠らせ,バレル野付近の頭皮を取り除き,さらに,頭蓋骨を薄く削り開頭することなく大脳皮質表層が直接に測定できる状態にした.胎仔のときに膜電位感受性蛍光タンパク質を遺伝子導入しておけば開頭手術は必要ない.このため,in vivo記録のときにとくに問題となる心拍や呼吸の動きによるアーティファクトを最小限に抑え,さらに,FRET技術と組み合わせることでさまざまなノイズを除外することができる.1本のヒゲを正確に刺激するため,電圧変化によって動くピエゾ素子により刺激の大きさとタイミングとをコントロールした(図2).1本のヒゲを1回たわませたところ,供与体と受容体の両方のチャネルで心拍や呼吸によるノイズにまじってVSFP2.3のシグナルが記録された.このノイズは供与体と受容体との比をとることで除去され,ヒゲを刺激したことによる膜電位の変化は1回の測定でも十分に記録することができた.また,加算平均することでシグナル/ノイズ比は改善され,1本のヒゲによって活動するバレル野の一部を膜電位の変化としてより鮮明に可視化することができた.
さらに,蛍光タンパク質のペアとして,供与体を水色のCeruleanから黄色のCitrineに,受容体をCitrineから赤色のmkate2に置き換えたVSFP2.42を発現させたマウスにおいて,in vitroとin vivoでの実験を行ったところ,VSFP2.42はVSFP2.3と同じ性能をもっていることが確認された.このVSFP2.42は受容体の蛍光を赤外光にシフトさせており,ヘモグロビンの吸収波長の影響をうけにくく,また,皮膚などへの浸透深度があるため,生体内の深い組織の蛍光観察も可能である.
最後に,VSFP2の空間解像度を調べるため6つのヒゲを順番に刺激してみたところ,それぞれのヒゲに対応する蛍光変化がバレル野のうえでオーバーラップせずに観察された.これは,以前より知られていた大脳皮質体性感覚野におけるヒゲの投射性地図と一致したため9),VSFP2の空間解像度が高精度であることが実証された.
近年,チャネルロドプシンなどを用いた神経細胞の光刺激を利用した研究によって,光により神経細胞の活動をコントロールする技術が非常に発達してきた10).今回,光によって神経細胞の活動をリアルタイムで観察する技術に,新たに膜電位感受性蛍光タンパク質がくわわった.これら光遺伝学的な技術の特徴は,タンパク質をベースに作製するためセンサーを目的の神経細胞へ遺伝的に導入することができ,in vivo実験への応用が容易であることにある.光遺伝学的ツールをさらに開発し,また,応用していくことで,脳機能の研究の飛躍的な発展が期待できるだろう.筆者らの研究室では,現在も,さらに高い時空間解像度レベルで細胞の膜電位の変化を可視化する膜電位感受性蛍光タンパク質の開発・改良を進めている.また,開発した膜電位感受性蛍光タンパク質を実験に応用し,神経回路のダイナミクスを解明することもめざしている.
略歴:2002年 東京学芸大学大学院教育学研究科修士課程 修了,同年 理化学研究所脳科学総合研究センター リサーチアソシエイト,2007年 医学博士(浜松医科大学),同年より理化学研究所脳科学総合研究センター 博士研究員.
研究テーマ:蛍光タンパク質プローブを用いた脳機能イメージング.
Thomas Knöpfel(トーマス クヌェッフェル)
理化学研究所脳科学総合研究センター チームチームリーダー.
研究室URL:http://neurodynamics.brain.riken.jp/
© 2010 武藤弘樹・Thomas Knöpfel Licensed under CC 表示 2.1 日本
(理化学研究所脳科学総合研究センター 神経回路ダイナミクス研究チーム)
email:武藤弘樹,Thomas Knöpfel
DOI: 10.7875/first.author.2010.006
Imaging brain electric signals with genetically targeted voltage-sensitive fluorescent proteins.
Walther Akemann, Hiroki Mutoh, Amélie Perron, Jean Rossier, Thomas Knöpfel
Nature Methods, 7, 643-649 (2010)
要 約
筆者らの研究室では,特定かつ複数の神経細胞における膜電位の変化を同時かつリアルタイムに観察するため,膜電位感受性蛍光タンパク質の開発と実験への応用を行っている.タンパク質をベースとしたセンサーは神経細胞へ遺伝的に導入することができるため,目的の神経細胞を非侵襲的に観察することができる.今回,大脳皮質体性感覚野に膜電位感受性蛍光タンパク質VSFP2を発現させることで,1本のヒゲを刺激することで生じる神経細胞の膜電位の変化を画像化することに成功した.このVSFP2を新たな光遺伝学的ツールとして用いることにより,脳機能の研究の飛躍的な進展に貢献することが期待される.さらには,神経科学だけでなく創薬スクリーニングの効率化も期待できるだろう.
はじめに
われわれの脳では,いくつもの神経細胞が同時にコミュニケーションをとりあいさまざまな情報処理を行なっている.この脳内での情報処理を理解するためには,神経細胞どうしのコミュニケーションをリアルタイムで観察する必要がある.
従来から,神経細胞の活動を観察するのに,神経細胞の膜電位の変化や細胞内Ca2+濃度の変動を記録する手法がよく用いられている.膜電位の変化を記録する場合,微小電極法やパッチクランプ法などの電気生理学的な手法を用いれば,活動電位など約1ミリ秒の速い変化を正確に記録することはできるが,同時に記録できる神経細胞の数に限りがある.別な手法として,膜電位感受性色素をもちいることでも速い変化を記録することができるが,これは不特定多数の細胞を染色してしまうため,どの細胞から記録された変化なのか特定することは困難である.
一方,細胞内におけるCa2+濃度の変動の記録についてはさまざまな技術が発達している.とくに,蛍光タンパク質をベースとしたGCaMPなどのCa2+センサーを,遺伝子工学的な手法を用いて特定の神経細胞にのみ発現させた遺伝子改変動物は,さまざまな研究分野で使用されている1).しかしながら,Ca2+濃度の変動の多くは膜電位の変化に付随して生じるものであり,さらに,Ca2+の流入から流出・取り込みへとつづく一連の変動には時間を要するため,神経細胞のコミュニケーションをリアルタイムで観察するには反応速度が遅い.
これらの時空間解像度の問題を解決するため,筆者らの研究室では,蛍光タンパク質GFPをベースとした膜電位感受性蛍光タンパク質(voltage sensitive fluorescence protein:VSFP)の開発,および,機能の確認と実験への応用を行っている.
1.膜電位感受性蛍光タンパク質の構造と機能
FlaSh 2),VSFP1 3),SPARC 4) などの初期の膜電位感受性蛍光タンパク質は,K+チャネルやNa+チャネルといった機能や構造などについて研究がよく行われていたイオンチャネルを用い,電位感受性領域の構造変化などを蛍光タンパク質の蛍光強度の変化としてとらえるものであった.しかしながら,これらのセンサーは発現ののちの細胞膜への移行が十分には起こらず細胞内のオルガネラやサイトゾルにとどまってしまう.このことは,バックグラウンドノイズの増加とシグナルの減少をひき起こしていた5).
2005年,岡村康司らは,イオンチャネルと異なり電位感受性領域と酵素活性部位とで独立して機能する電位依存性酵素Ci-VSPを発見した6).このタンパク質は,イオンを通すためのポアを形成せず,膜電位の変化に応じて細胞内の酵素活性を調節するシンプルな構造であった(図1a).
筆者らの研究室では,このCi-VSPをベースに膜電位感受性蛍光タンパク質のさらなる改良を行った.神経細胞の活動を感知するのにCi-VSPの電位感受性領域を用い,酵素活性部位の代わりにGFPの改変型であるCFPとYFPの蛍光タンパク質のペアを付加した.この原型に改良を重ねることで,神経細胞が活動することで生じる膜電位の変化をFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)によって観察できる膜電位感受性蛍光タンパク質VSFP2の開発にいたった(図1b).培養細胞(PC12細胞)で行ったVSFP2の特徴と機能の確認実験では,センサーの細胞膜への移行が著しく改善されており,また,このことにより膜電位の変化により得られるシグナルの大幅な向上もみられた.さらに,神経細胞の活動を模した刺激をPC12細胞へあたえたところ,活動電位など神経細胞の電気的な活動をVSFP2の蛍光強度の変化として記録できることが実証された7).
2.VSFP2.3による神経細胞と大脳皮質の活動の可視化
VSFP2が機能的に神経細胞の活動を可視化できることが実証されたので,今回,実際の神経細胞に最新型の膜電位感受性蛍光タンパク質VSFP2.3 8) およびVSFP2.42を発現させ,in vitroとin vivoでの膜電位の変化の記録を行った.
まず,蛍光タンパク質のペアとして供与体に水色のCerulean,受容体に黄色のCitrineをもつVSFP2.3を海馬初代培養神経細胞に発現させたところ,VSFP2.3は細胞体と樹状突起を縁どるように細胞膜にきれいに発現することが確認された.これは,神経細胞の膜電位の変化を蛍光強度の変化へと正確に変換するための,膜電位感受性蛍光タンパク質の重要な性質である.また,パッチクランプ法による電位の変化とVSFP2.3の蛍光強度の変化とを同時に記録したところ,培養神経細胞が自発的に生じる活動電位をVSFP2.3の蛍光強度の変化としても記録できることがわかった.
つぎに,マウスの生体脳でVSFP2.3の機能確認を行うため,マウス胎仔(胎生15.5日)の側脳室にVSFP2.3を子宮内エレクトロポレーション法により遺伝子導入した.生後,成熟したマウスの大脳皮質の急性脳切片標本を作製したところ,おもに大脳皮質体性感覚野(いわゆる,バレル野付近)の第2層,第3層または第5層にある錐体細胞においてVSFP2.3の発現が観察された.これらVSFP2.3を発現している錐体細胞にパッチクランプ法と蛍光測定とを同時に行ったところ,VSFP2.3の蛍光強度の変化と膜電位の変化とが一致し,VSFP2.3がマウス生体脳の神経細胞で機能していることが確認された.
さらに,このマウスを用いて,ヒゲを刺激したときのバレル野の錐体細胞集団の活動をどのように記録できるのか,in vivoで検証してみた.VSFP2.3を発現させたマウスを麻酔で眠らせ,バレル野付近の頭皮を取り除き,さらに,頭蓋骨を薄く削り開頭することなく大脳皮質表層が直接に測定できる状態にした.胎仔のときに膜電位感受性蛍光タンパク質を遺伝子導入しておけば開頭手術は必要ない.このため,in vivo記録のときにとくに問題となる心拍や呼吸の動きによるアーティファクトを最小限に抑え,さらに,FRET技術と組み合わせることでさまざまなノイズを除外することができる.1本のヒゲを正確に刺激するため,電圧変化によって動くピエゾ素子により刺激の大きさとタイミングとをコントロールした(図2).1本のヒゲを1回たわませたところ,供与体と受容体の両方のチャネルで心拍や呼吸によるノイズにまじってVSFP2.3のシグナルが記録された.このノイズは供与体と受容体との比をとることで除去され,ヒゲを刺激したことによる膜電位の変化は1回の測定でも十分に記録することができた.また,加算平均することでシグナル/ノイズ比は改善され,1本のヒゲによって活動するバレル野の一部を膜電位の変化としてより鮮明に可視化することができた.
さらに,蛍光タンパク質のペアとして,供与体を水色のCeruleanから黄色のCitrineに,受容体をCitrineから赤色のmkate2に置き換えたVSFP2.42を発現させたマウスにおいて,in vitroとin vivoでの実験を行ったところ,VSFP2.42はVSFP2.3と同じ性能をもっていることが確認された.このVSFP2.42は受容体の蛍光を赤外光にシフトさせており,ヘモグロビンの吸収波長の影響をうけにくく,また,皮膚などへの浸透深度があるため,生体内の深い組織の蛍光観察も可能である.
最後に,VSFP2の空間解像度を調べるため6つのヒゲを順番に刺激してみたところ,それぞれのヒゲに対応する蛍光変化がバレル野のうえでオーバーラップせずに観察された.これは,以前より知られていた大脳皮質体性感覚野におけるヒゲの投射性地図と一致したため9),VSFP2の空間解像度が高精度であることが実証された.
おわりに
近年,チャネルロドプシンなどを用いた神経細胞の光刺激を利用した研究によって,光により神経細胞の活動をコントロールする技術が非常に発達してきた10).今回,光によって神経細胞の活動をリアルタイムで観察する技術に,新たに膜電位感受性蛍光タンパク質がくわわった.これら光遺伝学的な技術の特徴は,タンパク質をベースに作製するためセンサーを目的の神経細胞へ遺伝的に導入することができ,in vivo実験への応用が容易であることにある.光遺伝学的ツールをさらに開発し,また,応用していくことで,脳機能の研究の飛躍的な発展が期待できるだろう.筆者らの研究室では,現在も,さらに高い時空間解像度レベルで細胞の膜電位の変化を可視化する膜電位感受性蛍光タンパク質の開発・改良を進めている.また,開発した膜電位感受性蛍光タンパク質を実験に応用し,神経回路のダイナミクスを解明することもめざしている.
文 献
- Fletcher, M. L., Masurkar, A. V., Xing, J. et al.: Optical imaging of postsynaptic odor representation in the glomerular layer of the mouse olfactory bulb. J. Neurophysiol., 102, 817-830 (2009)[PubMed]
- Siegel, M. S & Isacoff, E. Y.: A genetically encoded optical probe of membrane voltage. Neuron, 19, 735-741 (1997)[PubMed]
- Sakai, R., Repunte-Canonigo, V., Raj, C. D. et al.: Design and characterization of a DNA-encoded, voltage-sensitive fluorescent protein. Eur. J. Neurosci., 13, 2314-2318 (2001)[PubMed]
- Ataka, K. & Pieribone, V. A.: A genetically targetable fluorescent probe of channel gating with rapid kinetics. Biophys. J., 82, 509-516 (2002)[PubMed]
- Baker, B. J, Lee, H., Pieribone, V. A. et al.: Three fluorescent protein voltage sensors exhibit low plasma membrane expression in mammalian cells. J. Neurosci. Methods, 161, 32-38 (2007)[PubMed]
- Murata, Y., Iwasaki, H., Sasaki, M. et al.: Phosphoinositide phoshatase activity coupled to an intrinsic voltage sensor. Nature, 435, 1239-1243 (2005)[PubMed]
- Dimitrov, D., He, Y., Mutoh, H. et al.: Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One, 2, e440 (2007)[PubMed]
- Mutoh, H., Perron, A., Dimitrov, D. et al.: Spectrally-resolved response properties of the three most advanced FRET based fluorescent protein voltage probes. PLoS One, 4, e4555 (2009)[PubMed]
- Petersen, C. C. Grinvald, A., Sakmann, B.: Spatiotemporal dynamics of sensory responses in layer 2/3 of rat barrel cortex measured in vivo by voltage-sensitive dye imaging combined with whole-cell voltage recording and neuron reconstructions. J. Neurosci., 23, 1298-1309 (2003)[PubMed]
- Boyden, E. S., Zhang, F., Bamberg, E. et al.: Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci., 8, 1263-1268 (2005)[PubMed]
著者プロフィール
略歴:2002年 東京学芸大学大学院教育学研究科修士課程 修了,同年 理化学研究所脳科学総合研究センター リサーチアソシエイト,2007年 医学博士(浜松医科大学),同年より理化学研究所脳科学総合研究センター 博士研究員.
研究テーマ:蛍光タンパク質プローブを用いた脳機能イメージング.
Thomas Knöpfel(トーマス クヌェッフェル)
理化学研究所脳科学総合研究センター チームチームリーダー.
研究室URL:http://neurodynamics.brain.riken.jp/
© 2010 武藤弘樹・Thomas Knöpfel Licensed under CC 表示 2.1 日本