RNA結合タンパク質Musashi1によるRobo3の転写後発現調節を介した軸索誘導機構
桑子賢一郎1・岡野栄之2
(1慶應義塾大学医学部 ブリヂストン神経発生・再生学寄附講座,2慶應義塾大学医学部 生理学教室)
email:桑子賢一郎,岡野栄之
DOI: 10.7875/first.author.2010.009
Neural RNA-binding protein Musashi1 controls midline crossing of precerebellar neurons through posttranscriptional regulation of Robo3/Rig-1 expression.
Ken-ichiro Kuwako, Kyoko Kakumoto, Takao Imai, Mana Igarashi, Takao Hamakubo, Shin-ichi Sakakibara, Marc Tessier-Lavigne, Hirotaka James Okano, Hideyuki Okano
Neuron, 67, 407-421 (2010)
精巧な神経回路の形成のためには厳密に制御された遺伝子発現が必須である.これまでの研究により,軸索誘導因子やその受容体の転写レベルでの発現制御については多くが明らかにされてきたが,翻訳レベルでの転写後発現制御の重要性についてはいまだほとんどわかっていない.今回,筆者らは,軸索の正中線交差において重要なはたらきをするSlit受容体Robo3/Rig-1(以降,Robo3と表記する)の発現が,RNA結合タンパク質Musashi1(Msi1)によって制御されていることを明らかにした.Msi1はRNA認識モチーフを介してRobo3をコードしているmRNAに結合し,その翻訳を促進した.Msi1ノックアウトマウスの小脳前核ニューロンではRobo3タンパク質の発現量が顕著に減少し,一方で,Robo3 mRNAの発現量には変動はみられなかった.さらに,Msi1ノックアウトマウスではRobo3ノックアウトマウスと同じく,小脳前核ニューロンの軸索の正中線交差に著しい異常が認められた.この研究の結果から,小脳前核ニューロンの軸索の正常な正中線交差のためには,Msi1によるRobo3 mRNAの翻訳制御が重要であることが示された.
複雑な神経回路網をつくるため,発生期の軸索は遠く離れた標的組織にむかって非常に長く複雑な道のりを伸展していく.この過程では,軸索はいくつかの中間標的組織を順々に通過し最終的な標的組織へとむかう1).後脳や脊髄の腹側部正中線上に存在する底板は代表的な中間標的組織であり,一部の軸索は底板に誘引され,正中線を超えて,やがて,つぎの標的へと伸展していく.このように,軸索が正中線を超えて反対側へとむかう現象は“正中線交差”とよばれ,軸索誘導機構の研究でもっともよく使われるモデル実験系である.伸展中の軸索は底板などから分泌されるNetrinやSlitなどの軸索誘導因子によって進路を決定され最終標的組織へと導かれる.軸索誘導因子は軸索上に局在する軸索誘導因子受容体に結合し,ニューロンにシグナルを伝えることで軸索を誘引あるいは反発させる.そのため,軸索誘導因子やその受容体の発現レベルは軸索の反応を決定する非常に大きな要因であり2),実際に,Slit受容体であるRoboファミリータンパク質は正中線の付近でその発現が急激に変動し,軸索の誘引・反発に大きな影響をあたえていることが知られている.これまでに,軸索誘導因子やその受容体の転写レベルでの発現制御機構については知られてきたが3),翻訳レベルでの転写後発現制御の重要性についてはほとんど明らかにされていなかった.しかしながら,正中線交差のような軸索誘導機構では,軸索の伸展にともない細胞外の環境が刻々と変化するなかで,受容体などの発現をきわめて迅速に制御する必要があるため,遺伝子からの転写を介さない転写後発現制御の関与が考えられてきた.
Musashiファミリータンパク質は進化的によく保存されたRNA結合タンパク質で,標的mRNAに結合してその翻訳を制御することが知られている4).哺乳類ではMusashi1(Msi1)とMusashi2(Msi2)の2つが存在し,いずれも神経幹細胞で高発現し,標的mRNAの翻訳制御をつうじて神経幹細胞の自己増殖能の維持にはたらいているものと考えられている5).これまでに,m-Numbやp21WAFをコードしているmRNAなどがMsi1の標的mRNAとして同定されており,Msi1はそれらmRNAの3’側非翻訳領域に存在するコンセンサス配列に結合して翻訳を抑制することが明らかにされている6).一方で,アフリカツメガエルのMsi1ホモログであるNRPは,卵成熟の過程で複数のmRNAに結合してそれらの翻訳を促進する.よって,Musashiファミリータンパク質は発現する細胞や標的のmRNAによって翻訳促進因子あるいは翻訳抑制因子のいずれともなりうるものと考えられる.
今回,筆者らは,RNA結合タンパク質Msi1の新たな機能を探るため,胎生期の神経系においてMsi1の詳細な発現解析を行った.その結果,Msi1はこれまで知られていた神経幹細胞などの未分化細胞だけでなく,大脳皮質や後脳を含む多くの領域における発生過程のニューロンでも発現していることが明らかになった.胎生期後脳ではMsi1は移動中のすべての小脳前核ニューロンで高発現していたことから,今回,とくに小脳前核ニューロンでのMsi1の機能に焦点をしぼって解析を行った.
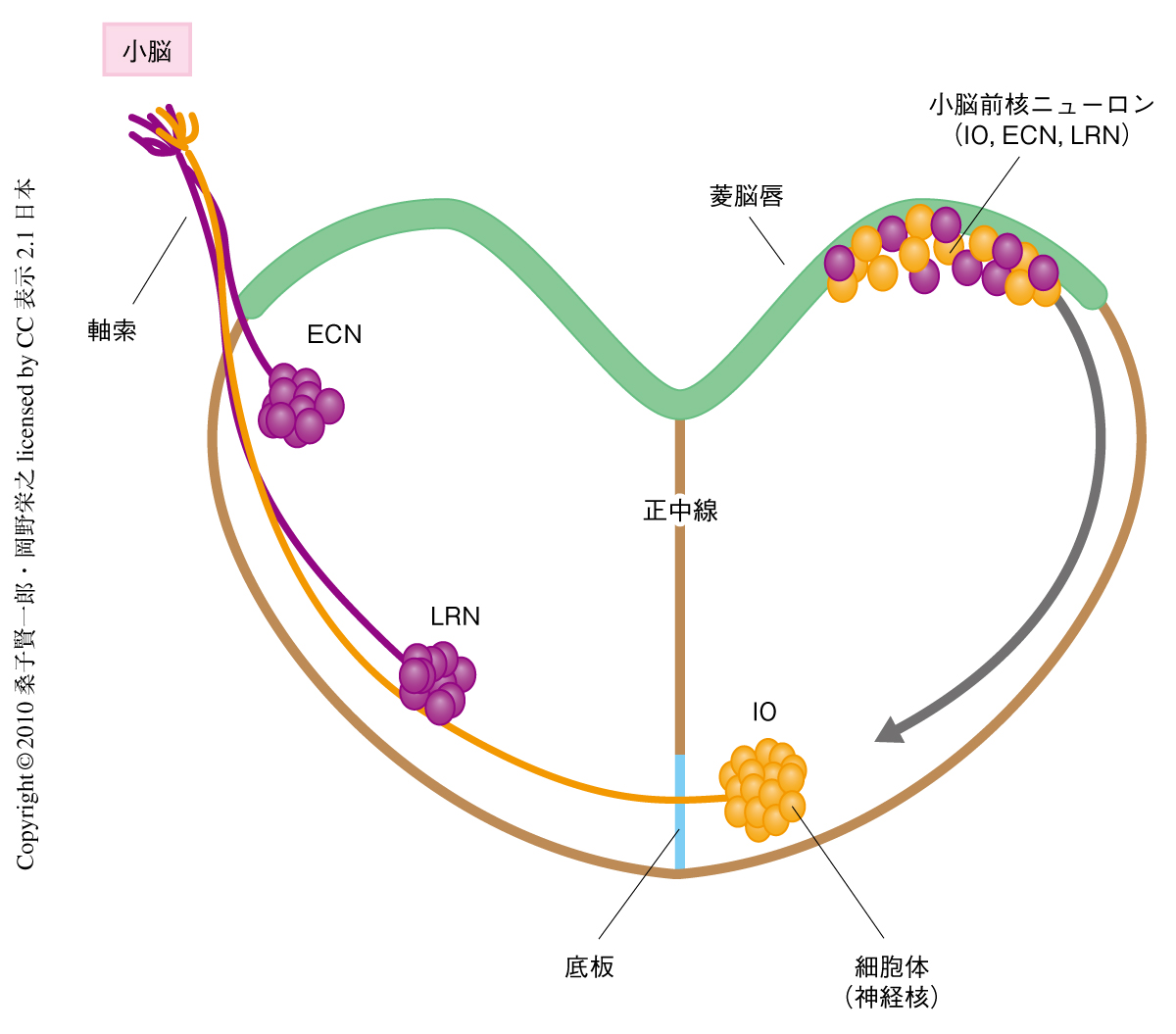
小脳前核ニューロンの発生期における軸索投射と細胞移動は,正中線交差の制御機構を解析するためのモデル実験系として古くから研究されてきた7)(図1).小脳前核ニューロンの軸索は登上繊維・苔状繊維とよばれ,小脳皮質へ入力する主要な求心性神経回路を担う.IOニューロン(inferior olivary neuron),LRNニューロン(lateral reticular nucleus neuron),ECNニューロン(external cuneate nucleus neuron)を含むすべての小脳前核ニューロンは後脳背側部の菱脳唇で誕生し,軸索を伸展しながら底板にむかって移動する.小脳前核ニューロンのすべての軸索は正中線を超えるが,それらの細胞体は底板付近で異なる挙動を示す.IOニューロンは長い軸索を伸ばしながら正中線にむかって移動し,その軸索は正中線を超えて反対側の小脳へと投射するが,細胞体は底板の直前で止まりそこで神経核を形成する.一方,LRNニューロンおよびECNニューロンは短い軸索を伸ばしながら移動し,軸索・細胞体ともに正中線を超え,その結果,軸索は同側の小脳へ投射する.
小脳前核ニューロンの正中線交差におけるMsi1の機能を調べるため,まず,Msi1ノックアウトマウスの表現型の解析を行った.IOニューロンの軸索投射が完了した生後0日目において,左側の小脳から蛍光色素DiIを用いてIOニューロンを逆行性に標識した.野生型マウスではIOニューロンは反体側小脳へ軸索を投射するため標識されたIOニューロンの細胞体はすべて正中線をはさんで右側で観察されたが,Msi1ノックアウトマウスでは標識されたIOニューロンの細胞体は左側で観察され,底板上では標識された軸索は観察されなかった.さらに,IOニューロンの正中線交差のピークである胎生13.5日目においても,Msi1ノックアウトマウスでは底板上を交差するIOニューロンの軸索は顕著に減少していた.一方,Msi1ノックアウトマウスでも,胎生期のあいだ,底板上でIOニューロンが観察されなかったことから,野生型マウスと同じくIOニューロンの細胞体は正中線を超えていないものと考えられた.また,順行性の標識によりMsi1ノックアウトマウスのIOニューロンの小脳への軸索投射を調べたところ,異常はみられなかった.これらの結果から,Msi1ノックアウトマウスではIOニューロンの軸索は正中線を超えることができず,同側の小脳へ投射している可能性が示唆された.つぎに,同様にLRNニューロンおよびECNニューロンの正中線交差についても解析を行った.これらのニューロンは短い軸索とともに細胞体も正中線を超えることから,正中線交差のピークである胎生13.5日目において底板上のLRNニューロンおよびECNニューロンの数を調べたところ,Msi1ノックアウトマウスでは顕著に減少していた.
以上の結果から,Msi1が小脳前核ニューロンの正中線交差において非常に重要な機能をもつことが明らかになった.
Msi1ノックアウトマウスにおける小脳前核ニューロンの正中線交差の異常は,軸索誘導機構のなんらかの異常による可能性が強く考えられたため,つぎに,小脳前核ニューロンの正中線交差で重要なはたらきをすることが知られているNetrinやSlitなどの軸索誘導因子,および,それらの受容体であるDCCやRoboファミリータンパク質の発現を解析した.そして,Slit受容体であるRobo3の発現がMsi1ノックアウトマウスの小脳前核ニューロンにおいて顕著に低下していることが明らかになった.一方で,NetrinやSlit,あるいは,それらのほかの受容体の発現に異常はみられなかった.興味深いことに,Robo3 mRNAの発現量には変動はみられなかったことから,Robo3は転写後発現制御をうけている可能性が示唆された.
Robo3は,Slit-Robo1/2による反発シグナルを抑えることで,結果的に軸索を誘引させる作用をもつことが示唆されている8).また,Robo3ノックアウトマウスではすべての小脳前核ニューロンの軸索が正中線を超えられなくなり9),さらに,Robo3ノックアウトマウスの表現型と同じく後脳ニューロンの軸索正中線交差に異常がみられる水平注視麻痺・脊柱側彎症候群患者において,Robo3遺伝子に多数の変異がみつかっている10).これらの知見から,Robo3は小脳前核ニューロンの正中線交差をつかさどるきわめて重要なタンパク質であるものと考えられている.
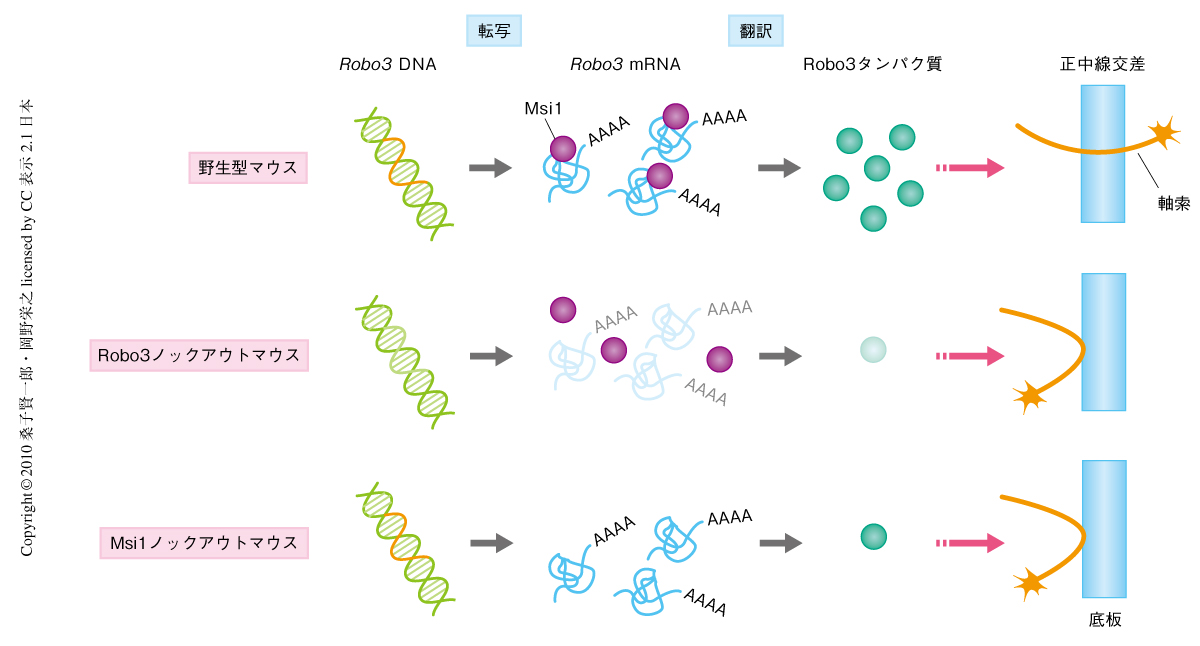
これまでの研究ではMsi1は翻訳制御因子として知られていたため,つぎに,Msi1がRobo3 mRNAの発現を翻訳レベルで直接に制御しているかどうかを検討した.まず,COS-7細胞にMsi1とRobo3を共発現させたところ,Robo3 mRNAの発現量は変動しなかったがRobo3タンパク質の発現量はMsi1の発現量に依存して増加した.この結果は,Msi1ノックアウトマウスでのRobo3の発現変動の結果と一致し,転写後発現制御が行われている可能性を強く支持した.そこで,胎生13.5日目の後脳抽出液を用いてタンパク質-RNA結合実験を行ったところ,Msi1はRobo3 mRNAに結合していることが明らかになった.一方で,Msi1はRobo3タンパク質とは結合せず,その安定化にも寄与していなかった.そこで,ポリソーム解析によりMsi1によるRobo3 mRNAの翻訳制御の可能性を調べた結果,対照群に比べて,Msi1共発現下ではRobo3 mRNAはより翻訳活性の高いポリソーム画分に集積していた.これらの結果から,Msi1はRobo3 mRNAに結合してその翻訳を促進することが明らかになり,Msi1ノックアウトマウスの小脳前核ニューロンではRobo3 mRNAの翻訳効率が低下したことでタンパク質量の減少にいたったものと考えられた.
さらに,Msi1およびRobo3の欠失変異体を用いたより詳細な発現解析から,Msi1はRNA認識モチーフを介してRobo3 mRNAの発現を制御すること,また,これまで知られていたMsi1の結合様式とは異なり,Msi1はコンセンサス配列に非依存的にRobo3 mRNAの翻訳領域に結合することも明らかになった.
Msi1ノックアウトマウスにおける異常とRobo3の発現低下との関連を調べるため,Msi1ノックアウトマウスとRobo3ノックアウトマウスの小脳前核ニューロンの表現型をさらに比較した.IOニューロンは正中線の左右で特徴的な管状構造の下オリーブ神経核を形成することが知られている.そこで,神経核が完全に形成されたあとの生後0日目のMsi1ノックアウトマウスとRobo3ノックアウトマウスにおいて下オリーブ神経核の構造を観察したところ,この2つのノックアウトマウスの下オリーブ神経核はきわめて類似した異常形態を示すことが明らかになった.
さらに,LRNニューロンおよびECNニューロンの正中線交差に関して,Msi1遺伝子とRobo3遺伝子との相互作用についても解析した.野生型マウスと比較して,Msi1ヘテロノックアウトマウス,Robo3ヘテロノックアウトマウスともに,胎生13.5日目の底板上のLRNニューロンおよびECNニューロンの数に異常はみられなかったが,Msi1とRobo3のダブルヘテロノックアウトマウスではその数が有意に減少していた.
これらの結果から,Msi1ノックアウトマウスでみられる小脳前核ニューロンの異常はRobo3の発現低下に起因する可能性が強く示唆された.
小脳前核ニューロンが底板に近づくにつれてMsi1の発現量が低下することから,底板から分泌されるシグナルがMsi1の発現を抑制している可能性が考えられた.そこで,その可能性を検討するため組織片培養を行った.小脳前核ニューロンを含む胎生12.5日目の菱脳唇の組織片を単独培養,あるいは,大脳皮質組織片や底板組織片との共培養を行い,菱脳唇の組織片でのMsi1の発現量を解析した.その結果,菱脳唇の単独培養や大脳皮質との共培養に比べ,底板との共培養を行った菱脳唇ではMsi1の発現が有意に低下していた.実際に,小脳前核ニューロンが底板に近づくにつれてRobo3の発現も低下することから9),底板に由来するシグナルがMsi1の発現を抑制し,それにともなってRobo3の翻訳が抑えられている可能性が示唆された.この機構は,IOニューロンは軸索のみが正中線を超えるという現象を説明しうる可能性がある.つまり,軸索が底板に到達した際には,誘引作用をもつRobo3が高発現しているため軸索は正中線を超える.しかし,そののち,底板に由来するシグナルがMsi1の発現を抑制すると結果的にRobo3 mRNAの翻訳が抑えられるため,軸索より遅れて細胞体が正中線に到達した際にはすでにRobo3の発現が低下しており,そのためIOニューロンの細胞体は正中線を超えられないことが考えられる.今後,この未知の底板に由来するシグナルを解明することにより,正中線交差の分子機構の理解が進むものと期待される.
この研究の結果から,小脳前核ニューロンの正中線交差ではRobo3の発現が翻訳レベルで適切に制御される必要があることが明らかになり(図2),軸索誘導機構における翻訳発現制御の重要性がはじめて示された.そのほかのニューロンの軸索誘導においても翻訳発現制御がかかわっている可能性が十分に考えられ,今後,Msi1やRobo3以外のタンパク質についても検討していく必要がある.さらに近年では,マイクロRNAによる転写後発現制御がさまざまな生命現象において重要な役割をもつことが明らかにされており,軸索誘導においてもマイクロRNAがmRNAの翻訳抑制や分解を介し重要なはたらきをしている可能性も考えられる.このように,迅速な発現制御が必要となる軸索誘導機構では,翻訳制御も含め転写後発現制御が重要になるものと考えられ,今後のさらなる研究によりその全体像が明らかにされることを期待する.
略歴:2005年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Harvard大学Medical School Children's Hospital Boston研究員を経て,2007年より慶應義塾大学医学部 特別研究助教.
研究テーマ:神経回路の形成機構.
抱負:運動・記憶・学習などの基盤となる精巧な神経回路が形成される過程のさまざまな現象を幅広い視点から解明していきたい.また,神経回路の形成異常と疾患との関連についても明らかにしていきたい.
岡野 栄之(Hideyuki Okano)
慶應義塾大学医学部 教授.
研究室URL:http://www.okano-lab.com/
© 2010 桑子賢一郎・岡野栄之 Licensed under CC 表示 2.1 日本
(1慶應義塾大学医学部 ブリヂストン神経発生・再生学寄附講座,2慶應義塾大学医学部 生理学教室)
email:桑子賢一郎,岡野栄之
DOI: 10.7875/first.author.2010.009
Neural RNA-binding protein Musashi1 controls midline crossing of precerebellar neurons through posttranscriptional regulation of Robo3/Rig-1 expression.
Ken-ichiro Kuwako, Kyoko Kakumoto, Takao Imai, Mana Igarashi, Takao Hamakubo, Shin-ichi Sakakibara, Marc Tessier-Lavigne, Hirotaka James Okano, Hideyuki Okano
Neuron, 67, 407-421 (2010)
要 約
精巧な神経回路の形成のためには厳密に制御された遺伝子発現が必須である.これまでの研究により,軸索誘導因子やその受容体の転写レベルでの発現制御については多くが明らかにされてきたが,翻訳レベルでの転写後発現制御の重要性についてはいまだほとんどわかっていない.今回,筆者らは,軸索の正中線交差において重要なはたらきをするSlit受容体Robo3/Rig-1(以降,Robo3と表記する)の発現が,RNA結合タンパク質Musashi1(Msi1)によって制御されていることを明らかにした.Msi1はRNA認識モチーフを介してRobo3をコードしているmRNAに結合し,その翻訳を促進した.Msi1ノックアウトマウスの小脳前核ニューロンではRobo3タンパク質の発現量が顕著に減少し,一方で,Robo3 mRNAの発現量には変動はみられなかった.さらに,Msi1ノックアウトマウスではRobo3ノックアウトマウスと同じく,小脳前核ニューロンの軸索の正中線交差に著しい異常が認められた.この研究の結果から,小脳前核ニューロンの軸索の正常な正中線交差のためには,Msi1によるRobo3 mRNAの翻訳制御が重要であることが示された.
はじめに
複雑な神経回路網をつくるため,発生期の軸索は遠く離れた標的組織にむかって非常に長く複雑な道のりを伸展していく.この過程では,軸索はいくつかの中間標的組織を順々に通過し最終的な標的組織へとむかう1).後脳や脊髄の腹側部正中線上に存在する底板は代表的な中間標的組織であり,一部の軸索は底板に誘引され,正中線を超えて,やがて,つぎの標的へと伸展していく.このように,軸索が正中線を超えて反対側へとむかう現象は“正中線交差”とよばれ,軸索誘導機構の研究でもっともよく使われるモデル実験系である.伸展中の軸索は底板などから分泌されるNetrinやSlitなどの軸索誘導因子によって進路を決定され最終標的組織へと導かれる.軸索誘導因子は軸索上に局在する軸索誘導因子受容体に結合し,ニューロンにシグナルを伝えることで軸索を誘引あるいは反発させる.そのため,軸索誘導因子やその受容体の発現レベルは軸索の反応を決定する非常に大きな要因であり2),実際に,Slit受容体であるRoboファミリータンパク質は正中線の付近でその発現が急激に変動し,軸索の誘引・反発に大きな影響をあたえていることが知られている.これまでに,軸索誘導因子やその受容体の転写レベルでの発現制御機構については知られてきたが3),翻訳レベルでの転写後発現制御の重要性についてはほとんど明らかにされていなかった.しかしながら,正中線交差のような軸索誘導機構では,軸索の伸展にともない細胞外の環境が刻々と変化するなかで,受容体などの発現をきわめて迅速に制御する必要があるため,遺伝子からの転写を介さない転写後発現制御の関与が考えられてきた.
Musashiファミリータンパク質は進化的によく保存されたRNA結合タンパク質で,標的mRNAに結合してその翻訳を制御することが知られている4).哺乳類ではMusashi1(Msi1)とMusashi2(Msi2)の2つが存在し,いずれも神経幹細胞で高発現し,標的mRNAの翻訳制御をつうじて神経幹細胞の自己増殖能の維持にはたらいているものと考えられている5).これまでに,m-Numbやp21WAFをコードしているmRNAなどがMsi1の標的mRNAとして同定されており,Msi1はそれらmRNAの3’側非翻訳領域に存在するコンセンサス配列に結合して翻訳を抑制することが明らかにされている6).一方で,アフリカツメガエルのMsi1ホモログであるNRPは,卵成熟の過程で複数のmRNAに結合してそれらの翻訳を促進する.よって,Musashiファミリータンパク質は発現する細胞や標的のmRNAによって翻訳促進因子あるいは翻訳抑制因子のいずれともなりうるものと考えられる.
1.Msi1ノックアウトマウスにおける小脳前核ニューロンの正中線交差の異常
今回,筆者らは,RNA結合タンパク質Msi1の新たな機能を探るため,胎生期の神経系においてMsi1の詳細な発現解析を行った.その結果,Msi1はこれまで知られていた神経幹細胞などの未分化細胞だけでなく,大脳皮質や後脳を含む多くの領域における発生過程のニューロンでも発現していることが明らかになった.胎生期後脳ではMsi1は移動中のすべての小脳前核ニューロンで高発現していたことから,今回,とくに小脳前核ニューロンでのMsi1の機能に焦点をしぼって解析を行った.
小脳前核ニューロンの発生期における軸索投射と細胞移動は,正中線交差の制御機構を解析するためのモデル実験系として古くから研究されてきた7)(図1).小脳前核ニューロンの軸索は登上繊維・苔状繊維とよばれ,小脳皮質へ入力する主要な求心性神経回路を担う.IOニューロン(inferior olivary neuron),LRNニューロン(lateral reticular nucleus neuron),ECNニューロン(external cuneate nucleus neuron)を含むすべての小脳前核ニューロンは後脳背側部の菱脳唇で誕生し,軸索を伸展しながら底板にむかって移動する.小脳前核ニューロンのすべての軸索は正中線を超えるが,それらの細胞体は底板付近で異なる挙動を示す.IOニューロンは長い軸索を伸ばしながら正中線にむかって移動し,その軸索は正中線を超えて反対側の小脳へと投射するが,細胞体は底板の直前で止まりそこで神経核を形成する.一方,LRNニューロンおよびECNニューロンは短い軸索を伸ばしながら移動し,軸索・細胞体ともに正中線を超え,その結果,軸索は同側の小脳へ投射する.
小脳前核ニューロンの正中線交差におけるMsi1の機能を調べるため,まず,Msi1ノックアウトマウスの表現型の解析を行った.IOニューロンの軸索投射が完了した生後0日目において,左側の小脳から蛍光色素DiIを用いてIOニューロンを逆行性に標識した.野生型マウスではIOニューロンは反体側小脳へ軸索を投射するため標識されたIOニューロンの細胞体はすべて正中線をはさんで右側で観察されたが,Msi1ノックアウトマウスでは標識されたIOニューロンの細胞体は左側で観察され,底板上では標識された軸索は観察されなかった.さらに,IOニューロンの正中線交差のピークである胎生13.5日目においても,Msi1ノックアウトマウスでは底板上を交差するIOニューロンの軸索は顕著に減少していた.一方,Msi1ノックアウトマウスでも,胎生期のあいだ,底板上でIOニューロンが観察されなかったことから,野生型マウスと同じくIOニューロンの細胞体は正中線を超えていないものと考えられた.また,順行性の標識によりMsi1ノックアウトマウスのIOニューロンの小脳への軸索投射を調べたところ,異常はみられなかった.これらの結果から,Msi1ノックアウトマウスではIOニューロンの軸索は正中線を超えることができず,同側の小脳へ投射している可能性が示唆された.つぎに,同様にLRNニューロンおよびECNニューロンの正中線交差についても解析を行った.これらのニューロンは短い軸索とともに細胞体も正中線を超えることから,正中線交差のピークである胎生13.5日目において底板上のLRNニューロンおよびECNニューロンの数を調べたところ,Msi1ノックアウトマウスでは顕著に減少していた.
以上の結果から,Msi1が小脳前核ニューロンの正中線交差において非常に重要な機能をもつことが明らかになった.
2.Msi1ノックアウトマウスの小脳前核ニューロンにおけるRobo3の発現低下
Msi1ノックアウトマウスにおける小脳前核ニューロンの正中線交差の異常は,軸索誘導機構のなんらかの異常による可能性が強く考えられたため,つぎに,小脳前核ニューロンの正中線交差で重要なはたらきをすることが知られているNetrinやSlitなどの軸索誘導因子,および,それらの受容体であるDCCやRoboファミリータンパク質の発現を解析した.そして,Slit受容体であるRobo3の発現がMsi1ノックアウトマウスの小脳前核ニューロンにおいて顕著に低下していることが明らかになった.一方で,NetrinやSlit,あるいは,それらのほかの受容体の発現に異常はみられなかった.興味深いことに,Robo3 mRNAの発現量には変動はみられなかったことから,Robo3は転写後発現制御をうけている可能性が示唆された.
Robo3は,Slit-Robo1/2による反発シグナルを抑えることで,結果的に軸索を誘引させる作用をもつことが示唆されている8).また,Robo3ノックアウトマウスではすべての小脳前核ニューロンの軸索が正中線を超えられなくなり9),さらに,Robo3ノックアウトマウスの表現型と同じく後脳ニューロンの軸索正中線交差に異常がみられる水平注視麻痺・脊柱側彎症候群患者において,Robo3遺伝子に多数の変異がみつかっている10).これらの知見から,Robo3は小脳前核ニューロンの正中線交差をつかさどるきわめて重要なタンパク質であるものと考えられている.
3.Msi1によるRobo3 mRNAの翻訳制御
これまでの研究ではMsi1は翻訳制御因子として知られていたため,つぎに,Msi1がRobo3 mRNAの発現を翻訳レベルで直接に制御しているかどうかを検討した.まず,COS-7細胞にMsi1とRobo3を共発現させたところ,Robo3 mRNAの発現量は変動しなかったがRobo3タンパク質の発現量はMsi1の発現量に依存して増加した.この結果は,Msi1ノックアウトマウスでのRobo3の発現変動の結果と一致し,転写後発現制御が行われている可能性を強く支持した.そこで,胎生13.5日目の後脳抽出液を用いてタンパク質-RNA結合実験を行ったところ,Msi1はRobo3 mRNAに結合していることが明らかになった.一方で,Msi1はRobo3タンパク質とは結合せず,その安定化にも寄与していなかった.そこで,ポリソーム解析によりMsi1によるRobo3 mRNAの翻訳制御の可能性を調べた結果,対照群に比べて,Msi1共発現下ではRobo3 mRNAはより翻訳活性の高いポリソーム画分に集積していた.これらの結果から,Msi1はRobo3 mRNAに結合してその翻訳を促進することが明らかになり,Msi1ノックアウトマウスの小脳前核ニューロンではRobo3 mRNAの翻訳効率が低下したことでタンパク質量の減少にいたったものと考えられた.
さらに,Msi1およびRobo3の欠失変異体を用いたより詳細な発現解析から,Msi1はRNA認識モチーフを介してRobo3 mRNAの発現を制御すること,また,これまで知られていたMsi1の結合様式とは異なり,Msi1はコンセンサス配列に非依存的にRobo3 mRNAの翻訳領域に結合することも明らかになった.
4.Msi1ノックアウトマウスの異常とRobo3の発現低下
Msi1ノックアウトマウスにおける異常とRobo3の発現低下との関連を調べるため,Msi1ノックアウトマウスとRobo3ノックアウトマウスの小脳前核ニューロンの表現型をさらに比較した.IOニューロンは正中線の左右で特徴的な管状構造の下オリーブ神経核を形成することが知られている.そこで,神経核が完全に形成されたあとの生後0日目のMsi1ノックアウトマウスとRobo3ノックアウトマウスにおいて下オリーブ神経核の構造を観察したところ,この2つのノックアウトマウスの下オリーブ神経核はきわめて類似した異常形態を示すことが明らかになった.
さらに,LRNニューロンおよびECNニューロンの正中線交差に関して,Msi1遺伝子とRobo3遺伝子との相互作用についても解析した.野生型マウスと比較して,Msi1ヘテロノックアウトマウス,Robo3ヘテロノックアウトマウスともに,胎生13.5日目の底板上のLRNニューロンおよびECNニューロンの数に異常はみられなかったが,Msi1とRobo3のダブルヘテロノックアウトマウスではその数が有意に減少していた.
これらの結果から,Msi1ノックアウトマウスでみられる小脳前核ニューロンの異常はRobo3の発現低下に起因する可能性が強く示唆された.
5.底板に由来するシグナルによるMsi1の発現制御
小脳前核ニューロンが底板に近づくにつれてMsi1の発現量が低下することから,底板から分泌されるシグナルがMsi1の発現を抑制している可能性が考えられた.そこで,その可能性を検討するため組織片培養を行った.小脳前核ニューロンを含む胎生12.5日目の菱脳唇の組織片を単独培養,あるいは,大脳皮質組織片や底板組織片との共培養を行い,菱脳唇の組織片でのMsi1の発現量を解析した.その結果,菱脳唇の単独培養や大脳皮質との共培養に比べ,底板との共培養を行った菱脳唇ではMsi1の発現が有意に低下していた.実際に,小脳前核ニューロンが底板に近づくにつれてRobo3の発現も低下することから9),底板に由来するシグナルがMsi1の発現を抑制し,それにともなってRobo3の翻訳が抑えられている可能性が示唆された.この機構は,IOニューロンは軸索のみが正中線を超えるという現象を説明しうる可能性がある.つまり,軸索が底板に到達した際には,誘引作用をもつRobo3が高発現しているため軸索は正中線を超える.しかし,そののち,底板に由来するシグナルがMsi1の発現を抑制すると結果的にRobo3 mRNAの翻訳が抑えられるため,軸索より遅れて細胞体が正中線に到達した際にはすでにRobo3の発現が低下しており,そのためIOニューロンの細胞体は正中線を超えられないことが考えられる.今後,この未知の底板に由来するシグナルを解明することにより,正中線交差の分子機構の理解が進むものと期待される.
おわりに
この研究の結果から,小脳前核ニューロンの正中線交差ではRobo3の発現が翻訳レベルで適切に制御される必要があることが明らかになり(図2),軸索誘導機構における翻訳発現制御の重要性がはじめて示された.そのほかのニューロンの軸索誘導においても翻訳発現制御がかかわっている可能性が十分に考えられ,今後,Msi1やRobo3以外のタンパク質についても検討していく必要がある.さらに近年では,マイクロRNAによる転写後発現制御がさまざまな生命現象において重要な役割をもつことが明らかにされており,軸索誘導においてもマイクロRNAがmRNAの翻訳抑制や分解を介し重要なはたらきをしている可能性も考えられる.このように,迅速な発現制御が必要となる軸索誘導機構では,翻訳制御も含め転写後発現制御が重要になるものと考えられ,今後のさらなる研究によりその全体像が明らかにされることを期待する.
文 献
- Tessier-Lavigne, M. & Goodman, C. S.: The molecular biology of axon guidance. Science, 274, 1123-1133 (1996)[PubMed]
- Dickson, B. J. & Gilestro, G. F.: Regulation of commissural axon pathfinding by slit and its Robo receptors. Annu. Rev. Cell. Dev. Biol., 22, 651-675 (2006)[PubMed]
- Wilson, S. I., Shafer, B., Lee, K. J. et al.: A molecular program for contralateral trajectory: Rig-1 control by LIM homeodomain transcription factors. Neuron, 59, 413-424 (2008)[PubMed]
- Okano, H., Imai, T., Okabe, M.: Musashi: a translational regulator of cell fate. J. Cell. Sci., 115, 1355-1359 (2002)[PubMed]
- Okano, H., Kawahara, H., Toriya, M. et al.: Function of RNA-binding protein Musashi-1 in stem cells. Exp. Cell. Res., 306, 349-356 (2005)[PubMed]
- Imai, T., Tokunaga, A., Yoshida, T. et al.: The neural RNA-binding protein musashi1 translationally regulates mammalian numb. Mol. Cell. Biol., 21, 3888-3900 (2001)[PubMed]
- Bourrat, F. & Sotelo, C.: Migratory pathways and neuritic differentiation of inferior olivary neurons in the rat embryo. Axonal tracing study using the in vitro slab technique. Brain. Res., 467, 19-37 (1988)[PubMed]
- Sabatier, C., Plump, A. S., Le, M. et al.: The divergent Robo family protein rig-1/Robo3 is a negative regulator of slit responsiveness required for midline crossing by commissural axons. Cell, 117, 157-169 (2004)[PubMed]
- Marillat, V., Sabatier, C., Failli, V. et al.: The slit receptor Rig-1/Robo3 controls midline crossing by hindbrain precerebellar neurons and axons. Neuron, 43, 69-79 (2004)[PubMed]
- Jen, J. C., Chan, W. M., Bosley, T. M. et al.: Mutations in a human ROBO gene disrupt hindbrain axon pathway crossing and morphogenesis. Science, 304, 1509-1513 (2004)[PubMed]
著者プロフィール
略歴:2005年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Harvard大学Medical School Children's Hospital Boston研究員を経て,2007年より慶應義塾大学医学部 特別研究助教.
研究テーマ:神経回路の形成機構.
抱負:運動・記憶・学習などの基盤となる精巧な神経回路が形成される過程のさまざまな現象を幅広い視点から解明していきたい.また,神経回路の形成異常と疾患との関連についても明らかにしていきたい.
岡野 栄之(Hideyuki Okano)
慶應義塾大学医学部 教授.
研究室URL:http://www.okano-lab.com/
© 2010 桑子賢一郎・岡野栄之 Licensed under CC 表示 2.1 日本