LMIR3と細胞外のセラミドとの結合はマスト細胞の活性化とアレルギー反応を抑制する
伊沢久未・北村俊雄・北浦次郎
(東京大学医科学研究所 先端医療研究センター細胞療法分野)
email:北浦次郎
DOI: 10.7875/first.author.2012.145
The receptor LMIR3 negatively regulates mast cell activation and allergic responses by binding to extracellular ceramide.
Kumi Izawa, Yoshinori Yamanishi, Akie Maehara, Mariko Takahashi, Masamichi Isobe, Shinichi Ito, Ayako Kaitani, Toshihiro Matsukawa, Takayuki Matsuoka, Fumio Nakahara, Toshihiko Oki, Hiroshi Kiyonari, Takaya Abe, Ko Okumura, Toshio Kitamura, Jiro Kitaura
Immunity, 37, 827-839 (2012)
抗原および免疫グロブリンEにより高親和性免疫グロブリンE受容体が刺激されると,マスト細胞は活性化しアレルギー反応をひき起こす.一方,生体においてアレルギー反応を抑制するしくみは謎であった.LMIR3はペア型免疫受容体のひとつで,ITIMおよびITSMとよばれるアミノ酸配列をもつ抑制型受容体である.LMIR3ノックアウトマウスを作製しそのアレルギー反応を調べたところ,マスト細胞の活性化により起こるアナフィラキシー,気道炎症,皮膚炎が増悪していた.他方,LMIR3の生理的なリガンドとして細胞外のセラミドが同定された.セラミドと結合したLMIR3は高親和性免疫グロブリンE受容体への刺激によりこれと共局在し,ITIMおよびITSMのリン酸化を介しマスト細胞の活性化を抑制した.また,LMIR3と細胞外のセラミドとの結合を阻害すると,野生型マウスにおいて皮膚アナフィラキシー反応が増悪した.これらの結果から,マスト細胞の周囲に存在するセラミドとLMIR3との結合により,マスト細胞の活性化とそれに付随するアレルギー反応が抑制されることが示された.
生体は花粉やダニのような抗原に対して特異的な免疫グロブリンE(IgE)を産生する.産生したIgEは細胞の表面に高親和性IgE受容体をもつマスト細胞と結合する.ふたたび同じ抗原に曝されると,マスト細胞の高親和性IgE受容体は刺激により架橋した構造になる.その結果,マスト細胞は活性化し即時にヒスタミンなどを脱顆粒してアレルギー反応をひき起こす1).一方,生体においてマスト細胞の活性化を抑制するしくみは十分に解明されていなかった.
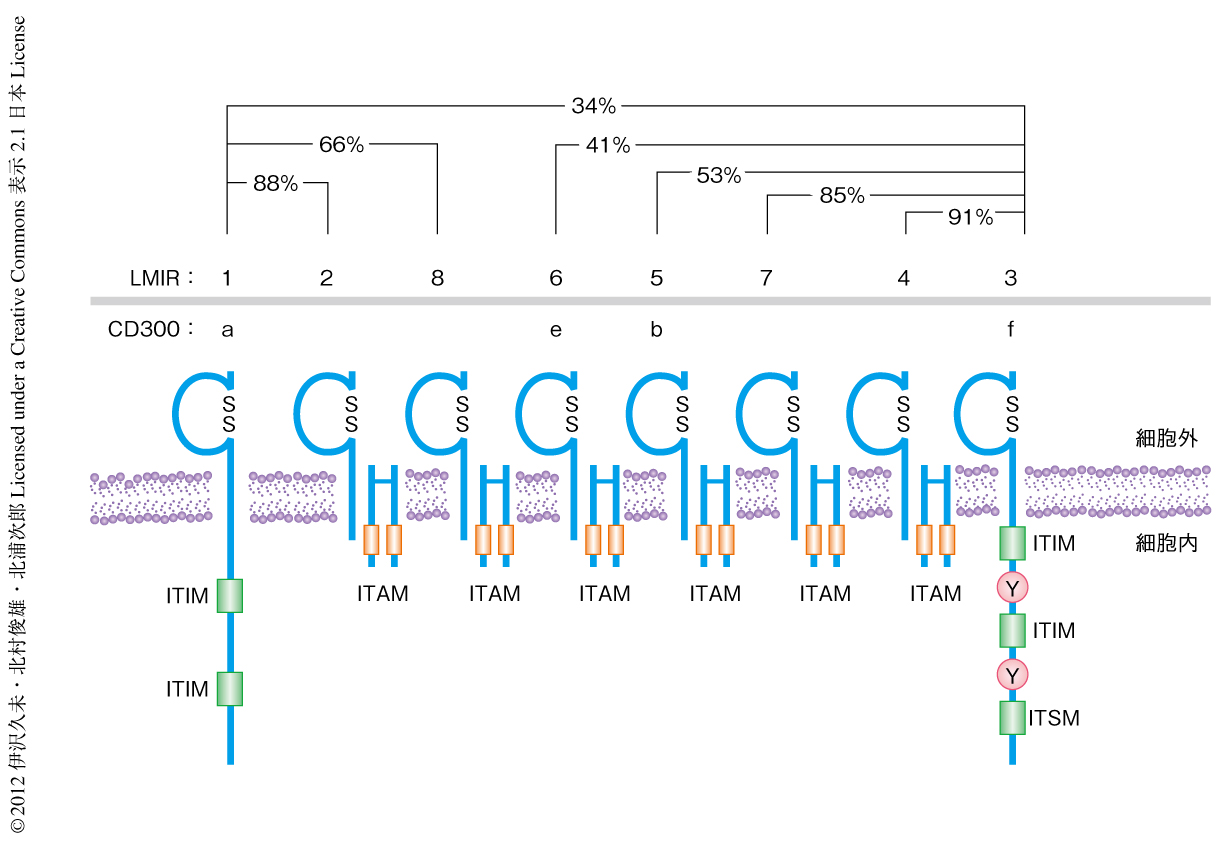
細胞外領域の構造は類似するが正反対の機能(活性化型および抑制型)をもつ受容体をペア型免疫受容体とよぶ.LMIR(leukocyte mono-immunoglobulin-like receptor,白血球単一免疫グロブリン様受容体,別名CD300)は細胞外領域に1個の免疫グロブリン様の構造をもつペア型免疫受容体である.おもにミエロイド系の細胞に発現し,マウスにはLMIR1~LMIR8の少なくとも8種類のLMIRが存在する.LMIR1とLMIR3は抑制型受容体であり,ほかのLMIRは活性化型受容体である2-7)(図1).LMIR3(別名CD300f)は,細胞内領域にITIM(immunoreceptor tyrosine-based inhibitory motif,免疫受容体チロシン依存性抑制モチーフ),および,ITSM(immunoreceptor tyrosine-based switch motif,免疫受容体チロシン依存性スイッチモチーフ)をもつ.この配列にあるチロシン残基がリン酸化されるとチロシンホスファターゼであるSHP-1とSHP-2が動員されて抑制シグナルを伝達する5,6).
筆者らは,これまでの研究により,マウスの骨髄に由来するマスト細胞に発現するLMIR3と高親和性IgE受容体を人工的に架橋すると,LMIR3のもつITIMおよびITSMのリン酸化を介し高親和性IgE受容体からのシグナルが抑制されることを示した5,6).しかし,LMIR3のリガンドは同定されていなかったことから,生体におけるLMIR3の役割は不明であった.
LMIR3の生理的な機能を明らかにするためLMIR3ノックアウトマウスを作製した.LMIR3ノックアウトマウスは野生型マウスと比較して,組織に存在するマスト細胞も含め,血球系の細胞の分化および分布に異常を認めなかった.また,野生型マウスおよびLMIR3ノックアウトマウスからマウスの骨髄に由来するマスト細胞を誘導しても,その分化および増殖に差は認められなかった.マスト細胞をIgEおよび抗原により刺激したときの脱顆粒の指標であるβヘキソサミニダーゼの放出やサイトカインの産生にも差は認められなかった.
野生型マウスおよびLMIR3ノックアウトマウスに対し,マスト細胞の関与するアナフィラィシーのモデル実験を行った.受動的皮膚アナフィラキシー実験では,IgEを耳介に皮下注射してから24時間後に特異的な抗原と色素を静脈注射し,1時間後の耳介における色素の漏出量を測定して,マスト細胞の脱顆粒にともなう血管透過性の亢進を評価する.LMIR3ノックアウトマウスでは受動的皮膚アナフィラキシー実験において色素漏出量の顕著な増加を認めた.LMIR3のもつITIMおよびITSMの役割を明らかにするため,LMIR3の2個のITIMおよび1個のITSMのチロシン残基をフェニルアラニン残基に置換した変異体を作製した.レトロウイルスの感染を利用してLMIR3ノックアウトマウスの骨髄に由来するマスト細胞に野生型LMIR3あるいは変異体LMIR3を発現させたのち,マスト細胞を欠損するKitW-sh/W-shマウスの耳介に生着させて同様の受動的皮膚アナフィラキシー実験を行った.その結果,チロシン残基を置換したLMIR3変異体を発現するマスト細胞を生着させた耳介における色素漏出量は,LMIR3ノックアウトマウスに由来するマスト細胞を生着させた耳介における色素漏出量と同等で,野生型LMIR3を発現するマスト細胞を生着させた耳介における色素漏出量より著しく多かった.以上の結果より,マスト細胞の活性化によるアナフィラキシー反応はLMIR3のもつITIMおよびITSMのリン酸化を介し抑制されることが証明された.
マスト細胞の関与するほかのアレルギー疾患として,アレルギー性の気道炎症モデル,および,皮膚炎のモデルについて調べた.気道炎症モデルでは,アジュバンドなしで卵白アルブミンを免疫したのち卵白アルブミンを経鼻投与し,一定期間ののちに肺胞の洗浄液における炎症細胞の数やサイトカインを測定して気道炎症の程度を評価する.その結果,LMIR3ノックアウトマウスは野生型マウスと比較して気道の炎症が顕著に増悪した.皮膚炎のモデルでは,ダニ抗原を定期的に耳介に塗布しその肥厚を測定する.その結果,LMIR3ノックアウトマウスにおける皮膚炎は野生型マウスと比較して著しく悪化した.これら2つの疾患モデルによる炎症は,マスト細胞を欠損するKitW-sh/W-shマウスでは惹起されないことも確認された.以上の結果より,LMIR3はマスト細胞の関与するアレルギー性気道炎症や皮膚炎を抑制することが明らかになった.
LMIR3の欠損はin vitroにおいて高親和性IgE受容体を介するマスト細胞の活性化に影響しなかったが,in vivoにおいてはマスト細胞の活性化を亢進させた.このことから,LMIR3のリガンドは組織においてマスト細胞の周囲に局在していることが想定された.そこで,野生型マウスの耳介にLMIR3の阻害抗体を皮下注射してから受動的皮膚アナフィラキシー実験を行ったところ,対照となる抗体を投与したときと比較して色素漏出量が増大し,その程度はLMIR3ノックアウトマウスにおける色素漏出量と同じであった.また,LMIR3の阻害抗体の投与はLMIR3ノックアウトマウスにおける色素漏出量には影響を及ぼさなかった.LMIR3の細胞外領域とヒトの免疫グロブリンG1のFc領域を融合させたタンパク質を前投与したとき,野生型マウスの耳介における色素漏出量は対照となるFc領域を前投与したときと比較して増大した.一方,このLMIR3細胞外領域-Fc領域融合タンパク質の前投与により,LMIR3ノックアウトマウスにおける色素漏出量は変化しなかった.LMIR3の阻害抗体あるいはLMIR3細胞外領域-Fc領域融合タンパク質は,マスト細胞のもつLMIR3とその周囲に存在すると想定されるリガンドとの結合を阻害すると考えられるので,LMIR3と生理的なリガンドとの結合はマスト細胞の活性化を抑制することが示唆された.
LMIR3のリガンドを同定するため,LMIR3細胞外領域-Fc領域融合タンパク質を利用して物理的な結合アッセイを行った.また,より機能的なリガンドを同定するため,レポーター細胞株2B4-GFPを利用した8).2B4-GFP細胞株においては,転写因子NFATが活性化するとGFPの発現が誘導される.2B4-GFP細胞株にLMIR3の細胞外領域および膜貫通領域と,ITAM(immunoreceptor tyrosine-based activating motif,免疫受容体チロシン依存性活性化モチーフ)を3個もつヒトCD3ζの細胞内領域とを融合させたキメラ受容体を発現させることにより,2B4-LMIR3-GFP細胞株を作製した.ITAMは活性化シグナルを伝達するので,2B4-LMIR3-GFP細胞株においてLMIR3のリガンドがこのキメラ受容体に結合するとGFPの発現が誘導されると想定した.
抗LMIR3抗体を固相化したプレートにおいて2B4-LMIR3-GFP細胞株を培養しGFPの発現することを確認した.しかし,この2B4-LMIR3-GFP細胞株をさまざまな細胞株と共培養してもGFPは発現しなかった.また,いくつかの細胞外マトリックスタンパク質を固相化したプレートにおいて培養してもGFPは発現しなかった.これらの結果から,細胞の表面に存在するタンパク質や細胞外マトリックスタンパク質がLMIR3のリガンドである可能性は低いと考えた.そこで,細胞外に存在する脂質に注目し,さまざまな脂質やリポタンパク質について調べた9).その結果,固相化したセラミド,スフィンゴシルホスホリルコリン,ホスファチジルコリンなどの脂質,および,低密度リポタンパク質(LDL)や高密度リポタンパク質(HDL)などのリポタンパク質は,LMIR3細胞外領域-Fc領域融合タンパク質と結合すること,かつ,2B4-LMIR3-GFP細胞株においてGFPの発現を誘導することが示された.また,このGFPの発現誘導は阻害抗体としてはたらく抗LMIR3抗体の培養液への添加により抑制された.したがって,さきの脂質あるいはリポタンパク質はLMIR3のリガンド候補分子であると考えた.
これらリガンド候補分子を固相化したプレートにおいて,マウスの骨髄に由来するマスト細胞をIgEおよび抗原により刺激した.マスト細胞の脱顆粒やサイトカインの産生について調べた結果,セラミド,スフィンゴシルホスホリルコリン,リポタンパク質とLMIR3との結合はマスト細胞の活性化を抑制したが,ホスファチジルコリンにはこのような作用はなかった.また,細胞外に存在する脂質であるセラミドと結合したLMIR3は,高親和性IgE受容体をIgEおよび抗原により刺激したところ,ITIMおよびITSMのリン酸化を介しSHP-1およびSHP-2を動員した.また,リポソームに埋め込んだセラミドもLMIR3と結合して高親和性IgE受容体を介するマスト細胞の活性化を抑制した.
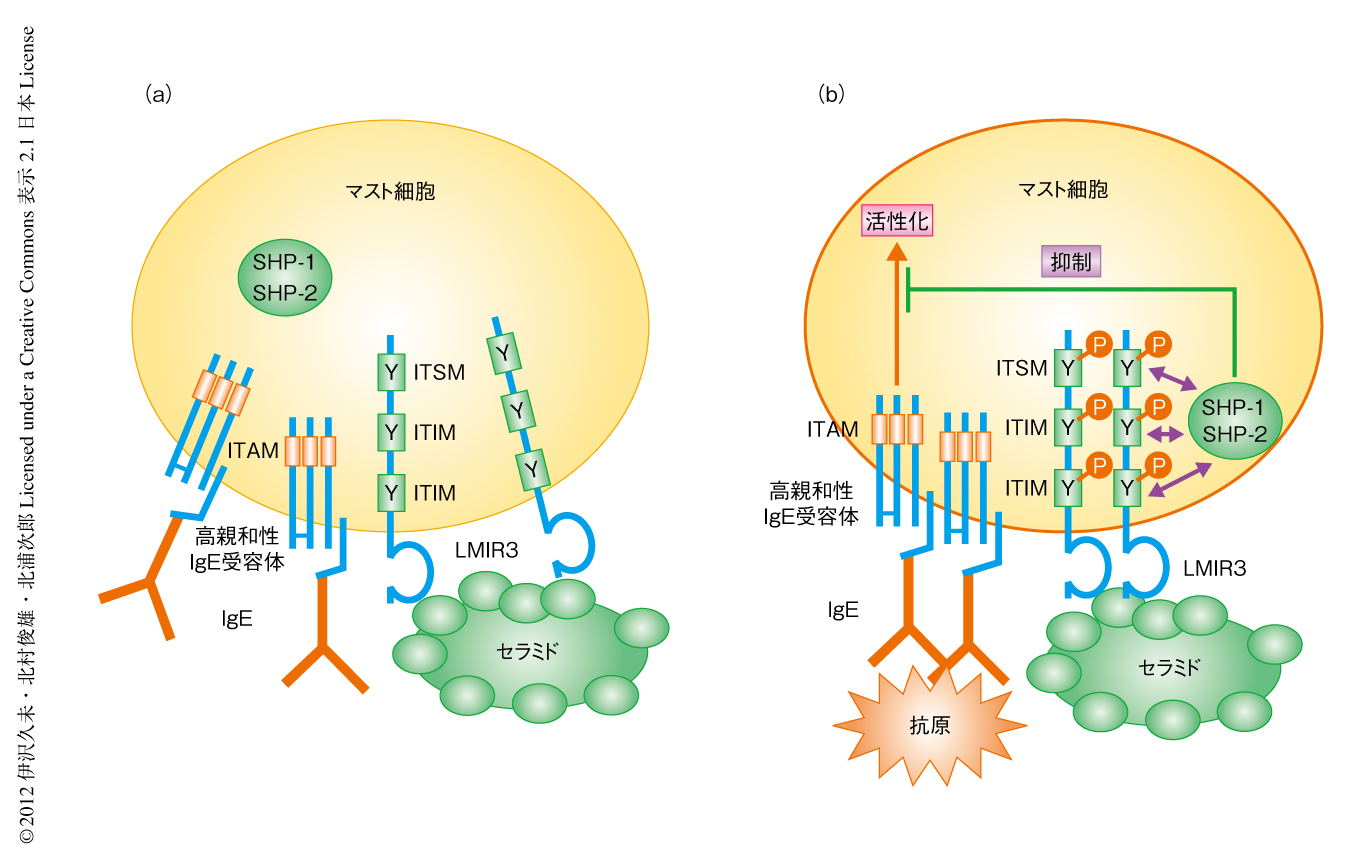
マスト細胞におけるLMIR3および高親和性IgE受容体の局在を調べた.IgEで感作されたマスト細胞の表面に発現するLMIR3と高親和性IgE受容体の局在は必ずしも一致しなかった.セラミドを含むリポソームだけを添加してもこの局在パターンは変わらなかった.しかし,抗原だけを添加したときには高親和性IgE受容体とLMIR3はある程度まで共局在した.他方,セラミドを含むリポソームと抗原をともに添加すると,高親和性IgE受容体とLMIR3は細胞の表面および細胞の内部においてきわめて強く共局在した.以上の結果より,マスト細胞のもつLMIR3と細胞外のセラミドとの結合は高親和性IgE受容体の架橋刺激に際し,LMIR3と高親和性IgE受容体との共局在,LMIR3のもつITIMおよびITSMのリン酸化,さらに,SHP-1およびSHP-2の動員を促しマスト細胞の活性化を抑制すると考えられた.
細胞外におけるセラミドの分布を明らかにするため,各種の組織を抗セラミド抗体により免疫染色した.細胞の内部に存在するセラミドとともに,細胞外組織におけるセラミドの存在が確認された.セラミドは皮膚の上皮において豊富であったが,マスト細胞が局在する真皮にも細胞外脂質として存在していた.注目すべきことに,細胞外のセラミドはしばしばマスト細胞と接触して存在することが明らかになった.また,マウスの皮膚炎を生じた組織では真皮において細胞外のセラミドの量が増える傾向が認められた.
in vivoにおける細胞外のセラミドとLMIR3との結合の生理的な意義を明らかにするため,野生型マウスあるいはLMIR3ノックアウトマウスの耳介にセラミドを含むリポソームあるいは抗セラミド抗体を前投与してから受動的皮膚アナフィラキシー実験を行った.セラミドを含むリポソームの前投与は野生型マウスにおいて受動的皮膚アナフィラキシー反応を減弱させる一方,抗セラミド抗体の前投与はこれを増悪させた.また,これらの前投与はLMIR3ノックアウトマウスにおいて受動的皮膚アナフィラキシー反応に影響を及ぼさなかった.以上の結果より,マスト細胞のもつLMIR3と細胞外のセラミドとの結合は高親和性IgE受容体を介するマスト細胞の活性化およびそれに付随するアレルギー反応を抑制すると結論した(図2).
この研究において,LMIR3はセラミドを認識する抑制型受容体であること,また,マスト細胞のもつLMIR3と細胞外脂質であるセラミドとの結合はマスト細胞の活性化および関連するアレルギー反応を抑制することを証明した.LMIR3のリガンドはホスファチジルセリンであるという報告もあるが10),筆者らの実験系では,ホスファチジルセリンがLMIR3の生理的なリガンドであるという証拠は得られなかった.また,ホスファチジルコリンはレポーター細胞株においてGFPの発現を誘導したにもかかわらず,マスト細胞においてLMIR3のリガンドとして機能しなかった理由は不明であった.マスト細胞の細胞表面の構造(タンパク質あるいは脂質)がLMIR3によるホスファチジルコリンの認識を阻害している可能性が考えられた.リポタンパク質はセラミドを含むいくつかの脂質を含有するが,リポタンパク質とLMIR3との結合による(マスト細胞の活性化の)抑制作用は抗セラミド抗体の添加によりほとんど消失した.したがって,リポタンパク質においてLMIR3のリガンドとして機能する主要な成分はセラミドであると考えられた.また,細胞外のセラミドは炎症ののちの真皮において増加する傾向があるので,LMIR3の抑制機能は慢性炎症のもとにおいてより重要な意味をもつのかもしれない.マスト細胞におけるLMIR3とセラミドとの結合が高親和性IgE受容体の架橋刺激と協調してLMIR3と高親和性IgE受容体との共局在を促進する機序については,さらに詳細な解析が必要である.今後,脂質を利用してLMIR3の抑制機能を強めることが可能になれば,マスト細胞の活性化を抑制する新しいアレルギー薬の開発につながるかもしれない.
順天堂大学医学部 協力研究員.
北村 俊雄(Toshio Kitamura)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/clinical_oncol/
北浦 次郎(Jiro Kitaura)
略歴:2008年 東京大学大学院新領域創成科学研究科にて博士号取得.1996年 東京大学医学部附属病院 助手,1997年 米国La Jolla Institute for Allergy & Immunologyポスドクトルフェローを経て,2004年より東京大学医科学研究所 助手(現 助教).
研究テーマ:ペア型受容体LMIR/CD300ファミリータンパク質の機能解析,マスト細胞とアレルギー.
抱負:アレルギーや炎症を制御する分子機構を明らかにしたい.
© 2012 伊沢久未・北村俊雄・北浦次郎 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 先端医療研究センター細胞療法分野)
email:北浦次郎
DOI: 10.7875/first.author.2012.145
The receptor LMIR3 negatively regulates mast cell activation and allergic responses by binding to extracellular ceramide.
Kumi Izawa, Yoshinori Yamanishi, Akie Maehara, Mariko Takahashi, Masamichi Isobe, Shinichi Ito, Ayako Kaitani, Toshihiro Matsukawa, Takayuki Matsuoka, Fumio Nakahara, Toshihiko Oki, Hiroshi Kiyonari, Takaya Abe, Ko Okumura, Toshio Kitamura, Jiro Kitaura
Immunity, 37, 827-839 (2012)
要 約
抗原および免疫グロブリンEにより高親和性免疫グロブリンE受容体が刺激されると,マスト細胞は活性化しアレルギー反応をひき起こす.一方,生体においてアレルギー反応を抑制するしくみは謎であった.LMIR3はペア型免疫受容体のひとつで,ITIMおよびITSMとよばれるアミノ酸配列をもつ抑制型受容体である.LMIR3ノックアウトマウスを作製しそのアレルギー反応を調べたところ,マスト細胞の活性化により起こるアナフィラキシー,気道炎症,皮膚炎が増悪していた.他方,LMIR3の生理的なリガンドとして細胞外のセラミドが同定された.セラミドと結合したLMIR3は高親和性免疫グロブリンE受容体への刺激によりこれと共局在し,ITIMおよびITSMのリン酸化を介しマスト細胞の活性化を抑制した.また,LMIR3と細胞外のセラミドとの結合を阻害すると,野生型マウスにおいて皮膚アナフィラキシー反応が増悪した.これらの結果から,マスト細胞の周囲に存在するセラミドとLMIR3との結合により,マスト細胞の活性化とそれに付随するアレルギー反応が抑制されることが示された.
はじめに
生体は花粉やダニのような抗原に対して特異的な免疫グロブリンE(IgE)を産生する.産生したIgEは細胞の表面に高親和性IgE受容体をもつマスト細胞と結合する.ふたたび同じ抗原に曝されると,マスト細胞の高親和性IgE受容体は刺激により架橋した構造になる.その結果,マスト細胞は活性化し即時にヒスタミンなどを脱顆粒してアレルギー反応をひき起こす1).一方,生体においてマスト細胞の活性化を抑制するしくみは十分に解明されていなかった.
細胞外領域の構造は類似するが正反対の機能(活性化型および抑制型)をもつ受容体をペア型免疫受容体とよぶ.LMIR(leukocyte mono-immunoglobulin-like receptor,白血球単一免疫グロブリン様受容体,別名CD300)は細胞外領域に1個の免疫グロブリン様の構造をもつペア型免疫受容体である.おもにミエロイド系の細胞に発現し,マウスにはLMIR1~LMIR8の少なくとも8種類のLMIRが存在する.LMIR1とLMIR3は抑制型受容体であり,ほかのLMIRは活性化型受容体である2-7)(図1).LMIR3(別名CD300f)は,細胞内領域にITIM(immunoreceptor tyrosine-based inhibitory motif,免疫受容体チロシン依存性抑制モチーフ),および,ITSM(immunoreceptor tyrosine-based switch motif,免疫受容体チロシン依存性スイッチモチーフ)をもつ.この配列にあるチロシン残基がリン酸化されるとチロシンホスファターゼであるSHP-1とSHP-2が動員されて抑制シグナルを伝達する5,6).
筆者らは,これまでの研究により,マウスの骨髄に由来するマスト細胞に発現するLMIR3と高親和性IgE受容体を人工的に架橋すると,LMIR3のもつITIMおよびITSMのリン酸化を介し高親和性IgE受容体からのシグナルが抑制されることを示した5,6).しかし,LMIR3のリガンドは同定されていなかったことから,生体におけるLMIR3の役割は不明であった.
1.LMIR3ノックアウトマウスではマスト細胞の活性化に依存するアナフィラキシー,気道炎症,皮膚炎が増悪する
LMIR3の生理的な機能を明らかにするためLMIR3ノックアウトマウスを作製した.LMIR3ノックアウトマウスは野生型マウスと比較して,組織に存在するマスト細胞も含め,血球系の細胞の分化および分布に異常を認めなかった.また,野生型マウスおよびLMIR3ノックアウトマウスからマウスの骨髄に由来するマスト細胞を誘導しても,その分化および増殖に差は認められなかった.マスト細胞をIgEおよび抗原により刺激したときの脱顆粒の指標であるβヘキソサミニダーゼの放出やサイトカインの産生にも差は認められなかった.
野生型マウスおよびLMIR3ノックアウトマウスに対し,マスト細胞の関与するアナフィラィシーのモデル実験を行った.受動的皮膚アナフィラキシー実験では,IgEを耳介に皮下注射してから24時間後に特異的な抗原と色素を静脈注射し,1時間後の耳介における色素の漏出量を測定して,マスト細胞の脱顆粒にともなう血管透過性の亢進を評価する.LMIR3ノックアウトマウスでは受動的皮膚アナフィラキシー実験において色素漏出量の顕著な増加を認めた.LMIR3のもつITIMおよびITSMの役割を明らかにするため,LMIR3の2個のITIMおよび1個のITSMのチロシン残基をフェニルアラニン残基に置換した変異体を作製した.レトロウイルスの感染を利用してLMIR3ノックアウトマウスの骨髄に由来するマスト細胞に野生型LMIR3あるいは変異体LMIR3を発現させたのち,マスト細胞を欠損するKitW-sh/W-shマウスの耳介に生着させて同様の受動的皮膚アナフィラキシー実験を行った.その結果,チロシン残基を置換したLMIR3変異体を発現するマスト細胞を生着させた耳介における色素漏出量は,LMIR3ノックアウトマウスに由来するマスト細胞を生着させた耳介における色素漏出量と同等で,野生型LMIR3を発現するマスト細胞を生着させた耳介における色素漏出量より著しく多かった.以上の結果より,マスト細胞の活性化によるアナフィラキシー反応はLMIR3のもつITIMおよびITSMのリン酸化を介し抑制されることが証明された.
マスト細胞の関与するほかのアレルギー疾患として,アレルギー性の気道炎症モデル,および,皮膚炎のモデルについて調べた.気道炎症モデルでは,アジュバンドなしで卵白アルブミンを免疫したのち卵白アルブミンを経鼻投与し,一定期間ののちに肺胞の洗浄液における炎症細胞の数やサイトカインを測定して気道炎症の程度を評価する.その結果,LMIR3ノックアウトマウスは野生型マウスと比較して気道の炎症が顕著に増悪した.皮膚炎のモデルでは,ダニ抗原を定期的に耳介に塗布しその肥厚を測定する.その結果,LMIR3ノックアウトマウスにおける皮膚炎は野生型マウスと比較して著しく悪化した.これら2つの疾患モデルによる炎症は,マスト細胞を欠損するKitW-sh/W-shマウスでは惹起されないことも確認された.以上の結果より,LMIR3はマスト細胞の関与するアレルギー性気道炎症や皮膚炎を抑制することが明らかになった.
LMIR3の欠損はin vitroにおいて高親和性IgE受容体を介するマスト細胞の活性化に影響しなかったが,in vivoにおいてはマスト細胞の活性化を亢進させた.このことから,LMIR3のリガンドは組織においてマスト細胞の周囲に局在していることが想定された.そこで,野生型マウスの耳介にLMIR3の阻害抗体を皮下注射してから受動的皮膚アナフィラキシー実験を行ったところ,対照となる抗体を投与したときと比較して色素漏出量が増大し,その程度はLMIR3ノックアウトマウスにおける色素漏出量と同じであった.また,LMIR3の阻害抗体の投与はLMIR3ノックアウトマウスにおける色素漏出量には影響を及ぼさなかった.LMIR3の細胞外領域とヒトの免疫グロブリンG1のFc領域を融合させたタンパク質を前投与したとき,野生型マウスの耳介における色素漏出量は対照となるFc領域を前投与したときと比較して増大した.一方,このLMIR3細胞外領域-Fc領域融合タンパク質の前投与により,LMIR3ノックアウトマウスにおける色素漏出量は変化しなかった.LMIR3の阻害抗体あるいはLMIR3細胞外領域-Fc領域融合タンパク質は,マスト細胞のもつLMIR3とその周囲に存在すると想定されるリガンドとの結合を阻害すると考えられるので,LMIR3と生理的なリガンドとの結合はマスト細胞の活性化を抑制することが示唆された.
2.マスト細胞におけるLMIR3の生理的なリガンドとしてセラミドを同定した
LMIR3のリガンドを同定するため,LMIR3細胞外領域-Fc領域融合タンパク質を利用して物理的な結合アッセイを行った.また,より機能的なリガンドを同定するため,レポーター細胞株2B4-GFPを利用した8).2B4-GFP細胞株においては,転写因子NFATが活性化するとGFPの発現が誘導される.2B4-GFP細胞株にLMIR3の細胞外領域および膜貫通領域と,ITAM(immunoreceptor tyrosine-based activating motif,免疫受容体チロシン依存性活性化モチーフ)を3個もつヒトCD3ζの細胞内領域とを融合させたキメラ受容体を発現させることにより,2B4-LMIR3-GFP細胞株を作製した.ITAMは活性化シグナルを伝達するので,2B4-LMIR3-GFP細胞株においてLMIR3のリガンドがこのキメラ受容体に結合するとGFPの発現が誘導されると想定した.
抗LMIR3抗体を固相化したプレートにおいて2B4-LMIR3-GFP細胞株を培養しGFPの発現することを確認した.しかし,この2B4-LMIR3-GFP細胞株をさまざまな細胞株と共培養してもGFPは発現しなかった.また,いくつかの細胞外マトリックスタンパク質を固相化したプレートにおいて培養してもGFPは発現しなかった.これらの結果から,細胞の表面に存在するタンパク質や細胞外マトリックスタンパク質がLMIR3のリガンドである可能性は低いと考えた.そこで,細胞外に存在する脂質に注目し,さまざまな脂質やリポタンパク質について調べた9).その結果,固相化したセラミド,スフィンゴシルホスホリルコリン,ホスファチジルコリンなどの脂質,および,低密度リポタンパク質(LDL)や高密度リポタンパク質(HDL)などのリポタンパク質は,LMIR3細胞外領域-Fc領域融合タンパク質と結合すること,かつ,2B4-LMIR3-GFP細胞株においてGFPの発現を誘導することが示された.また,このGFPの発現誘導は阻害抗体としてはたらく抗LMIR3抗体の培養液への添加により抑制された.したがって,さきの脂質あるいはリポタンパク質はLMIR3のリガンド候補分子であると考えた.
これらリガンド候補分子を固相化したプレートにおいて,マウスの骨髄に由来するマスト細胞をIgEおよび抗原により刺激した.マスト細胞の脱顆粒やサイトカインの産生について調べた結果,セラミド,スフィンゴシルホスホリルコリン,リポタンパク質とLMIR3との結合はマスト細胞の活性化を抑制したが,ホスファチジルコリンにはこのような作用はなかった.また,細胞外に存在する脂質であるセラミドと結合したLMIR3は,高親和性IgE受容体をIgEおよび抗原により刺激したところ,ITIMおよびITSMのリン酸化を介しSHP-1およびSHP-2を動員した.また,リポソームに埋め込んだセラミドもLMIR3と結合して高親和性IgE受容体を介するマスト細胞の活性化を抑制した.
マスト細胞におけるLMIR3および高親和性IgE受容体の局在を調べた.IgEで感作されたマスト細胞の表面に発現するLMIR3と高親和性IgE受容体の局在は必ずしも一致しなかった.セラミドを含むリポソームだけを添加してもこの局在パターンは変わらなかった.しかし,抗原だけを添加したときには高親和性IgE受容体とLMIR3はある程度まで共局在した.他方,セラミドを含むリポソームと抗原をともに添加すると,高親和性IgE受容体とLMIR3は細胞の表面および細胞の内部においてきわめて強く共局在した.以上の結果より,マスト細胞のもつLMIR3と細胞外のセラミドとの結合は高親和性IgE受容体の架橋刺激に際し,LMIR3と高親和性IgE受容体との共局在,LMIR3のもつITIMおよびITSMのリン酸化,さらに,SHP-1およびSHP-2の動員を促しマスト細胞の活性化を抑制すると考えられた.
3.マスト細胞のもつLMIR3と細胞外のセラミドとの結合による受動的皮膚アナフィラキシー反応の抑制
細胞外におけるセラミドの分布を明らかにするため,各種の組織を抗セラミド抗体により免疫染色した.細胞の内部に存在するセラミドとともに,細胞外組織におけるセラミドの存在が確認された.セラミドは皮膚の上皮において豊富であったが,マスト細胞が局在する真皮にも細胞外脂質として存在していた.注目すべきことに,細胞外のセラミドはしばしばマスト細胞と接触して存在することが明らかになった.また,マウスの皮膚炎を生じた組織では真皮において細胞外のセラミドの量が増える傾向が認められた.
in vivoにおける細胞外のセラミドとLMIR3との結合の生理的な意義を明らかにするため,野生型マウスあるいはLMIR3ノックアウトマウスの耳介にセラミドを含むリポソームあるいは抗セラミド抗体を前投与してから受動的皮膚アナフィラキシー実験を行った.セラミドを含むリポソームの前投与は野生型マウスにおいて受動的皮膚アナフィラキシー反応を減弱させる一方,抗セラミド抗体の前投与はこれを増悪させた.また,これらの前投与はLMIR3ノックアウトマウスにおいて受動的皮膚アナフィラキシー反応に影響を及ぼさなかった.以上の結果より,マスト細胞のもつLMIR3と細胞外のセラミドとの結合は高親和性IgE受容体を介するマスト細胞の活性化およびそれに付随するアレルギー反応を抑制すると結論した(図2).
おわりに
この研究において,LMIR3はセラミドを認識する抑制型受容体であること,また,マスト細胞のもつLMIR3と細胞外脂質であるセラミドとの結合はマスト細胞の活性化および関連するアレルギー反応を抑制することを証明した.LMIR3のリガンドはホスファチジルセリンであるという報告もあるが10),筆者らの実験系では,ホスファチジルセリンがLMIR3の生理的なリガンドであるという証拠は得られなかった.また,ホスファチジルコリンはレポーター細胞株においてGFPの発現を誘導したにもかかわらず,マスト細胞においてLMIR3のリガンドとして機能しなかった理由は不明であった.マスト細胞の細胞表面の構造(タンパク質あるいは脂質)がLMIR3によるホスファチジルコリンの認識を阻害している可能性が考えられた.リポタンパク質はセラミドを含むいくつかの脂質を含有するが,リポタンパク質とLMIR3との結合による(マスト細胞の活性化の)抑制作用は抗セラミド抗体の添加によりほとんど消失した.したがって,リポタンパク質においてLMIR3のリガンドとして機能する主要な成分はセラミドであると考えられた.また,細胞外のセラミドは炎症ののちの真皮において増加する傾向があるので,LMIR3の抑制機能は慢性炎症のもとにおいてより重要な意味をもつのかもしれない.マスト細胞におけるLMIR3とセラミドとの結合が高親和性IgE受容体の架橋刺激と協調してLMIR3と高親和性IgE受容体との共局在を促進する機序については,さらに詳細な解析が必要である.今後,脂質を利用してLMIR3の抑制機能を強めることが可能になれば,マスト細胞の活性化を抑制する新しいアレルギー薬の開発につながるかもしれない.
文 献
- Kawakami, T., & Galli, S. J.: Regulation of mast-cell and basophil function and survival by IgE. Nat. Rev. Immunol., 2, 773-786 (2002)[PubMed]
- Chung, D. H., Humphrey, M. B., Nakamura, M. C. et al.: CMRF-35-like molecule-1, a novel mouse myeloid receptor, can inhibit osteoclast formation. J. Immunol., 171, 6541-6548 (2003)[PubMed]
- Kumagai, H., Oki, T., Tamitsu, K., Feng, S. Z. et al.: Identification and characterization of a new pair of immunoglobulin-like receptors LMIR1 and 2 derived from murine bone marrow derived mast cells. Biochem. Biophys. Res. Commun., 307, 719-729 (2003)[PubMed]
- Yotsumoto, K., Okoshi, Y., Shibuya, K. et al.: Paired activating and inhibitory immunoglobulin-like receptors, MAIR-I and MAIR-II, regulate mast cell and macrophage activation. J. Exp. Med., 198, 223-233 (2003)[PubMed]
- Izawa, K., Kitaura, J., Yamanishi, Y. et al.: Functional analysis of activating receptor LMIR4 as a counterpart of inhibitory receptor LMIR3. J. Biol. Chem., 282, 17997-18008 (2007)[PubMed]
- Izawa, K., Kitaura, J., Yamanishi, Y. et al.: An activating and inhibitory signal from an inhibitory receptor LMIR3/CLM-1: LMIR3 augments lipopolysaccharide response through association with FcRγ in mast cells. J. Immunol., 183, 925-936 (2009)[PubMed]
- Yamanishi, Y., Kitaura, J., Izawa, K. et al.: TIM1 is an endogenous ligand for LMIR5/CD300b: LMIR5 deficiency ameliorates mouse kidney ischemia/reperfusion injury. J. Exp. Med., 207, 1501-1511 (2010)[PubMed]
- Ohtsuka, M., Arase, H., Takeuchi, A. et al.: NFAM1, an immunoreceptor tyrosine-based activation motif-bearing molecule that regulates B cell development and signaling. Proc. Natl. Acad. Sci. USA, 101, 8126-8131 (2004)[PubMed]
- Zheng, W., Kollmeyer, J., Symolon, H. et al.: Ceramides and other bioactive sphingolipid backbones in health and disease: lipidomic analysis, metabolism and roles in membrane structure, dynamics, signaling and autophagy. Biochim. Biophys. Acta, 1758, 1864-1884 (2006)[PubMed]
- Choi, S. C., Simhadri, V. R., Tian, L. et al.: Cutting edge: mouse CD300f (CMRF-35-like molecule-1) recognizes outer membrane-exposed phosphatidylserine and can promote phagocytosis. J. Immunol., 187, 3483-3487 (2011)[PubMed]
著者プロフィール
順天堂大学医学部 協力研究員.
北村 俊雄(Toshio Kitamura)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/clinical_oncol/
北浦 次郎(Jiro Kitaura)
略歴:2008年 東京大学大学院新領域創成科学研究科にて博士号取得.1996年 東京大学医学部附属病院 助手,1997年 米国La Jolla Institute for Allergy & Immunologyポスドクトルフェローを経て,2004年より東京大学医科学研究所 助手(現 助教).
研究テーマ:ペア型受容体LMIR/CD300ファミリータンパク質の機能解析,マスト細胞とアレルギー.
抱負:アレルギーや炎症を制御する分子機構を明らかにしたい.
© 2012 伊沢久未・北村俊雄・北浦次郎 Licensed under CC 表示 2.1 日本