kelchリピートタンパク質KLHDC10はPP5の抑制を介し酸化ストレスに依存的なASK1の活性化を制御する
関根悠介・一條秀憲
(東京大学大学院薬学系研究科 細胞情報学教室)
email:関根悠介,一條秀憲
DOI: 10.7875/first.author.2012.143
The kelch repeat protein KLHDC10 regulates oxidative stress-induced ASK1 activation by suppressing PP5.
Yusuke Sekine, Ryo Hatanaka, Takeshi Watanabe, Naoki Sono, Shun-ichiro Iemura, Tohru Natsume, Erina Kuranaga, Masayuki Miura, Kohsuke Takeda, Hidenori Ichijo
Molecular Cell, 48, 692-704 (2012)
酸化ストレスによりひき起こされる細胞死はヒトのさまざまな疾患の病態に関与している.しかしながら,その細胞死の誘導の分子機構に関しては未解明な部分が残されている.活性酸素種によるASK1の活性化は酸化ストレスにより誘導される細胞死において重要な役割をはたしている.今回,筆者らは,ショウジョウバエの遺伝子発現系を用いたスクリーニングにより,新たなASK1活性化タンパク質としてkelchリピートタンパク質KLHDC10を同定した.さらに,KLHDC10の結合タンパク質としてPP5を同定した.PP5は活性酸素種に依存的にASK1と結合し,ASK1を脱リン酸化して不活性化することが知られている.KLHDC10はPP5のもつホスファターゼドメインと結合し,その脱リン酸化活性を抑制した.さらに,KLHDC10は過酸化水素による刺激に依存したASK1の持続的な活性化ならびに細胞死に必要であった.これらの結果より,KLHDC10はPP5の抑制を介し活性酸素種に依存したASK1の持続的な活性化を可能にし,酸化ストレスのもとでの細胞死の誘導に寄与していることが示唆された.
活性酸素種はミトコンドリアにおける電子伝達系など細胞においてさまざまな代謝の過程に付随し発生する.また,紫外線や放射線,抗がん剤,病原体など,外部の環境からの侵入物も生体における活性酸素種の産生の原因となる.細胞のもつ抗酸化システムの許容範囲をこえて発生した過剰な活性酸素種はタンパク質,脂質,核酸などの生体分子を非特異的に酸化し,細胞の機能維持機構を破綻させ死にいたらしめる.酸化ストレスにより誘導される細胞死は神経変性疾患や虚血性心疾患などヒトのさまざまな疾患の病態に関与していることが知られている.しかしながら,酸化ストレスによりいかにして細胞死が誘導されるかという分子機構については依然として不明な点も多い.
MAPキナーゼ経路は細胞の内外のさまざまな環境変化に応答する細胞内シグナル伝達経路である.ASK1(apoptosis signal-regulating kinase 1)はその最上流に位置するMAPキナーゼキナーゼキナーゼファミリータンパク質であり,酸化ストレス,小胞体ストレス,浸透圧ストレスなど,さまざまなストレスに応答して活性化し,下流のJNK経路ならびにp38 MAPキナーゼ経路を活性化して細胞死や炎症応答などの細胞応答を誘導する1).なかでも,酸化ストレスを惹起する活性酸素種はASK1の強い活性化剤であり,ASK1ノックアウトマウスやそこから単離した細胞を用いた実験などにより,酸化ストレスにより誘導される細胞死にASK1の必要であることが明らかになっている2,3).これまでの研究から酸化ストレスに依存的なASK1の活性化の分子機構は徐々に明らかになってきた.ASK1は定常状態においては抗酸化タンパク質であるチオレドキシンと複合体を形成しその活性が抑制されている.活性酸素種の発生にともないチオレドキシンが酸化されるとASK1から解離し,それと相反してTRAFファミリータンパク質であるTRAF2やTRAF6がASK1と結合する.これによりASK1のもつキナーゼドメインにある活性に必須のスレオニン残基の自己リン酸化が促進されることでASK1は活性化する.この機構は活性酸素種の発生をシグナル伝達系の活性化へと変換する分子スイッチとしての機能をはたしているものと考えられている1).
一方,ASK1の負の制御機構として,PP5(protein phosphatase 5)による脱リン酸化機構,および,ユビキチン-プロテアソーム系を介したタンパク質分解機構の存在することが明らかになっている4,5).近年,筆者らは,酸化ストレスに依存的なASK1結合タンパク質として脱ユビキチン化酵素USP9Xを同定した5).USP9Xは酸化ストレスに依存的にASK1に付加されるユビキチン鎖を切断することにより,活性化したASK1の安定化に寄与している.さらに,このことよりもたらされるASK1の持続的な活性化は酸化ストレスに依存的な細胞死に重要であることが示唆された.これらの知見より,酸化ストレスの発生に対し,ASK1活性化のオンオフだけでなく,ASK1活性の持続時間の制御が誘導される細胞応答を決定する重要なファクターとなっている可能性が提示された.今回,筆者らは,ショウジョウバエを用いた遺伝学的なスクリーニングにより,より幅広くASK1の活性化タンパク質を探索することにより,ASK1の活性制御機構のさらなる解明をめざした.
筆者らはこれまでに,ショウジョウバエにおけるASK1のオルソログであるDASK1の恒常活性化変異体をショウジョウバエの背側の正中線領域において発現させると,胸部のDASK1の発現領域において異所性のメラニンの蓄積という表現型の現われることを見い出していた6).このメラニンの蓄積はショウジョウバエのp38 MAPキナーゼ経路を構成するタンパク質をノックダウンすることにより抑制されたことから,DASK1-p38 MAPキナーゼ経路に依存的であることが明らかになった.そこで,このメラニンの蓄積の表現型をショウジョウバエ個体におけるDASK1-p38 MAPキナーゼ経路の活性化の指標としてとらえ,DASK1を活性化するタンパク質であればメラニンの蓄積を誘導できるはずだという予想のもと,異所性の遺伝子発現系を用いたスクリーニング系を構築した.
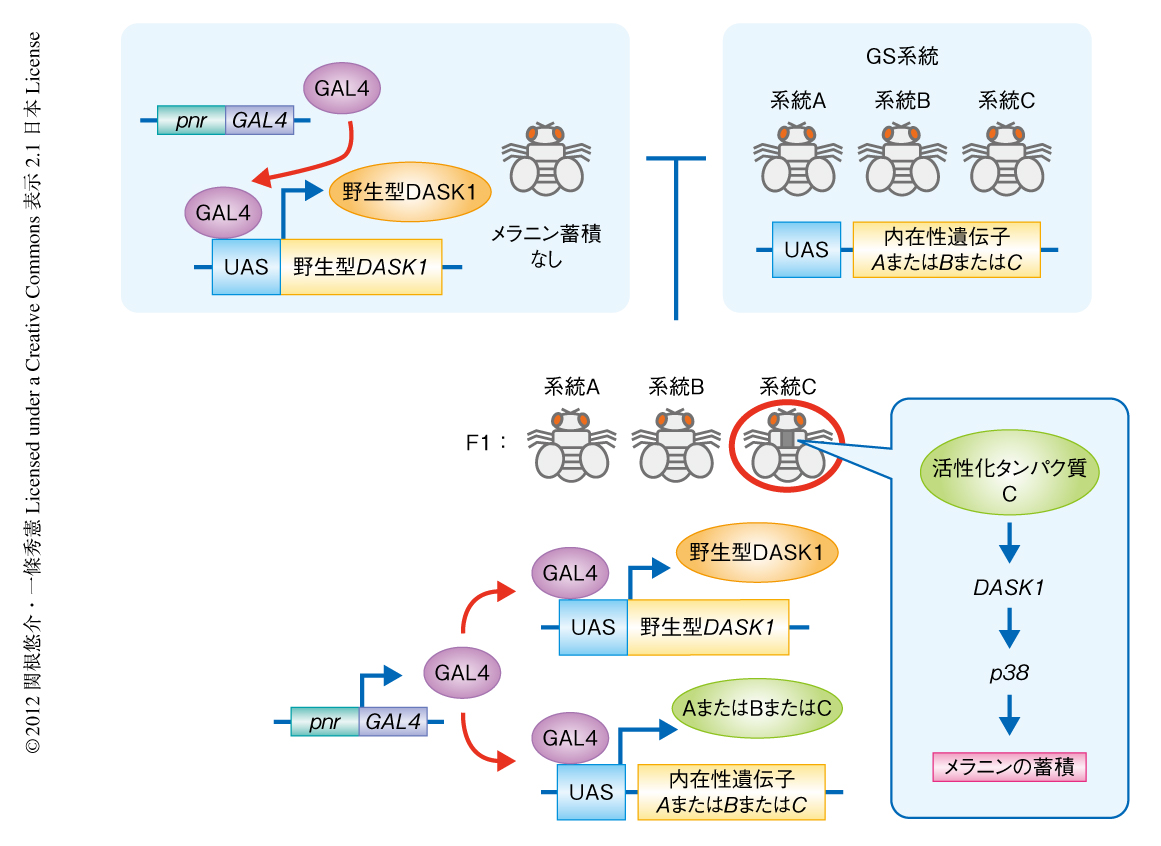
GS系統は,UAS配列を含むベクター(GSベクター)が系統ごとにランダムにゲノムに挿入されることにより,GSベクターの下流に存在する内在性の遺伝子の転写因子GAL4に依存的な発現の誘導が可能なショウジョウバエの変異体の系統である7).このGS系統ライブラリーを用いて,背側の正中線領域において,単独の発現ではメラニンの蓄積を誘導できない野生型のDASK1とともに内在性の遺伝子をランダムに過剰発現させたとき,DASK1を活性化してメラニンの蓄積を誘導できる遺伝子を探索した(図1).約4500系統をスクリーニングした結果,メラニンの蓄積を誘導する9つの系統を同定した.このうち,最初にみつけた系統においてslim(scruin like at the midline)遺伝子の発現が確認された.Slimの発現によるメラニンの蓄積はDASK1のノックダウンやp38のドミナントネガティブ体の共発現により抑制されたことから,DASK1-p38 MAPキナーゼ経路に依存的であることが明らかになった.
実際にslim遺伝子をクローニングしS2細胞においてDASK1と共発現させると,Slimの共発現に依存的なDASK1の活性化が観察された.SlimのヒトオルソログであるKLHDC10(kelch domain containing 10)も,HEK293細胞においてDASK1のヒトオルソログであるASK1と共発現させるとASK1を活性化した.よって,SlimおよびKLHDC10は種をこえて保存されたASK1活性化タンパク質であることが明らかになった.
では,KLHDC10はどのようにASK1の活性化に寄与しているのだろうか.SlimもKLHDC10もその機能はまったく未知のタンパク質であったが,1次配列の情報からkelchリピートドメインというくり返し構造をもつkelchリピートタンパク質ファミリーに属することがわかっていた.kelchリピートドメインは立体構造としてkelchモチーフとよばれるβシート構造を構成単位とするプロペラ様の構造をとり,タンパク質-タンパク質相互作用に重要なドメインであることが知られている8).そこで,KLHDC10を用いたプルダウン解析によりKLHDC10と結合するタンパク質を探索したところ,ユビキチンリガーゼ複合体として知られるCullin2複合体の構成タンパク質の複数が同定された.さらに解析を進めている過程で,Cullin2やそのアダプタータンパク質であるElongin Bを用いた網羅的なプルダウン解析により,KLHDC10を含むkelchリピートファミリータンパク質はCullin2複合体やほかのCullin複合体の基質特異性を決定する基質認識タンパク質であることを示唆する報告がなされた9,10).実際に,KLHDC10のC末端領域にはCullin2複合体との結合に重要なコンセンサス配列(Cul2ボックス配列およびBCボックス配列)が存在し,それらの配列を欠損した変異体や配列に点変異を導入した変異体ではCullin2複合体との結合がみられなくなったことから,KLHDC10はCullin2複合体の基質認識タンパク質であることが示唆された.
これらの結果より,KLHDC10がASK1を活性化する分子機構として,Cullin2-KLHDC10複合体がなんらかのASK1抑制タンパク質をユビキチン化し分解している可能性が想定された.しかしながら予想に反し,Cullin2と結合できないKLHDC10変異体でも共発現したASK1を活性化したことから,KLHDC10によるASK1の活性化はCullin2複合体に非依存的であることが示唆された.
一方で,Cullin2と結合できないKLHDC10変異体を用いてプルダウン解析を行った結果,結合タンパク質のひとつとして脱リン酸化酵素PP5が同定された.さきに述べたように,筆者らは以前,PP5をASK1の結合タンパク質として同定し,活性酸素種により活性化したASK1をPP5が脱リン酸化することにより不活性化することを報告していたことから,KLHDC10がASK1を活性化する機構として,PP5の機能抑制を介しているのではないかと仮説をたてた.
PP5は立体構造の解析から,N末端側に存在するTPRドメインがC末端側にあるホスファターゼドメインの酵素活性中心をマスクしており,その結果,定常状態では脱リン酸化活性は低く保たれていることが知られている11).PP5の部分欠失変異体を用いてKLHDC10とPP5との結合領域を検討した結果,KLHDC10はPP5のホスファターゼドメインを含む領域と結合することが明らかになった.そこで,PP5の脱リン酸化活性に対するKLHDC10の影響を検討した.PP5の組換えタンパク質を用いたin vitro脱リン酸化アッセイにより,PP5のアラキドン酸に依存的な活性化はKLHDC10の存在により抑制されることが明らかになった.さらに,ASK1とPP5とは酸化ストレスに依存的に結合することから,KLHDC10とPP5との酸化ストレスに依存的な結合を検討した結果,この結合はH2O2による刺激に依存的に増強することが明らかになった.
これらの結果を総合して考えると,KLHDC10は酸化ストレスに依存的にPP5のホスファターゼドメインに結合しその活性を抑制していることが示唆された.活性酸素種に依存してどのようにKLHDC10とPP5との結合が誘導されているのかは今後の検討課題だが,活性酸素種によりPP5になんらかの構造変化が起こり,ホスファターゼドメインが露出してKLHDC10との結合が誘導されている可能性も考えられる.
活性酸素種に依存的なASK1の活性化に対するKLHDC10の必要性を検討した.マウスの神経芽腫に由来するNeuro2A細胞においてKLHDC10をノックダウンすると,H2O2による刺激に依存的なASK1の活性化が,とくに刺激ののち60分以降の遅い経時変化において顕著に減弱した.このASK1活性化の減弱はKLHDC10のノックダウンにより活性化したPP5により起こっているのかどうか検討するため,KLHDC10とPP5をダブルノックダウンしたところ,H2O2による刺激に依存したASK1の持続的な活性化は回復した.さらに,酸化ストレスに依存的な細胞死に対するKLHDC10の影響を検討した結果,KLHDC10のノックダウンによりH2O2による刺激に依存的なNeuro2A細胞の細胞死は抑制され,この細胞死の抑制もPP5とのダブルノックダウンにより回復した.よって,KLHDC10はPP5の抑制を介し酸化ストレスに依存したASK1の持続的な活性化を誘導することにより,細胞死に寄与していることが示唆された(図2).
今回,明らかにされたKLHDC10によるPP5の阻害機構が,さきに述べた,脱ユビキチン化酵素USP9XによるASK1の安定化機構とともにはたらくことにより,活性酸素種に依存したASK1の持続的な活性化を可能にし,最終的には細胞死を誘導していることが予想された.しかし,これら2つの機構がどのように協調して機能しているのか,あるいは,ストレスの状況や細胞環境により使い分けがなされているのかは,まだ明らかになっていない.ASK1というひとつのシグナルタンパク質の活性化を詳細につきつめていくことにより,多くの制御タンパク質により厳密に制御されたシグナル伝達の制御機構の実体が明らかになってきた.このような多段階にわたる活性制御が時空間的にどのように制御されているのか,そのダイナミクスをいかにとらえていくかが,今後の重要な課題である.くわえて,持続的なASK1の活性化がどのような機構により細胞死を誘導しているのか,また,KLHDC10とPP5との相互作用を介したASK1の活性制御が生体においていかなる局面で起こっているのか,なども明らかにしていきたいと考えている.
略歴:2010年 東京大学大学院薬学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より同 助教.
研究テーマ:ストレス応答性のシグナル伝達機構.
関心事:さまざまなストレスの受容と認識の分子機構や,シグナル伝達の時空間的な制御機構を明らかにしていきたい.
一條 秀憲(Hidenori Ichijo)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~toxicol/index.html
© 2012 関根悠介・一條秀憲 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 細胞情報学教室)
email:関根悠介,一條秀憲
DOI: 10.7875/first.author.2012.143
The kelch repeat protein KLHDC10 regulates oxidative stress-induced ASK1 activation by suppressing PP5.
Yusuke Sekine, Ryo Hatanaka, Takeshi Watanabe, Naoki Sono, Shun-ichiro Iemura, Tohru Natsume, Erina Kuranaga, Masayuki Miura, Kohsuke Takeda, Hidenori Ichijo
Molecular Cell, 48, 692-704 (2012)
要 約
酸化ストレスによりひき起こされる細胞死はヒトのさまざまな疾患の病態に関与している.しかしながら,その細胞死の誘導の分子機構に関しては未解明な部分が残されている.活性酸素種によるASK1の活性化は酸化ストレスにより誘導される細胞死において重要な役割をはたしている.今回,筆者らは,ショウジョウバエの遺伝子発現系を用いたスクリーニングにより,新たなASK1活性化タンパク質としてkelchリピートタンパク質KLHDC10を同定した.さらに,KLHDC10の結合タンパク質としてPP5を同定した.PP5は活性酸素種に依存的にASK1と結合し,ASK1を脱リン酸化して不活性化することが知られている.KLHDC10はPP5のもつホスファターゼドメインと結合し,その脱リン酸化活性を抑制した.さらに,KLHDC10は過酸化水素による刺激に依存したASK1の持続的な活性化ならびに細胞死に必要であった.これらの結果より,KLHDC10はPP5の抑制を介し活性酸素種に依存したASK1の持続的な活性化を可能にし,酸化ストレスのもとでの細胞死の誘導に寄与していることが示唆された.
はじめに
活性酸素種はミトコンドリアにおける電子伝達系など細胞においてさまざまな代謝の過程に付随し発生する.また,紫外線や放射線,抗がん剤,病原体など,外部の環境からの侵入物も生体における活性酸素種の産生の原因となる.細胞のもつ抗酸化システムの許容範囲をこえて発生した過剰な活性酸素種はタンパク質,脂質,核酸などの生体分子を非特異的に酸化し,細胞の機能維持機構を破綻させ死にいたらしめる.酸化ストレスにより誘導される細胞死は神経変性疾患や虚血性心疾患などヒトのさまざまな疾患の病態に関与していることが知られている.しかしながら,酸化ストレスによりいかにして細胞死が誘導されるかという分子機構については依然として不明な点も多い.
MAPキナーゼ経路は細胞の内外のさまざまな環境変化に応答する細胞内シグナル伝達経路である.ASK1(apoptosis signal-regulating kinase 1)はその最上流に位置するMAPキナーゼキナーゼキナーゼファミリータンパク質であり,酸化ストレス,小胞体ストレス,浸透圧ストレスなど,さまざまなストレスに応答して活性化し,下流のJNK経路ならびにp38 MAPキナーゼ経路を活性化して細胞死や炎症応答などの細胞応答を誘導する1).なかでも,酸化ストレスを惹起する活性酸素種はASK1の強い活性化剤であり,ASK1ノックアウトマウスやそこから単離した細胞を用いた実験などにより,酸化ストレスにより誘導される細胞死にASK1の必要であることが明らかになっている2,3).これまでの研究から酸化ストレスに依存的なASK1の活性化の分子機構は徐々に明らかになってきた.ASK1は定常状態においては抗酸化タンパク質であるチオレドキシンと複合体を形成しその活性が抑制されている.活性酸素種の発生にともないチオレドキシンが酸化されるとASK1から解離し,それと相反してTRAFファミリータンパク質であるTRAF2やTRAF6がASK1と結合する.これによりASK1のもつキナーゼドメインにある活性に必須のスレオニン残基の自己リン酸化が促進されることでASK1は活性化する.この機構は活性酸素種の発生をシグナル伝達系の活性化へと変換する分子スイッチとしての機能をはたしているものと考えられている1).
一方,ASK1の負の制御機構として,PP5(protein phosphatase 5)による脱リン酸化機構,および,ユビキチン-プロテアソーム系を介したタンパク質分解機構の存在することが明らかになっている4,5).近年,筆者らは,酸化ストレスに依存的なASK1結合タンパク質として脱ユビキチン化酵素USP9Xを同定した5).USP9Xは酸化ストレスに依存的にASK1に付加されるユビキチン鎖を切断することにより,活性化したASK1の安定化に寄与している.さらに,このことよりもたらされるASK1の持続的な活性化は酸化ストレスに依存的な細胞死に重要であることが示唆された.これらの知見より,酸化ストレスの発生に対し,ASK1活性化のオンオフだけでなく,ASK1活性の持続時間の制御が誘導される細胞応答を決定する重要なファクターとなっている可能性が提示された.今回,筆者らは,ショウジョウバエを用いた遺伝学的なスクリーニングにより,より幅広くASK1の活性化タンパク質を探索することにより,ASK1の活性制御機構のさらなる解明をめざした.
1.ショウジョウバエの遺伝子発現スクリーニングによるASK1活性化タンパク質の探索と同定
筆者らはこれまでに,ショウジョウバエにおけるASK1のオルソログであるDASK1の恒常活性化変異体をショウジョウバエの背側の正中線領域において発現させると,胸部のDASK1の発現領域において異所性のメラニンの蓄積という表現型の現われることを見い出していた6).このメラニンの蓄積はショウジョウバエのp38 MAPキナーゼ経路を構成するタンパク質をノックダウンすることにより抑制されたことから,DASK1-p38 MAPキナーゼ経路に依存的であることが明らかになった.そこで,このメラニンの蓄積の表現型をショウジョウバエ個体におけるDASK1-p38 MAPキナーゼ経路の活性化の指標としてとらえ,DASK1を活性化するタンパク質であればメラニンの蓄積を誘導できるはずだという予想のもと,異所性の遺伝子発現系を用いたスクリーニング系を構築した.
GS系統は,UAS配列を含むベクター(GSベクター)が系統ごとにランダムにゲノムに挿入されることにより,GSベクターの下流に存在する内在性の遺伝子の転写因子GAL4に依存的な発現の誘導が可能なショウジョウバエの変異体の系統である7).このGS系統ライブラリーを用いて,背側の正中線領域において,単独の発現ではメラニンの蓄積を誘導できない野生型のDASK1とともに内在性の遺伝子をランダムに過剰発現させたとき,DASK1を活性化してメラニンの蓄積を誘導できる遺伝子を探索した(図1).約4500系統をスクリーニングした結果,メラニンの蓄積を誘導する9つの系統を同定した.このうち,最初にみつけた系統においてslim(scruin like at the midline)遺伝子の発現が確認された.Slimの発現によるメラニンの蓄積はDASK1のノックダウンやp38のドミナントネガティブ体の共発現により抑制されたことから,DASK1-p38 MAPキナーゼ経路に依存的であることが明らかになった.
2.Slim/KLHDC10はASK1を活性化する
実際にslim遺伝子をクローニングしS2細胞においてDASK1と共発現させると,Slimの共発現に依存的なDASK1の活性化が観察された.SlimのヒトオルソログであるKLHDC10(kelch domain containing 10)も,HEK293細胞においてDASK1のヒトオルソログであるASK1と共発現させるとASK1を活性化した.よって,SlimおよびKLHDC10は種をこえて保存されたASK1活性化タンパク質であることが明らかになった.
では,KLHDC10はどのようにASK1の活性化に寄与しているのだろうか.SlimもKLHDC10もその機能はまったく未知のタンパク質であったが,1次配列の情報からkelchリピートドメインというくり返し構造をもつkelchリピートタンパク質ファミリーに属することがわかっていた.kelchリピートドメインは立体構造としてkelchモチーフとよばれるβシート構造を構成単位とするプロペラ様の構造をとり,タンパク質-タンパク質相互作用に重要なドメインであることが知られている8).そこで,KLHDC10を用いたプルダウン解析によりKLHDC10と結合するタンパク質を探索したところ,ユビキチンリガーゼ複合体として知られるCullin2複合体の構成タンパク質の複数が同定された.さらに解析を進めている過程で,Cullin2やそのアダプタータンパク質であるElongin Bを用いた網羅的なプルダウン解析により,KLHDC10を含むkelchリピートファミリータンパク質はCullin2複合体やほかのCullin複合体の基質特異性を決定する基質認識タンパク質であることを示唆する報告がなされた9,10).実際に,KLHDC10のC末端領域にはCullin2複合体との結合に重要なコンセンサス配列(Cul2ボックス配列およびBCボックス配列)が存在し,それらの配列を欠損した変異体や配列に点変異を導入した変異体ではCullin2複合体との結合がみられなくなったことから,KLHDC10はCullin2複合体の基質認識タンパク質であることが示唆された.
これらの結果より,KLHDC10がASK1を活性化する分子機構として,Cullin2-KLHDC10複合体がなんらかのASK1抑制タンパク質をユビキチン化し分解している可能性が想定された.しかしながら予想に反し,Cullin2と結合できないKLHDC10変異体でも共発現したASK1を活性化したことから,KLHDC10によるASK1の活性化はCullin2複合体に非依存的であることが示唆された.
3.KLHDC10はPP5と結合しその活性を抑制する
一方で,Cullin2と結合できないKLHDC10変異体を用いてプルダウン解析を行った結果,結合タンパク質のひとつとして脱リン酸化酵素PP5が同定された.さきに述べたように,筆者らは以前,PP5をASK1の結合タンパク質として同定し,活性酸素種により活性化したASK1をPP5が脱リン酸化することにより不活性化することを報告していたことから,KLHDC10がASK1を活性化する機構として,PP5の機能抑制を介しているのではないかと仮説をたてた.
PP5は立体構造の解析から,N末端側に存在するTPRドメインがC末端側にあるホスファターゼドメインの酵素活性中心をマスクしており,その結果,定常状態では脱リン酸化活性は低く保たれていることが知られている11).PP5の部分欠失変異体を用いてKLHDC10とPP5との結合領域を検討した結果,KLHDC10はPP5のホスファターゼドメインを含む領域と結合することが明らかになった.そこで,PP5の脱リン酸化活性に対するKLHDC10の影響を検討した.PP5の組換えタンパク質を用いたin vitro脱リン酸化アッセイにより,PP5のアラキドン酸に依存的な活性化はKLHDC10の存在により抑制されることが明らかになった.さらに,ASK1とPP5とは酸化ストレスに依存的に結合することから,KLHDC10とPP5との酸化ストレスに依存的な結合を検討した結果,この結合はH2O2による刺激に依存的に増強することが明らかになった.
これらの結果を総合して考えると,KLHDC10は酸化ストレスに依存的にPP5のホスファターゼドメインに結合しその活性を抑制していることが示唆された.活性酸素種に依存してどのようにKLHDC10とPP5との結合が誘導されているのかは今後の検討課題だが,活性酸素種によりPP5になんらかの構造変化が起こり,ホスファターゼドメインが露出してKLHDC10との結合が誘導されている可能性も考えられる.
4.KLHDC10は活性酸素種に依存したASK1の持続的な活性化と細胞死に必要である
活性酸素種に依存的なASK1の活性化に対するKLHDC10の必要性を検討した.マウスの神経芽腫に由来するNeuro2A細胞においてKLHDC10をノックダウンすると,H2O2による刺激に依存的なASK1の活性化が,とくに刺激ののち60分以降の遅い経時変化において顕著に減弱した.このASK1活性化の減弱はKLHDC10のノックダウンにより活性化したPP5により起こっているのかどうか検討するため,KLHDC10とPP5をダブルノックダウンしたところ,H2O2による刺激に依存したASK1の持続的な活性化は回復した.さらに,酸化ストレスに依存的な細胞死に対するKLHDC10の影響を検討した結果,KLHDC10のノックダウンによりH2O2による刺激に依存的なNeuro2A細胞の細胞死は抑制され,この細胞死の抑制もPP5とのダブルノックダウンにより回復した.よって,KLHDC10はPP5の抑制を介し酸化ストレスに依存したASK1の持続的な活性化を誘導することにより,細胞死に寄与していることが示唆された(図2).
おわりに
今回,明らかにされたKLHDC10によるPP5の阻害機構が,さきに述べた,脱ユビキチン化酵素USP9XによるASK1の安定化機構とともにはたらくことにより,活性酸素種に依存したASK1の持続的な活性化を可能にし,最終的には細胞死を誘導していることが予想された.しかし,これら2つの機構がどのように協調して機能しているのか,あるいは,ストレスの状況や細胞環境により使い分けがなされているのかは,まだ明らかになっていない.ASK1というひとつのシグナルタンパク質の活性化を詳細につきつめていくことにより,多くの制御タンパク質により厳密に制御されたシグナル伝達の制御機構の実体が明らかになってきた.このような多段階にわたる活性制御が時空間的にどのように制御されているのか,そのダイナミクスをいかにとらえていくかが,今後の重要な課題である.くわえて,持続的なASK1の活性化がどのような機構により細胞死を誘導しているのか,また,KLHDC10とPP5との相互作用を介したASK1の活性制御が生体においていかなる局面で起こっているのか,なども明らかにしていきたいと考えている.
文 献
- Takeda, K., Noguchi, T., Naguro, I. et al.: Apoptosis signal-regulating kinase 1 in stress and immune response. Annu. Rev. Pharmacol. Toxicol., 48, 199-225 (2008)[PubMed]
- Tobiume, K., Matsuzawa, A., Takahashi, T. et al.: ASK1 is required for sustained activations of JNK/p38 MAP kinases and apoptosis. EMBO Rep., 2, 222-228 (2001)[PubMed]
- Noguchi, T., Ishii, K., Fukutomi, H. et al.: Requirement of reactive oxygen species-dependent activation of ASK1-p38 MAPK pathway for extracellular ATP-induced apoptosis in macrophage. J. Biol. Chem., 283, 7657-7665 (2008)[PubMed]
- Morita, K., Saitoh, M., Tobiume, K. et al.: Negative feedback regulation of ASK1 by protein phosphatase 5 (PP5) in response to oxidative stress. EMBO J., 20, 6028-6036 (2001)[PubMed]
- Nagai, H., Noguchi, T., Homma, K. et al.: Ubiquitin-like sequence in ASK1 plays critical roles in the recognition and stabilization by USP9X and oxidative stress-induced cell death. Mol. Cell, 36, 805-818 (2009)[PubMed]
- Sekine, Y., Takagahara, S., Hatanaka, R. et al.: p38 MAPKs regulate the expression of genes in the dopamine synthesis pathway through phosphorylation of NR4A nuclear receptors. J. Cell Sci., 124, 3006-3016 (2011)[PubMed]
- Toba, G., Ohsako, T., Miyata, N. et al.: The gene search system. A method for efficient detection and rapid molecular identification of genes in Drosophila melanogaster. Genetics, 151, 725-737 (1999)[PubMed]
- Prag, S. & Adams, J.: Molecular phylogeny of the kelch-repeat superfamily reveals an expansion of BTB/kelch proteins in animals. BMC Bioinformatics, 4, 42 (2003)[PubMed]
- Mahrour, N., Redwine, W. B., Florens, L. et al.: Characterization of Cullin-box sequences that direct recruitment of Cul2-Rbx1 and Cul5-Rbx2 modules to Elongin BC-based ubiquitin ligases. J. Biol. Chem., 283, 8005-8013 (2008)[PubMed]
- Bennett, E.J., Rush, J., Gygi, S. P. et al.: Dynamics of cullin-RING ubiquitin ligase network revealed by systematic quantitative proteomics. Cell, 143, 951-965 (2010)[PubMed]
- Yang, J., Roe, S. M., Cliff, M. J. et al.: Molecular basis for TPR domain-mediated regulation of protein phosphatase 5. EMBO J., 24, 1-10 (2005)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院薬学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より同 助教.
研究テーマ:ストレス応答性のシグナル伝達機構.
関心事:さまざまなストレスの受容と認識の分子機構や,シグナル伝達の時空間的な制御機構を明らかにしていきたい.
一條 秀憲(Hidenori Ichijo)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~toxicol/index.html
© 2012 関根悠介・一條秀憲 Licensed under CC 表示 2.1 日本