自閉症に関連するタンパク質Neuroliginの神経活動に依存的な代謝はニューロンのシナプス形成を制御している
鈴木邦道・富田泰輔
(東京大学大学院薬学系研究科 臨床薬学教室)
email:鈴木邦道,富田泰輔
DOI: 10.7875/first.author.2012.138
Activity-dependent proteolytic cleavage of Neuroligin-1.
Kunimichi Suzuki, Yukari Hayashi, Soichiro Nakahara, Hiroshi Kumazaki, Johannes Prox, Keisuke Horiuchi, Mingshuo Zeng, Shun Tanimura, Yoshitake Nishiyama, Satoko Osawa, Atsuko Sehara-Fujisawa, Paul Saftig, Satoshi Yokoshima, Tohru Fukuyama, Norio Matsuki, Ryuta Koyama, Taisuke Tomita, Takeshi Iwatsubo
Neuron, 76, 410-422 (2012)
シナプスは神経活動に応じてその結合様式やかたちを変えることが知られている.しかし,神経活動からシナプス形成までの一連の流れについてはいまだ不明の点が多い.シナプス膜タンパク質であるNeuroliginファミリーはシナプスの形成および維持に重要な役割をはたし,また,自閉症の発症との関連が示されている.筆者らは,Neuroliginファミリータンパク質のうち,とくに興奮性シナプスに存在するNLG1に着目し解析した.そして,興奮性の神経活動によりプロテアーゼが活性化してNLG1が切断をうけ,細胞外領域と細胞内領域をそれぞれシナプス膜から放出すること,その結果,シナプス膜におけるNLG1の量が減少し興奮性シナプスの形成が抑制性に制御されるという一連の流れを見い出した.また,この切断の責任プロテアーゼとしてADAM10とγセクレターゼの関与を明らかにした.
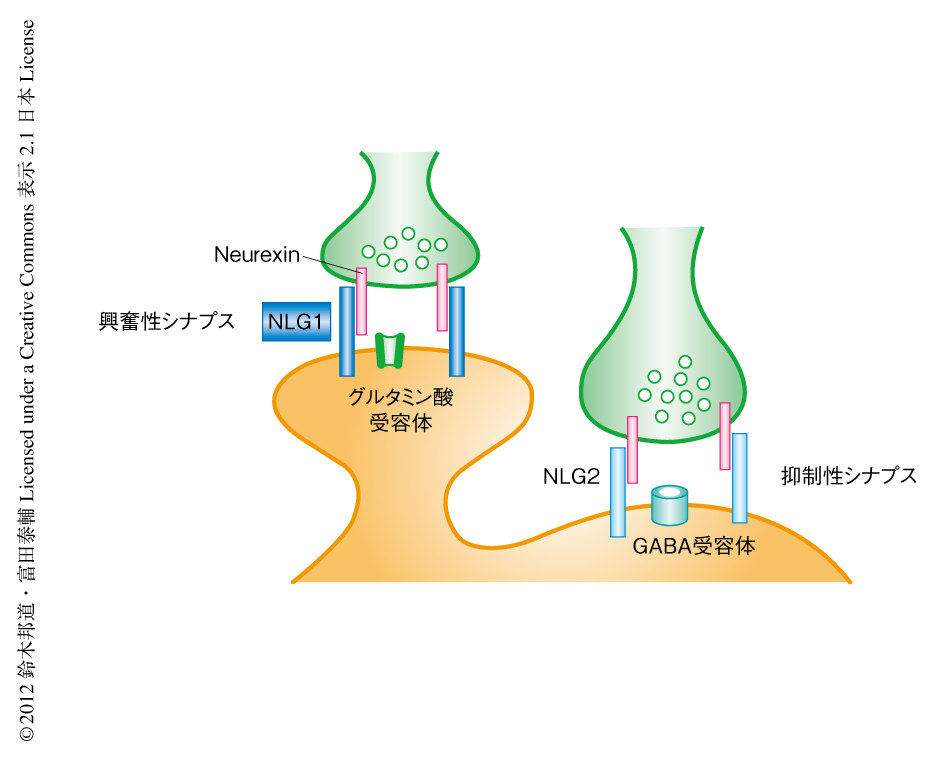
記憶や認識などを処理する脳はニューロンを最小の機能単位とし,ニューロンどうしがつながる綿密なネットワークを形成して中枢神経系を構築している.ニューロンのあいだはシナプスとよばれる構造により接続されている.このシナプスの間隙に,軸索の終末部の側の前シナプス(プレシナプス)から神経伝達物質が放出され,樹状突起の側の後シナプス(ポストシナプス)に存在する受容体がそれを受け取ることにより,シグナルが伝達されていく.シナプスは異なる2つの細胞の接点でもあり,そこにはNカドヘリンをはじめとする多数のシナプス接着分子が同定されてきた.そういったなか,2000年,Neuroligin(NLG)がシナプスを誘導する“シナプスオーガナイザー”機能をもつ接着分子として同定され注目されるようになった1).Neuroliginは後シナプスに局在する接着分子で,前シナプスに存在するNeurexin(NRX)をリガンドとする.Neuroliginをコードする遺伝子としてNLG1遺伝子,NLG2遺伝子,NLG3遺伝子,NLG4X/Y遺伝子が存在するが2),興味深いことに,NLG1は興奮性の後シナプスを形成する樹状突起に存在するスパイン(棘突起)に局在するという特異性をもち,興奮性シナプスの形成および成熟にかかわっていることが明らかになっている(図1).一方,神経活動に応じシナプスの量や質が変化していることが,おもに電気生理学的な解析および生細胞イメージング法による観察により示され,神経可塑性をささえる分子基盤として理解されつつある.シナプスの量や質が変化するためには,シナプスにおける接着が神経活動に応じて分子レベルで変化する必要があるが,その分子機構についてはいまだ不明の点が多く残されている.
自閉症とは対人関係の質的な障害などを特徴とする発達障害である.自閉症の発症機構として,中枢神経系における興奮と抑制のバランスがくずれることが一因であるという説が提唱されているが,その発症機構についてはいまだ不明の点が多い.近年,ゲノムワイド関連解析によりシナプス接着分子における遺伝子変異やコピー数異常と自閉症など精神疾患との関連が報告され,さらに注目されている.とくにNLG1遺伝子については自閉症の患者においてコピー数異常がみつかり3),また,NLG1過剰発現マウスおよびNLG1ノックアウトマウスにおいては興奮と抑制のバランスがくずれ自閉症様の表現型を呈することが報告された2).これらのことから,NLG1の発現量の変化は興奮性シナプスおよび抑制性シナプスの量に影響を及ぼして神経ネットワーク回路の形成に異常をあたえ,自閉症の発症に寄与するものと想定されている.すなわち,NLG1の発現量の制御は脳の発生および高次機能の発揮に重要であると考えられるが,NLG1が脳においてどのような分子機構により代謝をうけその発現量が制御されているかについてはまったく不明であった.
NLG1は大きな細胞外ドメインをもつI型膜貫通タンパク質である.このような構造的な特徴をもつタンパク質は細胞膜の近傍の細胞外領域において切断(シェディング)をうけることが複数のタンパク質について報告されている4).そこで,NLG1の発現量を制御する代謝機構について検討した.ラットの大脳皮質より膜画分を回収しNLG1の発現を確認したところ,全長型のNLG1にくわえ,分子量の小さい膜結合型のC末端側の断片が検出された.さらに,膜画分を37度でインキュベーションすると,全長型NLG1よりも分子量の小さい細胞外領域を含むN末端側の断片と,膜結合型のC末端側の断片よりさらに分子量の小さい可溶性の細胞質内断片が産生された.N末端側断片の産生はシェディングを抑制するメタロプロテアーゼ阻害剤であるTAPI-2により,また,細胞質内断片の産生は細胞膜の内部の配列を切断するγセクレターゼの特異的な阻害剤であるDAPTにより,それぞれ抑制された.また,初代培養ニューロンにおいてもN末端側の細胞外領域が培養上清に分泌型NLG1として分泌されること,ひきつづいて,C末端側の断片はγセクレターゼにより切断されることが示唆された.さらに,各種の阻害剤とRNAi法,そして,NLG1ノックアウトマウスに由来する線維芽細胞を利用することによりNLG1のシェディングを行う酵素を探索したところ,膜結合型メタロプロテアーゼのひとつであるADAM10の関与が示唆された.
そこで,2種類のADAM10コンディショナルノックアウトマウスを用いてNLG1のシェディングについて検討した.まず,ADAM10コンディショナルノックアウトマウスより初代培養ニューロンを得てin vitroにおいてADAM10を欠損させたところ,培養上清における分泌型NLG1の著しい減少が観察された.また,別のADAM10コンディショナルノックアウトマウスにおいて発生の終了したのちニューロンに特異的にADAM10を欠損させ脳に由来する膜画分を解析したところ,全長型NLG1の蓄積と分泌型NLG1の産生低下が観察された.これらの結果から,NLG1はADAM10およびγセクレターゼによる段階的な切断をうけることが明らかになった.興味深いことに,抑制性シナプスに局在するNLG2の切断はADAM10の欠損により大きな影響をうけなかったことから,NLG2のシェディングを行うプロテアーゼは別に存在することが示唆された.
NLG1のシェディングをうける部位について詳細な検討を行った.C末端側の断片の分子量からシェディング部位として細胞膜の近傍のストーク領域が想定されたことから,この領域についてシステマチックに変異体の解析を行ったところ,678番目のプロリン残基から681番目のグルタミン残基までの4残基をアラニン残基に置換した変異体においてシェディングが減少した.一方,その直後の682番目のプロリン残基から4残基をアラニン残基に置換した変異体や,686番目のセリン残基から4残基をアラニン残基に置換した変異体においては,分泌型NLG1の産生は著しく増加した.さらに,C末端側の断片についても相当する分子量をもつ組換えタンパク質を強制発現させたところ,細胞においてγセクレターゼとプロテアソームによりすみやかに分解されていることが明らかになった.これらのことから,NLG1はストーク領域においてADAM10によるシェディングをうけると,γセクレターゼにより迅速に切断をうけたのち,プロテアソームにより分解されシナプス膜から消失することが示唆された.
NLG1は興奮性シナプスに局在することから,興奮性の刺激によりシェディングが制御されている可能性が考えられた.初代培養ニューロンにグルタミン酸を処理するとNLG1のシェディングが亢進し,これはグルタミン酸受容体のひとつであるNMDA受容体の阻害剤AP-5により抑制された.興味深いことに,グルタミン酸と結合したNMDA受容体のみを阻害するオープンチャネルブロッカーMK-801によっても分泌型NLG1の産生は抑制されたことから,NLG1は興奮性のシナプス伝達に応じてシェディングをうけていることが示唆された.また,細胞表面ビオチン化実験により,ニューロンの細胞膜の表面に存在するNLG1がシェディングをうけていることが示唆された.さらに,こうした興奮性の神経活動に依存的なNLG1のシェディング亢進が生体においても生じているかどうかを検討するため,ピロカルピンを用いたてんかんモデルマウスを解析したところ,てんかん重積状態のマウスの脳において分泌型NLG1の産生が著明に上昇していることが認められた.これらのことから,NLG1のシェディングはNMDA受容体を介した興奮性の神経活動により亢進することが明らかになった.
一方,リガンドであるNeurexinとの結合がNLG1のシェディングに及ぼす影響について検討した.初代培養ニューロンにおいてNeurexinもNLG1と同様に細胞外領域が切断され,これを放出することが確認された.そこで,Neurexinを過剰発現する細胞より分泌されたNeurexinの細胞外断片をニューロンに処理したところ,NLG1のシェディングが亢進した.このことから,分泌型Neurexinとの結合はNLG1のシェディングを制御していることが示唆された.
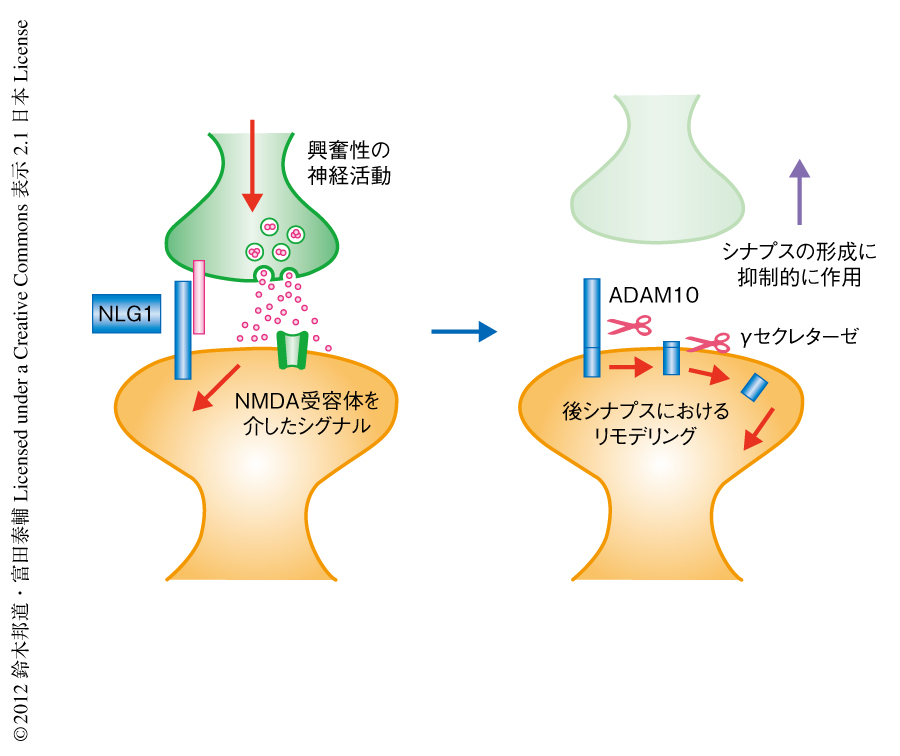
NLG1のシェディングが興奮性シナプスにおいてスパインの形成に及ぼす影響について検討するため,ラットの海馬の急性スライス培養において歯状回顆粒細胞に対しNLG1を一過性に発現させスパインの密度を計測した.その結果,すでに報告されていたとおり,NLG1の過剰発現はスパインの密度を上昇させたが,導入するNLG1発現プラスミドの量を少なくするとその効果は失われた.しかし,少ない量のNLG1発現プラスミドを導入したときにNLG1のシェディングを抑制する目的でメタロプロテアーゼ阻害剤TAPI-2の処理を行ったところ,やはり,スパイン密度の上昇が観察された.このことから,シェディングの抑制によりシナプス膜におけるNLG1の量の増加したことが推測された.興味深いことに,膜結合型のC末端側の断片の組換え体を過剰発現したときにもスパイン密度は上昇したのに対し,細胞質内断片の組換え体の発現により影響はみられなかったことから,γセクレターゼによるNLG1の切断はスパインの形成能に対し抑制的に作用していることが推測された.そこで,シェディングが抑制される678番目のプロリン残基から4残基をアラニン残基に置換したNLG1変異体をラットの海馬のニューロンに遺伝子導入して,NLG1の局在およびスパインの密度を計測した.野生型NLG1を遺伝子導入したニューロンではNLG1のスパインへの局在がみられ,スパイン密度の上昇傾向はみられたものの遺伝子導入を行っていない細胞と統計学的な有意差はみられなかった.一方,それと同量のNLG1変異体の発現プラスミドを遺伝子導入したニューロンではNLG1のスパインへの強い集積がみられ,スパイン密度は有意に上昇していた.これらのことから,NLG1のシェディングおよびγセクレターゼによる切断はスパインの形成に抑制的に作用していることが示唆された(図2).
今回,筆者らは,シナプス接着分子NLG1がADAM10およびγセクレターゼにより切断されることを発見した.また,この切断は,NMDA受容体を介した興奮性の神経活動や,NLG1のリガンドであるNeurexinの細胞外断片との結合により亢進すること,興奮性シナプスの形成に抑制的にはたらくことを明らかにした.一方,筆者らの報告と同時に,NLG1が分泌型メタロプロテアーゼであるMMP9により切断されて分泌型NLG1を放出すると報告する論文が発表された5).そこではさらに,トロンビン切断配列を挿入したNLG1の誘導性切断実験やケージドグルタミン酸を利用した実験により,スパインの局所における興奮性の神経活動はNMDA受容体からCamKを介したシグナルによりNLG1の切断を亢進していること,NLG1の切断がNeurexinの消失そしてシナプスの不安定化をまねき,前シナプスからの神経伝達物質の放出を低下させていることを示した.すなわち,後シナプスの側の変化が前シナプスの機能に影響するtrans-synapticなシグナル伝達を起こすことが示された.一方,Neurexinもシェディングをうけ,それにより産生された分泌型NeurexinがNLG1のシェディングを増加させたという筆者らの結果を考えると,前シナプスの側のNeurexinの代謝の変化を介することでもNLG1の機能は制御されていると推測された.さらに,ADAM10に依存性の分泌型NLG1と,MMP9により生じる分泌型NLG1とが,まったく同じものであるかどうか現段階では不明だが,ADAM10ノックアウトマウスの脳およびMMP9ノックアウトマウスの脳とも,分泌型NLG1の産生は完全には消失していないことから,NLG1はADAM10およびMMP9により切断をうけてその発現量を適切に保ちシナプスの形成を制御している可能性が示唆される.また,発生段階に応じNLG1のシェディングの様式が変化していることも示唆されており,その違いがADAM10とMMP9との使い分けを生んでいる可能性もある.今後,NLG1-Neurexin系における両方向性のシナプスへの影響を検討する必要があるだろう.
一方,NLG1は自閉症に関連するシナプス接着分子であることから,自閉症の発症においてNLG1の切断は関係があるかどうか興味がもたれる.また,ADAM10やγセクレターゼはアルツハイマー病の原因産物であるアミロイドβタンパク質の産生にも関与している6).また,MMP9もアミロイドβタンパク質の分解酵素として知られている.アルツハイマー病の初期病変としてシナプス機能の異常が報告されており7),アルツハイマー病の発症においてNLG1をはじめとするシナプス接着分子の切断に変化の生じている可能性も考えられる.今後は,NLG1の切断とこれら疾患との関係や,切断によるNLG1発現量の増減が脳の記憶活動へ及ぼす影響について検討したいと考えている.
略歴:東京大学大学院薬学系研究科博士課程 在籍中.
研究テーマ:シナプス接着分子の切断におけるその機能的な意義.
抱負:自閉症について分子レベルで明らかにし,基礎研究をとおして発達障害を支援・理解することに尽力したい.
富田 泰輔(Taisuke Tomita)
東京大学大学院薬学系研究科 准教授.
© 2012 鈴木邦道・富田泰輔 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 臨床薬学教室)
email:鈴木邦道,富田泰輔
DOI: 10.7875/first.author.2012.138
Activity-dependent proteolytic cleavage of Neuroligin-1.
Kunimichi Suzuki, Yukari Hayashi, Soichiro Nakahara, Hiroshi Kumazaki, Johannes Prox, Keisuke Horiuchi, Mingshuo Zeng, Shun Tanimura, Yoshitake Nishiyama, Satoko Osawa, Atsuko Sehara-Fujisawa, Paul Saftig, Satoshi Yokoshima, Tohru Fukuyama, Norio Matsuki, Ryuta Koyama, Taisuke Tomita, Takeshi Iwatsubo
Neuron, 76, 410-422 (2012)
要 約
シナプスは神経活動に応じてその結合様式やかたちを変えることが知られている.しかし,神経活動からシナプス形成までの一連の流れについてはいまだ不明の点が多い.シナプス膜タンパク質であるNeuroliginファミリーはシナプスの形成および維持に重要な役割をはたし,また,自閉症の発症との関連が示されている.筆者らは,Neuroliginファミリータンパク質のうち,とくに興奮性シナプスに存在するNLG1に着目し解析した.そして,興奮性の神経活動によりプロテアーゼが活性化してNLG1が切断をうけ,細胞外領域と細胞内領域をそれぞれシナプス膜から放出すること,その結果,シナプス膜におけるNLG1の量が減少し興奮性シナプスの形成が抑制性に制御されるという一連の流れを見い出した.また,この切断の責任プロテアーゼとしてADAM10とγセクレターゼの関与を明らかにした.
はじめに
記憶や認識などを処理する脳はニューロンを最小の機能単位とし,ニューロンどうしがつながる綿密なネットワークを形成して中枢神経系を構築している.ニューロンのあいだはシナプスとよばれる構造により接続されている.このシナプスの間隙に,軸索の終末部の側の前シナプス(プレシナプス)から神経伝達物質が放出され,樹状突起の側の後シナプス(ポストシナプス)に存在する受容体がそれを受け取ることにより,シグナルが伝達されていく.シナプスは異なる2つの細胞の接点でもあり,そこにはNカドヘリンをはじめとする多数のシナプス接着分子が同定されてきた.そういったなか,2000年,Neuroligin(NLG)がシナプスを誘導する“シナプスオーガナイザー”機能をもつ接着分子として同定され注目されるようになった1).Neuroliginは後シナプスに局在する接着分子で,前シナプスに存在するNeurexin(NRX)をリガンドとする.Neuroliginをコードする遺伝子としてNLG1遺伝子,NLG2遺伝子,NLG3遺伝子,NLG4X/Y遺伝子が存在するが2),興味深いことに,NLG1は興奮性の後シナプスを形成する樹状突起に存在するスパイン(棘突起)に局在するという特異性をもち,興奮性シナプスの形成および成熟にかかわっていることが明らかになっている(図1).一方,神経活動に応じシナプスの量や質が変化していることが,おもに電気生理学的な解析および生細胞イメージング法による観察により示され,神経可塑性をささえる分子基盤として理解されつつある.シナプスの量や質が変化するためには,シナプスにおける接着が神経活動に応じて分子レベルで変化する必要があるが,その分子機構についてはいまだ不明の点が多く残されている.
自閉症とは対人関係の質的な障害などを特徴とする発達障害である.自閉症の発症機構として,中枢神経系における興奮と抑制のバランスがくずれることが一因であるという説が提唱されているが,その発症機構についてはいまだ不明の点が多い.近年,ゲノムワイド関連解析によりシナプス接着分子における遺伝子変異やコピー数異常と自閉症など精神疾患との関連が報告され,さらに注目されている.とくにNLG1遺伝子については自閉症の患者においてコピー数異常がみつかり3),また,NLG1過剰発現マウスおよびNLG1ノックアウトマウスにおいては興奮と抑制のバランスがくずれ自閉症様の表現型を呈することが報告された2).これらのことから,NLG1の発現量の変化は興奮性シナプスおよび抑制性シナプスの量に影響を及ぼして神経ネットワーク回路の形成に異常をあたえ,自閉症の発症に寄与するものと想定されている.すなわち,NLG1の発現量の制御は脳の発生および高次機能の発揮に重要であると考えられるが,NLG1が脳においてどのような分子機構により代謝をうけその発現量が制御されているかについてはまったく不明であった.
1.NLG1はADAM10およびγセクレターゼにより段階的な切断をうける
NLG1は大きな細胞外ドメインをもつI型膜貫通タンパク質である.このような構造的な特徴をもつタンパク質は細胞膜の近傍の細胞外領域において切断(シェディング)をうけることが複数のタンパク質について報告されている4).そこで,NLG1の発現量を制御する代謝機構について検討した.ラットの大脳皮質より膜画分を回収しNLG1の発現を確認したところ,全長型のNLG1にくわえ,分子量の小さい膜結合型のC末端側の断片が検出された.さらに,膜画分を37度でインキュベーションすると,全長型NLG1よりも分子量の小さい細胞外領域を含むN末端側の断片と,膜結合型のC末端側の断片よりさらに分子量の小さい可溶性の細胞質内断片が産生された.N末端側断片の産生はシェディングを抑制するメタロプロテアーゼ阻害剤であるTAPI-2により,また,細胞質内断片の産生は細胞膜の内部の配列を切断するγセクレターゼの特異的な阻害剤であるDAPTにより,それぞれ抑制された.また,初代培養ニューロンにおいてもN末端側の細胞外領域が培養上清に分泌型NLG1として分泌されること,ひきつづいて,C末端側の断片はγセクレターゼにより切断されることが示唆された.さらに,各種の阻害剤とRNAi法,そして,NLG1ノックアウトマウスに由来する線維芽細胞を利用することによりNLG1のシェディングを行う酵素を探索したところ,膜結合型メタロプロテアーゼのひとつであるADAM10の関与が示唆された.
そこで,2種類のADAM10コンディショナルノックアウトマウスを用いてNLG1のシェディングについて検討した.まず,ADAM10コンディショナルノックアウトマウスより初代培養ニューロンを得てin vitroにおいてADAM10を欠損させたところ,培養上清における分泌型NLG1の著しい減少が観察された.また,別のADAM10コンディショナルノックアウトマウスにおいて発生の終了したのちニューロンに特異的にADAM10を欠損させ脳に由来する膜画分を解析したところ,全長型NLG1の蓄積と分泌型NLG1の産生低下が観察された.これらの結果から,NLG1はADAM10およびγセクレターゼによる段階的な切断をうけることが明らかになった.興味深いことに,抑制性シナプスに局在するNLG2の切断はADAM10の欠損により大きな影響をうけなかったことから,NLG2のシェディングを行うプロテアーゼは別に存在することが示唆された.
NLG1のシェディングをうける部位について詳細な検討を行った.C末端側の断片の分子量からシェディング部位として細胞膜の近傍のストーク領域が想定されたことから,この領域についてシステマチックに変異体の解析を行ったところ,678番目のプロリン残基から681番目のグルタミン残基までの4残基をアラニン残基に置換した変異体においてシェディングが減少した.一方,その直後の682番目のプロリン残基から4残基をアラニン残基に置換した変異体や,686番目のセリン残基から4残基をアラニン残基に置換した変異体においては,分泌型NLG1の産生は著しく増加した.さらに,C末端側の断片についても相当する分子量をもつ組換えタンパク質を強制発現させたところ,細胞においてγセクレターゼとプロテアソームによりすみやかに分解されていることが明らかになった.これらのことから,NLG1はストーク領域においてADAM10によるシェディングをうけると,γセクレターゼにより迅速に切断をうけたのち,プロテアソームにより分解されシナプス膜から消失することが示唆された.
2.興奮性の神経活動およびNeurexinの細胞外断片との結合はNLG1のシェディングを亢進する
NLG1は興奮性シナプスに局在することから,興奮性の刺激によりシェディングが制御されている可能性が考えられた.初代培養ニューロンにグルタミン酸を処理するとNLG1のシェディングが亢進し,これはグルタミン酸受容体のひとつであるNMDA受容体の阻害剤AP-5により抑制された.興味深いことに,グルタミン酸と結合したNMDA受容体のみを阻害するオープンチャネルブロッカーMK-801によっても分泌型NLG1の産生は抑制されたことから,NLG1は興奮性のシナプス伝達に応じてシェディングをうけていることが示唆された.また,細胞表面ビオチン化実験により,ニューロンの細胞膜の表面に存在するNLG1がシェディングをうけていることが示唆された.さらに,こうした興奮性の神経活動に依存的なNLG1のシェディング亢進が生体においても生じているかどうかを検討するため,ピロカルピンを用いたてんかんモデルマウスを解析したところ,てんかん重積状態のマウスの脳において分泌型NLG1の産生が著明に上昇していることが認められた.これらのことから,NLG1のシェディングはNMDA受容体を介した興奮性の神経活動により亢進することが明らかになった.
一方,リガンドであるNeurexinとの結合がNLG1のシェディングに及ぼす影響について検討した.初代培養ニューロンにおいてNeurexinもNLG1と同様に細胞外領域が切断され,これを放出することが確認された.そこで,Neurexinを過剰発現する細胞より分泌されたNeurexinの細胞外断片をニューロンに処理したところ,NLG1のシェディングが亢進した.このことから,分泌型Neurexinとの結合はNLG1のシェディングを制御していることが示唆された.
3.NLG1の切断はスパインの形成に抑制的にはたらく
NLG1のシェディングが興奮性シナプスにおいてスパインの形成に及ぼす影響について検討するため,ラットの海馬の急性スライス培養において歯状回顆粒細胞に対しNLG1を一過性に発現させスパインの密度を計測した.その結果,すでに報告されていたとおり,NLG1の過剰発現はスパインの密度を上昇させたが,導入するNLG1発現プラスミドの量を少なくするとその効果は失われた.しかし,少ない量のNLG1発現プラスミドを導入したときにNLG1のシェディングを抑制する目的でメタロプロテアーゼ阻害剤TAPI-2の処理を行ったところ,やはり,スパイン密度の上昇が観察された.このことから,シェディングの抑制によりシナプス膜におけるNLG1の量の増加したことが推測された.興味深いことに,膜結合型のC末端側の断片の組換え体を過剰発現したときにもスパイン密度は上昇したのに対し,細胞質内断片の組換え体の発現により影響はみられなかったことから,γセクレターゼによるNLG1の切断はスパインの形成能に対し抑制的に作用していることが推測された.そこで,シェディングが抑制される678番目のプロリン残基から4残基をアラニン残基に置換したNLG1変異体をラットの海馬のニューロンに遺伝子導入して,NLG1の局在およびスパインの密度を計測した.野生型NLG1を遺伝子導入したニューロンではNLG1のスパインへの局在がみられ,スパイン密度の上昇傾向はみられたものの遺伝子導入を行っていない細胞と統計学的な有意差はみられなかった.一方,それと同量のNLG1変異体の発現プラスミドを遺伝子導入したニューロンではNLG1のスパインへの強い集積がみられ,スパイン密度は有意に上昇していた.これらのことから,NLG1のシェディングおよびγセクレターゼによる切断はスパインの形成に抑制的に作用していることが示唆された(図2).
おわりに
今回,筆者らは,シナプス接着分子NLG1がADAM10およびγセクレターゼにより切断されることを発見した.また,この切断は,NMDA受容体を介した興奮性の神経活動や,NLG1のリガンドであるNeurexinの細胞外断片との結合により亢進すること,興奮性シナプスの形成に抑制的にはたらくことを明らかにした.一方,筆者らの報告と同時に,NLG1が分泌型メタロプロテアーゼであるMMP9により切断されて分泌型NLG1を放出すると報告する論文が発表された5).そこではさらに,トロンビン切断配列を挿入したNLG1の誘導性切断実験やケージドグルタミン酸を利用した実験により,スパインの局所における興奮性の神経活動はNMDA受容体からCamKを介したシグナルによりNLG1の切断を亢進していること,NLG1の切断がNeurexinの消失そしてシナプスの不安定化をまねき,前シナプスからの神経伝達物質の放出を低下させていることを示した.すなわち,後シナプスの側の変化が前シナプスの機能に影響するtrans-synapticなシグナル伝達を起こすことが示された.一方,Neurexinもシェディングをうけ,それにより産生された分泌型NeurexinがNLG1のシェディングを増加させたという筆者らの結果を考えると,前シナプスの側のNeurexinの代謝の変化を介することでもNLG1の機能は制御されていると推測された.さらに,ADAM10に依存性の分泌型NLG1と,MMP9により生じる分泌型NLG1とが,まったく同じものであるかどうか現段階では不明だが,ADAM10ノックアウトマウスの脳およびMMP9ノックアウトマウスの脳とも,分泌型NLG1の産生は完全には消失していないことから,NLG1はADAM10およびMMP9により切断をうけてその発現量を適切に保ちシナプスの形成を制御している可能性が示唆される.また,発生段階に応じNLG1のシェディングの様式が変化していることも示唆されており,その違いがADAM10とMMP9との使い分けを生んでいる可能性もある.今後,NLG1-Neurexin系における両方向性のシナプスへの影響を検討する必要があるだろう.
一方,NLG1は自閉症に関連するシナプス接着分子であることから,自閉症の発症においてNLG1の切断は関係があるかどうか興味がもたれる.また,ADAM10やγセクレターゼはアルツハイマー病の原因産物であるアミロイドβタンパク質の産生にも関与している6).また,MMP9もアミロイドβタンパク質の分解酵素として知られている.アルツハイマー病の初期病変としてシナプス機能の異常が報告されており7),アルツハイマー病の発症においてNLG1をはじめとするシナプス接着分子の切断に変化の生じている可能性も考えられる.今後は,NLG1の切断とこれら疾患との関係や,切断によるNLG1発現量の増減が脳の記憶活動へ及ぼす影響について検討したいと考えている.
文 献
- Scheiffele, P., Fan, J., Choih, J. et al.: Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell, 101, 657-669 (2000)[PubMed]
- Sudhof, T. C.: Neuroligins and neurexins link synaptic function to cognitive disease. Nature, 455, 903-911 (2008)[PubMed]
- Glessner, J. T., Wang, K., Cai, G. et al.: Autism genome-wide copy number variation reveals ubiquitin and neuronal genes. Nature, 459, 569-573 (2009)[PubMed]
- Weber, S. & Saftig, P.: Ectodomain shedding and ADAMs in development. Development, 139, 3693-3709 (2012)[PubMed]
- Peixoto, R. T., Kunz, P. A., Kwon, H. et al.: Transsynaptic signaling by activity-dependent cleavage of neuroligin-1. Neuron, 76, 396-409 (2012)[PubMed]
- Tomita, T.: Secretase inhibitors and modulators for Alzheimer's disease treatment. Expert Rev. Neurother., 9, 661-679 (2009)[PubMed]
- Holtzman, D. M., Goate, A., Kelly, J. et al.: Mapping the road forward in Alzheimer's disease. Sci. Transl. Med., 3, 114ps148 (2011)[PubMed]
著者プロフィール
略歴:東京大学大学院薬学系研究科博士課程 在籍中.
研究テーマ:シナプス接着分子の切断におけるその機能的な意義.
抱負:自閉症について分子レベルで明らかにし,基礎研究をとおして発達障害を支援・理解することに尽力したい.
富田 泰輔(Taisuke Tomita)
東京大学大学院薬学系研究科 准教授.
© 2012 鈴木邦道・富田泰輔 Licensed under CC 表示 2.1 日本