ミトコンドリアの機能障害はHippo経路を介し周辺組織の腫瘍の悪性化をひき起こす
大澤志津江・井垣達吏
(神戸大学大学院医学研究科 遺伝学分野)
email:大澤志津江,井垣達吏
DOI: 10.7875/first.author.2012.136
Mitochondrial defect drives non-autonomous tumour progression through Hippo signalling in Drosophila.
Shizue Ohsawa, Yoshitaka Sato, Masato Enomoto, Mai Nakamura, Aya Betsumiya, Tatsushi Igaki
Nature, 490, 547-551 (2012)
ヒトのがんにおいてはミトコンドリアの機能障害が高頻度に認められるが,その意義はこれまでほとんど不明であった.筆者らは,ショウジョウバエの上皮をモデル系とした遺伝学的な解析により,ミトコンドリアの機能障害はがん遺伝子Rasの活性化と協調することにより周辺組織の腫瘍の悪性化をひき起こすことを見い出した.ミトコンドリアの機能障害とRasシグナルの活性化を同時に起こした細胞においては活性酸素種が大量に産生され,これがJNKシグナルを活性化することがわかった.さらに,JNKシグナルがRasシグナルと協調することによりがん抑制経路であるHippo経路が不活性化され,これにより分泌性の増殖因子であるUpdやWgの発現が誘導されることで,その周辺の良性腫瘍は浸潤能および転移能を獲得することが明らかになった.ミトコンドリアに機能障害を起こしたヒトのがん組織においても,同様の分子機構がはたらいている可能性が考えられる.
がんは複数の突然変異の蓄積により発生し進展すると考えられている.たとえば,あるひとつの上皮細胞は腫瘍原性の突然変異(がん遺伝子の活性化やがん抑制遺伝子の不活性化)を多段階的に蓄積し,さまざまな選択圧を克服しながら増殖能や浸潤能および転移能を獲得することによりがん化していくと考えられる.一方,最近になり,がんの発生および進展はこのような細胞の“自律的な”変異の蓄積のみによりひき起こされているのではなく,細胞どうしの相互作用を介した“非遺伝的な”変化も重要な役割を担っていることがわかってきた.たとえば,上皮に由来するがんの周辺には上皮細胞のほかにも間質細胞である線維芽細胞や免疫系細胞,炎症細胞などが存在するが,上皮のがん細胞はこれらの細胞と相互作用することによっても増殖能や浸潤能および転移能を獲得すると推察されている1).また,ヒトのがん組織は必ずしも単一の細胞を起源とする遺伝的な背景をもつわけではなく,異なる遺伝的な背景をもつヘテロな細胞の集団であることもわかってきた2,3).これらの事実は,異なる性質をもつ細胞どうしの相互作用が,がんの発生および進展に重要な役割をはたしている可能性を示唆している.しかし,そのような細胞間の相互作用がいかにしてがんの発生および進展に寄与しているのか,その分子機構はほとんどわかっていない.その理由として,生物の個体においてひき起こされる細胞に非自律的な影響を系統的に解析できるすぐれたモデル系の存在しなかったことがあげられる.この研究では,この問題を克服しうるモデル系として,ショウジョウバエにおけるモザイククローン法を用いた腫瘍悪性化モデルを利用し,細胞間コミュニケーションを介した腫瘍悪性化の分子機構の遺伝学的な解析を行った.
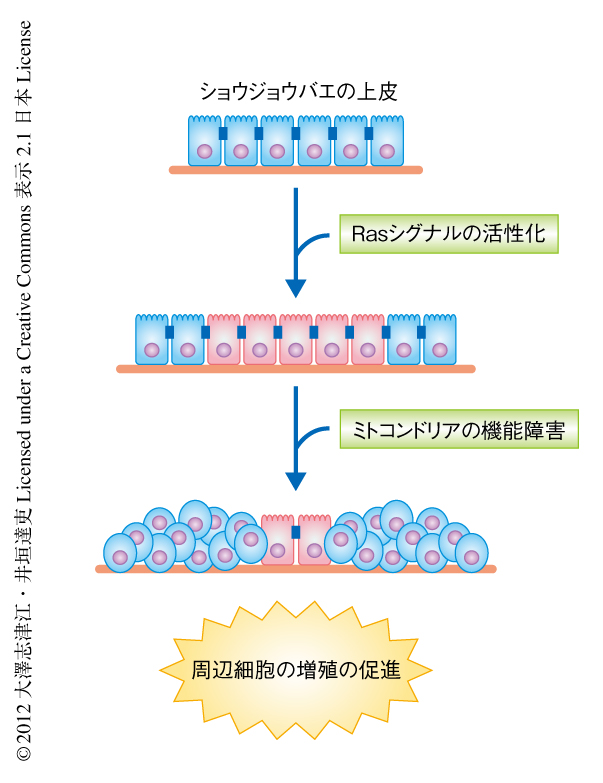
細胞間コミュニケーションを介した腫瘍悪性化の分子機構を解析するため,ショウジョウバエの上皮をモデル系として遺伝学的なスクリーニングを行った.具体的には,ショウジョウバエ3齢幼虫の複眼原基の上皮組織にがん遺伝子Rasを活性化した細胞のクローンを誘導するとこれらの細胞は過剰に増殖し良性腫瘍を形成するが,この良性腫瘍にさらに変異を導入しその表現型の変化をスクリーニングした.その結果,変異の導入されたRas遺伝子の活性化した細胞それ自体ではなく,その周辺に存在する野生型の細胞が非自律的に増殖を促進するという一連の興味深い変異体が単離され,nag(non-cell autonomous growth)変異体と命名した.これら一連のnag変異体の責任遺伝子を解析した結果,ミトコンドリア呼吸鎖複合体の構成タンパク質をコードする遺伝子,あるいは,その合成にかかわるミトコンドリアリボソームタンパク質をコードする遺伝子に変異の集中していることが判明した.すなわち,ミトコンドリアの機能障害とRasシグナルの活性化が同時に起こると,その周辺の正常な細胞の増殖能は亢進することがわかった(図1).そこで,このミトコンドリアの機能障害とRasシグナルの活性化によりひき起こされる細胞に非自律的な増殖の促進機構の解析を進めることにした.
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞が非自律的な増殖の促進をひき起こす分子機構を明らかにするため,この現象を起こすのに必要な遺伝子のスクリーニングを行った.具体的には,一連のショウジョウバエ染色体欠失系統ライブラリーを用い,ミトコンドリアの機能障害とRasシグナルの活性化を同時に起こした細胞クローンにひき起こされる細胞に非自律的な増殖を,抑制(サプレッサー)あるいは亢進(エンハンサー)する染色体の欠失を探索した.このスクリーニングにより単離された強力なサプレッサー活性を示す染色体の欠失のなかには,stat92E遺伝子が含まれていた.Stat92EはショウジョウバエのJAK/STAT経路において機能する転写因子であり,そのリガンドとして,炎症性サイトカインであるインターロイキン6のホモログUpdが知られている.実際に,ミトコンドリアの機能障害とRasシグナルの活性化を起こした細胞ではUpdの発現が誘導され,これによりJAK/STAT経路の活性化を介し周辺細胞の増殖の促進されていることがわかった.
Updの発現はJNKシグナルやNotchシグナルにより制御されていることが知られている.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞においてJNKシグナルを抑制するとUpdの発現誘導が起こらなくなり,かつ,細胞に非自律的な増殖も強く抑制されることがわかった.一方,Notchの機能を抑制しても細胞に非自律的な増殖は抑制されなかった.さらに,JNKシグナルの活性をその標的遺伝子の発現レベルにより解析した結果,ミトコンドリアの機能障害のみ,あるいは,Rasシグナルの活性化のみを起こした細胞では低レベルのJNK活性しか認められなかったが,この2つを同時に起こした細胞ではJNKシグナルの非常に強い活性化が検出された.以上の結果から,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞ではJNKシグナルが協調的に活性化し,これによりUpdの発現が誘導されているものと考えられた.
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞においてJNKシグナルが活性化する分子機構を解析した.JNKシグナルは活性酸素種などさまざまな細胞内ストレスにより活性化されることが知られている.興味深いことに,ミトコンドリアの機能障害のみ,あるいは,Rasシグナルの活性化のみを起こした細胞では活性酸素種の産生や酸化ストレスは認められなかったが,この2つを同時に起こした細胞では活性酸素種を大量に産生し酸化ストレスをひき起こしていることが明らかになった.さらに,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞において抗酸化酵素を強制発現させることにより酸化ストレスを軽減させると,JNKシグナルの活性化は抑制され細胞に非自律的な増殖も抑制された.これらの結果から,ミトコンドリアの機能障害とRasシグナルの活性化は活性酸素種の産生を協調的に誘導し,これがJNKシグナルを活性化してUpdの発現を誘導するものと考えられた.
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞において活性化するJNKシグナルが細胞に非自律的な増殖に対し必須であることがわかったが,JNKシグナルの活性化はUpdの発現誘導には十分ではないことも明らかになった.解析を進めた結果,JNKシグナルの活性化と同時にRasシグナルの活性化の起こることがUpdの発現誘導に必要十分であることがわかった.その分子機構として,RasシグナルとJNKシグナルの活性化とが起こるとがん抑制経路のひとつHippo経路が不活性化し,これによりUpdの発現が誘導されることがわかった.
Hippo経路は進化的に保存されたがん抑制経路であり,転写コアクチベーターであるYki(Yapのホモログ)をリン酸化し抑制することにより細胞の増殖を負に制御する.最近,upd遺伝子はYkiの転写ターゲット遺伝子のひとつであることが報告されたことから,JNKシグナルとRasシグナルとを活性化した細胞がYkiを介しUpdの発現を誘導している可能性が考えられた.これを検証した結果,JNKシグナルとRasシグナルとを活性化した細胞ではYkiの特異的な転写ターゲット遺伝子であるexpanded遺伝子やcyclin E遺伝子,daip1遺伝子などの発現が強く誘導されていることがわかった.同様に,ミトコンドリアの機能障害とRasシグナルの活性化とを起した細胞においても,これらYkiの転写ターゲット遺伝子の発現は強く誘導されていた.さらに,これらYkiの転写ターゲット遺伝子の発現は,Hippo経路の活性化(Ykiの不活性化)を起こしたりYkiの発現を阻害したりすることにより強く抑制されることがわかった.くわえて,Ykiの別の転写ターゲット遺伝子の産物である分泌性の増殖因子Wg(Wntのホモログ)の発現もRasシグナルとJNKシグナルの協調により誘導されること,また,Wgの発現誘導もミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞による周辺細胞の増殖の促進に貢献していることが遺伝学的に明らかになった.
以上の結果から,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はHippo経路を不活性化することによりYkiの活性化を介しUpdやWgの発現を誘導し,これらの分泌性の増殖因子が周辺細胞の増殖を促進しているものと考えられた(図2).
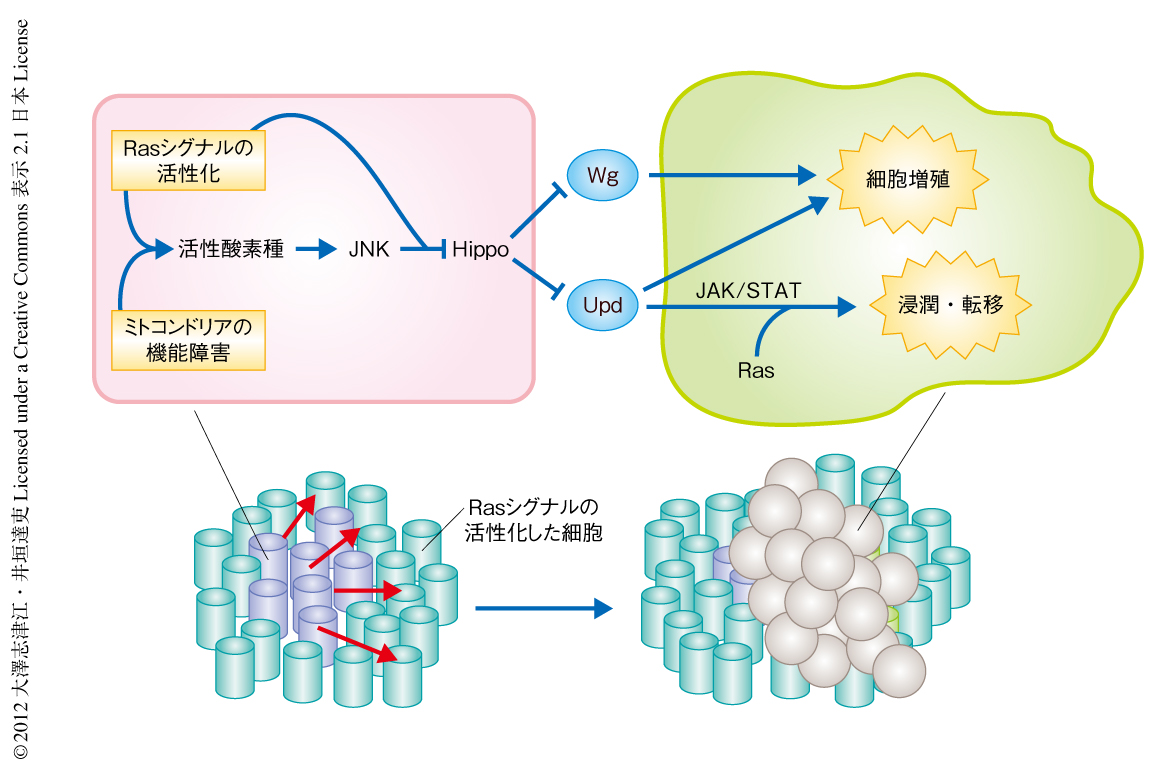
ここで,実際のヒトのがん組織を考えてみると,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞の周辺には,正常な細胞のみならず,Rasシグナルの活性化した(正常なミトコンドリア機能をもつ)良性の腫瘍細胞の存在することが想定される.そこで,そのような状況をショウジョウバエの上皮において遺伝学的に再現しその表現型を解析した.ショウジョウバエの複眼原基の組織全体においてRasシグナルを活性化すると,細胞は過剰に増殖するものの浸潤能あるいは転移能は示さない.興味深いことに,このようにRasシグナルを組織全体で活性化した複眼原基において,ミトコンドリアの機能障害を同時に起こした細胞をパッチ状に誘導すると,その周辺に存在する正常なミトコンドリア機能をもつRasシグナルの活性化した細胞は,過剰に増殖するだけでなく,隣接する組織や器官へと浸潤し転移する能力を獲得することがわかった(図2).すなわち,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はその周辺の良性腫瘍を悪性化する能力をもつことが明らかになった.
ミトコンドリアの機能障害とがんとの関係は古くから注目されてきた.これは,Warburgによる“がん細胞は正常な細胞とは異なり,酸素の濃度が十分な条件においてもミトコンドリアにおける酸化的リン酸化を使わず解糖系によりエネルギーを産生する”という観察(Warburg効果)に端を発する4).Warburgは1950年代,この観察結果から,がん組織ではミトコンドリアに機能障害の起こっている可能性,さらには,ミトコンドリアの機能障害ががん化を駆動するという仮説(Warburg仮説)を提唱した5).このWarburg仮説の提唱から約60年の時をへて,実際に,がん組織においてミトコンドリアの機能障害が高頻度に認められることがわかってきた6-8).とくに,ミトコンドリア呼吸鎖複合体の構成タンパク質をコードするミトコンドリアDNAには,膵臓がんにおいて高頻度に変異が見い出されているが,膵臓がんではRasシグナルの活性化も90%以上ときわめて高頻度に認められることが知られている9).したがって,今回,ショウジョウバエにおいて明らかになったミトコンドリアの機能障害とRasシグナルの活性化により誘発される細胞に非自律的な腫瘍悪性化の機構は,ヒトのがん組織における細胞間コミュニケーションを介したがんの進展に寄与している可能性が考えられる.
略歴:2008年 東京大学大学院薬学系研究科博士後期課程 修了,同年より神戸大学大学院医学研究科 研究員.
研究テーマ:細胞間コミュニケーションを介した組織成長の制御機構の分子基盤.
抱負:多細胞コミュニティーのなかで細胞どうしが互いに影響しあうことにより正確な大きさおよびかたちをもつ組織が形成される分子機構を明らかにしたい.
井垣 達吏(Tatsushi Igaki)
神戸大学大学院医学研究科 准教授.
研究室URL:http://www.med.kobe-u.ac.jp/igalab/index.html
© 2012 大澤志津江・井垣達吏 Licensed under CC 表示 2.1 日本
(神戸大学大学院医学研究科 遺伝学分野)
email:大澤志津江,井垣達吏
DOI: 10.7875/first.author.2012.136
Mitochondrial defect drives non-autonomous tumour progression through Hippo signalling in Drosophila.
Shizue Ohsawa, Yoshitaka Sato, Masato Enomoto, Mai Nakamura, Aya Betsumiya, Tatsushi Igaki
Nature, 490, 547-551 (2012)
要 約
ヒトのがんにおいてはミトコンドリアの機能障害が高頻度に認められるが,その意義はこれまでほとんど不明であった.筆者らは,ショウジョウバエの上皮をモデル系とした遺伝学的な解析により,ミトコンドリアの機能障害はがん遺伝子Rasの活性化と協調することにより周辺組織の腫瘍の悪性化をひき起こすことを見い出した.ミトコンドリアの機能障害とRasシグナルの活性化を同時に起こした細胞においては活性酸素種が大量に産生され,これがJNKシグナルを活性化することがわかった.さらに,JNKシグナルがRasシグナルと協調することによりがん抑制経路であるHippo経路が不活性化され,これにより分泌性の増殖因子であるUpdやWgの発現が誘導されることで,その周辺の良性腫瘍は浸潤能および転移能を獲得することが明らかになった.ミトコンドリアに機能障害を起こしたヒトのがん組織においても,同様の分子機構がはたらいている可能性が考えられる.
はじめに
がんは複数の突然変異の蓄積により発生し進展すると考えられている.たとえば,あるひとつの上皮細胞は腫瘍原性の突然変異(がん遺伝子の活性化やがん抑制遺伝子の不活性化)を多段階的に蓄積し,さまざまな選択圧を克服しながら増殖能や浸潤能および転移能を獲得することによりがん化していくと考えられる.一方,最近になり,がんの発生および進展はこのような細胞の“自律的な”変異の蓄積のみによりひき起こされているのではなく,細胞どうしの相互作用を介した“非遺伝的な”変化も重要な役割を担っていることがわかってきた.たとえば,上皮に由来するがんの周辺には上皮細胞のほかにも間質細胞である線維芽細胞や免疫系細胞,炎症細胞などが存在するが,上皮のがん細胞はこれらの細胞と相互作用することによっても増殖能や浸潤能および転移能を獲得すると推察されている1).また,ヒトのがん組織は必ずしも単一の細胞を起源とする遺伝的な背景をもつわけではなく,異なる遺伝的な背景をもつヘテロな細胞の集団であることもわかってきた2,3).これらの事実は,異なる性質をもつ細胞どうしの相互作用が,がんの発生および進展に重要な役割をはたしている可能性を示唆している.しかし,そのような細胞間の相互作用がいかにしてがんの発生および進展に寄与しているのか,その分子機構はほとんどわかっていない.その理由として,生物の個体においてひき起こされる細胞に非自律的な影響を系統的に解析できるすぐれたモデル系の存在しなかったことがあげられる.この研究では,この問題を克服しうるモデル系として,ショウジョウバエにおけるモザイククローン法を用いた腫瘍悪性化モデルを利用し,細胞間コミュニケーションを介した腫瘍悪性化の分子機構の遺伝学的な解析を行った.
1.ミトコンドリアの機能障害とRasシグナルの活性化により周辺細胞の増殖が促進される
細胞間コミュニケーションを介した腫瘍悪性化の分子機構を解析するため,ショウジョウバエの上皮をモデル系として遺伝学的なスクリーニングを行った.具体的には,ショウジョウバエ3齢幼虫の複眼原基の上皮組織にがん遺伝子Rasを活性化した細胞のクローンを誘導するとこれらの細胞は過剰に増殖し良性腫瘍を形成するが,この良性腫瘍にさらに変異を導入しその表現型の変化をスクリーニングした.その結果,変異の導入されたRas遺伝子の活性化した細胞それ自体ではなく,その周辺に存在する野生型の細胞が非自律的に増殖を促進するという一連の興味深い変異体が単離され,nag(non-cell autonomous growth)変異体と命名した.これら一連のnag変異体の責任遺伝子を解析した結果,ミトコンドリア呼吸鎖複合体の構成タンパク質をコードする遺伝子,あるいは,その合成にかかわるミトコンドリアリボソームタンパク質をコードする遺伝子に変異の集中していることが判明した.すなわち,ミトコンドリアの機能障害とRasシグナルの活性化が同時に起こると,その周辺の正常な細胞の増殖能は亢進することがわかった(図1).そこで,このミトコンドリアの機能障害とRasシグナルの活性化によりひき起こされる細胞に非自律的な増殖の促進機構の解析を進めることにした.
2.細胞に非自律的な増殖の促進はUpd-JAK/STATシグナルを介して起こる
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞が非自律的な増殖の促進をひき起こす分子機構を明らかにするため,この現象を起こすのに必要な遺伝子のスクリーニングを行った.具体的には,一連のショウジョウバエ染色体欠失系統ライブラリーを用い,ミトコンドリアの機能障害とRasシグナルの活性化を同時に起こした細胞クローンにひき起こされる細胞に非自律的な増殖を,抑制(サプレッサー)あるいは亢進(エンハンサー)する染色体の欠失を探索した.このスクリーニングにより単離された強力なサプレッサー活性を示す染色体の欠失のなかには,stat92E遺伝子が含まれていた.Stat92EはショウジョウバエのJAK/STAT経路において機能する転写因子であり,そのリガンドとして,炎症性サイトカインであるインターロイキン6のホモログUpdが知られている.実際に,ミトコンドリアの機能障害とRasシグナルの活性化を起こした細胞ではUpdの発現が誘導され,これによりJAK/STAT経路の活性化を介し周辺細胞の増殖の促進されていることがわかった.
3.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はJNKシグナルの活性化を介しUpdの発現を誘導する
Updの発現はJNKシグナルやNotchシグナルにより制御されていることが知られている.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞においてJNKシグナルを抑制するとUpdの発現誘導が起こらなくなり,かつ,細胞に非自律的な増殖も強く抑制されることがわかった.一方,Notchの機能を抑制しても細胞に非自律的な増殖は抑制されなかった.さらに,JNKシグナルの活性をその標的遺伝子の発現レベルにより解析した結果,ミトコンドリアの機能障害のみ,あるいは,Rasシグナルの活性化のみを起こした細胞では低レベルのJNK活性しか認められなかったが,この2つを同時に起こした細胞ではJNKシグナルの非常に強い活性化が検出された.以上の結果から,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞ではJNKシグナルが協調的に活性化し,これによりUpdの発現が誘導されているものと考えられた.
4.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞は酸化ストレスを介しJNKシグナルを活性化する
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞においてJNKシグナルが活性化する分子機構を解析した.JNKシグナルは活性酸素種などさまざまな細胞内ストレスにより活性化されることが知られている.興味深いことに,ミトコンドリアの機能障害のみ,あるいは,Rasシグナルの活性化のみを起こした細胞では活性酸素種の産生や酸化ストレスは認められなかったが,この2つを同時に起こした細胞では活性酸素種を大量に産生し酸化ストレスをひき起こしていることが明らかになった.さらに,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞において抗酸化酵素を強制発現させることにより酸化ストレスを軽減させると,JNKシグナルの活性化は抑制され細胞に非自律的な増殖も抑制された.これらの結果から,ミトコンドリアの機能障害とRasシグナルの活性化は活性酸素種の産生を協調的に誘導し,これがJNKシグナルを活性化してUpdの発現を誘導するものと考えられた.
5.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はHippo経路の不活性化を介しUpdおよびWgの発現を誘導する
ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞において活性化するJNKシグナルが細胞に非自律的な増殖に対し必須であることがわかったが,JNKシグナルの活性化はUpdの発現誘導には十分ではないことも明らかになった.解析を進めた結果,JNKシグナルの活性化と同時にRasシグナルの活性化の起こることがUpdの発現誘導に必要十分であることがわかった.その分子機構として,RasシグナルとJNKシグナルの活性化とが起こるとがん抑制経路のひとつHippo経路が不活性化し,これによりUpdの発現が誘導されることがわかった.
Hippo経路は進化的に保存されたがん抑制経路であり,転写コアクチベーターであるYki(Yapのホモログ)をリン酸化し抑制することにより細胞の増殖を負に制御する.最近,upd遺伝子はYkiの転写ターゲット遺伝子のひとつであることが報告されたことから,JNKシグナルとRasシグナルとを活性化した細胞がYkiを介しUpdの発現を誘導している可能性が考えられた.これを検証した結果,JNKシグナルとRasシグナルとを活性化した細胞ではYkiの特異的な転写ターゲット遺伝子であるexpanded遺伝子やcyclin E遺伝子,daip1遺伝子などの発現が強く誘導されていることがわかった.同様に,ミトコンドリアの機能障害とRasシグナルの活性化とを起した細胞においても,これらYkiの転写ターゲット遺伝子の発現は強く誘導されていた.さらに,これらYkiの転写ターゲット遺伝子の発現は,Hippo経路の活性化(Ykiの不活性化)を起こしたりYkiの発現を阻害したりすることにより強く抑制されることがわかった.くわえて,Ykiの別の転写ターゲット遺伝子の産物である分泌性の増殖因子Wg(Wntのホモログ)の発現もRasシグナルとJNKシグナルの協調により誘導されること,また,Wgの発現誘導もミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞による周辺細胞の増殖の促進に貢献していることが遺伝学的に明らかになった.
以上の結果から,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はHippo経路を不活性化することによりYkiの活性化を介しUpdやWgの発現を誘導し,これらの分泌性の増殖因子が周辺細胞の増殖を促進しているものと考えられた(図2).
6.ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞は周辺の良性腫瘍を悪性化する
ここで,実際のヒトのがん組織を考えてみると,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞の周辺には,正常な細胞のみならず,Rasシグナルの活性化した(正常なミトコンドリア機能をもつ)良性の腫瘍細胞の存在することが想定される.そこで,そのような状況をショウジョウバエの上皮において遺伝学的に再現しその表現型を解析した.ショウジョウバエの複眼原基の組織全体においてRasシグナルを活性化すると,細胞は過剰に増殖するものの浸潤能あるいは転移能は示さない.興味深いことに,このようにRasシグナルを組織全体で活性化した複眼原基において,ミトコンドリアの機能障害を同時に起こした細胞をパッチ状に誘導すると,その周辺に存在する正常なミトコンドリア機能をもつRasシグナルの活性化した細胞は,過剰に増殖するだけでなく,隣接する組織や器官へと浸潤し転移する能力を獲得することがわかった(図2).すなわち,ミトコンドリアの機能障害とRasシグナルの活性化とを起こした細胞はその周辺の良性腫瘍を悪性化する能力をもつことが明らかになった.
おわりに
ミトコンドリアの機能障害とがんとの関係は古くから注目されてきた.これは,Warburgによる“がん細胞は正常な細胞とは異なり,酸素の濃度が十分な条件においてもミトコンドリアにおける酸化的リン酸化を使わず解糖系によりエネルギーを産生する”という観察(Warburg効果)に端を発する4).Warburgは1950年代,この観察結果から,がん組織ではミトコンドリアに機能障害の起こっている可能性,さらには,ミトコンドリアの機能障害ががん化を駆動するという仮説(Warburg仮説)を提唱した5).このWarburg仮説の提唱から約60年の時をへて,実際に,がん組織においてミトコンドリアの機能障害が高頻度に認められることがわかってきた6-8).とくに,ミトコンドリア呼吸鎖複合体の構成タンパク質をコードするミトコンドリアDNAには,膵臓がんにおいて高頻度に変異が見い出されているが,膵臓がんではRasシグナルの活性化も90%以上ときわめて高頻度に認められることが知られている9).したがって,今回,ショウジョウバエにおいて明らかになったミトコンドリアの機能障害とRasシグナルの活性化により誘発される細胞に非自律的な腫瘍悪性化の機構は,ヒトのがん組織における細胞間コミュニケーションを介したがんの進展に寄与している可能性が考えられる.
文 献
- Bissell, M. J. & Hines, W. C.: Why don't we get more cancer? A proposed role of the microenvironment in restraining cancer progression. Nat. Med., 17, 320-329 (2011)[PubMed]
- Going, J. J.: Epithelial carcinogenesis: challenging monoclonality. J. Pathol., 200, 1-3 (2003)[PubMed]
- Novelli, M. R., Williamson, J. A., Tomlinson, I. P. et al.: Polyclonal origin of colonic adenomas in an XO/XY patient with FAP. Science, 272, 1187-1190 (1996)[PubMed]
- Warburg, O., Posener, E. & Negelein, E.: Ueber den Stoffwechsel der Tumoren. Biochem. Z., 152, 319-344 (1924)
- Warburg, O.: On the origin of cancer cells. Science, 123, 309-314 (1956)[PubMed]
- Brandon, M., Baldi, P. & Wallace, D. C.: Mitochondrial mutations in cancer. Oncogene, 25, 4647-4662 (2006)[PubMed]
- Carew, J. S. & Huang, P.: Mitochondrial defects in cancer. Mol. Cancer, 1, 9 (2002)[PubMed]
- Modica-Napolitano, J. S., Kulawiec, M. & Singh, K. K.: Mitochondria and human cancer. Curr. Mol. Med., 7, 121-131 (2007)[PubMed]
- Downward, J.: Targeting RAS signalling pathways in cancer therapy. Nat. Rev. Cancer, 3, 11-22 (2003)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院薬学系研究科博士後期課程 修了,同年より神戸大学大学院医学研究科 研究員.
研究テーマ:細胞間コミュニケーションを介した組織成長の制御機構の分子基盤.
抱負:多細胞コミュニティーのなかで細胞どうしが互いに影響しあうことにより正確な大きさおよびかたちをもつ組織が形成される分子機構を明らかにしたい.
井垣 達吏(Tatsushi Igaki)
神戸大学大学院医学研究科 准教授.
研究室URL:http://www.med.kobe-u.ac.jp/igalab/index.html
© 2012 大澤志津江・井垣達吏 Licensed under CC 表示 2.1 日本