Reelinはインテグリンα5β1を細胞内から活性化することにより細胞外基質との接着を亢進しニューロンの配置を制御する
関根克敏・仲嶋一範
(慶應義塾大学医学部 解剖学教室)
email:仲嶋一範
DOI: 10.7875/first.author.2012.137
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrinα5β1.
Katsutoshi Sekine, Takeshi Kawauchi, Ken-ichiro Kubo, Takao Honda, Joachim Herz, Mitsuharu Hattori, Tatsuo Kinashi, Kazunori Nakajima
Neuron, 76, 353-369 (2012)
大脳皮質のニューロンは誕生の時期に依存して整然と配置されることにより,大脳皮質の高度な機能に寄与していることが知られている.このニューロンの配置を決定するうえで細胞外タンパク質であるReelinが重要な役割を担っていることが知られているが,その詳細な分子機構は明らかではない.筆者らは,この研究において,Reelinはニューロンに発現しているReelin受容体に結合したのち,細胞内のシグナル伝達経路を介しインテグリンα5β1を細胞内から活性化していることを見い出した.そして,このReelinシグナルを介したインテグリンα5β1の活性化によりフィブロネクチンへの接着が亢進されていることが示された.さらに,インテグリンα5β1の活性化はニューロンの最終的な配置の決定に重要であることを見い出した.これらの結果から,Reelinに依存したニューロンと細胞外基質との接着の亢進が,大脳皮質におけるニューロンの配置を決定するうえで重要であることが示唆された.
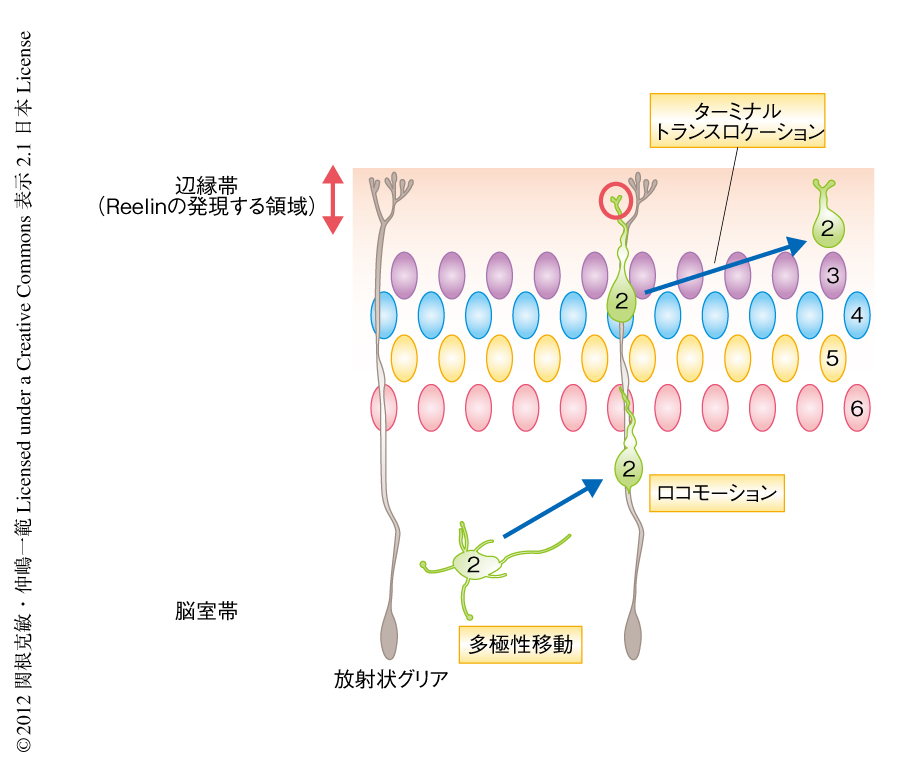
哺乳類の大脳皮質は多くのニューロンが整然と並んだ6層からなる構造を形成しており,この構造は哺乳類が進化の過程で獲得した特別な形質であるものと考えられている.この層構造の形成過程において,大脳皮質のニューロンのうち7~8割をしめる興奮性ニューロンは脳の深部にある脳室の周囲で誕生し,脳の表面にむかい放射状に移動して,表層の付近で正しく移動を終了する.この際,遅く生まれたニューロンは早く生まれたニューロンをすべて乗り越えて,より表層の側に到達して停止することから,最終的には早く生まれたニューロンが深層に,遅く生まれたニューロンが表層に並ぶ“inside-out”型とよばれる様式で層構造を形成する(図1).興味深いことに,ニューロンは大脳皮質の最表層(辺縁帯とよばれる細胞の少ない領域)には決して進入しない.この層構造の形成における異常は,発達障害や統合失調症,てんかんといった精神神経疾患の患者に多数報告されていることから,ニューロンを正しく配置させることが大脳皮質の高度な機能を発揮させるうえで重要であることが示唆されている.
近年の生細胞イメージング法の発達により,ニューロンは移動様式を複雑に変化させながら動いていることがわかってきた.大脳皮質の興奮性ニューロンの場合,まず,多数の突起を伸び縮みさせながらただようように動く“多極性移動”とよばれる移動様式をとったのち1),すでに移動を終えたニューロンの集団のなかを遅く生まれたニューロンが脳を貫くように走る長い線維(放射状グリア)につかまりながらよじ登っていく“ロコモーション”とよばれる移動様式に変化する2)(図1).しかし,放射状グリアの線維は辺縁帯を貫いて脳の表層にまで伸びているにもかかわらず,なぜニューロンはその途中の辺縁帯の直下で移動を終了するのか不明であった.
筆者らは,辺縁帯で発現し大脳皮質の層構造の形成に決定的な役割をもつReelinとよばれる細胞外タンパク質に着目した.Reelinの異常は滑脳症とよばれる脳構造の異常の原因のひとつであり,統合失調症や自閉症など精神神経疾患との関連も示唆されている.Reelinを欠損したマウスにおいては大脳皮質の層構造がおおまかに逆転してしまうことから,Reelinの層構造の形成における重要性が示唆されてきた.ReelinはApoER2/VLDLRとよばれる移動しているニューロンに発現しているReelin受容体と結合したのち,細胞内タンパク質であるDab1をリン酸化することが知られている.しかし,実際の大脳皮質の形成過程においてReelinがニューロンのinside-out型の配置をいかに制御しているかは,Reelin欠損マウスの発見から半世紀以上が経過しているにもかかわらず依然として謎のままであった.
最近,筆者らは,発生期の大脳皮質において辺縁帯の直下に一過性に観察される特徴的な領域を同定し,原皮質帯(primitive cortical zone:PCZ)と命名した.そして,Reelinがこの原皮質帯へのニューロンの進入にかかわる特殊な移動様式(ターミナルトランスロケーションとよばれている)を制御していること,原皮質帯はニューロンの最終的なinside-out型の配置が決定される場所であることを報告した3).この研究においては,Reelinと原皮質帯との関係に着目し,ニューロンのinside-out型の配置の制御における分子機構を明らかにすることを目的とした.
筆者らの研究室において開発された,簡便な遺伝子導入法である子宮内電気穿孔法により4),ニューロンの原皮質帯への進入の分子機構を解析した.この手法は,妊娠したマウスを麻酔し腹部に切開を入れて胎仔を子宮ごと取り出し,微小ガラスピペットを用いてその側脳室にプラスミドを注入して,パルス電流を流すことにより任意の時期に任意の場所においてニューロンへの遺伝子導入を可能にする技術である.
まず,ニューロンの原皮質帯への進入にDab1のリン酸化が必要であるかどうかを検討した.ReelinによりDab1のもつ複数のチロシン残基がリン酸化されることが知られている.Dab1の発現をRNAi法によりノックダウンするとニューロンの原皮質帯への進入は阻害されたが,この表現型は野生型のDab1を同時に導入することによりもとにもどった.しかし,Reelinによりリン酸化されるすべてのチロシン残基を変異させリン酸化を起こらなくした変異Dab1の導入ではもとにもどらないことが観察された.そこでさらに解析を進め,ニューロンの原皮質帯への進入にはDab1の220番目ないし232番目のチロシン残基のリン酸化が必要であることを見い出した.
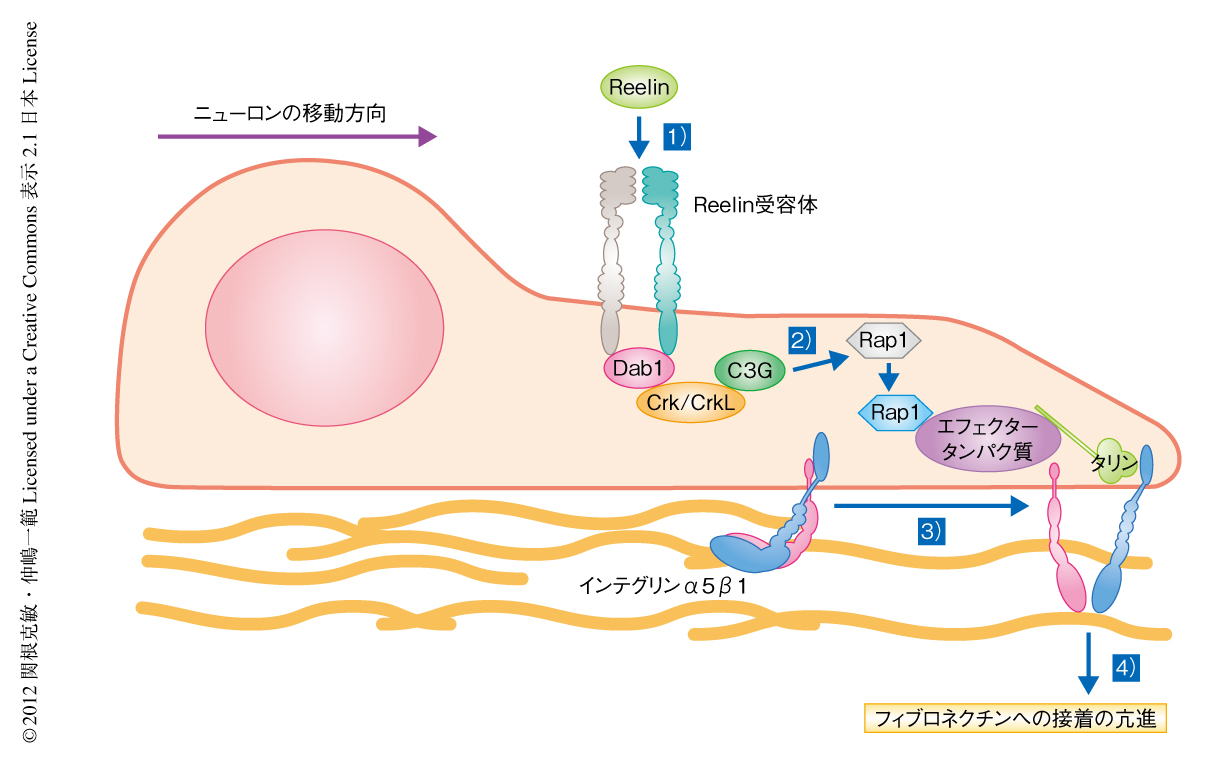
過去の知見から複数のDab1の下流タンパク質の候補が知られていたが,実験により,Crk/CrkLおよびNckβとよばれるタンパク質が候補としてあげられた.そこでRNAi法を用いて解析したところ,Crk/CrkLは確かに原皮質帯への進入を含むニューロンの移動を制御していたがNckβのノックダウンはニューロンの移動に大きな影響をあたえないことがわかった.さらに,Crk/CrkLと結合しReelinにより活性化されるC3Gとよばれるタンパク質も,ニューロンの原皮質帯への進入に必要であることが見い出された.C3GはRap1とよばれる低分子量Gタンパク質の活性化タンパク質であることが知られている.そこでつぎに,Rap1の機能を解析するためSpa1というRap1の阻害タンパク質を子宮内電気穿孔法により移動しているニューロンに導入した.その結果,興味深いことに,Spa1の発現量を増大させRap1を強力に阻害した場合には多極性移動からロコモーションへの変換が阻害されるのに対し,Rap1を弱く阻害した場合はニューロンの原皮質帯への進入に異常の生じることがわかった.過去の報告において,RA-GEF1とよばれる別のC3Gの活性化タンパク質がニューロンの移動初期にかかわることが知られている5).この結果から,Rap1は移動過程の多くの段階において異なる役割を担っていることが示唆され,ReelinによるC3Gを介したRap1の活性化がニューロンの原皮質帯への進入を制御していることがわかった.
ニューロンの原皮質帯への進入は放射状グリアに依存しない特殊な移動様式であるターミナルトランスロケーションにより起こることから6),ニューロンは周囲の細胞外環境を足場にして動いて移動を終了するのではないかという仮説をたてた.筆者らは以前に,原皮質帯を含む脳の表面において特異的に発現するタンパク質について報告したが7),そのうち,細胞の移動に重要な足場となる細胞外マトリックスのひとつフィブロネクチンが多く発現していることに着目した.フィブロネクチンは移動している細胞のもつ細胞接着分子のひとつインテグリンα5β1と結合することが知られている.移動しているニューロンは先導突起とよばれる突起を伸ばし,つづいて核を含む細胞体を持ち上げ,さらにまた先導突起を伸ばし,という過程をくり返すことで移動しているが,原皮質帯の付近のフィブロネクチンの発現している部位では,移動しているニューロンの先導突起において,インテグリンβ1が活性化していることを,活性化インテグリンβ1を特異的に認識する抗体を用いて見い出した.
Reelin欠損マウスやReelin受容体ノックアウトマウス,Dab1ノックアウトマウスにおいて,このインテグリンβ1の活性化は観察されなかったことから,Reelinシグナルによるインテグリンα5β1の活性化がニューロンの原皮質帯への進入において重要なのではないかと考えた.そこでさらに解析を進めた結果,Reelinシグナルはインテグリンα5β1を活性化することを見い出し,Reelinシグナルによりフィブロネクチンへの接着が亢進することも明らかになった.そして,インテグリンα5β1の作用をRNAi法により阻害するとニューロンの原皮質帯への進入に異常が生じたことから,インテグリンα5β1はニューロンの原皮質帯への進入に必要であることがわかった.さらに,RNAi法によるReelin受容体の阻害によりニューロンの原皮質帯への進入が阻害された表現型は,インテグリンα5β1の恒常的な活性化型(および,別のReelinの下流タンパク質であるAkt)を導入することによりもとにもどったことから,Reelinの下流においてインテグリンα5β1の活性化が起こりニューロンの原皮質帯への進入を制御していることがわかった(図2).
インテグリンα5β1の阻害は,Reelinの阻害と同様に,ニューロンの最終的な配置であるinside-out型に影響をあたえるかどうかを,2日連続して子宮内電気穿孔法を行うことで,早く生まれたニューロンと遅く生まれたニューロンとを別々に標識することにより解析した.その結果,インテグリンα5β1の阻害により確かにニューロンの最終的な配置に乱れの生じることを確認した.以上の実験から,放射状グリアをつたって大脳皮質のなかをよじ登ってきたニューロンは,原皮質帯の直下に到達しその先導突起の先端でReelinを受け取ると,細胞内のシグナル伝達経路を介し先導突起においてインテグリンα5β1を活性化させることがわかった.その結果,ニューロンの原皮質帯への進入が起こり,最終的な配置部位,すなわち,原皮質帯の最表層の部分に正しく定着することが明らかになった.脳の深部で生まれ脳の表面にむかい移動するニューロンは,このしくみにより原皮質帯において早く生まれたニューロンを乗り越えつぎつぎと最表層に到達するため,ニューロンのinside-out型の層構造が形成されることがわかった.
この研究では,Reelinという細胞外タンパク質が細胞内のシグナル伝達経路を介しインテグリンα5β1を細胞内から活性化する経路を明らかにしたが,インテグリンα5β1そのものも細胞外からのシグナルを受け取り細胞内へとシグナルを伝えていることが知られている.このインテグリンα5β1を介した細胞外からのシグナル伝達経路が,どのようにして原皮質帯におけるニューロンの運動を制御しているのかは未解明のままであり,とくに,インテグリンを介した細胞骨格系の制御が重要と考えられる.
近年,試験管内における神経組織の再生の研究が進み,移植による脊髄損傷などの治療についても研究されているが,将来的には,脳血管の障害や神経変性疾患などにより損傷をうけた大脳皮質も再生医療の対象になりうるものと期待される.Reelinは大脳皮質を含め脳の多くの部位においてニューロンの正しい配置を制御しているため,この研究は,将来の脳の再生医療においてニューロンを正しく配置させる手法を確立するための基盤となることが期待される.
略歴:2012年 慶應義塾大学大学院医学研究科博士課程 修了,同年よりさいたま市立病院.
研究テーマ:大脳皮質の形成におけるReelinシグナルの解析.
抱負:医学部を卒業して7年になります.その間,臨床および研究の両面から多くの方々の指導をうけました.今後は,分子細胞レベルの視点も備えた総合的な医師をめざし努力を続けたいと考えています.
仲嶋 一範(Kazunori Nakajima)
慶應義塾大学医学部 教授.
研究室URL:http://plaza.umin.ac.jp/~Nakajima/
© 2012 関根克敏・仲嶋一範 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 解剖学教室)
email:仲嶋一範
DOI: 10.7875/first.author.2012.137
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrinα5β1.
Katsutoshi Sekine, Takeshi Kawauchi, Ken-ichiro Kubo, Takao Honda, Joachim Herz, Mitsuharu Hattori, Tatsuo Kinashi, Kazunori Nakajima
Neuron, 76, 353-369 (2012)
要 約
大脳皮質のニューロンは誕生の時期に依存して整然と配置されることにより,大脳皮質の高度な機能に寄与していることが知られている.このニューロンの配置を決定するうえで細胞外タンパク質であるReelinが重要な役割を担っていることが知られているが,その詳細な分子機構は明らかではない.筆者らは,この研究において,Reelinはニューロンに発現しているReelin受容体に結合したのち,細胞内のシグナル伝達経路を介しインテグリンα5β1を細胞内から活性化していることを見い出した.そして,このReelinシグナルを介したインテグリンα5β1の活性化によりフィブロネクチンへの接着が亢進されていることが示された.さらに,インテグリンα5β1の活性化はニューロンの最終的な配置の決定に重要であることを見い出した.これらの結果から,Reelinに依存したニューロンと細胞外基質との接着の亢進が,大脳皮質におけるニューロンの配置を決定するうえで重要であることが示唆された.
はじめに
哺乳類の大脳皮質は多くのニューロンが整然と並んだ6層からなる構造を形成しており,この構造は哺乳類が進化の過程で獲得した特別な形質であるものと考えられている.この層構造の形成過程において,大脳皮質のニューロンのうち7~8割をしめる興奮性ニューロンは脳の深部にある脳室の周囲で誕生し,脳の表面にむかい放射状に移動して,表層の付近で正しく移動を終了する.この際,遅く生まれたニューロンは早く生まれたニューロンをすべて乗り越えて,より表層の側に到達して停止することから,最終的には早く生まれたニューロンが深層に,遅く生まれたニューロンが表層に並ぶ“inside-out”型とよばれる様式で層構造を形成する(図1).興味深いことに,ニューロンは大脳皮質の最表層(辺縁帯とよばれる細胞の少ない領域)には決して進入しない.この層構造の形成における異常は,発達障害や統合失調症,てんかんといった精神神経疾患の患者に多数報告されていることから,ニューロンを正しく配置させることが大脳皮質の高度な機能を発揮させるうえで重要であることが示唆されている.
近年の生細胞イメージング法の発達により,ニューロンは移動様式を複雑に変化させながら動いていることがわかってきた.大脳皮質の興奮性ニューロンの場合,まず,多数の突起を伸び縮みさせながらただようように動く“多極性移動”とよばれる移動様式をとったのち1),すでに移動を終えたニューロンの集団のなかを遅く生まれたニューロンが脳を貫くように走る長い線維(放射状グリア)につかまりながらよじ登っていく“ロコモーション”とよばれる移動様式に変化する2)(図1).しかし,放射状グリアの線維は辺縁帯を貫いて脳の表層にまで伸びているにもかかわらず,なぜニューロンはその途中の辺縁帯の直下で移動を終了するのか不明であった.
筆者らは,辺縁帯で発現し大脳皮質の層構造の形成に決定的な役割をもつReelinとよばれる細胞外タンパク質に着目した.Reelinの異常は滑脳症とよばれる脳構造の異常の原因のひとつであり,統合失調症や自閉症など精神神経疾患との関連も示唆されている.Reelinを欠損したマウスにおいては大脳皮質の層構造がおおまかに逆転してしまうことから,Reelinの層構造の形成における重要性が示唆されてきた.ReelinはApoER2/VLDLRとよばれる移動しているニューロンに発現しているReelin受容体と結合したのち,細胞内タンパク質であるDab1をリン酸化することが知られている.しかし,実際の大脳皮質の形成過程においてReelinがニューロンのinside-out型の配置をいかに制御しているかは,Reelin欠損マウスの発見から半世紀以上が経過しているにもかかわらず依然として謎のままであった.
最近,筆者らは,発生期の大脳皮質において辺縁帯の直下に一過性に観察される特徴的な領域を同定し,原皮質帯(primitive cortical zone:PCZ)と命名した.そして,Reelinがこの原皮質帯へのニューロンの進入にかかわる特殊な移動様式(ターミナルトランスロケーションとよばれている)を制御していること,原皮質帯はニューロンの最終的なinside-out型の配置が決定される場所であることを報告した3).この研究においては,Reelinと原皮質帯との関係に着目し,ニューロンのinside-out型の配置の制御における分子機構を明らかにすることを目的とした.
1.ニューロンの原皮質帯への進入を制御するシグナル伝達経路
筆者らの研究室において開発された,簡便な遺伝子導入法である子宮内電気穿孔法により4),ニューロンの原皮質帯への進入の分子機構を解析した.この手法は,妊娠したマウスを麻酔し腹部に切開を入れて胎仔を子宮ごと取り出し,微小ガラスピペットを用いてその側脳室にプラスミドを注入して,パルス電流を流すことにより任意の時期に任意の場所においてニューロンへの遺伝子導入を可能にする技術である.
まず,ニューロンの原皮質帯への進入にDab1のリン酸化が必要であるかどうかを検討した.ReelinによりDab1のもつ複数のチロシン残基がリン酸化されることが知られている.Dab1の発現をRNAi法によりノックダウンするとニューロンの原皮質帯への進入は阻害されたが,この表現型は野生型のDab1を同時に導入することによりもとにもどった.しかし,Reelinによりリン酸化されるすべてのチロシン残基を変異させリン酸化を起こらなくした変異Dab1の導入ではもとにもどらないことが観察された.そこでさらに解析を進め,ニューロンの原皮質帯への進入にはDab1の220番目ないし232番目のチロシン残基のリン酸化が必要であることを見い出した.
過去の知見から複数のDab1の下流タンパク質の候補が知られていたが,実験により,Crk/CrkLおよびNckβとよばれるタンパク質が候補としてあげられた.そこでRNAi法を用いて解析したところ,Crk/CrkLは確かに原皮質帯への進入を含むニューロンの移動を制御していたがNckβのノックダウンはニューロンの移動に大きな影響をあたえないことがわかった.さらに,Crk/CrkLと結合しReelinにより活性化されるC3Gとよばれるタンパク質も,ニューロンの原皮質帯への進入に必要であることが見い出された.C3GはRap1とよばれる低分子量Gタンパク質の活性化タンパク質であることが知られている.そこでつぎに,Rap1の機能を解析するためSpa1というRap1の阻害タンパク質を子宮内電気穿孔法により移動しているニューロンに導入した.その結果,興味深いことに,Spa1の発現量を増大させRap1を強力に阻害した場合には多極性移動からロコモーションへの変換が阻害されるのに対し,Rap1を弱く阻害した場合はニューロンの原皮質帯への進入に異常の生じることがわかった.過去の報告において,RA-GEF1とよばれる別のC3Gの活性化タンパク質がニューロンの移動初期にかかわることが知られている5).この結果から,Rap1は移動過程の多くの段階において異なる役割を担っていることが示唆され,ReelinによるC3Gを介したRap1の活性化がニューロンの原皮質帯への進入を制御していることがわかった.
2.Reelinシグナルによるインテグリンα5β1の活性化
ニューロンの原皮質帯への進入は放射状グリアに依存しない特殊な移動様式であるターミナルトランスロケーションにより起こることから6),ニューロンは周囲の細胞外環境を足場にして動いて移動を終了するのではないかという仮説をたてた.筆者らは以前に,原皮質帯を含む脳の表面において特異的に発現するタンパク質について報告したが7),そのうち,細胞の移動に重要な足場となる細胞外マトリックスのひとつフィブロネクチンが多く発現していることに着目した.フィブロネクチンは移動している細胞のもつ細胞接着分子のひとつインテグリンα5β1と結合することが知られている.移動しているニューロンは先導突起とよばれる突起を伸ばし,つづいて核を含む細胞体を持ち上げ,さらにまた先導突起を伸ばし,という過程をくり返すことで移動しているが,原皮質帯の付近のフィブロネクチンの発現している部位では,移動しているニューロンの先導突起において,インテグリンβ1が活性化していることを,活性化インテグリンβ1を特異的に認識する抗体を用いて見い出した.
Reelin欠損マウスやReelin受容体ノックアウトマウス,Dab1ノックアウトマウスにおいて,このインテグリンβ1の活性化は観察されなかったことから,Reelinシグナルによるインテグリンα5β1の活性化がニューロンの原皮質帯への進入において重要なのではないかと考えた.そこでさらに解析を進めた結果,Reelinシグナルはインテグリンα5β1を活性化することを見い出し,Reelinシグナルによりフィブロネクチンへの接着が亢進することも明らかになった.そして,インテグリンα5β1の作用をRNAi法により阻害するとニューロンの原皮質帯への進入に異常が生じたことから,インテグリンα5β1はニューロンの原皮質帯への進入に必要であることがわかった.さらに,RNAi法によるReelin受容体の阻害によりニューロンの原皮質帯への進入が阻害された表現型は,インテグリンα5β1の恒常的な活性化型(および,別のReelinの下流タンパク質であるAkt)を導入することによりもとにもどったことから,Reelinの下流においてインテグリンα5β1の活性化が起こりニューロンの原皮質帯への進入を制御していることがわかった(図2).
3.インテグリンα5β1の活性化によるニューロンのinside-out型の層構造の形成
インテグリンα5β1の阻害は,Reelinの阻害と同様に,ニューロンの最終的な配置であるinside-out型に影響をあたえるかどうかを,2日連続して子宮内電気穿孔法を行うことで,早く生まれたニューロンと遅く生まれたニューロンとを別々に標識することにより解析した.その結果,インテグリンα5β1の阻害により確かにニューロンの最終的な配置に乱れの生じることを確認した.以上の実験から,放射状グリアをつたって大脳皮質のなかをよじ登ってきたニューロンは,原皮質帯の直下に到達しその先導突起の先端でReelinを受け取ると,細胞内のシグナル伝達経路を介し先導突起においてインテグリンα5β1を活性化させることがわかった.その結果,ニューロンの原皮質帯への進入が起こり,最終的な配置部位,すなわち,原皮質帯の最表層の部分に正しく定着することが明らかになった.脳の深部で生まれ脳の表面にむかい移動するニューロンは,このしくみにより原皮質帯において早く生まれたニューロンを乗り越えつぎつぎと最表層に到達するため,ニューロンのinside-out型の層構造が形成されることがわかった.
おわりに
この研究では,Reelinという細胞外タンパク質が細胞内のシグナル伝達経路を介しインテグリンα5β1を細胞内から活性化する経路を明らかにしたが,インテグリンα5β1そのものも細胞外からのシグナルを受け取り細胞内へとシグナルを伝えていることが知られている.このインテグリンα5β1を介した細胞外からのシグナル伝達経路が,どのようにして原皮質帯におけるニューロンの運動を制御しているのかは未解明のままであり,とくに,インテグリンを介した細胞骨格系の制御が重要と考えられる.
近年,試験管内における神経組織の再生の研究が進み,移植による脊髄損傷などの治療についても研究されているが,将来的には,脳血管の障害や神経変性疾患などにより損傷をうけた大脳皮質も再生医療の対象になりうるものと期待される.Reelinは大脳皮質を含め脳の多くの部位においてニューロンの正しい配置を制御しているため,この研究は,将来の脳の再生医療においてニューロンを正しく配置させる手法を確立するための基盤となることが期待される.
文 献
- Tabata, H. & Nakajima, K.: Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. J. Neurosci., 23, 9996-10001 (2003)[PubMed]
- Rakic, P.: Mode of cell migration to the superficial layers of fetal monkey neocortex. J. Comp. Neurol., 145, 61-83 (1972)[PubMed]
- Sekine, K., Honda, T., Kawauchi, T. et al.: The outermost region of the developing cortical plate is crucial for both the switch of the radial migration mode and the dab1-dependent "inside-out" lamination in the neocortex. J. Neurosci., 31, 9426-9439 (2011)[PubMed]
- Tabata, H. & Nakajima, K.: Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience, 103, 865-872 (2001)[PubMed]
- Bilasy, S. E., Satoh, T., Ueda, S. et al.: Dorsal telencephalon-specific RA-GEF-1 knockout mice develop heterotopic cortical mass and commissural fiber defect. Eur. J. Neurosci., 29, 1994-2008 (2009)[PubMed]
- Nadarajah, B., Brunstrom, J. E., Grutzendler, J. et al.: Two modes of radial migration in early development of the cerebral cortex. Nat. Neurosci., 4, 143-150 (2001)[PubMed]
- Tachikawa, K., Sasaki, S., Maeda, T. et al.: Identification of molecules preferentially expressed beneath the marginal zone in the developing cerebral cortex. Neurosci. Res., 60, 135-146 (2008)[PubMed]
著者プロフィール
略歴:2012年 慶應義塾大学大学院医学研究科博士課程 修了,同年よりさいたま市立病院.
研究テーマ:大脳皮質の形成におけるReelinシグナルの解析.
抱負:医学部を卒業して7年になります.その間,臨床および研究の両面から多くの方々の指導をうけました.今後は,分子細胞レベルの視点も備えた総合的な医師をめざし努力を続けたいと考えています.
仲嶋 一範(Kazunori Nakajima)
慶應義塾大学医学部 教授.
研究室URL:http://plaza.umin.ac.jp/~Nakajima/
© 2012 関根克敏・仲嶋一範 Licensed under CC 表示 2.1 日本