Ups1-Mdm35複合体によるミトコンドリア膜間におけるホスファチジン酸の輸送
龍田高志・Thomas Langer
(ドイツCologne大学Institute for Genetics)
email:龍田高志
DOI: 10.7875/first.author.2012.131
Intramitochondrial transport of phosphatidic acid in yeast by a lipid transfer protein.
Melanie Connerth, Takashi Tatsuta, Mathias Haag, Till Klecker, Benedikt Westermann, Thomas Langer
Science, 338, 815-818 (2012)
ミトコンドリアが正常に機能するためには,それを構成する生体膜の脂質組成が保たれている必要がある.なかでも,ミトコンドリア内膜において合成されるカルジオリピンはミトコンドリアに特有でありその機能にも重要な脂質である.その前駆体であるホスファチジン酸は小胞体よりミトコンドリアにもたらされるが,それがどのようにしてミトコンドリアへ,そして,ミトコンドリア膜間において輸送されているのかについては不明であった.これに関連して,最近,出芽酵母においてミトコンドリア膜間腔に存在するUps1の欠損によりカルジオリピンの量の低下することが報告されていた.筆者らは,遺伝学的な手法と脂質の定量的な質量分析により,Ups1がカルジオリピン合成経路のごく初期においてホスファチジン酸の供給に必要であること,また,in vitroの再構成系により,Ups1はMdm35と複合体を形成しホスファチジン酸をミトコンドリア膜間において輸送しうることを示した.筆者らは,この知見をベースとして,ミトコンドリアにおける脂質の輸送と合成経路についてその全容の解明に取り組んでいる.
図鑑に載っていた真核細胞のイラストを初めて見たとき,核や細胞内小器官のかたちを奇妙に思ったことをよく覚えている.実際の細胞ではこれら生体膜でできた構造は柔らかくてダイナミックに動いているのだが,瞬間的にそういうかたちをとることは確かだろう.しかし,どうやってこれら膜構造のアイデンティティとかたちが保たれ,正しく機能をすることができるのだろう? 生体膜を構成する主要な物質は脂質である.ひとつの細胞には1000種類をこえる脂質があり,また,それぞれの膜構造の脂質組成は驚くほど異なっている1).これは,それぞれの生体膜における脂質組成をきちんと保つことが,そのかたちを決め生命活動をつつがなく行うのに必要であることを示している.脂質はおもに小胞体において合成されるが,ほかのオルガネラにおいて合成されるものもある.それらが細胞においてどのように分配され,それぞれの生体膜の脂質組成が保たれているのだろう? 近年の研究から,小胞体,ゴルジ体,細胞膜のあいだでは,おもに膜そのものを輸送する小胞輸送経路をつうじ脂質の輸送は行われるとされている1).では,ミトコンドリアのように小胞輸送経路に組み込まれていないオルガネラの脂質組成はどうやって保たれているのだろう?
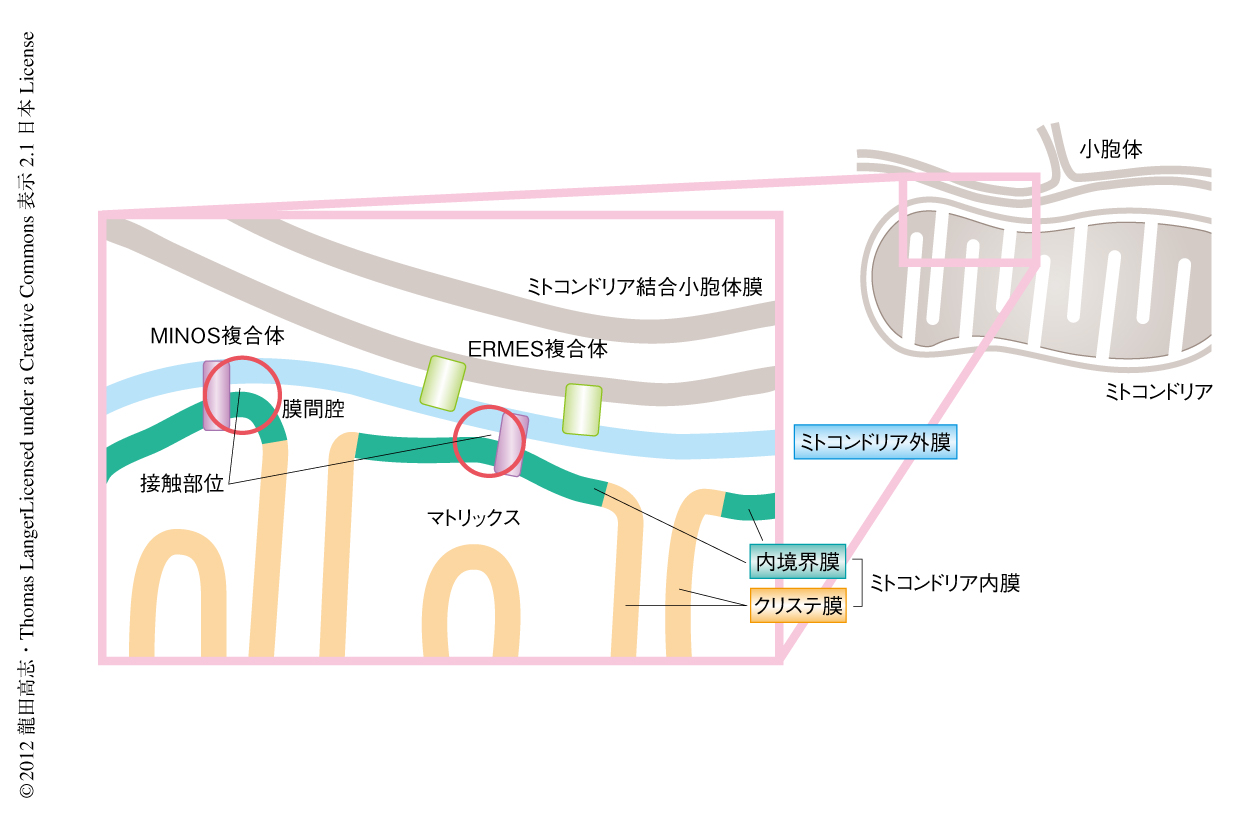
ミトコンドリアは2つの膜,ミトコンドリア外膜とミトコンドリア内膜によりかたちづくられている.内膜はさらに,外膜の近くにある内境界膜と,ひだ状に陥入するクリステ膜とに分けられる.外膜と内膜は接触部位とよばれる部位において近接しており,また,小胞体の一部はミトコンドリア結合小胞体膜においてミトコンドリア外膜と接している(図1).ミトコンドリア膜はほかの生体膜に比べコレステロール類が少なく,グリセロリン脂質に富んでいる2).呼吸鎖複合体を含め,ミトコンドリアの機能のほとんどを担う内膜はホスファチジルエタノールアミンに富み,また,カルジオリピンとよばれる4本の脂肪酸鎖をもつ独特の脂質を15%ほど含んでいる.カルジオリピンの異常はミトコンドリアの機能に大きな影響をあたえることが知られており,ヒトにおいてはBarth症候群を含む重篤な心臓疾患をもたらすほか,パーキンソン病など神経性の疾患との関連も示唆されている3).
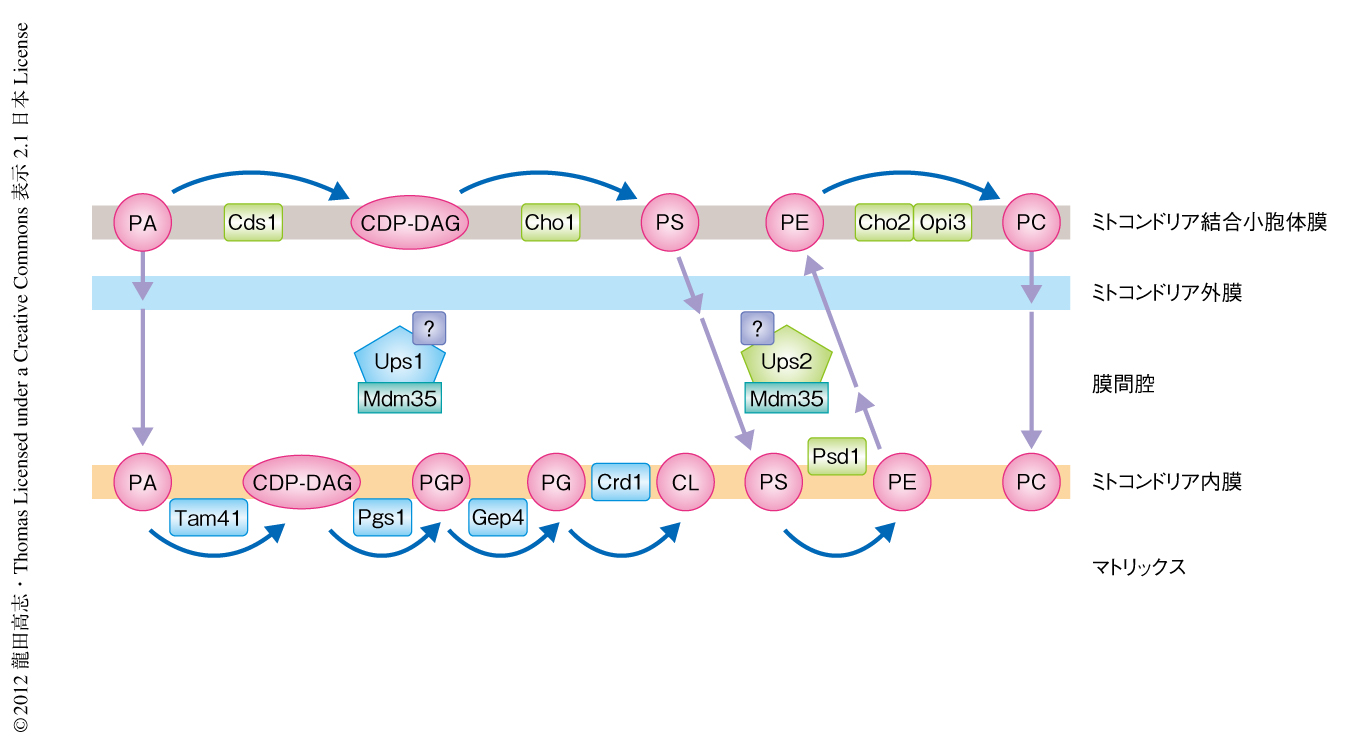
カルジオリピンおよびホスファチジルエタノールアミンはそれぞれ,ホスファチジン酸およびホスファチジルセリンよりミトコンドリア内膜において合成される4)(図2).出芽酵母においては,小胞体においてホスファチジルエタノールアミンを前駆体としてつくられるホスファチジルコリンの合成も,ミトコンドリアにおけるホスファチジルエタノールアミンの合成に依存する.ホスファチジルコリンとホスファチジルエタノールアミンは生体膜を構成するもっとも主要な脂質なので,ミトコンドリア内膜は脂質の合成において重要な場のひとつであるといえる.ただし,それらの合成のためには,小胞体において合成されるホスファチジン酸やホスファチジルセリンがミトコンドリア内膜へと輸送されなければならないし,そこでつくられたホスファチジルエタノールアミンは逆に小胞体へと輸送されなければならない.つまり,ミトコンドリアと小胞体のあいだ,および,ミトコンドリア外膜とミトコンドリア内膜のあいだには,脂質およびその前駆体の高度なやりとりがあるはずである.しかし,これについては,ミトコンドリアと小胞体との結合を担うERMES複合体(endoplasmic reticulum-mitochondria encounter structure complex)がホスファチジルセリンの輸送に寄与することが示された5) 以外には,ほとんどなにもわかっていなかった.
2009年,出芽酵母のミトコンドリア膜間腔に存在する2つのよく似たタンパク質,Ups1とUps2がそれぞれカルジオリピンとホスファチジルエタノールアミンの量の制御にかかわっていることが見い出された6,7).UPS1欠損株ではカルジオリピンの量が,UPS2欠損株ではホスファチジルエタノールアミンの量が,野生株に比べ大きく減少していたのである.Ups1およびUps2はミトコンドリア内膜に存在するプロテアーゼにより継続的に分解されているが,ジスルフィド結合をもつ小さなタンパク質Mdm35がUps1あるいはUps2とそれぞれ複合体を形成することにより,それらが少量ながら存在できていた8).出芽酵母にはさらにUps2と相同性の高いUps3が存在するが,その欠損はミトコンドリアの脂質組成には影響をあたえない.Upsタンパク質およびMdm35は真核生物において進化的に保存されているので,これらのタンパク質がミトコンドリアの脂質組成の制御に本質的な役割をはたしているものと思われた.
Upsタンパク質の機能を明らかにするべく,Ups1のカルジオリピン合成における役割を解析した.まず,32Pにより短時間の標識を行ったUPS1欠損株から脂質を抽出し,薄層クロマトグラフィーによりカルジオリピンへの32Pの取り込みを測定した.その結果,UPS1遺伝子の欠損によりカルジオリピンの合成速度は大きく低下することがわかった.
Ups1がカルジオリピン合成経路のどの段階においてはたらくのかを知るため,UPS1遺伝子とカルジオリピン合成の初期段階においてはたらく酵素をコードするTAM41遺伝子およびPGS1遺伝子とのあいだでエピスタシス解析を行った.Tam41はホスファチジン酸からCDP-ジアシルグリセロールを合成する酵素,Pgs1はCDP-ジアシルグリセロールからホスファチジルグリセロールリン酸を合成する酵素である(図2).エピスタシス解析とは,2つの遺伝子を同時に変異させたときどのような表現型が現われるかをみてその関係性を知る手法である.まず,これらの遺伝子の欠損が出芽酵母の生育にあたえる影響を観察したところ,TAM41遺伝子およびPGS1遺伝子の欠損は出芽酵母の生育を大きく損なったが,UPS1遺伝子をそれらと同時に欠損させることにより生育は著しく改善されることがわかった.また,PGS1遺伝子の欠損は,非常に長く伸張したクリステ膜による層状構造というミトコンドリアの形態異常をもたらしたが,UPS1遺伝子との同時欠損はその異常を完全に抑えた.
これらの欠損株よりスクロース密度勾配遠心法を用いてミトコンドリアを高度に単離し,その脂質組成を定量的な質量分析法により解析したところ,TAM41欠損株におけるホスファチジン酸の蓄積,および,PGS1欠損株におけるCDP-ジアシルグリセロールの蓄積は,UPS1遺伝子との同時欠損により抑制されることがわかった.これらの結果は,Ups1はTam41およびPgs1よりまえにはたらくこと,つまり,Ups1はなんらかのかたちでTam41へのホスファチジン酸の供給にかかわっていることを示していた.UPS1単独欠損株においてホスファチジン酸の有意な蓄積がみられたことも,このことに合致した.
Ups1の分子レベルでのはたらきを明らかにするべくUps1の単離および精製に取り組んだが,Ups1はとても厄介なタンパク質であった.すぐに凝集するし,カラム担体にもベタベタとくっついてしまう.ミトコンドリアにおいてUps1はMdm35と複合体を形成しているので,大腸菌において大量のMdm35をUps1と共発現させてみたところ,Ups1の大部分を可溶性画分に回収することができた.そこから30 kDaのUps1-Mdm35ヘテロ二量体を精製するのは比較的容易であった.
最初に,Ups1-Mdm35複合体が脂質に結合するかどうかを調べた.純粋な脂質を用いてさまざまな組成をもつリポソームを作製し,Ups1-Mdm35複合体と混ぜたのち,スクロース密度勾配遠心にかけてUps1-Mdm35複合体がリポソーム(油なので軽い)といっしょに浮いてくるかどうかを観察した.その結果,Ups1は負に帯電した頭部基をもつカルジオリピン,ホスファチジン酸,ホスファチジルセリン,CDP-ジアシルグリセロール,ホスファチジルグリセロール,ホスファチジルイノシトールとは結合するが,電荷をもたないホスファチジルコリンおよびホスファチジルエタノールアミンとは結合しないことがわかった.
Ups1-Mdm35複合体が脂質を輸送する可能性を検証するためin vitroアッセイ系を確立した.まず,ミトコンドリアに存在する主要な脂質をミックスした“ドナーリポソーム”,および,ホスファチジルコリンとホスファチジルエタノールアミンだけからできた“アクセプターリポソーム”とUps1-Mdm35複合体とを混ぜインキュベーションした.それをスクロース密度勾配遠心にかけアクセプターリポソームのみを浮かせて単離し(ドナーリポソームは10%スクロースが封入されていて重いため浮かない),その脂質組成を定量的な質量分析により調べた.もし,ドナーリポソームにしか入れていなかった脂質がアクセプターリポソームから検出されれば,それはリポソームのあいだを輸送されたことになる.その結果は明らかであった.ホスファチジン酸の移動が選択的かつUps1-Mdm35複合体に依存的に起こっていたのである! なお,リポソームどうしの融合は起こっていなかった.
しかし,奇妙なことがひとつあった.Ups1-Mdm35複合体は負に帯電した脂質すべてに結合するのに,効率よく輸送するのはホスファチジン酸だけであった.このことは,輸送と結合は2つの独立した現象であることを示していた.では,なぜUps1は輸送しない脂質にくっつくのだろう? in vitroアッセイ系において,アクセプターリポソームに負に帯電した脂質を少量くわえるとホスファチジン酸の輸送が促進されたことは,それらがUps1をリポソーム膜にターゲットしていることを示唆した.また,アクセプターリポソームにもホスファチジン酸をくわえることにより輸送の効率は飛躍的に高まることがわかった.このことは,ホスファチジン酸は双方向に輸送されることを示唆した.脂肪酸鎖の長さの異なるホスファチジン酸を含む2つのリポソームのあいだで,ホスファチジン酸はUps1-Mdm35複合体により交換されることが確認された.つまり,Ups1-Mdm35複合体はリポソーム膜のあいだでホスファチジン酸を双方向的に交換することができるということになった.しかし,このことがミトコンドリアにおいて起こっているのなら,ホスファチジン酸は均一に分配されるだけではないかという疑問がでてきた.ミトコンドリアにおいては,なんらかのかたちで方向性が決められているのではないか?
そこでミトコンドリア外膜とミトコンドリア内膜の組成においてその存在比率が大きく異なるカルジオリピンに注目した.内膜には15%から20%ほどのカルジオリピンがあるが,外膜では10%以下である.ホスファチジン酸をドナーリポソームおよびアクセプターリポソームの両方に含むもっとも効率のよい条件のもとアクセプターリポソームにカルジオリピンを添加したところ,カルジオリピンの量が10%をこえるとUps1はアクセプターリポソームにトラップされて,ホスファチジン酸の輸送の効率は低下した.Ups1を分解するプロテアーゼの欠損株において蓄積したUps1がカルジオリピンの多いミトコンドリア内膜に局在していたことは,このin vitroにおけるデータと符合していた.これらのデータから,カルジオリピンがミトコンドリア内膜に多量にあるとき,Ups1は内膜にトラップされてプロテアーゼによりすみやかに分解され,その結果,ホスファチジン酸の逆輸送とUps1のリサイクルは抑制される,というモデルを提唱した.このモデルは,ミトコンドリア内膜におけるカルジオリピンの量に応じてホスファチジン酸の輸送速度に負のフィードバックがかかり,カルジオリピンの合成量が制御されるという可能性を示唆した.
今回,精製タンパク質を用いたin vitroアッセイ系を用いることにより,Ups1がMdm35とともにホスファチジン酸をミトコンドリア膜間において輸送しうることを示した.Ups1-Mdm35複合体によりホスファチジン酸が輸送されると考えることにより,これまでに得られた多くの遺伝学的および細胞生物学的な知見を説明することができた.ただし,Ups1はミトコンドリアにおいて本当にホスファチジン酸を輸送しているのか,また,そもそもカルジオリピンの合成においてホスファチジン酸がミトコンドリア膜間をタンパク質に依存して輸送される必要があるのかについては,まだ議論の余地が残されている.たとえば,Ups1がホスファチジン酸をミトコンドリア膜から“抜き出す”ことにより,ホスファチジン酸が別のタンパク質に認識されるようにしている可能性などが残されている.この点を明らかにするためには,in vivoにおいて脂質の流れを直接にとらえる手法が必要となろう.
また,Ups1-Mdm35複合体がミトコンドリアにおいてホスファチジン酸を輸送するとき,ミトコンドリア膜にくっついていない遊離の状態というのが存在するのかどうかもはっきりしない.ミトコンドリア膜はカルジオリピンだけでなく負に帯電したほかの脂質も多く含んでいるため,Ups1の多くはミトコンドリア膜に結合した状態で存在すると思われる.また,接触部位にはカルジオリピンが高い比率で存在するので,Ups1がカルジオリピンに導かれて接触部位に集積し,そこでホスファチジン酸を輸送する可能性もあるのではないかと思っている.この場合,Ups1はミトコンドリア膜から離れる必要はないのかもしれない.UPS1欠損株において蓄積しているホスファチジン酸は,接触部位に集積していることもその仮説に合致している.ただし,in vitroにおいては,ドナーリポソームとアクセプターリポソームとの接触はUps1-Mdm35複合体によるホスファチジン酸の輸送に必要ではなかった.
もうひとつ,エピスタシス解析のデータにも,とても奇妙な点があった.PGS1欠損株やTAM41欠損株においてカルジオリピンはほとんど検出されないが,PGS1 UPS1二重欠損株およびTAM41 UPS1二重欠損株においてはカルジオリピンの蓄積がみられたのである.このことは,カルジオリピン合成経路にはPgs1を必要としない未知のバイパス経路が存在し,UPS1欠損はそのバイパス経路を活性化することを意味していた.カルジオリピン合成経路とその制御の解明はまだ端緒についたばかりというのが正直な印象である.
くわえて,Ups1のほかのUpsタンパク質が何をしているのか,また,Ups1によるホスファチジン酸の輸送の分子機構もまったくわかっていない.というわけで,まだまだやるべきことはたくさん残されており,楽しい暗中模索の日々はしばらく続きそうである.
略歴:2000年 熊本大学大学院医学研究科 修了,同年 ドイツMunich大学 博士研究員,2001年 ドイツCologne大学 博士研究員を経て,2010年より同 常任研究員.
研究テーマ:ミトコンドリアにおけるタンパク質の品質管理と膜脂質の合成.
抱負:生体膜とタンパク質との関係を,ボトムアップ(生化学)とトップダウン(遺伝学)の両方を駆使してその分子機構を含め明らかにしていきたい.脂質のとらえどころのなさに魅力を感じている.
Thomas Langer
ドイツCologne大学 教授.
研究室URL:http://www.genetik.uni-koeln.de/groups/Langer/
© 2012 龍田高志・Thomas Langer Licensed under CC 表示 2.1 日本
(ドイツCologne大学Institute for Genetics)
email:龍田高志
DOI: 10.7875/first.author.2012.131
Intramitochondrial transport of phosphatidic acid in yeast by a lipid transfer protein.
Melanie Connerth, Takashi Tatsuta, Mathias Haag, Till Klecker, Benedikt Westermann, Thomas Langer
Science, 338, 815-818 (2012)
要 約
ミトコンドリアが正常に機能するためには,それを構成する生体膜の脂質組成が保たれている必要がある.なかでも,ミトコンドリア内膜において合成されるカルジオリピンはミトコンドリアに特有でありその機能にも重要な脂質である.その前駆体であるホスファチジン酸は小胞体よりミトコンドリアにもたらされるが,それがどのようにしてミトコンドリアへ,そして,ミトコンドリア膜間において輸送されているのかについては不明であった.これに関連して,最近,出芽酵母においてミトコンドリア膜間腔に存在するUps1の欠損によりカルジオリピンの量の低下することが報告されていた.筆者らは,遺伝学的な手法と脂質の定量的な質量分析により,Ups1がカルジオリピン合成経路のごく初期においてホスファチジン酸の供給に必要であること,また,in vitroの再構成系により,Ups1はMdm35と複合体を形成しホスファチジン酸をミトコンドリア膜間において輸送しうることを示した.筆者らは,この知見をベースとして,ミトコンドリアにおける脂質の輸送と合成経路についてその全容の解明に取り組んでいる.
はじめに
図鑑に載っていた真核細胞のイラストを初めて見たとき,核や細胞内小器官のかたちを奇妙に思ったことをよく覚えている.実際の細胞ではこれら生体膜でできた構造は柔らかくてダイナミックに動いているのだが,瞬間的にそういうかたちをとることは確かだろう.しかし,どうやってこれら膜構造のアイデンティティとかたちが保たれ,正しく機能をすることができるのだろう? 生体膜を構成する主要な物質は脂質である.ひとつの細胞には1000種類をこえる脂質があり,また,それぞれの膜構造の脂質組成は驚くほど異なっている1).これは,それぞれの生体膜における脂質組成をきちんと保つことが,そのかたちを決め生命活動をつつがなく行うのに必要であることを示している.脂質はおもに小胞体において合成されるが,ほかのオルガネラにおいて合成されるものもある.それらが細胞においてどのように分配され,それぞれの生体膜の脂質組成が保たれているのだろう? 近年の研究から,小胞体,ゴルジ体,細胞膜のあいだでは,おもに膜そのものを輸送する小胞輸送経路をつうじ脂質の輸送は行われるとされている1).では,ミトコンドリアのように小胞輸送経路に組み込まれていないオルガネラの脂質組成はどうやって保たれているのだろう?
1.ミトコンドリアの膜構造と脂質の合成における役割
ミトコンドリアは2つの膜,ミトコンドリア外膜とミトコンドリア内膜によりかたちづくられている.内膜はさらに,外膜の近くにある内境界膜と,ひだ状に陥入するクリステ膜とに分けられる.外膜と内膜は接触部位とよばれる部位において近接しており,また,小胞体の一部はミトコンドリア結合小胞体膜においてミトコンドリア外膜と接している(図1).ミトコンドリア膜はほかの生体膜に比べコレステロール類が少なく,グリセロリン脂質に富んでいる2).呼吸鎖複合体を含め,ミトコンドリアの機能のほとんどを担う内膜はホスファチジルエタノールアミンに富み,また,カルジオリピンとよばれる4本の脂肪酸鎖をもつ独特の脂質を15%ほど含んでいる.カルジオリピンの異常はミトコンドリアの機能に大きな影響をあたえることが知られており,ヒトにおいてはBarth症候群を含む重篤な心臓疾患をもたらすほか,パーキンソン病など神経性の疾患との関連も示唆されている3).
カルジオリピンおよびホスファチジルエタノールアミンはそれぞれ,ホスファチジン酸およびホスファチジルセリンよりミトコンドリア内膜において合成される4)(図2).出芽酵母においては,小胞体においてホスファチジルエタノールアミンを前駆体としてつくられるホスファチジルコリンの合成も,ミトコンドリアにおけるホスファチジルエタノールアミンの合成に依存する.ホスファチジルコリンとホスファチジルエタノールアミンは生体膜を構成するもっとも主要な脂質なので,ミトコンドリア内膜は脂質の合成において重要な場のひとつであるといえる.ただし,それらの合成のためには,小胞体において合成されるホスファチジン酸やホスファチジルセリンがミトコンドリア内膜へと輸送されなければならないし,そこでつくられたホスファチジルエタノールアミンは逆に小胞体へと輸送されなければならない.つまり,ミトコンドリアと小胞体のあいだ,および,ミトコンドリア外膜とミトコンドリア内膜のあいだには,脂質およびその前駆体の高度なやりとりがあるはずである.しかし,これについては,ミトコンドリアと小胞体との結合を担うERMES複合体(endoplasmic reticulum-mitochondria encounter structure complex)がホスファチジルセリンの輸送に寄与することが示された5) 以外には,ほとんどなにもわかっていなかった.
2.Upsタンパク質とMdm35
2009年,出芽酵母のミトコンドリア膜間腔に存在する2つのよく似たタンパク質,Ups1とUps2がそれぞれカルジオリピンとホスファチジルエタノールアミンの量の制御にかかわっていることが見い出された6,7).UPS1欠損株ではカルジオリピンの量が,UPS2欠損株ではホスファチジルエタノールアミンの量が,野生株に比べ大きく減少していたのである.Ups1およびUps2はミトコンドリア内膜に存在するプロテアーゼにより継続的に分解されているが,ジスルフィド結合をもつ小さなタンパク質Mdm35がUps1あるいはUps2とそれぞれ複合体を形成することにより,それらが少量ながら存在できていた8).出芽酵母にはさらにUps2と相同性の高いUps3が存在するが,その欠損はミトコンドリアの脂質組成には影響をあたえない.Upsタンパク質およびMdm35は真核生物において進化的に保存されているので,これらのタンパク質がミトコンドリアの脂質組成の制御に本質的な役割をはたしているものと思われた.
3.Ups1はカルジオリピン合成経路のもっとも初期段階においてはたらく
Upsタンパク質の機能を明らかにするべく,Ups1のカルジオリピン合成における役割を解析した.まず,32Pにより短時間の標識を行ったUPS1欠損株から脂質を抽出し,薄層クロマトグラフィーによりカルジオリピンへの32Pの取り込みを測定した.その結果,UPS1遺伝子の欠損によりカルジオリピンの合成速度は大きく低下することがわかった.
Ups1がカルジオリピン合成経路のどの段階においてはたらくのかを知るため,UPS1遺伝子とカルジオリピン合成の初期段階においてはたらく酵素をコードするTAM41遺伝子およびPGS1遺伝子とのあいだでエピスタシス解析を行った.Tam41はホスファチジン酸からCDP-ジアシルグリセロールを合成する酵素,Pgs1はCDP-ジアシルグリセロールからホスファチジルグリセロールリン酸を合成する酵素である(図2).エピスタシス解析とは,2つの遺伝子を同時に変異させたときどのような表現型が現われるかをみてその関係性を知る手法である.まず,これらの遺伝子の欠損が出芽酵母の生育にあたえる影響を観察したところ,TAM41遺伝子およびPGS1遺伝子の欠損は出芽酵母の生育を大きく損なったが,UPS1遺伝子をそれらと同時に欠損させることにより生育は著しく改善されることがわかった.また,PGS1遺伝子の欠損は,非常に長く伸張したクリステ膜による層状構造というミトコンドリアの形態異常をもたらしたが,UPS1遺伝子との同時欠損はその異常を完全に抑えた.
これらの欠損株よりスクロース密度勾配遠心法を用いてミトコンドリアを高度に単離し,その脂質組成を定量的な質量分析法により解析したところ,TAM41欠損株におけるホスファチジン酸の蓄積,および,PGS1欠損株におけるCDP-ジアシルグリセロールの蓄積は,UPS1遺伝子との同時欠損により抑制されることがわかった.これらの結果は,Ups1はTam41およびPgs1よりまえにはたらくこと,つまり,Ups1はなんらかのかたちでTam41へのホスファチジン酸の供給にかかわっていることを示していた.UPS1単独欠損株においてホスファチジン酸の有意な蓄積がみられたことも,このことに合致した.
4.Ups1-Mdm35複合体の分子レベルでのはたらき
Ups1の分子レベルでのはたらきを明らかにするべくUps1の単離および精製に取り組んだが,Ups1はとても厄介なタンパク質であった.すぐに凝集するし,カラム担体にもベタベタとくっついてしまう.ミトコンドリアにおいてUps1はMdm35と複合体を形成しているので,大腸菌において大量のMdm35をUps1と共発現させてみたところ,Ups1の大部分を可溶性画分に回収することができた.そこから30 kDaのUps1-Mdm35ヘテロ二量体を精製するのは比較的容易であった.
最初に,Ups1-Mdm35複合体が脂質に結合するかどうかを調べた.純粋な脂質を用いてさまざまな組成をもつリポソームを作製し,Ups1-Mdm35複合体と混ぜたのち,スクロース密度勾配遠心にかけてUps1-Mdm35複合体がリポソーム(油なので軽い)といっしょに浮いてくるかどうかを観察した.その結果,Ups1は負に帯電した頭部基をもつカルジオリピン,ホスファチジン酸,ホスファチジルセリン,CDP-ジアシルグリセロール,ホスファチジルグリセロール,ホスファチジルイノシトールとは結合するが,電荷をもたないホスファチジルコリンおよびホスファチジルエタノールアミンとは結合しないことがわかった.
Ups1-Mdm35複合体が脂質を輸送する可能性を検証するためin vitroアッセイ系を確立した.まず,ミトコンドリアに存在する主要な脂質をミックスした“ドナーリポソーム”,および,ホスファチジルコリンとホスファチジルエタノールアミンだけからできた“アクセプターリポソーム”とUps1-Mdm35複合体とを混ぜインキュベーションした.それをスクロース密度勾配遠心にかけアクセプターリポソームのみを浮かせて単離し(ドナーリポソームは10%スクロースが封入されていて重いため浮かない),その脂質組成を定量的な質量分析により調べた.もし,ドナーリポソームにしか入れていなかった脂質がアクセプターリポソームから検出されれば,それはリポソームのあいだを輸送されたことになる.その結果は明らかであった.ホスファチジン酸の移動が選択的かつUps1-Mdm35複合体に依存的に起こっていたのである! なお,リポソームどうしの融合は起こっていなかった.
5.ホスファチジン酸の輸送における方向性は何が決めるのか?
しかし,奇妙なことがひとつあった.Ups1-Mdm35複合体は負に帯電した脂質すべてに結合するのに,効率よく輸送するのはホスファチジン酸だけであった.このことは,輸送と結合は2つの独立した現象であることを示していた.では,なぜUps1は輸送しない脂質にくっつくのだろう? in vitroアッセイ系において,アクセプターリポソームに負に帯電した脂質を少量くわえるとホスファチジン酸の輸送が促進されたことは,それらがUps1をリポソーム膜にターゲットしていることを示唆した.また,アクセプターリポソームにもホスファチジン酸をくわえることにより輸送の効率は飛躍的に高まることがわかった.このことは,ホスファチジン酸は双方向に輸送されることを示唆した.脂肪酸鎖の長さの異なるホスファチジン酸を含む2つのリポソームのあいだで,ホスファチジン酸はUps1-Mdm35複合体により交換されることが確認された.つまり,Ups1-Mdm35複合体はリポソーム膜のあいだでホスファチジン酸を双方向的に交換することができるということになった.しかし,このことがミトコンドリアにおいて起こっているのなら,ホスファチジン酸は均一に分配されるだけではないかという疑問がでてきた.ミトコンドリアにおいては,なんらかのかたちで方向性が決められているのではないか?
そこでミトコンドリア外膜とミトコンドリア内膜の組成においてその存在比率が大きく異なるカルジオリピンに注目した.内膜には15%から20%ほどのカルジオリピンがあるが,外膜では10%以下である.ホスファチジン酸をドナーリポソームおよびアクセプターリポソームの両方に含むもっとも効率のよい条件のもとアクセプターリポソームにカルジオリピンを添加したところ,カルジオリピンの量が10%をこえるとUps1はアクセプターリポソームにトラップされて,ホスファチジン酸の輸送の効率は低下した.Ups1を分解するプロテアーゼの欠損株において蓄積したUps1がカルジオリピンの多いミトコンドリア内膜に局在していたことは,このin vitroにおけるデータと符合していた.これらのデータから,カルジオリピンがミトコンドリア内膜に多量にあるとき,Ups1は内膜にトラップされてプロテアーゼによりすみやかに分解され,その結果,ホスファチジン酸の逆輸送とUps1のリサイクルは抑制される,というモデルを提唱した.このモデルは,ミトコンドリア内膜におけるカルジオリピンの量に応じてホスファチジン酸の輸送速度に負のフィードバックがかかり,カルジオリピンの合成量が制御されるという可能性を示唆した.
おわりに
今回,精製タンパク質を用いたin vitroアッセイ系を用いることにより,Ups1がMdm35とともにホスファチジン酸をミトコンドリア膜間において輸送しうることを示した.Ups1-Mdm35複合体によりホスファチジン酸が輸送されると考えることにより,これまでに得られた多くの遺伝学的および細胞生物学的な知見を説明することができた.ただし,Ups1はミトコンドリアにおいて本当にホスファチジン酸を輸送しているのか,また,そもそもカルジオリピンの合成においてホスファチジン酸がミトコンドリア膜間をタンパク質に依存して輸送される必要があるのかについては,まだ議論の余地が残されている.たとえば,Ups1がホスファチジン酸をミトコンドリア膜から“抜き出す”ことにより,ホスファチジン酸が別のタンパク質に認識されるようにしている可能性などが残されている.この点を明らかにするためには,in vivoにおいて脂質の流れを直接にとらえる手法が必要となろう.
また,Ups1-Mdm35複合体がミトコンドリアにおいてホスファチジン酸を輸送するとき,ミトコンドリア膜にくっついていない遊離の状態というのが存在するのかどうかもはっきりしない.ミトコンドリア膜はカルジオリピンだけでなく負に帯電したほかの脂質も多く含んでいるため,Ups1の多くはミトコンドリア膜に結合した状態で存在すると思われる.また,接触部位にはカルジオリピンが高い比率で存在するので,Ups1がカルジオリピンに導かれて接触部位に集積し,そこでホスファチジン酸を輸送する可能性もあるのではないかと思っている.この場合,Ups1はミトコンドリア膜から離れる必要はないのかもしれない.UPS1欠損株において蓄積しているホスファチジン酸は,接触部位に集積していることもその仮説に合致している.ただし,in vitroにおいては,ドナーリポソームとアクセプターリポソームとの接触はUps1-Mdm35複合体によるホスファチジン酸の輸送に必要ではなかった.
もうひとつ,エピスタシス解析のデータにも,とても奇妙な点があった.PGS1欠損株やTAM41欠損株においてカルジオリピンはほとんど検出されないが,PGS1 UPS1二重欠損株およびTAM41 UPS1二重欠損株においてはカルジオリピンの蓄積がみられたのである.このことは,カルジオリピン合成経路にはPgs1を必要としない未知のバイパス経路が存在し,UPS1欠損はそのバイパス経路を活性化することを意味していた.カルジオリピン合成経路とその制御の解明はまだ端緒についたばかりというのが正直な印象である.
くわえて,Ups1のほかのUpsタンパク質が何をしているのか,また,Ups1によるホスファチジン酸の輸送の分子機構もまったくわかっていない.というわけで,まだまだやるべきことはたくさん残されており,楽しい暗中模索の日々はしばらく続きそうである.
文 献
- van Meer, G., Voelker, D. R. & Feigenson, G. W.: Membrane lipids: where they are and how they behave. Nat. Rev. Mol. Cell Biol., 9, 112-124 (2008)[PubMed]
- Zinser, E. & Daum, G.: Isolation and biochemical characterization of organelles from the yeast Saccharomyces cerevisiae. Yeast, 11, 493-536 (1995)[PubMed]
- Chicco, A. J. & Sparagna, G. C.: Role of cardiolipin alterations in mitochondrial dysfunction and disease. Am. J. Physiol. Cell Physiol., 292, C33-C44 (2007)[PubMed]
- Osman, C., Voelker, D. R. & Langer, T.: Making heads or tails of phospholipids in mitochondria. J. Cell Biol., 192, 7-16 (2011)[PubMed]
- Kornmann, B., Currie, E., Collins, S. R. et al.: An ER-mitochondria tethering complex revealed by a synthetic biology screen. Science, 325, 477-481 (2009)[PubMed]
- Osman, C., Haag, M., Potting, C. et al.: The genetic interactome of prohibitins: coordinated control of cardiolipin and phosphatidylethanolamine by conserved regulators in mitochondria. J. Cell Biol., 184, 583-596 (2009)[PubMed]
- Tamura, Y., Endo, T., Iijima, M. et al.: Ups1p and Ups2p antagonistically regulate cardiolipin metabolism in mitochondria. J. Cell Biol., 185, 1029-1045 (2009)[PubMed]
- Potting, C., Wilmes, C., Engmann, T. et al.: Regulation of mitochondrial phospholipids by Ups1/PRELI-like proteins depends on proteolysis and Mdm35. EMBO J., 29, 2888-2898 (2010)[PubMed]
著者プロフィール
略歴:2000年 熊本大学大学院医学研究科 修了,同年 ドイツMunich大学 博士研究員,2001年 ドイツCologne大学 博士研究員を経て,2010年より同 常任研究員.
研究テーマ:ミトコンドリアにおけるタンパク質の品質管理と膜脂質の合成.
抱負:生体膜とタンパク質との関係を,ボトムアップ(生化学)とトップダウン(遺伝学)の両方を駆使してその分子機構を含め明らかにしていきたい.脂質のとらえどころのなさに魅力を感じている.
Thomas Langer
ドイツCologne大学 教授.
研究室URL:http://www.genetik.uni-koeln.de/groups/Langer/
© 2012 龍田高志・Thomas Langer Licensed under CC 表示 2.1 日本