アダプタータンパク質NDP52とAtg8のオーソログLC3Cによる病原性細菌を標的としたオートファジーの制御
阿久津誠人・Natalia von Muhlinen・David Komander・Felix Randow
(英国MRC Laboratory of Molecular Biology,Division of Protein and Nucleic Acid Chemistry)
email:阿久津誠人
DOI: 10.7875/first.author.2012.127
LC3C, bound selectively by a noncanonical LIR motif in NDP52, is required for antibacterial autophagy.
Natalia von Muhlinen, Masato Akutsu, Benjamin J. Ravenhill, Ágnes Foeglein, Stuart Bloor, Trevor J. Rutherford, Stefan M.V. Freund, David Komander, Felix Randow
Molecular Cell, 48, 329-342 (2012)
宿主細胞は細胞質に入り込んだ病原性微生物をオートファジーとよばれる分解機構により排除する.細胞質に存在する病原性微生物をみつけだし,オートファゴソームそしてリソソームへと輸送したのち分解することにより,細胞質における病原性微生物の増殖を抑制しているのである.これまで,NDP52と命名されたタンパク質を介してユビキチン化された病原性微生物がオートファジーにより分解されることが報告されていた.NDP52はN末端側にあるSKICHドメインとLC3結合領域によりオートファゴソームのマーカータンパク質として知られるLC3と結合し,さらには,C末端側にあるジンクフィンガードメインを介してユビキチンと結合し,ユビキチン化された病原性微生物とオートファゴソームとを結ぶアダプタータンパク質として機能する.筆者らは,NDP52が3種類のヒトLC3アイソフォームのうちLC3Cのみを特異的に認識すること,LC3Cが病原性微生物を標的としたオートファジーを制御していることを発見した.そして,NDP52変異体の作製およびNMRを用いた結合実験の結果からLC3Cとの結合領域を絞り込み,NDP52とLC3Cとの複合体のX線結晶構造解析に成功した.得られた立体構造から,NDP52のもつLC3C結合領域がLC3Cをどのように特異的に認識するかが示された.
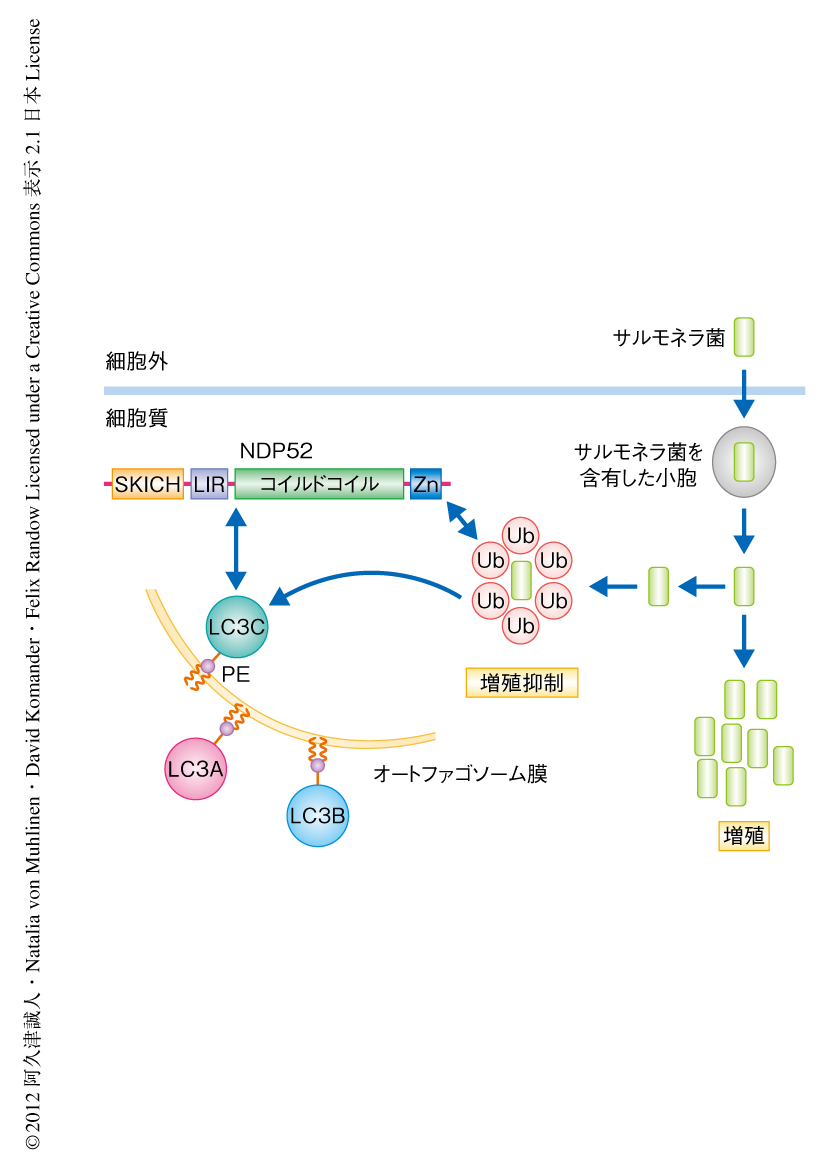
サルモネラ菌などの病原性細菌はIII型分泌装置を用いることにより宿主細胞にエフェクタータンパク質を注入し,宿主細胞のエンドサイトーシスを促進することにより細胞へと侵入する1).一方,宿主細胞は細胞質に入り込んだ病原性微生物をオートファジーとよばれる分解機構を用いて排除する.細胞質に存在する病原性微生物をみつけだし,オートファゴソーム,そして,リソソームへと輸送したのち分解することにより,細胞質における病原性微生物の増殖を抑制しているのである2)(図1).オートファジーは細胞質における非選択的なバルク分解機構として研究がはじまったが,のちに,標的タンパク質のユビキチン化を介した選択的なオートファジーが報告されたことにより,ユビキチン結合ドメインおよびLC3結合領域をもつアダプタータンパク質のはたらきが注目されている3).LC3は細胞質において合成されたのち,いくつかのプロセスをへてリン脂質ホスファチジルエタノールアミンとの結合を介しオートファゴソームに局在することから,オートファゴソームのマーカータンパク質として知られている4).選択的なオートファジーを制御するアダプタータンパク質は,ユビキチンとLC3とを同時に認識することによりユビキチン化された標的タンパク質をオートファゴソームへと輸送すると考えられている(図1).
筆者らのひとりの研究グループは,NDP52(nuclear dot protein 52)と命名されたタンパク質を介してユビキチン化された病原性微生物がオートファジーにより分解されることを報告した5).NDP52はN末端側にあるSKICHドメインとLC3結合領域によりLC3と結合し,さらには,C末端側にあるジンクフィンガードメインを介してユビキチンと結合することで,ユビキチン化された病原性微生物とオートファゴソームとを結ぶアダプタータンパク質としての機能をもつ.
LC3は出芽酵母Atg8の哺乳動物におけるオーソログであるが,ヒトには3種類のLC3アイソフォーム,LC3A,LC3B,LC3Cのほか,GABARAP,GABARAPL1,GABARAPL2など複数のオーソログが存在する.筆者らは,この研究において,NDP52がヒトにおける出芽酵母Atg8オーソログのうちLC3Cのみを特異的に認識すること,LC3Cが病原性微生物を標的としたオートファジーを制御していることを見い出した.NDP52変異体の作製およびNMRを用いた結合実験の結果からLC3Cとの結合領域を絞り込むことにより,NDP52とLC3Cとの複合体のX線結晶構造解析に成功した.得られた立体構造から,NDP52のもつLC3C結合領域によるLC3Cの特異的な結合様式を明らかにした.
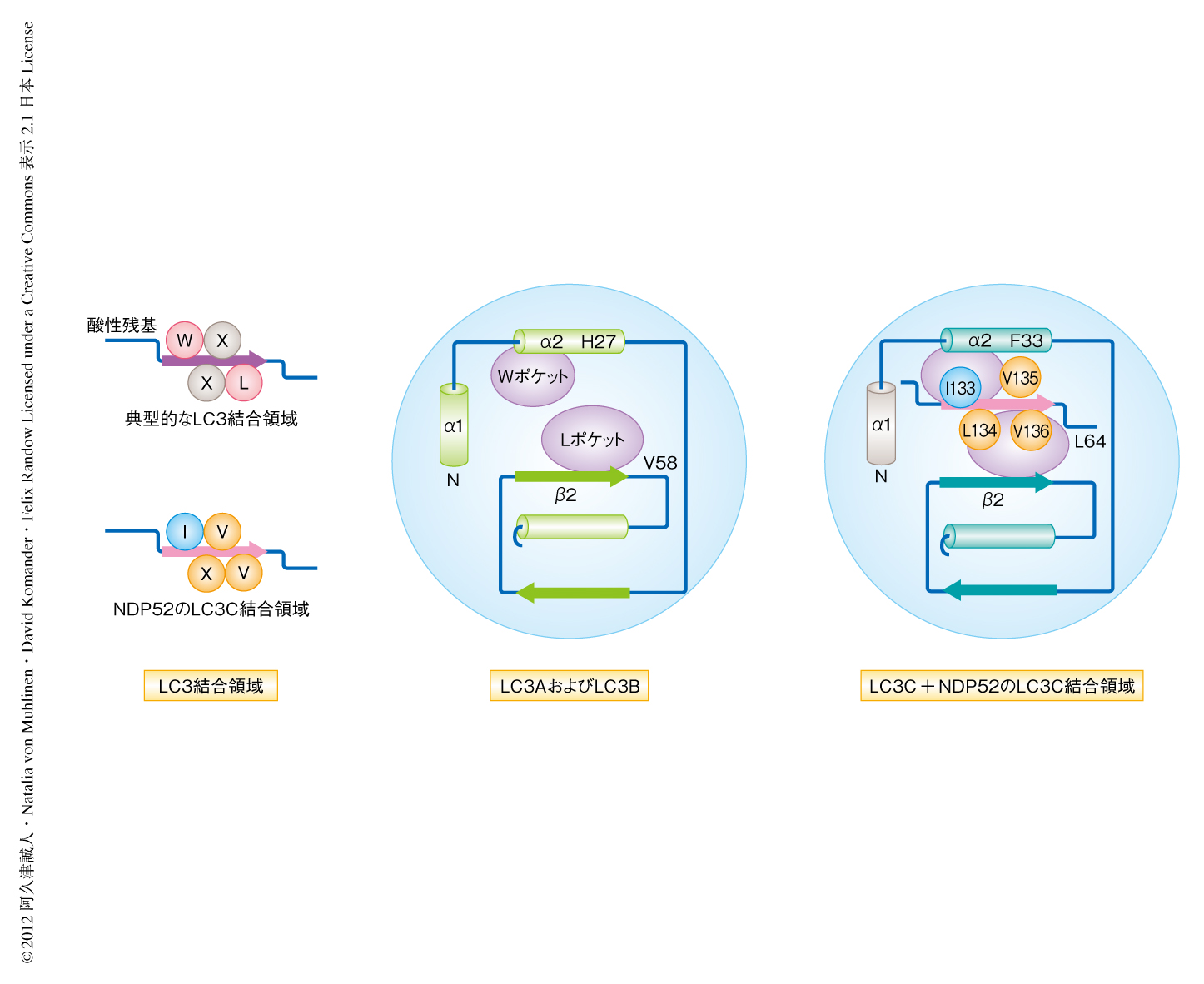
選択的なオートファジーを制御するアダプタータンパク質のもつLC3結合領域とLC3との結合様式は,構造解析も含めこれまでいくつかの報告がある6).典型的なLC3結合領域のアミノ酸配列は,酸性アミノ酸残基が連続したのちの,1番目に芳香族アミノ酸Trp,4番目に疎水性アミノ酸Leuをもつ4つの残基からなる配列Trp-X-X-Leuとして知られている(図2).LC3の表面には2つの疎水性ポケット,WポケットとLポケットが存在しており,それぞれにLC3結合領域のTrpとLeuが入り込むかたちで結合する.LC3結合領域よりN末端側に存在する酸性アミノ酸残基は,LC3の1番目のヘリックスα1に存在する塩基性アミノ酸残基とも相互作用する.さらに,LC3結合領域よりN末端側に存在するSerのリン酸化がLC3の塩基性アミノ酸残基との相互作用を強めることにより,アダプタータンパク質とLC3との結合を制御しているという報告もある7).
NDP52は,N末端側にある構造未知のSKICHドメイン,中央のコイルドコイルドメイン,C末端側にありユビキチンと結合するジンクフィンガードメインをもつ.NDP52変異体を用いた結合実験により,SKICHドメインとコイルドコイルドメインとをつなぐ13残基がLC3C結合領域であることが明らかになった.さらに,NMRを用いた結合実験の結果から,LC3Cとの結合にとくに必要な3つの残基,Leu134,Val135,Val136を絞り込み,NDP52のLC3結合領域,Ile133-Leu134-Val135-Val136を同定した.興味深いことに,通常のLC3結合領域に存在する1番目のTrpは,NDP52のLC3結合領域には存在していなかった(図2).
結合実験から絞り込んだNDP52のLC3結合領域は,これまで報告されていた典型的なLC3結合領域の配列とはかけ離れたものであった.そこで,この特徴的なNDP52のLC3結合領域は,ヒトにおける出芽酵母Atg8オーソログを認識することができるかどうか調べてみた.その結果,NDP52のLC3結合領域は,LC3A,LC3B,GABARAP,GABARAPL1,GABARAPL2を認識することはなく,LC3Cのみを特異的に認識することがわかった.そこで,このLC3Cのみを特異的に認識する新規のLC3結合領域の配列を,LC3C結合領域とよぶことにした.LC3C結合領域にはLC3結合領域のもつ1番目の芳香族アミノ酸残基がないため,LC3Cのみを認識すると考えられた.つづいて,結合様式の詳細を調べるため,NDP52とLC3Cとの複合体のX線結晶構造解析を行った.
はじめに,NDP52のSKICHドメインとLC3C結合領域を含む領域の単独での結晶構造解析を行った.その結果,NDP52のもつSKICHドメインの構造は7本の逆平行β鎖のサンドイッチ構造であることがわかった.結晶化に用いたコンストラクトはNDP52(21残基~141残基)でありLC3C結合領域を含んでいたが,LC3C結合領域の電子密度は確認されなかった.NDP52が単独で存在するとき,LC3C結合領域は一定の構造をもたないものと思われた.つづいて,NDP52(21残基~141残基)とLC3Cとの複合体の結晶構造解析を行ったところ,今度はLC3C結合領域にβ鎖の電子密度を確認することができた.NDP52のもつLC3C結合領域はLC3Cと結合することにより,はじめてβ鎖の構造をとるものと考えられた.変異体を用いた解析およびNMRを用いた解析から予想されたように,NDP52はおもにLeu134,Val135,Val136の3つの残基による疎水的な相互作用によりLC3Cと結合していた.
これまで,結晶構造の報告のされていたほかのアダプタータンパク質であるp62のもつLC3結合領域とLC3Bとの複合体8) と,NDP52のもつLC3C結合領域とLC3Cとの複合体の構造を比較した.p62のTrp340はWポケットに入り込みLC3Bと結合する.NDP52のIle133はp62のTrp340と等価の位置にあったが,側鎖が短いためWポケットには入り込めずLC3Cとの結合にはかかわっていなかった(図2).このIle133に変異をもつNDP52ついては,野生型NDP52と同じくLC3Cへの結合が確認された.通常のLC3結合領域において2番目と3番目に位置するアミノ酸残基はLC3との結合にとくに大きな役割をはたしていないが,NDP52のもつLC3C結合領域において,2番目のアミノ酸残基Leu134はVal136とともにLポケットに入り込みLC3Cと結合していた.LC3AおよびLC3BにおいてLポケットを構成するVal58とLeu63は,LC3CではLeu64とPhe69にそれぞれ置き換わっており,LC3CのLポケットはLC3AおよびLC3BのLポケットと比較して少し小さく,NDP52のもつLC3C結合領域のVal136をしっかりととりかこんでいた.さらに,LC3AおよびLC3Bのもつヘリックスα2のHis27は,LC3Cでは疎水性アミノ酸残基であるPhe33に置き換わっていた.その結果,LC3CのPhe33とNDP52のもつLC3C結合領域のVal135とのあいだに疎水的な相互作用がみられた.このように,LC3アイソフォームのあいだの微妙なアミノ酸配列の違いが,NDP52のもつLC3C結合領域によるLC3Cに特異的な結合を可能にしていた.
これまで,出芽酵母Atg8のヒトにおけるオーソログである3種類のLC3アイソフォームおよびGABARAPファミリータンパク質について,細胞におけるそれぞれを区別した機能あるいは役割についての研究はあまり行われていなかった9).NDP52のもつLC3C結合領域によるLC3Cに特異的な結合が明らかになったので,ヒトAtg8オーソログのあいだの機能の違いを調べた.LC3A,LC3B,LC3C,GABARAP,GABARAPL1,GABARAPL2それぞれの発現を抑制した細胞を用いてサルモネラ菌の感染実験を行ったところ,LC3Cだけがサルモネラ菌の感染制御に必要であることが示された.
NDP52のLC3C結合領域とLC3Cとの結合は,積極的な特異性をもつ結合ではなかったことを補足しておく.NDP52のLC3C結合領域の1番目のIleを芳香族アミノ酸であるTrpに置き換えると,NDP52はすべてのLC3アイソフォームおよびGABARAPファミリータンパク質と結合するようになった.このことから,NDP52のもつLC3C結合領域は不完全なLC3結合領域であって,LC3A,LC3B,GABARAP,GABARAPL1,GABARAPL2とは結合することができないが,LC3Cだけは認識できるという消極的な特異性をもつものであった.不完全なNDP52のLC3C結合領域はLC3Cだけとしか結合できないが,LC3Cだけがサルモネラ菌の感染制御に必要であることが示されたので,NDP52とLC3Cとの特異的な結合は,この点においては必要で十分なものであると考えられた.LC3AとLC3BとLC3C,および,GABARAPとGABARAPL1とGABARAPL2の違いは,これまでほとんど報告されていない.今後,アイソフォームそれぞれを特異的に認識する抗体やペプチドなどの開発により,それらの機能についての詳細が明らかになることが期待される.
さきに述べたように,LC3結合領域よりN末端側に存在するSerのリン酸化は,複数のオートファジーアダプタータンパク質とLC3との結合を制御している.NDP52のもつLC3C結合領域のN末端側のアミノ酸残基はリン酸化をうけないが,NDP52のもつSKICHドメインはNAP1というアダプタータンパク質を介しTBK1/IKK-iリン酸化酵素複合体と結合する.NDP52は,これまでの報告のうち唯一,リン酸化酵素と相互作用するオートファジーアダプタータンパク質であり,この相互作用がほかのアダプタータンパク質とLC3との結合,病原性微生物を標的としたオートファジーの制御に重要な役割をはたしている可能性がある.リン酸化酵素複合体とのかかわりも含めた,NDP52の機能や構造のさらなる研究が期待される.
略歴:2007年 総合研究大学院大学物質構造科学研究科 修了,同年 カナダToronto大学 ポスドク,2008年 英国MRC Laboratory of Molecular Biologyポスドクを経て,2011年よりドイツBuchmann Institute for Molecular Life Sciencesポスドク.
研究テーマ:生体防御機構.
抱負:生体防御機構について分子レベルで理解したい.
Natalia von Muhlinen
英国MRC Laboratory of Molecular Biologyにて博士課程 在学中.
David Komander
英国MRC Laboratory of Molecular Biologyグループリーダー.
Felix Randow
英国MRC Laboratory of Molecular Biologyグループリーダー.
© 2012 阿久津誠人・Natalia von Muhlinen・David Komander・Felix Randow Licensed under CC 表示 2.1 日本
(英国MRC Laboratory of Molecular Biology,Division of Protein and Nucleic Acid Chemistry)
email:阿久津誠人
DOI: 10.7875/first.author.2012.127
LC3C, bound selectively by a noncanonical LIR motif in NDP52, is required for antibacterial autophagy.
Natalia von Muhlinen, Masato Akutsu, Benjamin J. Ravenhill, Ágnes Foeglein, Stuart Bloor, Trevor J. Rutherford, Stefan M.V. Freund, David Komander, Felix Randow
Molecular Cell, 48, 329-342 (2012)
要 約
宿主細胞は細胞質に入り込んだ病原性微生物をオートファジーとよばれる分解機構により排除する.細胞質に存在する病原性微生物をみつけだし,オートファゴソームそしてリソソームへと輸送したのち分解することにより,細胞質における病原性微生物の増殖を抑制しているのである.これまで,NDP52と命名されたタンパク質を介してユビキチン化された病原性微生物がオートファジーにより分解されることが報告されていた.NDP52はN末端側にあるSKICHドメインとLC3結合領域によりオートファゴソームのマーカータンパク質として知られるLC3と結合し,さらには,C末端側にあるジンクフィンガードメインを介してユビキチンと結合し,ユビキチン化された病原性微生物とオートファゴソームとを結ぶアダプタータンパク質として機能する.筆者らは,NDP52が3種類のヒトLC3アイソフォームのうちLC3Cのみを特異的に認識すること,LC3Cが病原性微生物を標的としたオートファジーを制御していることを発見した.そして,NDP52変異体の作製およびNMRを用いた結合実験の結果からLC3Cとの結合領域を絞り込み,NDP52とLC3Cとの複合体のX線結晶構造解析に成功した.得られた立体構造から,NDP52のもつLC3C結合領域がLC3Cをどのように特異的に認識するかが示された.
はじめに
サルモネラ菌などの病原性細菌はIII型分泌装置を用いることにより宿主細胞にエフェクタータンパク質を注入し,宿主細胞のエンドサイトーシスを促進することにより細胞へと侵入する1).一方,宿主細胞は細胞質に入り込んだ病原性微生物をオートファジーとよばれる分解機構を用いて排除する.細胞質に存在する病原性微生物をみつけだし,オートファゴソーム,そして,リソソームへと輸送したのち分解することにより,細胞質における病原性微生物の増殖を抑制しているのである2)(図1).オートファジーは細胞質における非選択的なバルク分解機構として研究がはじまったが,のちに,標的タンパク質のユビキチン化を介した選択的なオートファジーが報告されたことにより,ユビキチン結合ドメインおよびLC3結合領域をもつアダプタータンパク質のはたらきが注目されている3).LC3は細胞質において合成されたのち,いくつかのプロセスをへてリン脂質ホスファチジルエタノールアミンとの結合を介しオートファゴソームに局在することから,オートファゴソームのマーカータンパク質として知られている4).選択的なオートファジーを制御するアダプタータンパク質は,ユビキチンとLC3とを同時に認識することによりユビキチン化された標的タンパク質をオートファゴソームへと輸送すると考えられている(図1).
筆者らのひとりの研究グループは,NDP52(nuclear dot protein 52)と命名されたタンパク質を介してユビキチン化された病原性微生物がオートファジーにより分解されることを報告した5).NDP52はN末端側にあるSKICHドメインとLC3結合領域によりLC3と結合し,さらには,C末端側にあるジンクフィンガードメインを介してユビキチンと結合することで,ユビキチン化された病原性微生物とオートファゴソームとを結ぶアダプタータンパク質としての機能をもつ.
LC3は出芽酵母Atg8の哺乳動物におけるオーソログであるが,ヒトには3種類のLC3アイソフォーム,LC3A,LC3B,LC3Cのほか,GABARAP,GABARAPL1,GABARAPL2など複数のオーソログが存在する.筆者らは,この研究において,NDP52がヒトにおける出芽酵母Atg8オーソログのうちLC3Cのみを特異的に認識すること,LC3Cが病原性微生物を標的としたオートファジーを制御していることを見い出した.NDP52変異体の作製およびNMRを用いた結合実験の結果からLC3Cとの結合領域を絞り込むことにより,NDP52とLC3Cとの複合体のX線結晶構造解析に成功した.得られた立体構造から,NDP52のもつLC3C結合領域によるLC3Cの特異的な結合様式を明らかにした.
選択的なオートファジーを制御するアダプタータンパク質のもつLC3結合領域とLC3との結合様式は,構造解析も含めこれまでいくつかの報告がある6).典型的なLC3結合領域のアミノ酸配列は,酸性アミノ酸残基が連続したのちの,1番目に芳香族アミノ酸Trp,4番目に疎水性アミノ酸Leuをもつ4つの残基からなる配列Trp-X-X-Leuとして知られている(図2).LC3の表面には2つの疎水性ポケット,WポケットとLポケットが存在しており,それぞれにLC3結合領域のTrpとLeuが入り込むかたちで結合する.LC3結合領域よりN末端側に存在する酸性アミノ酸残基は,LC3の1番目のヘリックスα1に存在する塩基性アミノ酸残基とも相互作用する.さらに,LC3結合領域よりN末端側に存在するSerのリン酸化がLC3の塩基性アミノ酸残基との相互作用を強めることにより,アダプタータンパク質とLC3との結合を制御しているという報告もある7).
1.NDP52のもつLC3結合領域の同定
NDP52は,N末端側にある構造未知のSKICHドメイン,中央のコイルドコイルドメイン,C末端側にありユビキチンと結合するジンクフィンガードメインをもつ.NDP52変異体を用いた結合実験により,SKICHドメインとコイルドコイルドメインとをつなぐ13残基がLC3C結合領域であることが明らかになった.さらに,NMRを用いた結合実験の結果から,LC3Cとの結合にとくに必要な3つの残基,Leu134,Val135,Val136を絞り込み,NDP52のLC3結合領域,Ile133-Leu134-Val135-Val136を同定した.興味深いことに,通常のLC3結合領域に存在する1番目のTrpは,NDP52のLC3結合領域には存在していなかった(図2).
2.NDP52のLC3結合領域はLC3Cを特異的に認識する
結合実験から絞り込んだNDP52のLC3結合領域は,これまで報告されていた典型的なLC3結合領域の配列とはかけ離れたものであった.そこで,この特徴的なNDP52のLC3結合領域は,ヒトにおける出芽酵母Atg8オーソログを認識することができるかどうか調べてみた.その結果,NDP52のLC3結合領域は,LC3A,LC3B,GABARAP,GABARAPL1,GABARAPL2を認識することはなく,LC3Cのみを特異的に認識することがわかった.そこで,このLC3Cのみを特異的に認識する新規のLC3結合領域の配列を,LC3C結合領域とよぶことにした.LC3C結合領域にはLC3結合領域のもつ1番目の芳香族アミノ酸残基がないため,LC3Cのみを認識すると考えられた.つづいて,結合様式の詳細を調べるため,NDP52とLC3Cとの複合体のX線結晶構造解析を行った.
3.NDP52とLC3Cとの複合体のX線結晶構造
はじめに,NDP52のSKICHドメインとLC3C結合領域を含む領域の単独での結晶構造解析を行った.その結果,NDP52のもつSKICHドメインの構造は7本の逆平行β鎖のサンドイッチ構造であることがわかった.結晶化に用いたコンストラクトはNDP52(21残基~141残基)でありLC3C結合領域を含んでいたが,LC3C結合領域の電子密度は確認されなかった.NDP52が単独で存在するとき,LC3C結合領域は一定の構造をもたないものと思われた.つづいて,NDP52(21残基~141残基)とLC3Cとの複合体の結晶構造解析を行ったところ,今度はLC3C結合領域にβ鎖の電子密度を確認することができた.NDP52のもつLC3C結合領域はLC3Cと結合することにより,はじめてβ鎖の構造をとるものと考えられた.変異体を用いた解析およびNMRを用いた解析から予想されたように,NDP52はおもにLeu134,Val135,Val136の3つの残基による疎水的な相互作用によりLC3Cと結合していた.
これまで,結晶構造の報告のされていたほかのアダプタータンパク質であるp62のもつLC3結合領域とLC3Bとの複合体8) と,NDP52のもつLC3C結合領域とLC3Cとの複合体の構造を比較した.p62のTrp340はWポケットに入り込みLC3Bと結合する.NDP52のIle133はp62のTrp340と等価の位置にあったが,側鎖が短いためWポケットには入り込めずLC3Cとの結合にはかかわっていなかった(図2).このIle133に変異をもつNDP52ついては,野生型NDP52と同じくLC3Cへの結合が確認された.通常のLC3結合領域において2番目と3番目に位置するアミノ酸残基はLC3との結合にとくに大きな役割をはたしていないが,NDP52のもつLC3C結合領域において,2番目のアミノ酸残基Leu134はVal136とともにLポケットに入り込みLC3Cと結合していた.LC3AおよびLC3BにおいてLポケットを構成するVal58とLeu63は,LC3CではLeu64とPhe69にそれぞれ置き換わっており,LC3CのLポケットはLC3AおよびLC3BのLポケットと比較して少し小さく,NDP52のもつLC3C結合領域のVal136をしっかりととりかこんでいた.さらに,LC3AおよびLC3Bのもつヘリックスα2のHis27は,LC3Cでは疎水性アミノ酸残基であるPhe33に置き換わっていた.その結果,LC3CのPhe33とNDP52のもつLC3C結合領域のVal135とのあいだに疎水的な相互作用がみられた.このように,LC3アイソフォームのあいだの微妙なアミノ酸配列の違いが,NDP52のもつLC3C結合領域によるLC3Cに特異的な結合を可能にしていた.
4.LC3Cは病原性微生物を標的としたオートファジーを制御する
これまで,出芽酵母Atg8のヒトにおけるオーソログである3種類のLC3アイソフォームおよびGABARAPファミリータンパク質について,細胞におけるそれぞれを区別した機能あるいは役割についての研究はあまり行われていなかった9).NDP52のもつLC3C結合領域によるLC3Cに特異的な結合が明らかになったので,ヒトAtg8オーソログのあいだの機能の違いを調べた.LC3A,LC3B,LC3C,GABARAP,GABARAPL1,GABARAPL2それぞれの発現を抑制した細胞を用いてサルモネラ菌の感染実験を行ったところ,LC3Cだけがサルモネラ菌の感染制御に必要であることが示された.
おわりに
NDP52のLC3C結合領域とLC3Cとの結合は,積極的な特異性をもつ結合ではなかったことを補足しておく.NDP52のLC3C結合領域の1番目のIleを芳香族アミノ酸であるTrpに置き換えると,NDP52はすべてのLC3アイソフォームおよびGABARAPファミリータンパク質と結合するようになった.このことから,NDP52のもつLC3C結合領域は不完全なLC3結合領域であって,LC3A,LC3B,GABARAP,GABARAPL1,GABARAPL2とは結合することができないが,LC3Cだけは認識できるという消極的な特異性をもつものであった.不完全なNDP52のLC3C結合領域はLC3Cだけとしか結合できないが,LC3Cだけがサルモネラ菌の感染制御に必要であることが示されたので,NDP52とLC3Cとの特異的な結合は,この点においては必要で十分なものであると考えられた.LC3AとLC3BとLC3C,および,GABARAPとGABARAPL1とGABARAPL2の違いは,これまでほとんど報告されていない.今後,アイソフォームそれぞれを特異的に認識する抗体やペプチドなどの開発により,それらの機能についての詳細が明らかになることが期待される.
さきに述べたように,LC3結合領域よりN末端側に存在するSerのリン酸化は,複数のオートファジーアダプタータンパク質とLC3との結合を制御している.NDP52のもつLC3C結合領域のN末端側のアミノ酸残基はリン酸化をうけないが,NDP52のもつSKICHドメインはNAP1というアダプタータンパク質を介しTBK1/IKK-iリン酸化酵素複合体と結合する.NDP52は,これまでの報告のうち唯一,リン酸化酵素と相互作用するオートファジーアダプタータンパク質であり,この相互作用がほかのアダプタータンパク質とLC3との結合,病原性微生物を標的としたオートファジーの制御に重要な役割をはたしている可能性がある.リン酸化酵素複合体とのかかわりも含めた,NDP52の機能や構造のさらなる研究が期待される.
文 献
- Randow, F.: How cells deploy ubiquitin and autophagy to defend their cytosol from bacterial invasion. Autophagy, 7, 304-309 (2011)[PubMed]
- Randow, F. & Munz, C.: Autophagy in the regulation of pathogen replication and adaptive immunity. Trends Immunol., 33, 475-487 (2012)[PubMed]
- Behrends, C., Sowa, M. E., Gygi, S. P. et al.: Network organization of the human autophagy system. Nature, 466, 68-76 (2010)[PubMed]
- Kabeya, Y., Mizushima, N., Yamamoto, A. et al.: LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation. J. Cell Sci., 117, 2805-2812 (2004)[PubMed]
- Thurston, T. L., Ryzhakov, G., Bloor, S. et al.: The TBK1 adaptor and autophagy receptor NDP52 restricts the proliferation of ubiquitin-coated bacteria. Nat. Immunol., 10, 1215-1221 (2009)[PubMed]
- Noda, N. N., Kumeta, H., Nakatogawa, H. et al.: Structural basis of target recognition by Atg8/LC3 during selective autophagy. Genes Cells, 13, 1211-1218 (2008)[PubMed]
- Wild, P., Farhan, H., McEwan, D. G. et al.: Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth. Science, 333, 228-233 (2011)[PubMed]
- Ichimura, Y., Kumanomidou, T., Sou, Y. S. et al.: Structural basis for sorting mechanism of p62 in selective autophagy. J. Biol. Chem., 283, 22847-22857 (2008)[PubMed]
- Weidberg, E., Shvets, E., Shpilka, T. et al.: LC3 and GATE-16/GABARAP subfamilies are both essential yet act differently in autophagosome biogenesis. EMBO J., 29, 1792-1802 (2010)[PubMed]
著者プロフィール
略歴:2007年 総合研究大学院大学物質構造科学研究科 修了,同年 カナダToronto大学 ポスドク,2008年 英国MRC Laboratory of Molecular Biologyポスドクを経て,2011年よりドイツBuchmann Institute for Molecular Life Sciencesポスドク.
研究テーマ:生体防御機構.
抱負:生体防御機構について分子レベルで理解したい.
Natalia von Muhlinen
英国MRC Laboratory of Molecular Biologyにて博士課程 在学中.
David Komander
英国MRC Laboratory of Molecular Biologyグループリーダー.
Felix Randow
英国MRC Laboratory of Molecular Biologyグループリーダー.
© 2012 阿久津誠人・Natalia von Muhlinen・David Komander・Felix Randow Licensed under CC 表示 2.1 日本