Rhoと微小管がひき起こす対称性の破れによる細胞壁パターンの形成
小田祥久・福田裕穂
(東京大学大学院理学系研究科 生物科学専攻生体制御研究室)
email:小田祥久,福田裕穂
DOI: 10.7875/first.author.2012.122
Initiation of cell wall pattern by a Rho- and microtubule-driven symmetry breaking.
Yoshihisa Oda, Hiroo Fukuda
Science, 337, 1333-1336 (2012)
植物において細胞の形態や機能は細胞壁に大きく依存しているが,細胞壁のパターンをつくりだす分子機構は明らかにされていない.筆者らは,特徴的なパターンの細胞壁を沈着する木部道管をモデルとして細胞壁のパターンをつくりだす分子機構を解析した.その結果,Rhoタイプの低分子量GTPaseであるROP11がROPGEF4およびROPGAP3により局所的に活性化され,微小管の脱重合を促進するタンパク質MIDD1と結合することにより,細胞壁の合成においてレールとなる表層微小管の脱重合を促進していることがわかった.一方,表層微小管はMIDD1を介し活性型ROP11の細胞膜ドメインの拡散を抑制していた.この表層微小管と活性型ROP11との排他的な相互作用が木部道管における特徴的な細胞壁パターンをつくりだしているものと考えられた.MIDD1はほかの細胞でも発現していることから,同様の分子機構がほかの細胞においてもはたらいている可能性が考えられた.
植物において細胞はセルロース微繊維をおもな成分とする細胞壁によりおおわれている.これが“たが”となって細胞の成長を制限するため,セルロース微繊維の位置と方向が細胞のかたちを決定しているものと考えられている.セルロース微繊維は細胞膜に埋め込まれたセルロース合成酵素複合体が表層微小管にそって移動することにより合成される.そのため,表層微小管の配向にしたがってセルロース微繊維が形成され,そのセルロース微繊維に依存して細胞壁のパターンが形成される.表層微小管は重合,脱重合,束化,切断などの制御をうけている1).
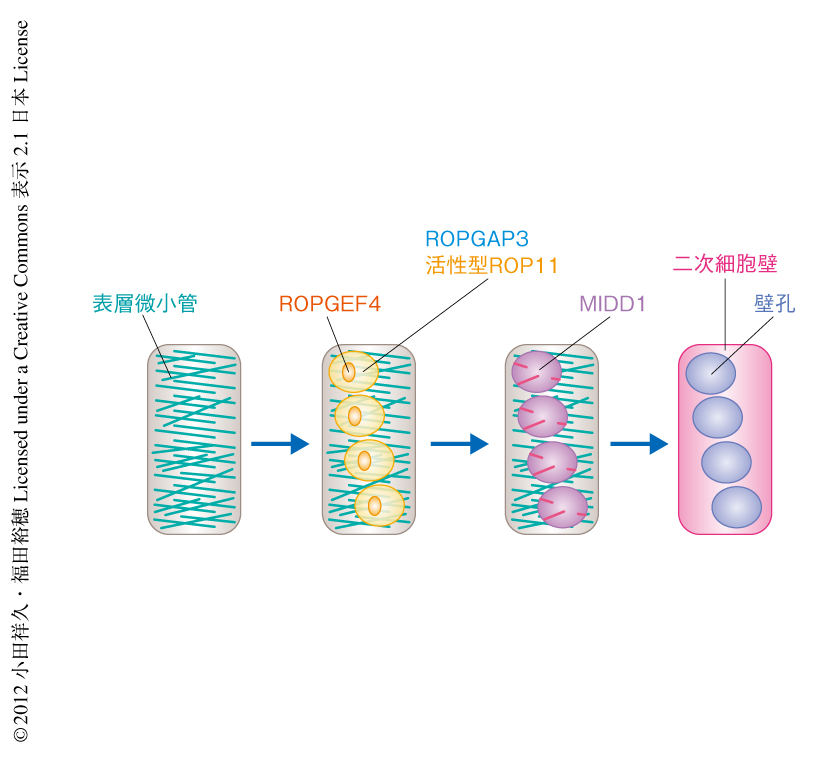
筆者らは,表層微小管の配向を制御し細胞壁のパターンをつくりだす分子機構を明らかにするため,特徴的なパターンの細胞壁をつくる木部道管に着目し研究を行った.木部道管の細胞は強固で疎水的な二次細胞壁を沈着し,そののち,プログラム細胞死を起こすことにより中空の管となる.木部道管は,らせん,網目,孔紋様など,特徴的な二次細胞壁パターンをもつ2).孔紋様のパターンでは二次細胞壁の沈着しない孔状の構造(壁孔)が散在する(図1).これまでに,筆者らは,シロイヌナズナ(Arabidopsis thaliana)の培養細胞を用いて,孔紋様のパターンをもつ二次細胞壁を沈着する木部道管の高頻度かつ同調的な分化誘導系を確立した3).そして,この実験系を用いたマイクロアレイ解析4) と細胞内局在の網羅的な解析により,新規の微小管付随タンパク質MIDD1を見い出した.MIDD1は未知の細胞膜ドメインにアンカーされ,表層微小管の脱重合を局所的に促進することにより壁孔の形成を誘導していた3).MIDD1は植物に特異的なRhoタイプの低分子量GTPaseであるROP GTPaseの活性型とC末端の近傍にあるモチーフを介し結合することから5),ROP GTPaseがMIDD1を細胞膜ドメインにアンカーしている可能性が考えられた.そこで,今回の研究では,ROP GTPaseに着目し二次細胞壁パターンを確立する分子機構を解析した.
まず,MIDD1とともにはたらくROP GTPaseを探索した.シロイヌナズナには11種のROP GTPaseの遺伝子が存在する.このうち,どのROP GTPaseが壁孔の形成に関与しているかを木部道管における特異的な発現と細胞内局在から探索した.その結果,ROP11が木部道管の壁孔において繊維状の構造に顕著に蓄積することが明らかになった.さらなる解析から,MIDD1とROP11とが壁孔の表層微小管において共局在していることがわかった.つぎに,MIDD1とROP11とが壁孔において直接に相互作用しているかどうかを,BiFC(bimolecular fluorescence complementation,二分子蛍光相補性)法およびFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)法により検証した.その結果,ROP11は壁孔において活性型として細胞膜ドメインに局在し,MIDD1と相互作用していることが示唆された.恒常的な活性型のROP11を発現させると細胞の細胞壁の全体にMIDD1が分布し,二次細胞壁も細胞の全体に形成され壁孔の形成は起こらなかった.この結果は,局所的なROP11の活性化がMIDD1を介した壁孔の形成に必須であることを示唆した.
ROP GTPaseはROPGEF(GEF:guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)により活性型(GTP結合型)に,ROPGAP(GAP:GTPase-activating protein,GTPase活性化タンパク質)により不活性型(GDP結合型)に変換される.そこで,壁孔においてROP11の局所的な活性化にはたらくROPGEFとROPGAPを探索した.木部道管において発現するROPGEFおよびROPGAPのなかから壁孔に局在するものを調べたところ,ROPGAP3が壁孔の細胞膜に局在していた.植物のROPGEFは,保存されたGEF活性ドメインであるPRONEと,N末端およびC末端の可変領域からなり,可変領域はそれ自体のGEF活性を抑制することが報告されている6).そこでPRONEの細胞内局在を観察した.その結果,ROPGEF4のPRONE(ROPGEF4PRONE)が壁孔の細胞膜に局在することを見い出した.興味深いことに,ROPGEF4PRONEは壁孔の中央付近に,ROPGAP3はROPGEF4PRONEの局在する領域を含め壁孔の全体に局在していた.このようなROPGEF4PRONEの局在は二次細胞壁の形成にさきだち観察されたことから,ROPGEF4が壁孔の形成を誘導するROP11の局所的な活性化を担っている可能性が考えられた.ROPGEF4のT-DNA挿入変異体であるropgef4-1変異体,および,RNAiによる発現抑制体であるropgef4-KD変異体において,根の木部道管では壁孔の密度が著しく低下していた.これらの結果は,ROPGEF4は壁孔の形成に必要であり,ROP11の局所的な活性化を介し壁孔の形成を誘導している可能性を示唆した(図1).
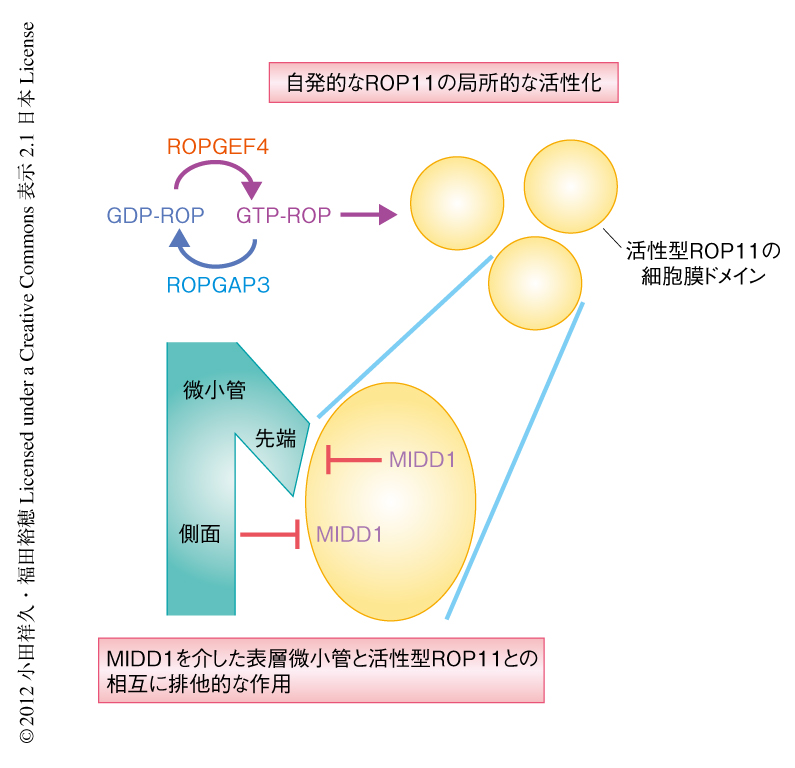
局所的にROP11が活性化されるしくみを明らかにするため再構築実験を試みた.道管に分化しないシロイヌナズナ培養細胞株に,エストロゲンによる発現誘導系7) を用いてROP11,ROPGAP3,ROPGEF4PRONEをすべて共発現させた.その結果,ROPGEF4PRONEは壁孔に似たパッチ状の局在を示した.このパッチ状に局在したROPGEF4PRONEが局所的にROP11を活性化しているかどうかを調べた.活性型ROP11はMIDD1をリクルートすることから,MIDD1を共発現させその局在を調べた.その結果,MIDD1はROPGEF4PRONEの周囲に局在していた.さらに,ROPGEF4PRONEの周囲において表層微小管は消失し,道管においてみられるような表層微小管のパターンが形成されていた.これらの結果は,ROPGEF4PRONEとROPGAP3が局所的なROP11の活性化を誘導し,MIDD1による表層微小管の脱重合をひき起こすのに十分であることを示していた.同様に,遺伝子導入の容易なタバコ(Nicotiana benthamiana)の葉の表皮を用いて定量的な解析を行った.その結果も,局所的なROP11の活性化にはROPGEF4PRONE,ROPGAP3,ROP11がすべて必要であり,ROP11のGTP/GDPサイクリングがROP11の局所的な活性化に必須であることを証明した.また,細胞骨格の構築に対する阻害剤を用いることにより,この現象は微小管およびアクチン繊維を必要としないことがわかった.これらの結果から,ROPGEF4PRONEとROPGAP3によるROP11のGTP/GDPサイクリングにより,自発的に局所的なROP11の活性化がひき起こされているものと考えられた(図2).
一方で,表層微小管が活性型ROP11の細胞膜ドメインを制御していることが明らかになった.微小管を安定化するタキソールを投与したところ,細胞膜ドメインの形態が細長くなり,網目状の二次細胞壁パターンが形成された.一方,微小管の重合阻害剤であるオリザリンを投与した場合には,活性型ROP11の細胞膜ドメインは拡散し消失した.そこで,表層微小管と活性型ROP11の細胞膜ドメインの局在との関係を,表層微小管の密度の低い成熟したタバコの葉の表皮を用いて調査した.さきと同様の再構築系を用いて解析したところ,表層微小管にかこまれた多角形の領域に活性型ROP11の細胞膜ドメインが閉じ込められていることが明らかになった.薬剤処理により微小管を破壊すると細胞膜ドメインは円形になった.微小管結合領域を除いたMIDD1とROP11をタバコの葉の表皮に共発現させたところ,ROP11がMIDD1に依存的に表層微小管の近傍から排除された.以上の結果から,表層微小管はMIDD1を介し活性型ROP11の細胞膜ドメインを制限していることが示された(図2).
今回の研究により,ROP11のGTP/GDPサイクリングにより自発的に局所的なROP11の活性化が誘導されること,このROP11の活性化がMIDD1による表層微小管の脱重合をひき起こすのに十分であることが明らかになった.ROP11が局所的に活性化するしくみの詳細は未解明だが,ROPGEF4をアクチベーター,ROPGAP3をインヒビターとして考えれば,Turingの反応拡散モデル8) により説明できるかもしれない.この反応拡散モデルにより説明するには正のフィードバックが必要であるが,出芽酵母ではスカフォールドタンパク質がRhoとGEFとのあいだの正のフィードバックを仲介することが報告されており9),壁孔の形成でも類似した現象が起こっているのかもしれない.今回の研究では,活性型ROP11の細胞膜ドメインがMIDD1を介し表層微小管の脱重合を促進するだけでなく,表層微小管もまたMIDD1を介し活性型ROP11の細胞膜ドメインの拡散を制限することにより,表層微小管と活性型ROP11の細胞膜ドメインとが相互に排他的な作用をしていることが明らかになった(図2).この相互作用をつうじ二次細胞壁のパターンをつくりだしているものと考えられた.興味深いことに,MIDD1は道管のほかの細胞にも発現しており,表層微小管とROP GTPaseとの相互作用を仲介することにより道管のほかでも細胞壁のパターン形成にかかわっている可能性が示唆された.
略歴:2007年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院理学系研究科 研究員を経て,2011年より同 助教.科学技術振興機構さきがけ研究者 兼任.
福田 裕穂(Hiroo Fukuda)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biol.s.u-tokyo.ac.jp/users/seigyo/lab.html
© 2012 小田祥久・福田裕穂 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生体制御研究室)
email:小田祥久,福田裕穂
DOI: 10.7875/first.author.2012.122
Initiation of cell wall pattern by a Rho- and microtubule-driven symmetry breaking.
Yoshihisa Oda, Hiroo Fukuda
Science, 337, 1333-1336 (2012)
要 約
植物において細胞の形態や機能は細胞壁に大きく依存しているが,細胞壁のパターンをつくりだす分子機構は明らかにされていない.筆者らは,特徴的なパターンの細胞壁を沈着する木部道管をモデルとして細胞壁のパターンをつくりだす分子機構を解析した.その結果,Rhoタイプの低分子量GTPaseであるROP11がROPGEF4およびROPGAP3により局所的に活性化され,微小管の脱重合を促進するタンパク質MIDD1と結合することにより,細胞壁の合成においてレールとなる表層微小管の脱重合を促進していることがわかった.一方,表層微小管はMIDD1を介し活性型ROP11の細胞膜ドメインの拡散を抑制していた.この表層微小管と活性型ROP11との排他的な相互作用が木部道管における特徴的な細胞壁パターンをつくりだしているものと考えられた.MIDD1はほかの細胞でも発現していることから,同様の分子機構がほかの細胞においてもはたらいている可能性が考えられた.
はじめに
植物において細胞はセルロース微繊維をおもな成分とする細胞壁によりおおわれている.これが“たが”となって細胞の成長を制限するため,セルロース微繊維の位置と方向が細胞のかたちを決定しているものと考えられている.セルロース微繊維は細胞膜に埋め込まれたセルロース合成酵素複合体が表層微小管にそって移動することにより合成される.そのため,表層微小管の配向にしたがってセルロース微繊維が形成され,そのセルロース微繊維に依存して細胞壁のパターンが形成される.表層微小管は重合,脱重合,束化,切断などの制御をうけている1).
筆者らは,表層微小管の配向を制御し細胞壁のパターンをつくりだす分子機構を明らかにするため,特徴的なパターンの細胞壁をつくる木部道管に着目し研究を行った.木部道管の細胞は強固で疎水的な二次細胞壁を沈着し,そののち,プログラム細胞死を起こすことにより中空の管となる.木部道管は,らせん,網目,孔紋様など,特徴的な二次細胞壁パターンをもつ2).孔紋様のパターンでは二次細胞壁の沈着しない孔状の構造(壁孔)が散在する(図1).これまでに,筆者らは,シロイヌナズナ(Arabidopsis thaliana)の培養細胞を用いて,孔紋様のパターンをもつ二次細胞壁を沈着する木部道管の高頻度かつ同調的な分化誘導系を確立した3).そして,この実験系を用いたマイクロアレイ解析4) と細胞内局在の網羅的な解析により,新規の微小管付随タンパク質MIDD1を見い出した.MIDD1は未知の細胞膜ドメインにアンカーされ,表層微小管の脱重合を局所的に促進することにより壁孔の形成を誘導していた3).MIDD1は植物に特異的なRhoタイプの低分子量GTPaseであるROP GTPaseの活性型とC末端の近傍にあるモチーフを介し結合することから5),ROP GTPaseがMIDD1を細胞膜ドメインにアンカーしている可能性が考えられた.そこで,今回の研究では,ROP GTPaseに着目し二次細胞壁パターンを確立する分子機構を解析した.
1.局所的なROP11の活性化がMIDD1を介し壁孔の形成を誘導する
まず,MIDD1とともにはたらくROP GTPaseを探索した.シロイヌナズナには11種のROP GTPaseの遺伝子が存在する.このうち,どのROP GTPaseが壁孔の形成に関与しているかを木部道管における特異的な発現と細胞内局在から探索した.その結果,ROP11が木部道管の壁孔において繊維状の構造に顕著に蓄積することが明らかになった.さらなる解析から,MIDD1とROP11とが壁孔の表層微小管において共局在していることがわかった.つぎに,MIDD1とROP11とが壁孔において直接に相互作用しているかどうかを,BiFC(bimolecular fluorescence complementation,二分子蛍光相補性)法およびFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)法により検証した.その結果,ROP11は壁孔において活性型として細胞膜ドメインに局在し,MIDD1と相互作用していることが示唆された.恒常的な活性型のROP11を発現させると細胞の細胞壁の全体にMIDD1が分布し,二次細胞壁も細胞の全体に形成され壁孔の形成は起こらなかった.この結果は,局所的なROP11の活性化がMIDD1を介した壁孔の形成に必須であることを示唆した.
2.ROPGEF4とROPGAP3が壁孔における局所的なROP11活性化を制御する
ROP GTPaseはROPGEF(GEF:guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)により活性型(GTP結合型)に,ROPGAP(GAP:GTPase-activating protein,GTPase活性化タンパク質)により不活性型(GDP結合型)に変換される.そこで,壁孔においてROP11の局所的な活性化にはたらくROPGEFとROPGAPを探索した.木部道管において発現するROPGEFおよびROPGAPのなかから壁孔に局在するものを調べたところ,ROPGAP3が壁孔の細胞膜に局在していた.植物のROPGEFは,保存されたGEF活性ドメインであるPRONEと,N末端およびC末端の可変領域からなり,可変領域はそれ自体のGEF活性を抑制することが報告されている6).そこでPRONEの細胞内局在を観察した.その結果,ROPGEF4のPRONE(ROPGEF4PRONE)が壁孔の細胞膜に局在することを見い出した.興味深いことに,ROPGEF4PRONEは壁孔の中央付近に,ROPGAP3はROPGEF4PRONEの局在する領域を含め壁孔の全体に局在していた.このようなROPGEF4PRONEの局在は二次細胞壁の形成にさきだち観察されたことから,ROPGEF4が壁孔の形成を誘導するROP11の局所的な活性化を担っている可能性が考えられた.ROPGEF4のT-DNA挿入変異体であるropgef4-1変異体,および,RNAiによる発現抑制体であるropgef4-KD変異体において,根の木部道管では壁孔の密度が著しく低下していた.これらの結果は,ROPGEF4は壁孔の形成に必要であり,ROP11の局所的な活性化を介し壁孔の形成を誘導している可能性を示唆した(図1).
3.局所的なROP11活性化の再構築
局所的にROP11が活性化されるしくみを明らかにするため再構築実験を試みた.道管に分化しないシロイヌナズナ培養細胞株に,エストロゲンによる発現誘導系7) を用いてROP11,ROPGAP3,ROPGEF4PRONEをすべて共発現させた.その結果,ROPGEF4PRONEは壁孔に似たパッチ状の局在を示した.このパッチ状に局在したROPGEF4PRONEが局所的にROP11を活性化しているかどうかを調べた.活性型ROP11はMIDD1をリクルートすることから,MIDD1を共発現させその局在を調べた.その結果,MIDD1はROPGEF4PRONEの周囲に局在していた.さらに,ROPGEF4PRONEの周囲において表層微小管は消失し,道管においてみられるような表層微小管のパターンが形成されていた.これらの結果は,ROPGEF4PRONEとROPGAP3が局所的なROP11の活性化を誘導し,MIDD1による表層微小管の脱重合をひき起こすのに十分であることを示していた.同様に,遺伝子導入の容易なタバコ(Nicotiana benthamiana)の葉の表皮を用いて定量的な解析を行った.その結果も,局所的なROP11の活性化にはROPGEF4PRONE,ROPGAP3,ROP11がすべて必要であり,ROP11のGTP/GDPサイクリングがROP11の局所的な活性化に必須であることを証明した.また,細胞骨格の構築に対する阻害剤を用いることにより,この現象は微小管およびアクチン繊維を必要としないことがわかった.これらの結果から,ROPGEF4PRONEとROPGAP3によるROP11のGTP/GDPサイクリングにより,自発的に局所的なROP11の活性化がひき起こされているものと考えられた(図2).
4.表層微小管はMIDD1を介し活性型ROP11の細胞膜ドメインを局在化する
一方で,表層微小管が活性型ROP11の細胞膜ドメインを制御していることが明らかになった.微小管を安定化するタキソールを投与したところ,細胞膜ドメインの形態が細長くなり,網目状の二次細胞壁パターンが形成された.一方,微小管の重合阻害剤であるオリザリンを投与した場合には,活性型ROP11の細胞膜ドメインは拡散し消失した.そこで,表層微小管と活性型ROP11の細胞膜ドメインの局在との関係を,表層微小管の密度の低い成熟したタバコの葉の表皮を用いて調査した.さきと同様の再構築系を用いて解析したところ,表層微小管にかこまれた多角形の領域に活性型ROP11の細胞膜ドメインが閉じ込められていることが明らかになった.薬剤処理により微小管を破壊すると細胞膜ドメインは円形になった.微小管結合領域を除いたMIDD1とROP11をタバコの葉の表皮に共発現させたところ,ROP11がMIDD1に依存的に表層微小管の近傍から排除された.以上の結果から,表層微小管はMIDD1を介し活性型ROP11の細胞膜ドメインを制限していることが示された(図2).
おわりに
今回の研究により,ROP11のGTP/GDPサイクリングにより自発的に局所的なROP11の活性化が誘導されること,このROP11の活性化がMIDD1による表層微小管の脱重合をひき起こすのに十分であることが明らかになった.ROP11が局所的に活性化するしくみの詳細は未解明だが,ROPGEF4をアクチベーター,ROPGAP3をインヒビターとして考えれば,Turingの反応拡散モデル8) により説明できるかもしれない.この反応拡散モデルにより説明するには正のフィードバックが必要であるが,出芽酵母ではスカフォールドタンパク質がRhoとGEFとのあいだの正のフィードバックを仲介することが報告されており9),壁孔の形成でも類似した現象が起こっているのかもしれない.今回の研究では,活性型ROP11の細胞膜ドメインがMIDD1を介し表層微小管の脱重合を促進するだけでなく,表層微小管もまたMIDD1を介し活性型ROP11の細胞膜ドメインの拡散を制限することにより,表層微小管と活性型ROP11の細胞膜ドメインとが相互に排他的な作用をしていることが明らかになった(図2).この相互作用をつうじ二次細胞壁のパターンをつくりだしているものと考えられた.興味深いことに,MIDD1は道管のほかの細胞にも発現しており,表層微小管とROP GTPaseとの相互作用を仲介することにより道管のほかでも細胞壁のパターン形成にかかわっている可能性が示唆された.
文 献
- Wasteneys, G. O. & Ambrose, J. C.: Spatial organization of plant cortical microtubules: close encounters of the 2D kind. Trends Cell Biol., 19, 62-71 (2009)[PubMed]
- Oda, Y. & Fukuda, H.: Secondary cell wall patterning during xylem differentiation. Curr. Opin. Plant Biol., 15, 38-44 (2012)[PubMed]
- Oda, Y., Iida, Y., Kondo, Y. et al.: Wood cell-wall structure requires local 2D-microtubule disassembly by a novel plasma membrane-anchored protein. Curr. Biol., 20, 1197-1202 (2010)[PubMed]
- Ohashi-Ito, K., Oda, Y. & Fukuda, H.: Arabidopsis VASCULAR-RELATED NAC-DOMAIN6 directly regulates the genes that govern programmed cell death and secondary wall formation during xylem differentiation. Plant Cell, 22, 3461-3473 (2010)[PubMed]
- Mucha, E., Hoefle, C., Huckelhoven, R. et al.: RIP3 and AtKinesin-13A: a novel interaction linking Rho proteins of plants to microtubules. Eur. J. Cell Biol., 89, 906-916 (2010)[PubMed]
- Zhang, Y. & McCormick, S.: A distinct mechanism regulating a pollen-specific guanine nucleotide exchange factor for the small GTPase Rop in Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA, 104, 18830-18835 (2007)[PubMed]
- Zuo, J., Niu, Q. W. & Chua, N. H.: Technical advance: An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants. Plant J., 24, 265-273 (2000)[PubMed]
- Turing, A. M.: The chemical basis of morphogenesis. Proc. R. Soc. Lond. B. Biol. Sci., 237, 37-72 (1952)
- Kozubowski, L., Saito, K., Johnson, J. M. et al.: Symmetry-breaking polarization driven by a Cdc42p GEF-PAK complex. Curr. Biol., 18, 1719-1726 (2008)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院理学系研究科 研究員を経て,2011年より同 助教.科学技術振興機構さきがけ研究者 兼任.
福田 裕穂(Hiroo Fukuda)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.biol.s.u-tokyo.ac.jp/users/seigyo/lab.html
© 2012 小田祥久・福田裕穂 Licensed under CC 表示 2.1 日本