血管内皮細胞においてクラスII型PI3キナーゼは血管新生および血管バリア機能に重要な役割を担う
吉岡和晃・多久和 陽
(金沢大学医薬保健学域医学類 血管分子生理学)
email:多久和 陽
DOI: 10.7875/first.author.2012.120
Endothelial PI3K-C2α, a class II PI3K, has an essential role in angiogenesis and vascular barrier function.
Kazuaki Yoshioka, Kotaro Yoshida, Hong Cui, Tomohiko Wakayama, Noriko Takuwa, Yasuo Okamoto, Wa Du, Xun Qi, Ken Asanuma, Kazushi Sugihara, Sho Aki, Hidekazu Miyazawa, Kuntal Biswas, Chisa Nagakura, Masaya Ueno, Shoichi Iseki, Robert J Schwartz, Hiroshi Okamoto, Takehiko Sasaki, Osamu Matsui, Masahide Asano, Ralf H Adams, Nobuyuki Takakura, Yoh Takuwa
Nature Medicine, 18, 1560-1569 (2012)
イノシトールリン脂質リン酸化酵素であるPI3キナーゼのうち,クラスI型PI3キナーゼは細胞の増殖,分化,遊走,生存に必須のシグナル伝達タンパク質としてよく知られている.筆者らは,これまで生理機能の不明であったクラスIIα型PI3キナーゼのひとつ,C2αのコンディショナルノックアウトマウスを用いた実験から,発生期および生後における生理的および病的な血管新生ならびに血管における恒常性の維持に,C2αが重要な役割をはたしていることを明らかにした.C2αは血管内皮細胞において初期エンドソーム,クラスリン被覆小胞,トランスゴルジネットワークに局在していた.血管内皮細胞においてC2αをノックダウンすると,ホスファチジルイノシトール3-リン酸に富むエンドソームの減少,エンドソーム輸送の障害,血管内皮細胞の細胞間接着部位へのVE-カドヘリンの輸送の異常,細胞間接着部位の構造の異常がひき起こされた.C2αのノックダウンによりVEGF受容体の内在化やエンドソームにおける低分子量Gタンパク質RhoAの活性化が障害された結果,血管内皮細胞の遊走,増殖,細胞間接着,および,管腔の形成が抑制された.生存の可能なC2αヘテロノックアウトマウスでは,アナフィラキシーに対する感受性の著しい増強,アンジオテンシンIIの投与に対する解離性大動脈瘤の形成における発症率の上昇がみられた.以上の結果から,C2αは血管内皮細胞において細胞内小胞輸送の制御を介し,VE-カドヘリンをはじめとする物質輸送およびエンドソームにおけるシグナル伝達に必須であり,これらの作用により血管の形成と血管の健全性の維持に重要な役割を担っていることが明らかになった.C2αは血管疾患の新しい治療標的となることが期待される.
胎生期の発達,生後の組織における修復およびリモデリング,腫瘍の増殖において,脈管の形成および血管新生からなる血管形成のプロセスは必須である.脈管の形成による未成熟な原始血管網は,動員された壁細胞と会合することにより安定な血管へと成熟していく1).静止期の安定した血管においては,強固なバリア機能が保たれ健全な循環機能が維持される.一方,腫瘍のような病的な組織において血管網は未成熟であり,漏れやすい構造をもっている.また,過剰なアンジオテンシンIIなどにより誘発される血管障害などでは,炎症性白血球の血管壁への浸潤をともなう血管透過性の亢進がみられ,血管壁の重大な障害をもたらす.したがって,血管バリア機能の維持および血管の安定化は,血管および組織の恒常性の維持において必須である.
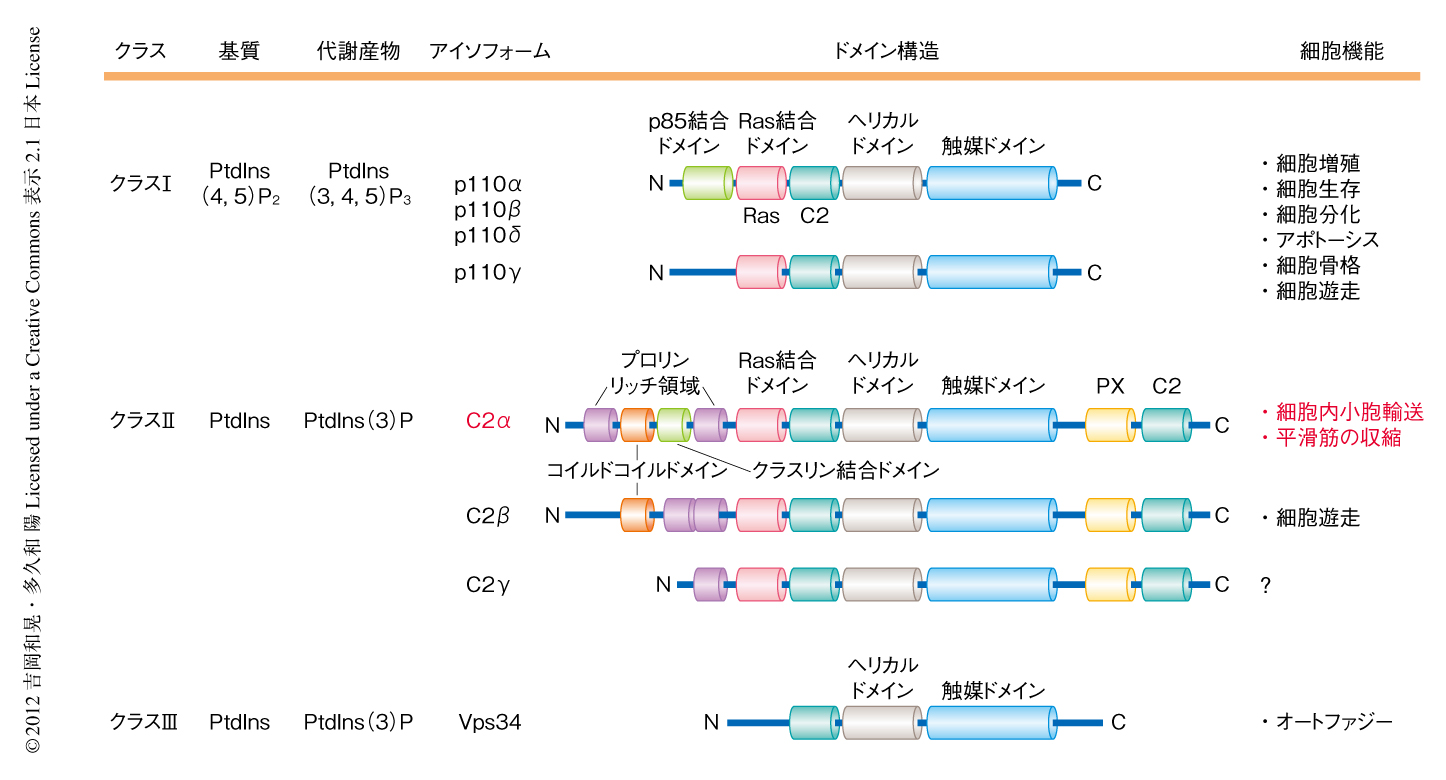
ホスファチジルイノシトール3-キナーゼ(PI3キナーゼ)はイノシトールリン脂質のもつイノシトール環の3位をリン酸化する酵素であり,リン酸化されたホスファチジルイノシトールを介し,細胞分裂,増殖,分化,遊走,アポトーシスの制御やがん化,細胞内小胞輸送など,多岐にわたる細胞応答に関与している.PI3キナーゼは哺乳類において,ドメインの構造や薬理学的な特性の違いにより,3つのクラス,8つのアイソフォームに分類されている(図1).クラスI型PI3キナーゼの触媒サブユニットはp110α,p110β,p110γ,p110δの4つのアイソフォームからなり,これらは多くのチロシンキナーゼ型受容体やGタンパク質共役受容体の刺激により活性化され,細胞膜においてホスファチジルイノシトール3,4,5-トリスリン酸を産生し下流にシグナルを伝達する.血管内皮細胞において,クラスI型PI3キナーゼ,とくにp110αは増殖,分化,生存,遊走,形態形成を制御し発生期の血管新生を担う必須のシグナルタンパク質である2,3).クラスIII型PI3キナーゼであるVps34はホスファチジルイノシトール3-リン酸を産生し,細胞内小胞輸送やオートファジーに関与することが知られている.一方,クラスII型PI3キナーゼについては,哺乳類ではC2α,C2β,C2γの3つのアイソフォームの存在が知られている(図1)が,これらの活性化の機序および生理機能はほとんど不明であった4).最近の報告では,C2αは細胞においてホスファチジルイノシトールを主要な基質としホスファチジルイノシトール3-リン酸を産生していることが示されている5).
クラスII型PI3キナーゼの構造的な特徴は,C末端にPXドメインとC2ドメインをもつこと,長いN末端においてクラスI型PI3キナーゼにはみられない複数の機能ドメインをもつことである(図1).C2αとC2βにはコイルドコイルドメインが存在するが,さらにC2αにのみクラスリン結合ドメインが存在し,これらのドメインがC2αの独自の機能を担っている可能性が高い.薬理学的にはPI3キナーゼ阻害剤に低感受性を示すことが示されている.C2αおよびC2βは全身の臓器に広汎に発現し,なかでもC2αは心臓,胎盤,子宮,血管に,C2βは皮膚,胸腺,胎盤に,比較的多く発現しているのに対し,C2γの発現は主として肝臓に限局している.C2αは細胞レベルでは上皮細胞,血管内皮細胞,平滑筋細胞に比較的多く発現しており,細胞においてクラスリン被覆小胞,エンドソーム,トランスゴルジネットワークに局在していることから,細胞内小胞輸送の制御に関与することが示唆されていた4,5).細胞レベルでのいくつか研究において,サイトカインやインスリンという細胞外からの刺激によりC2αの活性化することが報告されていたが,個体レベルでのC2αの機能的な役割はほとんど不明であった4-7).最近では,C2αの遺伝子を部分的に欠損したhypomorphicな(低形質を示す)変異マウスが腎糸球体の形成障害を呈することが報告された8).
この研究では,遺伝子改変マウスを用いて個体レベルにおけるC2αの機能を詳細に解析した.その結果,C2αは血管内皮の機能を制御することにより胎生期および生後の病的な血管新生において重要な役割を担うことが明らかにされた.このC2αの血管新生の作用は,クラスI型PI3キナーゼとはまったく異なる分子機構をもつものであった.すなわち,C2αは血管内皮細胞において細胞内小胞輸送を制御することにより,血管内皮細胞における接着分子VE-カドヘリンを含む膜タンパク質の輸送,および,エンドソームにおけるシグナル伝達に必須であった.C2αは血管内皮の機能を制御し血管新生において重要な役割を担うとともに,血管内皮のバリア機能と恒常性の維持に欠かせないPI3キナーゼのアイソフォームであることが明らかになった.
全身型のC2αホモノックアウトマウスは胎生8.5日目から発育不全となり,胎生10.5日目から胎生11.5日目のあいだに血管形成の不全により胎生致死となった.血管内皮のマーカーである抗CD31抗体を用いた胎生11.5日目のマウス胎仔のホールマウント染色において,C2αホモノックアウトマウスは全身にわたり血管形成の障害が観察された.この表現型がどの細胞に発現するC2αに依存しているのか明らかにするため,細胞に特異的なC2αのコンディショナルノックアウトマウスを作製した.平滑筋細胞に特異的なC2αコンディショナルノックアウトマウスあるいは心筋細胞に特異的なC2αコンディショナルノックアウトマウスは正常に発育しメンデルの法則にしたがい出生したのに対し,血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスは血管形成の不全を含む多臓器の障害により胎生致死となった.これらのことから,血管内皮細胞に発現するC2αは正常な血管の形成および個体の発生に必須であることが示された.
血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスは胎生致死であったことから,生後におけるC2αの機能解析を行うため,タモキシフェンにより誘導の可能な血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスを作製した.血管内皮細胞に特異的なVE-カドヘリン遺伝子プロモーターの下流にタモキシフェン誘導型Creリコンビナーゼ-エストロゲン受容体融合タンパク質を発現するトランスジェニックマウス9) を用いることで,生後,タモキシフェンを投与することにより血管内皮細胞でのみC2αを欠損するコンディショナルノックアウトマウスを作製することができた.このマウスの網膜における血管新生モデルを用いて,生後の生理的な血管新生に及ぼす血管内皮細胞におけるC2α欠損の効果を調べた.生後3日目にタモキシフェンを投与し生後6日目にて網膜における血管新生を観察したところ,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスでは著しく低下していた.以上のことから,血管内皮細胞に発現するC2αは胎生期における血管新生および生後における生理的な血管新生に必須なPI3キナーゼのアイソフォームであることが明らかになった.
RNAi法によりC2αをノックダウンしたヒトの臍帯静脈内皮細胞においては,血管内皮増殖因子VEGF-Aによるマトリゲル上での管腔の形成が阻害された.PI3キナーゼのほかのアイソフォームのノックダウンはVEGF-Aによる管腔の形成能に影響しなかった.さらに,C2αをノックダウンした細胞ではVEGF-Aによる細胞遊走能も著しく抑制された.しかし,C2αをノックアウトした血管平滑筋細胞ではPDGFによる細胞遊走能にまったく変化のみられなかったことから,C2αは血管内皮細胞に特異的に役割をもつことが示唆された.
C2αをノックダウンしたヒトの臍帯静脈内皮細胞では,VEGF-AによるVEGF受容体のチロシンリン酸化,および,そののちの細胞内シグナル伝達経路にあるAkt,ERK,PAK2,NO合成酵素のリン酸化はまったく影響をうけなかった.これらのVEGFシグナル伝達経路はクラスI型PI3キナーゼであるp110αに強く依存していることがよく知られている.興味深いことに,C2αをノックダウンした細胞において,VEGF-Aにより活性化されるミオシン脱リン酸化酵素サブユニットMYPT1のリン酸化が抑制された.このMYPT1は低分子量Gタンパク質RhoAにより活性化されるRhoキナーゼの直接の標的基質であることから,VEGF-Aの刺激によるRhoAの活性化について調べたところ,C2αのノックダウンによりRhoAの活性化の著しい減弱が観察された.ドミナントネガティブ変異をもつRhoAをアデノウイルスの感染によりヒトの臍帯静脈内皮細胞に導入しRhoAを不活性化したところ,VEGF-Aによるマトリゲル上での管腔の形成は顕著に抑制された.これらの結果から,C2αはRhoAを介した血管内皮細胞の形態形成に必須の役割をもつことが示された.
細胞でのエンドソーム輸送におけるC2αの役割を明らかにするため,まず,C2αの代謝産物であるホスファチジルイノシトール3-リン酸の特異的な蛍光プローブをコードする遺伝子をヒトの臍帯静脈内皮細胞に導入し,生細胞イメージング法による細胞内局在の可視化を試みた.正常な細胞においてホスファチジルイノシトール3-リン酸はおもにエンドソームに局在していた.しかし,C2αをノックダウンした細胞ではホスファチジルイノシトール3-リン酸に陽性のエンドソームの減少とエンドソームの運動の減弱がみられた.p110αあるいはVps34をノックダウンした細胞ではまったく変化はみられなかった.この観察と一致して,GFPにより標識したC2αはおもに,初期エンドソーム,クラスリン被覆小胞,トランスゴルジネットワークに強く限局していたことから,C2αはエンドドーム膜におけるホスファチジルイノシトール3-リン酸の産生とエンドソーム輸送に必須であると考えられた.
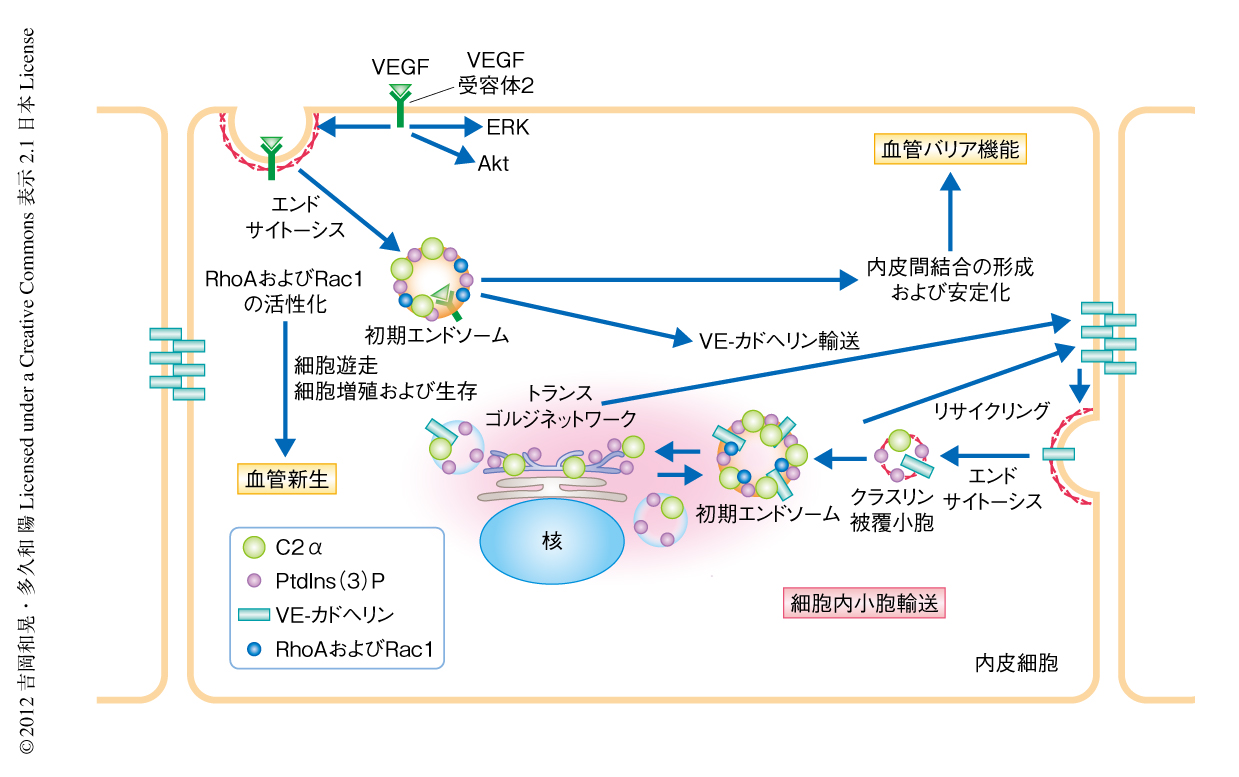
血管内皮細胞において重要な役割をはたしている接着分子VE-カドヘリンのエンドソームによる輸送を観察するため,GFPにより標識したVE-カドヘリンを発現させたヒトの臍帯静脈内皮細胞において生細胞イメージングを行った.C2αをノックダウンしたときのみ,トランスゴルジネットワークから細胞間接着部位へのホスファチジルイノシトール3-リン酸に陽性のエンドソームを介したVE-カドヘリンの輸送が著しく阻害された.このVE-カドヘリンのエンドソームによる輸送におけるC2α-RhoA系の関与を調べる目的で,RhoAのFRETプローブであるRaichu-RhoAを用いた生細胞イメージングによりRhoAの活性化の時空間変化を可視化した10).正常な血管内皮細胞において,RhoAの活性化はVEGF-Aの刺激により細胞内小胞膜および細胞間接着部位において強く観察された.このRhoA活性化がみられた細胞内小胞の一部は初期エンドソーム抗原に陽性を示すエンドソームであり,C2αのノックダウンによりエンドソームおよび細胞間接着部位におけるRhoAの活性化はほとんど消滅した.このことは,ホスファチジルイノシトール3-リン酸に陽性のエンドソームおよび細胞膜におけるRhoA活性化にC2αが必須であることを示していた.さらに,エンドソームにおけるRhoAの活性化の上流にあたるVEGF受容体2の内在化に着目した.VEGF-Aの刺激によるVEGF受容体2のホスファチジルイノシトール3-リン酸に陽性のエンドソームへの内在化は,C2αのノックダウンにより消失した.興味深いことに,VEGF-Aの刺激ののち2分でみられる細胞膜におけるVEGF受容体2のリン酸化はC2αをノックダウンした細胞においても正常な細胞と同様に観察されたが,刺激ののち30分でみられるリン酸化VEGF受容体2のエンドソームへの内在化はC2αのノックダウンにより抑制された.さらに,ダイナミン依存性エンドサイトーシスの阻害剤であるDynasoreの前処置により,VEGF-Aの刺激によるRhoAの活性化,細胞間接着部位へのVE-カドヘリンの集積,マトリゲル上での管腔の形成は減弱した.これらの結果から,C2αは活性化したVEGF受容体2のエンドソームへの内在化と,そののちのRhoAの活性化を含むエンドソームにおけるシグナル伝達,VE-カドヘリンのエンドソームによる輸送とその細胞間接着部位への集積に必須であると考えられた.
病的な血管新生におけるC2αの役割を明らかにするため,虚血性の血管新生および腫瘍における血管新生の2つのin vivoモデルを用い検討した.タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスにおいて,大腿動脈の切除による下肢の虚血ののちの血流の回復は,同腹の野生型マウスと比べ処理ののち14~28日で有意に減弱していた.抗CD31抗体を用いた免疫組織染色の結果,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスの虚血筋組織における新生した血管の密度は,野生型マウスに比べ処理ののち28日で約50%減少していた.
また,マウスの背側皮下組織にLewis肺がん細胞およびB16メラノーマ細胞を移植する腫瘍評価モデルにおいて,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスの腫瘍の増殖速度および移植ののち14日の腫瘍の重量は,野生型マウスと比べ有意に減少していた.腫瘍組織における新生した血管の密度を抗CD31抗体染色により定量したところ,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスにおいて低下しており,抗NG2抗体による周皮細胞の染色像から,腫瘍における新生した血管はNG2陽性の周皮細胞の血管壁への集積が著しく不良であることが明らかになった.
C2αをノックダウンしたヒトの臍帯静脈内皮細胞の単層培養における透過性をFITCデキストラン法により評価したところ,対照となる細胞と比べ,無刺激およびVEGF-Aにより刺激したときとも透過性は有意に亢進していた.エバンスブルー色素法によるin vivoにおける血管透過性の評価モデルにおいても,C2αヘテロノックアウトマウスにおけるVEGF-Aの皮下刺激による色素の血管の外部への露出の程度は,野生型マウスに比べ有意に亢進していた.また,C2αヘテロノックアウトマウスにおける血管透過性の亢進は,アナフィラキシーの誘発物質であるPAFを投与した場合にも観察された.野生型マウスへの影響はほとんどみられない低容量のPAFの投与により,C2αヘテロノックアウトマウスは投与ののち40分以内にすべて死亡した.その際,C2αヘテロノックアウトマウスのヘマトクリット値は野生型マウスに比べ上昇し,肺組織における血管透過性の亢進が観察されたことから,マウスにおけるC2αの欠損は血管内皮の機能障害による血管バリア機能の低下をもたらすことが示唆された.
アンジオテンシンIIの慢性投与による血管透過性の亢進は,C2αヘテロノックアウトマウスの大動脈および冠動脈において野生型マウスに比べ有意に増強していた.このとき,大動脈内皮細胞の細胞間接着部位がC2αヘテロノックアウトマウスにおいて傷害されていることが,抗VE-カドヘリン抗体を用いたen faceホールマウント免疫染色による観察により明らかになった.驚いたことに,アンジオテンシンIIの慢性投与により,C2αヘテロノックアウトマウスにおいて野生型マウスではみられない解離性大動脈瘤の形成が高頻度に観察された.アンジオテンシンIIの投与ののち3日からC2αヘテロノックアウトマウスにおいてのみ解離性大動脈瘤の破裂による出血死がみられ,投与ののち2週間で約50%が死亡した.タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスでも同様に,アンジオテンシンIIの慢性投与による解離性大動脈瘤の発症がみられたことから,血管内皮細胞におけるC2αの欠損は血管壁の構造を著しく脆弱にしているものと考えられた.マトリックスメタロプロテアーゼ-2およびマトリックスメタロプロテアーゼ-9の活性化は動脈瘤の形成の原因のひとつと考えられているが,アンジオテンシンIIの慢性投与によりC2αヘテロノックアウトマウスの血管壁におけるこれら酵素の活性は野生型マウスに比べ増大しており,これらの酵素の産生細胞であるMac3陽性炎症性マクロファージの血管壁への浸潤もC2αヘテロノックアウトマウスにおいて顕著に増加していた.
この研究により,内皮細胞に高く発現するクラスII型PI3キナーゼであるC2αは発生期における血管新生,および,生後の安定な血管における血管バリア機能の維持に欠かすことのできない役割をもつことが明らかになった.血管内皮細胞においてC2αは,その代謝産物であるホスファチジルイノシトール3-リン酸を介し細胞内小胞輸送を制御し,膜タンパク質の輸送,エンドサイトーシス,リサイクリング,エンドソームにおけるシグナル伝達に関与していた(図2).血管内皮細胞におけるこのC2αの機能が血管新生および血管バリア機能の維持をささえているものと考えられた.
クラスII型PI3キナーゼであるC2αとクラスI型PI3キナーゼは,血管内皮細胞においてまったく異なる細胞内機序により血管内皮の機能を制御していた.すなわち,クラスI型PI3キナーゼはAktの活性化を介して血管内皮細胞の増殖,生存,遊走に深く関与しているが,細胞内小胞輸送の制御やVE-カドヘリンの細胞間接着部位への集積には関与しない.したがって,この研究から明らかになったC2αの生理機能は,血管生物学におけるPI3キナーゼファミリーの新たな作用を見い出したものであり,血管バリア機能の障害により惹起される多くの血管疾患に対する新しい治療標的となることが期待される.
略歴:1997年 東京農工大学大学院工学研究科 修了,同年 米国Bioanalytical Systems社 博士研究員,1998年 東京都神経科学総合研究所 研究員を経て,2001年より金沢大学医薬保健研究域医学類 助教.
研究テーマ:血管新生および恒常性の維持におけるクラスII型PI3キナーゼC2αの機能.
抱負:誰も知らないことを知りたい.
多久和 陽(Yoh Takuwa)
金沢大学医薬保健研究域医学類 教授.
研究室URL:http://physiology1.w3.kanazawa-u.ac.jp/
© 2012 吉岡和晃・多久和 陽 Licensed under CC 表示 2.1 日本
(金沢大学医薬保健学域医学類 血管分子生理学)
email:多久和 陽
DOI: 10.7875/first.author.2012.120
Endothelial PI3K-C2α, a class II PI3K, has an essential role in angiogenesis and vascular barrier function.
Kazuaki Yoshioka, Kotaro Yoshida, Hong Cui, Tomohiko Wakayama, Noriko Takuwa, Yasuo Okamoto, Wa Du, Xun Qi, Ken Asanuma, Kazushi Sugihara, Sho Aki, Hidekazu Miyazawa, Kuntal Biswas, Chisa Nagakura, Masaya Ueno, Shoichi Iseki, Robert J Schwartz, Hiroshi Okamoto, Takehiko Sasaki, Osamu Matsui, Masahide Asano, Ralf H Adams, Nobuyuki Takakura, Yoh Takuwa
Nature Medicine, 18, 1560-1569 (2012)
要 約
イノシトールリン脂質リン酸化酵素であるPI3キナーゼのうち,クラスI型PI3キナーゼは細胞の増殖,分化,遊走,生存に必須のシグナル伝達タンパク質としてよく知られている.筆者らは,これまで生理機能の不明であったクラスIIα型PI3キナーゼのひとつ,C2αのコンディショナルノックアウトマウスを用いた実験から,発生期および生後における生理的および病的な血管新生ならびに血管における恒常性の維持に,C2αが重要な役割をはたしていることを明らかにした.C2αは血管内皮細胞において初期エンドソーム,クラスリン被覆小胞,トランスゴルジネットワークに局在していた.血管内皮細胞においてC2αをノックダウンすると,ホスファチジルイノシトール3-リン酸に富むエンドソームの減少,エンドソーム輸送の障害,血管内皮細胞の細胞間接着部位へのVE-カドヘリンの輸送の異常,細胞間接着部位の構造の異常がひき起こされた.C2αのノックダウンによりVEGF受容体の内在化やエンドソームにおける低分子量Gタンパク質RhoAの活性化が障害された結果,血管内皮細胞の遊走,増殖,細胞間接着,および,管腔の形成が抑制された.生存の可能なC2αヘテロノックアウトマウスでは,アナフィラキシーに対する感受性の著しい増強,アンジオテンシンIIの投与に対する解離性大動脈瘤の形成における発症率の上昇がみられた.以上の結果から,C2αは血管内皮細胞において細胞内小胞輸送の制御を介し,VE-カドヘリンをはじめとする物質輸送およびエンドソームにおけるシグナル伝達に必須であり,これらの作用により血管の形成と血管の健全性の維持に重要な役割を担っていることが明らかになった.C2αは血管疾患の新しい治療標的となることが期待される.
はじめに
胎生期の発達,生後の組織における修復およびリモデリング,腫瘍の増殖において,脈管の形成および血管新生からなる血管形成のプロセスは必須である.脈管の形成による未成熟な原始血管網は,動員された壁細胞と会合することにより安定な血管へと成熟していく1).静止期の安定した血管においては,強固なバリア機能が保たれ健全な循環機能が維持される.一方,腫瘍のような病的な組織において血管網は未成熟であり,漏れやすい構造をもっている.また,過剰なアンジオテンシンIIなどにより誘発される血管障害などでは,炎症性白血球の血管壁への浸潤をともなう血管透過性の亢進がみられ,血管壁の重大な障害をもたらす.したがって,血管バリア機能の維持および血管の安定化は,血管および組織の恒常性の維持において必須である.
ホスファチジルイノシトール3-キナーゼ(PI3キナーゼ)はイノシトールリン脂質のもつイノシトール環の3位をリン酸化する酵素であり,リン酸化されたホスファチジルイノシトールを介し,細胞分裂,増殖,分化,遊走,アポトーシスの制御やがん化,細胞内小胞輸送など,多岐にわたる細胞応答に関与している.PI3キナーゼは哺乳類において,ドメインの構造や薬理学的な特性の違いにより,3つのクラス,8つのアイソフォームに分類されている(図1).クラスI型PI3キナーゼの触媒サブユニットはp110α,p110β,p110γ,p110δの4つのアイソフォームからなり,これらは多くのチロシンキナーゼ型受容体やGタンパク質共役受容体の刺激により活性化され,細胞膜においてホスファチジルイノシトール3,4,5-トリスリン酸を産生し下流にシグナルを伝達する.血管内皮細胞において,クラスI型PI3キナーゼ,とくにp110αは増殖,分化,生存,遊走,形態形成を制御し発生期の血管新生を担う必須のシグナルタンパク質である2,3).クラスIII型PI3キナーゼであるVps34はホスファチジルイノシトール3-リン酸を産生し,細胞内小胞輸送やオートファジーに関与することが知られている.一方,クラスII型PI3キナーゼについては,哺乳類ではC2α,C2β,C2γの3つのアイソフォームの存在が知られている(図1)が,これらの活性化の機序および生理機能はほとんど不明であった4).最近の報告では,C2αは細胞においてホスファチジルイノシトールを主要な基質としホスファチジルイノシトール3-リン酸を産生していることが示されている5).
クラスII型PI3キナーゼの構造的な特徴は,C末端にPXドメインとC2ドメインをもつこと,長いN末端においてクラスI型PI3キナーゼにはみられない複数の機能ドメインをもつことである(図1).C2αとC2βにはコイルドコイルドメインが存在するが,さらにC2αにのみクラスリン結合ドメインが存在し,これらのドメインがC2αの独自の機能を担っている可能性が高い.薬理学的にはPI3キナーゼ阻害剤に低感受性を示すことが示されている.C2αおよびC2βは全身の臓器に広汎に発現し,なかでもC2αは心臓,胎盤,子宮,血管に,C2βは皮膚,胸腺,胎盤に,比較的多く発現しているのに対し,C2γの発現は主として肝臓に限局している.C2αは細胞レベルでは上皮細胞,血管内皮細胞,平滑筋細胞に比較的多く発現しており,細胞においてクラスリン被覆小胞,エンドソーム,トランスゴルジネットワークに局在していることから,細胞内小胞輸送の制御に関与することが示唆されていた4,5).細胞レベルでのいくつか研究において,サイトカインやインスリンという細胞外からの刺激によりC2αの活性化することが報告されていたが,個体レベルでのC2αの機能的な役割はほとんど不明であった4-7).最近では,C2αの遺伝子を部分的に欠損したhypomorphicな(低形質を示す)変異マウスが腎糸球体の形成障害を呈することが報告された8).
この研究では,遺伝子改変マウスを用いて個体レベルにおけるC2αの機能を詳細に解析した.その結果,C2αは血管内皮の機能を制御することにより胎生期および生後の病的な血管新生において重要な役割を担うことが明らかにされた.このC2αの血管新生の作用は,クラスI型PI3キナーゼとはまったく異なる分子機構をもつものであった.すなわち,C2αは血管内皮細胞において細胞内小胞輸送を制御することにより,血管内皮細胞における接着分子VE-カドヘリンを含む膜タンパク質の輸送,および,エンドソームにおけるシグナル伝達に必須であった.C2αは血管内皮の機能を制御し血管新生において重要な役割を担うとともに,血管内皮のバリア機能と恒常性の維持に欠かせないPI3キナーゼのアイソフォームであることが明らかになった.
1.血管内皮細胞においてC2αは生理的な血管新生に必須である
全身型のC2αホモノックアウトマウスは胎生8.5日目から発育不全となり,胎生10.5日目から胎生11.5日目のあいだに血管形成の不全により胎生致死となった.血管内皮のマーカーである抗CD31抗体を用いた胎生11.5日目のマウス胎仔のホールマウント染色において,C2αホモノックアウトマウスは全身にわたり血管形成の障害が観察された.この表現型がどの細胞に発現するC2αに依存しているのか明らかにするため,細胞に特異的なC2αのコンディショナルノックアウトマウスを作製した.平滑筋細胞に特異的なC2αコンディショナルノックアウトマウスあるいは心筋細胞に特異的なC2αコンディショナルノックアウトマウスは正常に発育しメンデルの法則にしたがい出生したのに対し,血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスは血管形成の不全を含む多臓器の障害により胎生致死となった.これらのことから,血管内皮細胞に発現するC2αは正常な血管の形成および個体の発生に必須であることが示された.
血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスは胎生致死であったことから,生後におけるC2αの機能解析を行うため,タモキシフェンにより誘導の可能な血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスを作製した.血管内皮細胞に特異的なVE-カドヘリン遺伝子プロモーターの下流にタモキシフェン誘導型Creリコンビナーゼ-エストロゲン受容体融合タンパク質を発現するトランスジェニックマウス9) を用いることで,生後,タモキシフェンを投与することにより血管内皮細胞でのみC2αを欠損するコンディショナルノックアウトマウスを作製することができた.このマウスの網膜における血管新生モデルを用いて,生後の生理的な血管新生に及ぼす血管内皮細胞におけるC2α欠損の効果を調べた.生後3日目にタモキシフェンを投与し生後6日目にて網膜における血管新生を観察したところ,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスでは著しく低下していた.以上のことから,血管内皮細胞に発現するC2αは胎生期における血管新生および生後における生理的な血管新生に必須なPI3キナーゼのアイソフォームであることが明らかになった.
2.C2αは低分子量Gタンパク質RhoAを介し血管内皮の機能に関与する
RNAi法によりC2αをノックダウンしたヒトの臍帯静脈内皮細胞においては,血管内皮増殖因子VEGF-Aによるマトリゲル上での管腔の形成が阻害された.PI3キナーゼのほかのアイソフォームのノックダウンはVEGF-Aによる管腔の形成能に影響しなかった.さらに,C2αをノックダウンした細胞ではVEGF-Aによる細胞遊走能も著しく抑制された.しかし,C2αをノックアウトした血管平滑筋細胞ではPDGFによる細胞遊走能にまったく変化のみられなかったことから,C2αは血管内皮細胞に特異的に役割をもつことが示唆された.
C2αをノックダウンしたヒトの臍帯静脈内皮細胞では,VEGF-AによるVEGF受容体のチロシンリン酸化,および,そののちの細胞内シグナル伝達経路にあるAkt,ERK,PAK2,NO合成酵素のリン酸化はまったく影響をうけなかった.これらのVEGFシグナル伝達経路はクラスI型PI3キナーゼであるp110αに強く依存していることがよく知られている.興味深いことに,C2αをノックダウンした細胞において,VEGF-Aにより活性化されるミオシン脱リン酸化酵素サブユニットMYPT1のリン酸化が抑制された.このMYPT1は低分子量Gタンパク質RhoAにより活性化されるRhoキナーゼの直接の標的基質であることから,VEGF-Aの刺激によるRhoAの活性化について調べたところ,C2αのノックダウンによりRhoAの活性化の著しい減弱が観察された.ドミナントネガティブ変異をもつRhoAをアデノウイルスの感染によりヒトの臍帯静脈内皮細胞に導入しRhoAを不活性化したところ,VEGF-Aによるマトリゲル上での管腔の形成は顕著に抑制された.これらの結果から,C2αはRhoAを介した血管内皮細胞の形態形成に必須の役割をもつことが示された.
3.C2αはVE-カドヘリンのエンドソームによる輸送に必須である
細胞でのエンドソーム輸送におけるC2αの役割を明らかにするため,まず,C2αの代謝産物であるホスファチジルイノシトール3-リン酸の特異的な蛍光プローブをコードする遺伝子をヒトの臍帯静脈内皮細胞に導入し,生細胞イメージング法による細胞内局在の可視化を試みた.正常な細胞においてホスファチジルイノシトール3-リン酸はおもにエンドソームに局在していた.しかし,C2αをノックダウンした細胞ではホスファチジルイノシトール3-リン酸に陽性のエンドソームの減少とエンドソームの運動の減弱がみられた.p110αあるいはVps34をノックダウンした細胞ではまったく変化はみられなかった.この観察と一致して,GFPにより標識したC2αはおもに,初期エンドソーム,クラスリン被覆小胞,トランスゴルジネットワークに強く限局していたことから,C2αはエンドドーム膜におけるホスファチジルイノシトール3-リン酸の産生とエンドソーム輸送に必須であると考えられた.
血管内皮細胞において重要な役割をはたしている接着分子VE-カドヘリンのエンドソームによる輸送を観察するため,GFPにより標識したVE-カドヘリンを発現させたヒトの臍帯静脈内皮細胞において生細胞イメージングを行った.C2αをノックダウンしたときのみ,トランスゴルジネットワークから細胞間接着部位へのホスファチジルイノシトール3-リン酸に陽性のエンドソームを介したVE-カドヘリンの輸送が著しく阻害された.このVE-カドヘリンのエンドソームによる輸送におけるC2α-RhoA系の関与を調べる目的で,RhoAのFRETプローブであるRaichu-RhoAを用いた生細胞イメージングによりRhoAの活性化の時空間変化を可視化した10).正常な血管内皮細胞において,RhoAの活性化はVEGF-Aの刺激により細胞内小胞膜および細胞間接着部位において強く観察された.このRhoA活性化がみられた細胞内小胞の一部は初期エンドソーム抗原に陽性を示すエンドソームであり,C2αのノックダウンによりエンドソームおよび細胞間接着部位におけるRhoAの活性化はほとんど消滅した.このことは,ホスファチジルイノシトール3-リン酸に陽性のエンドソームおよび細胞膜におけるRhoA活性化にC2αが必須であることを示していた.さらに,エンドソームにおけるRhoAの活性化の上流にあたるVEGF受容体2の内在化に着目した.VEGF-Aの刺激によるVEGF受容体2のホスファチジルイノシトール3-リン酸に陽性のエンドソームへの内在化は,C2αのノックダウンにより消失した.興味深いことに,VEGF-Aの刺激ののち2分でみられる細胞膜におけるVEGF受容体2のリン酸化はC2αをノックダウンした細胞においても正常な細胞と同様に観察されたが,刺激ののち30分でみられるリン酸化VEGF受容体2のエンドソームへの内在化はC2αのノックダウンにより抑制された.さらに,ダイナミン依存性エンドサイトーシスの阻害剤であるDynasoreの前処置により,VEGF-Aの刺激によるRhoAの活性化,細胞間接着部位へのVE-カドヘリンの集積,マトリゲル上での管腔の形成は減弱した.これらの結果から,C2αは活性化したVEGF受容体2のエンドソームへの内在化と,そののちのRhoAの活性化を含むエンドソームにおけるシグナル伝達,VE-カドヘリンのエンドソームによる輸送とその細胞間接着部位への集積に必須であると考えられた.
4.血管内皮細胞においてC2αは病的な血管新生に必須である
病的な血管新生におけるC2αの役割を明らかにするため,虚血性の血管新生および腫瘍における血管新生の2つのin vivoモデルを用い検討した.タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスにおいて,大腿動脈の切除による下肢の虚血ののちの血流の回復は,同腹の野生型マウスと比べ処理ののち14~28日で有意に減弱していた.抗CD31抗体を用いた免疫組織染色の結果,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスの虚血筋組織における新生した血管の密度は,野生型マウスに比べ処理ののち28日で約50%減少していた.
また,マウスの背側皮下組織にLewis肺がん細胞およびB16メラノーマ細胞を移植する腫瘍評価モデルにおいて,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスの腫瘍の増殖速度および移植ののち14日の腫瘍の重量は,野生型マウスと比べ有意に減少していた.腫瘍組織における新生した血管の密度を抗CD31抗体染色により定量したところ,タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスにおいて低下しており,抗NG2抗体による周皮細胞の染色像から,腫瘍における新生した血管はNG2陽性の周皮細胞の血管壁への集積が著しく不良であることが明らかになった.
5.C2αは血管バリア機能と恒常性の維持に必須である
C2αをノックダウンしたヒトの臍帯静脈内皮細胞の単層培養における透過性をFITCデキストラン法により評価したところ,対照となる細胞と比べ,無刺激およびVEGF-Aにより刺激したときとも透過性は有意に亢進していた.エバンスブルー色素法によるin vivoにおける血管透過性の評価モデルにおいても,C2αヘテロノックアウトマウスにおけるVEGF-Aの皮下刺激による色素の血管の外部への露出の程度は,野生型マウスに比べ有意に亢進していた.また,C2αヘテロノックアウトマウスにおける血管透過性の亢進は,アナフィラキシーの誘発物質であるPAFを投与した場合にも観察された.野生型マウスへの影響はほとんどみられない低容量のPAFの投与により,C2αヘテロノックアウトマウスは投与ののち40分以内にすべて死亡した.その際,C2αヘテロノックアウトマウスのヘマトクリット値は野生型マウスに比べ上昇し,肺組織における血管透過性の亢進が観察されたことから,マウスにおけるC2αの欠損は血管内皮の機能障害による血管バリア機能の低下をもたらすことが示唆された.
アンジオテンシンIIの慢性投与による血管透過性の亢進は,C2αヘテロノックアウトマウスの大動脈および冠動脈において野生型マウスに比べ有意に増強していた.このとき,大動脈内皮細胞の細胞間接着部位がC2αヘテロノックアウトマウスにおいて傷害されていることが,抗VE-カドヘリン抗体を用いたen faceホールマウント免疫染色による観察により明らかになった.驚いたことに,アンジオテンシンIIの慢性投与により,C2αヘテロノックアウトマウスにおいて野生型マウスではみられない解離性大動脈瘤の形成が高頻度に観察された.アンジオテンシンIIの投与ののち3日からC2αヘテロノックアウトマウスにおいてのみ解離性大動脈瘤の破裂による出血死がみられ,投与ののち2週間で約50%が死亡した.タモキシフェン誘導型の血管内皮細胞に特異的なC2αコンディショナルノックアウトマウスでも同様に,アンジオテンシンIIの慢性投与による解離性大動脈瘤の発症がみられたことから,血管内皮細胞におけるC2αの欠損は血管壁の構造を著しく脆弱にしているものと考えられた.マトリックスメタロプロテアーゼ-2およびマトリックスメタロプロテアーゼ-9の活性化は動脈瘤の形成の原因のひとつと考えられているが,アンジオテンシンIIの慢性投与によりC2αヘテロノックアウトマウスの血管壁におけるこれら酵素の活性は野生型マウスに比べ増大しており,これらの酵素の産生細胞であるMac3陽性炎症性マクロファージの血管壁への浸潤もC2αヘテロノックアウトマウスにおいて顕著に増加していた.
おわりに
この研究により,内皮細胞に高く発現するクラスII型PI3キナーゼであるC2αは発生期における血管新生,および,生後の安定な血管における血管バリア機能の維持に欠かすことのできない役割をもつことが明らかになった.血管内皮細胞においてC2αは,その代謝産物であるホスファチジルイノシトール3-リン酸を介し細胞内小胞輸送を制御し,膜タンパク質の輸送,エンドサイトーシス,リサイクリング,エンドソームにおけるシグナル伝達に関与していた(図2).血管内皮細胞におけるこのC2αの機能が血管新生および血管バリア機能の維持をささえているものと考えられた.
クラスII型PI3キナーゼであるC2αとクラスI型PI3キナーゼは,血管内皮細胞においてまったく異なる細胞内機序により血管内皮の機能を制御していた.すなわち,クラスI型PI3キナーゼはAktの活性化を介して血管内皮細胞の増殖,生存,遊走に深く関与しているが,細胞内小胞輸送の制御やVE-カドヘリンの細胞間接着部位への集積には関与しない.したがって,この研究から明らかになったC2αの生理機能は,血管生物学におけるPI3キナーゼファミリーの新たな作用を見い出したものであり,血管バリア機能の障害により惹起される多くの血管疾患に対する新しい治療標的となることが期待される.
文 献
- Adams, R. H. & Alitalo, K.: Molecular regulation of angiogenesis and lymphangiogenesis. Nat. Rev. Mol. Cell Biol., 8, 464-478 (2007)[PubMed]
- Vanhaesebroeck, B., Guillermet-Guibert, J., Graupera, M. et al.: The emerging mechanisms of isoform-specific PI3K signaling. Nat. Rev. Mol. Cell Biol., 11, 329-341 (2010)[PubMed]
- Graupera, M., Guillermet-Guibert, J., Foukas, L. C. et al.: Angiogenesis selectively requires the p110α isoform of PI3K to control endothelial cell migration. Nature, 453, 662-666 (2008)[PubMed]
- Falasca, M. & Maffucci, T.: Role of class II phosphoinositide 3-kinase in cell signalling. Biochem. Soc. Trans., 35, 211-214 (2007)[PubMed]
- Falasca, M., Hughes, W. E., Dominguez, V. et al.: The role of phosphoinositide 3-kinase C2α in insulin signaling. J. Biol. Chem., 282, 28226-28236 (2007)[PubMed]
- Wang, Y., Yoshioka, K., Azam, M. A. et al.: Class II phosphoinositide 3-kinase α-isoform regulates Rho, myosin phosphatase and contraction in vascular smooth muscle. Biochem. J., 394, 581-592 (2006)[PubMed]
- Yoshioka, K., Sugimoto, N., Takuwa, N. et al.: Essential role for class II phosphoinositide 3-kinase α-isoform in Ca2+-induced, Rho- and Rho kinase-dependent regulation of myosin phosphatase and contraction in isolated vascular smooth muscle cells. Mol. Pharmacol., 71, 912-920 (2007)[PubMed]
- Harris, D., Vogel, P., Wims, M. et al.: Requirement for class II phosphoinositide 3-kinase C2α in maintenance of glomerular structure and function. Mol. Cell. Biol., 31, 63-80 (2011)[PubMed]
- Wang, Y., Nakayama, M., Pitulescu, M. E. et al.: Ephrin-B2 controls VEGF-induced angiogenesis and lymphangiogenesis. Nature, 465, 483-486 (2010)[PubMed]
- Yoshizaki, H., Ohba, Y., Kurokawa, K. et al.: Activity of Rho-family GTPases during cell division as visualized with FRET-based probes. J. Cell. Biol., 162, 223-232 (2003)[PubMed]
著者プロフィール
略歴:1997年 東京農工大学大学院工学研究科 修了,同年 米国Bioanalytical Systems社 博士研究員,1998年 東京都神経科学総合研究所 研究員を経て,2001年より金沢大学医薬保健研究域医学類 助教.
研究テーマ:血管新生および恒常性の維持におけるクラスII型PI3キナーゼC2αの機能.
抱負:誰も知らないことを知りたい.
多久和 陽(Yoh Takuwa)
金沢大学医薬保健研究域医学類 教授.
研究室URL:http://physiology1.w3.kanazawa-u.ac.jp/
© 2012 吉岡和晃・多久和 陽 Licensed under CC 表示 2.1 日本