マウスの左右軸の形成においてノードにある繊毛は流れのセンサーとしてはたらく
吉場聡子・濱田博司
(大阪大学大学院生命機能研究科 発生遺伝学研究室)
email:吉場聡子
DOI: 10.7875/first.author.2012.121
Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2.
Satoko Yoshiba, Hidetaka Shiratori, Ivana Y. Kuo, Aiko Kawasumi, Kyosuke Shinohara, Shigenori Nonaka, Yasuko Asai, Genta Sasaki, Jose Antonio Belo, Hiroshi Sasaki, Junichi Nakai, Bernd Dworniczak, Barbara E. Ehrlich, Petra Pennekamp, Hiroshi Hamada
Science, 338, 226-231 (2012)
マウスの左右軸の形成においては,ノードにおける繊毛の回転運動による左向きの流れ(ノード流)により左右の決まることが知られている.ノードの細胞がどのようにノード流を感知しているのかについては,これまでいくつかのモデルが報告されているが明確な答えは得られていない.Ca2+チャネルPkd2の変異マウスは左右の異常を示し,このタンパク質がノード流のセンサーとしてはたらくことが示唆されていた.この研究において,筆者らは,Pkd2はノードの周縁部にある細胞の繊毛においてはたらいていることを強く示唆する結果を得た.まず,Pkd2がノードの周縁部の細胞においてのみ発現するトランスジェニックマウスを作製し,このトランスジェニックマウスではPkd2をノックアウトした胚の左右の異常がレスキューされることを示した.一方で,Ca2+チャネルとしての活性は維持しているがノードの繊毛に局在できなくなった変異Pkd2をもつトランスジェニック胚は左右の異常は回復できなかった.また,ノードの周縁部の細胞だけに繊毛を形成するトランスジェニック胚でも左右は正しく決定された.これらの結果より,ノード流は繊毛に局在するPkd2により受容されることが示唆された.この研究により,ノード流の感知の分子機構につき,これまでの仮説の段階から一歩進み実際に機能しているタンパク質が明らかになり,左右軸の形成の理解がよりいっそう深まった.
われわれのからだの外見は左右対称であるが,内臓のかたちや配置など内側は左右非対称である.たとえば,胃や心臓は左側,肝臓は右側によっているし,肺の分葉は左右非対称になっている.これらは決して偶然に決まっているわけではなく,からだのつくられる胚発生の時期に遺伝的に厳密に制御されている.
マウスでは胎生期7.5日目において三胚葉の形成に付随して,胚の腹側にノードとよばれるくぼんだ組織ができる.ノードには細胞ひとつひとつに1本の繊毛が生えており,それらが時計回りに回転することで左向きの体液の流れ(ノード流)をつくりだしている1).左右性はノード流の向きに依存して決まることから,ノード流が左右の決定に非常に重要なはたらきをすることがわかっている2).すなわち,ノード流により左右になんらかのかたよりが生じ,それを発端として左右の非対称性が形成されていくのである.
それでは,ノードの細胞はどのようにノード流を受け取っているのだろうか.これまで,物理的な流れそのものが細胞により感知されるというメカノセンサーモデル3) や,分泌タンパク質などがノード流の影響により左側に作用するモデル4) などが提唱されている.これらのモデルを積極的に否定するような結果は報告されていないが,これらを支持する直接の証拠もまだ得られていない.どのモデルにおいても,ノード流の作用は左右非対称なCa2+シグナルに収束し,Ca2+チャネルであるPkd2がこのシグナルの担い手と考えられている.腎臓細胞においてPkd2は繊毛に局在し水流のセンサーとしてはたらくことが報告されていることから5),ノードでも同様のはたらきをしていることが予想されたが,一方で,Pkd2が繊毛において機能しているのか,そして,そもそもノード流を感知するのに繊毛は本当に必要なのかについて,十分には検討されてこなかった.筆者らは,ノード流の受容されるしくみをくわしく知るため,とくにPkd2に着目しこのタンパク質をてがかりとして研究に着手した.マウスの遺伝学を主要な研究手法として,Pkd2が繊毛に局在できなくなるマウスや組織特異的に繊毛の形成されなくなるマウスなどを作製し,この問題について検討を行った.
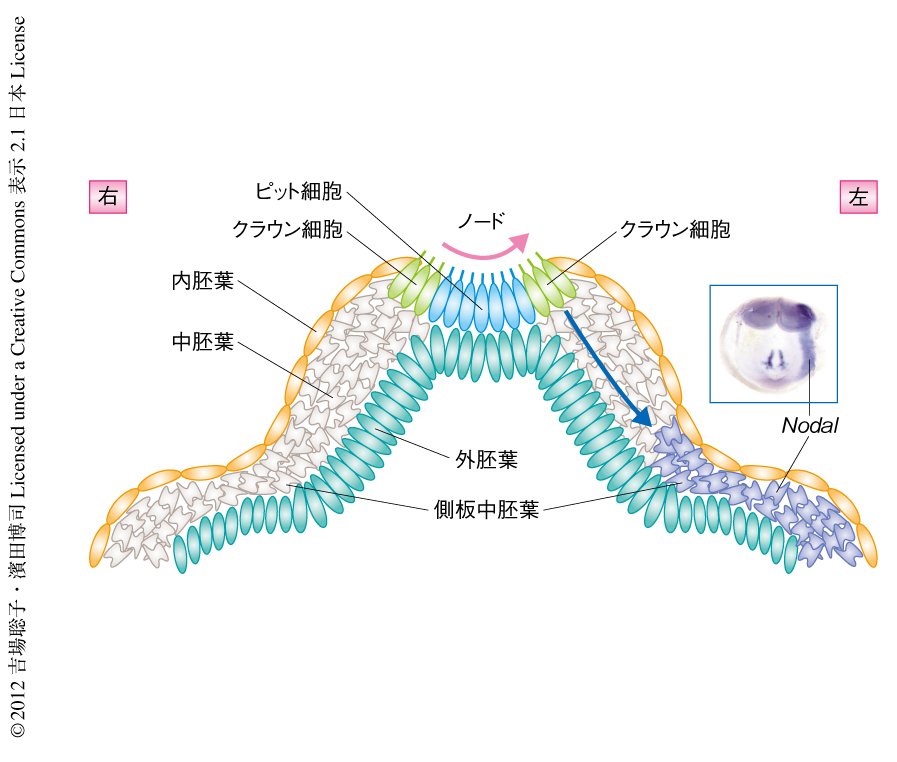
ノードにおいて生じた左右差の情報は,将来,臓器となる側板中胚葉に伝わり,TGFβファミリータンパク質をコードするNodal遺伝子やその下流の転写因子をコードするPitx2遺伝子の左特異的な発現というかたちで現われる6).そして,この情報をもとに左右非対称な形態形成が進んでいく.Pkd2をノックアウトした胚では側板中胚葉におけるNodal遺伝子の左特異的な発現が失われ左右の形態異常を示す7).一方で,Pkd2遺伝子はこの時期には胚の全体において発現しており,Pkd2のノックアウトによる左右の形成不全がどこの組織に起因するのかはわかっていなかった.そこで,ノードでのみPkd2を発現するトランスジェニックマウスを作製し左右が正常に決定されるかどうかを調べたところ,左特異的な発現が回復した.
ノードにある細胞はその場所または発現する遺伝子の違いにより,中心部のピット細胞と周縁部のクラウン細胞という2種類の細胞に分けることができる(図1).Pkd2がどちらの細胞で機能しているのかを知るため,ピット細胞あるいはクラウン細胞において特異的にPkd2を発現するトランスジェニックマウスを作製した.その結果,クラウン細胞において特異的にPkd2を発現するトランスジェニック胚では左右マーカーの左特異的な発現が回復したが,ピット細胞において特異的にPkd2を発現するトランスジェニック胚では回復しなかった.これらの結果より,左右軸の決定においてPkd2はノードの周縁部に存在するクラウン細胞において必要であることがわかった.
ノードにおけるPkd2の役割について検討した.Pkd2ノックアウト胚のノードの形態を走査型電子顕微鏡により調べたところ,野生型の胚と変わらず正常であることがわかった.また,ノードに蛍光マイクロビーズを投入しノード流の向きと流れの速さを調べたところ,Pkd2ノックアウト胚においても野生型の胚と同様の左向きの流れがみられた.これらの結果より,Pkd2は繊毛の形成やノード流の形成には寄与しないことがわかった.
そこで,Pkd2にはノード流のシグナルを受け取り下流に伝えるはたらきがあると考え,その可能性について検討した.ノード流の感知を評価するためのマーカーとして,ノードにおいて左右非対称な活性を示す転写エンハンサーANE(asymmetric node enhancer)を用いた8).このエンハンサーはヒトのlefty1遺伝子の制御配列に由来し,マウスはこれと相同な配列をもたないが導入するとクラウン細胞においてその左側で強い活性を示す.ノードに人工水流をかける装置2) を用いて,このマーカー遺伝子を導入したトランスジェニック胚のノードに右向きの流れをあたえて培養したところ,マーカーは右側で強い活性を示すようになり流れの向きにしたがうことがわかった.つぎに,このマーカー遺伝子をPkd2ノックアウト胚に導入したところ,マーカーの活性は左側で低下し左右非対称性が失われていた.これらの結果より,Pkd2はノード流のシグナルを受容するのに必要と考えられた.
また,Pkd2がCa2+チャネルであることから,ノードにおけるCa2+シグナルの関与について検討した.Ca2+シグナルの阻害剤を添加して胚を培養し,さきと同じマーカー遺伝子を導入することにより左右のシグナルが下流に伝達されるかどうかを調べた.その結果,Ca2+シグナル阻害剤であるGd3+,2-APB,または,タプシガルジンをくわえたとき,マーカーの左右非対称性は失われた.これらの結果より,クラウン細胞におけるCa2+シグナルの重要性が示唆された.
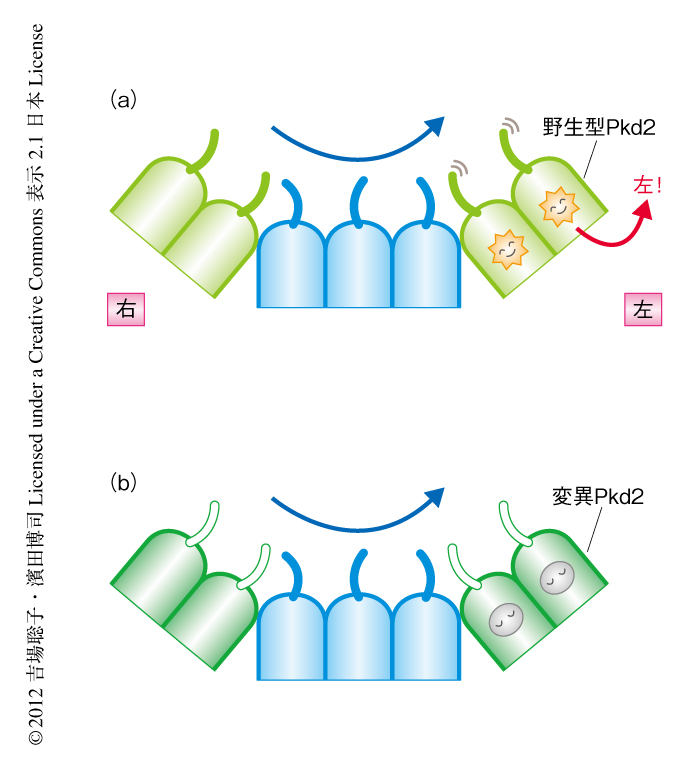
Pkd2がクラウン細胞にて本当に繊毛において機能しているのかどうかを検討した.まず,Pkd2のC末端に蛍光タンパク質Venusを融合しクラウン細胞にて発現させたところ,繊毛において局在がみられた.また,この融合タンパク質はPkd2ノックアウト胚の左右の異常をレスキューできたことから,機能的にはたらくことも確認された.Pkd2がノードの繊毛に局在することが必要であるかどうかを調べるため,Pkd2が繊毛に局在できなくなるような変異Pkd2トランスジェニックマウスの作製を試みた.これまでの報告を参考に,さまざまな変異を導入したPkd2をノードにおいて発現させ,その局在とPkd2ノックアウト胚の左右の異常のレスキュー,チャネルの性質などについて検討した.Pkd2はN末端に繊毛局在配列をもち,LLC-PK1細胞においてこの配列を欠損するとPkd2は繊毛に局在できなくなることが報告されているが9),ノードにおいてはこの配列に変異を導入したPkd2はノードの繊毛に局在することができ,Pkd2ノックアウト胚の左右の異常もレスキューした.一方,マウスのN-エチル-N-ニトロソ尿素(ENU)による突然変異誘発実験より得られた左右の異常を示す変異Pkd2は10),Ca2+チャネルとしての性質は正常であったがノードの繊毛には局在できなくなっていた.この結果より,左右軸の形成においてはPkd2のノードの繊毛への局在が必要であることが示唆された.
ノードのクラウン細胞の繊毛が左右軸の形成において必要であることをさらに直接的に示すため,クラウン細胞において特異的に繊毛を形成させることを試みた.繊毛の形成に必要なモータータンパク質Kif3aの変異胚ではノードの全体において繊毛が欠損しノード流がつくれなくなり左右は正常に決定されない1).そこで,クラウン細胞において特異的にKif3aを発現するトランスジェニックマウスを作製し,ノードの周縁部でのみ繊毛をつくらせた.このトランスジェニック胚においてノード流を調べたところ,局所的には渦ができていたが,全体としては左向きの流れが観察された.側板中胚葉において左右マーカーの発現を調べたところ左特異的に発現しており,Kif3aノックアウト胚の左右の異常はレスキューされていた.また,Kif3aノックアウト胚のノードに人工的な右向きの流れをあたえても反応はなかったが,クラウン細胞において特異的にKif3aを発現するトランスジェニック胚ではマーカー遺伝子は右側に発現するようになり,流れに対する反応性の回復することがわかった.これらの結果より,左右軸の形成においてノード流を受容するためにはクラウン細胞の繊毛が必要であると考えられた.
からだの左右が決まるしくみの分子基盤について,近年,筆者らの研究室やほかの研究グループの研究により,その多くが明らかになってきたが,ノード流の受容機構についてはモデルが先行し根拠は少なく混沌とした状態にあった.筆者らは,ノード流のセンサーの候補とされていたPkd2に焦点をしぼり,その機能する場所を追究することにより,より確かなことにせまろうとした.今回の結果は,ノード流はノードにある繊毛に局在するPkd2により受容されることを示唆しており(図2),ノードにおける左右非対称性の形成のしくみの解明にむけ大きな一歩といえる.
一方で,まだまだわかっていないことは多い.繊毛はノード流からどのような情報を受け取っているのだろうか.化学物質を受容しているのか,または,流れ自体の物理的な力を感知しているのだろうか.だとすると,どのようなしくみで受け取るのだろう.腎臓細胞においてPkd2はPkd1と複合体を形成し流れの物理的なセンサーとしてはたらくことが報告されているが5),ノードにおけるPkd2のパートナーはPkd1l1と考えられており11),このタンパク質も物理的な刺激を受け取るのに適した構造が予測されているが詳細は不明である.そしてさらに,繊毛が受容したシグナルはどのように下流に伝わり,左右非対称な遺伝子の発現にむすびつくのだろうか.これらの問いに答えるには,これまでこの分野を拓く原動力となった分子遺伝学にくわえ,物理学,イメージング,シミュレーションなど,さまざまな方向から検討していくことが必要となるだろう.
最後に,ノードの細胞にかぎらず多くの細胞は繊毛をもつが,近年,この繊毛が生体においてきわめて重要な役割をはたしており,繊毛の機能が異常となることでさまざまな疾患のひき起こされることがわかってきている.今回の研究成果が,左右形成のしくみの理解にとどまらず,広く細胞の機能一般の理解や疾患の解明につながることを期待したい.
略歴:2012年 大阪大学大学院生命機能研究科博士課程 修了,同年より同 特任研究員.
濱田 博司(Hiroshi Hamada)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/hamada/
© 2012 吉場聡子・濱田博司 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 発生遺伝学研究室)
email:吉場聡子
DOI: 10.7875/first.author.2012.121
Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2.
Satoko Yoshiba, Hidetaka Shiratori, Ivana Y. Kuo, Aiko Kawasumi, Kyosuke Shinohara, Shigenori Nonaka, Yasuko Asai, Genta Sasaki, Jose Antonio Belo, Hiroshi Sasaki, Junichi Nakai, Bernd Dworniczak, Barbara E. Ehrlich, Petra Pennekamp, Hiroshi Hamada
Science, 338, 226-231 (2012)
要 約
マウスの左右軸の形成においては,ノードにおける繊毛の回転運動による左向きの流れ(ノード流)により左右の決まることが知られている.ノードの細胞がどのようにノード流を感知しているのかについては,これまでいくつかのモデルが報告されているが明確な答えは得られていない.Ca2+チャネルPkd2の変異マウスは左右の異常を示し,このタンパク質がノード流のセンサーとしてはたらくことが示唆されていた.この研究において,筆者らは,Pkd2はノードの周縁部にある細胞の繊毛においてはたらいていることを強く示唆する結果を得た.まず,Pkd2がノードの周縁部の細胞においてのみ発現するトランスジェニックマウスを作製し,このトランスジェニックマウスではPkd2をノックアウトした胚の左右の異常がレスキューされることを示した.一方で,Ca2+チャネルとしての活性は維持しているがノードの繊毛に局在できなくなった変異Pkd2をもつトランスジェニック胚は左右の異常は回復できなかった.また,ノードの周縁部の細胞だけに繊毛を形成するトランスジェニック胚でも左右は正しく決定された.これらの結果より,ノード流は繊毛に局在するPkd2により受容されることが示唆された.この研究により,ノード流の感知の分子機構につき,これまでの仮説の段階から一歩進み実際に機能しているタンパク質が明らかになり,左右軸の形成の理解がよりいっそう深まった.
はじめに
われわれのからだの外見は左右対称であるが,内臓のかたちや配置など内側は左右非対称である.たとえば,胃や心臓は左側,肝臓は右側によっているし,肺の分葉は左右非対称になっている.これらは決して偶然に決まっているわけではなく,からだのつくられる胚発生の時期に遺伝的に厳密に制御されている.
マウスでは胎生期7.5日目において三胚葉の形成に付随して,胚の腹側にノードとよばれるくぼんだ組織ができる.ノードには細胞ひとつひとつに1本の繊毛が生えており,それらが時計回りに回転することで左向きの体液の流れ(ノード流)をつくりだしている1).左右性はノード流の向きに依存して決まることから,ノード流が左右の決定に非常に重要なはたらきをすることがわかっている2).すなわち,ノード流により左右になんらかのかたよりが生じ,それを発端として左右の非対称性が形成されていくのである.
それでは,ノードの細胞はどのようにノード流を受け取っているのだろうか.これまで,物理的な流れそのものが細胞により感知されるというメカノセンサーモデル3) や,分泌タンパク質などがノード流の影響により左側に作用するモデル4) などが提唱されている.これらのモデルを積極的に否定するような結果は報告されていないが,これらを支持する直接の証拠もまだ得られていない.どのモデルにおいても,ノード流の作用は左右非対称なCa2+シグナルに収束し,Ca2+チャネルであるPkd2がこのシグナルの担い手と考えられている.腎臓細胞においてPkd2は繊毛に局在し水流のセンサーとしてはたらくことが報告されていることから5),ノードでも同様のはたらきをしていることが予想されたが,一方で,Pkd2が繊毛において機能しているのか,そして,そもそもノード流を感知するのに繊毛は本当に必要なのかについて,十分には検討されてこなかった.筆者らは,ノード流の受容されるしくみをくわしく知るため,とくにPkd2に着目しこのタンパク質をてがかりとして研究に着手した.マウスの遺伝学を主要な研究手法として,Pkd2が繊毛に局在できなくなるマウスや組織特異的に繊毛の形成されなくなるマウスなどを作製し,この問題について検討を行った.
1.Pkd2は左右軸の形成においてノードの周縁部にある細胞においてはたらく
ノードにおいて生じた左右差の情報は,将来,臓器となる側板中胚葉に伝わり,TGFβファミリータンパク質をコードするNodal遺伝子やその下流の転写因子をコードするPitx2遺伝子の左特異的な発現というかたちで現われる6).そして,この情報をもとに左右非対称な形態形成が進んでいく.Pkd2をノックアウトした胚では側板中胚葉におけるNodal遺伝子の左特異的な発現が失われ左右の形態異常を示す7).一方で,Pkd2遺伝子はこの時期には胚の全体において発現しており,Pkd2のノックアウトによる左右の形成不全がどこの組織に起因するのかはわかっていなかった.そこで,ノードでのみPkd2を発現するトランスジェニックマウスを作製し左右が正常に決定されるかどうかを調べたところ,左特異的な発現が回復した.
ノードにある細胞はその場所または発現する遺伝子の違いにより,中心部のピット細胞と周縁部のクラウン細胞という2種類の細胞に分けることができる(図1).Pkd2がどちらの細胞で機能しているのかを知るため,ピット細胞あるいはクラウン細胞において特異的にPkd2を発現するトランスジェニックマウスを作製した.その結果,クラウン細胞において特異的にPkd2を発現するトランスジェニック胚では左右マーカーの左特異的な発現が回復したが,ピット細胞において特異的にPkd2を発現するトランスジェニック胚では回復しなかった.これらの結果より,左右軸の決定においてPkd2はノードの周縁部に存在するクラウン細胞において必要であることがわかった.
2.Pkd2はノード流のシグナルを伝達するのに必要である
ノードにおけるPkd2の役割について検討した.Pkd2ノックアウト胚のノードの形態を走査型電子顕微鏡により調べたところ,野生型の胚と変わらず正常であることがわかった.また,ノードに蛍光マイクロビーズを投入しノード流の向きと流れの速さを調べたところ,Pkd2ノックアウト胚においても野生型の胚と同様の左向きの流れがみられた.これらの結果より,Pkd2は繊毛の形成やノード流の形成には寄与しないことがわかった.
そこで,Pkd2にはノード流のシグナルを受け取り下流に伝えるはたらきがあると考え,その可能性について検討した.ノード流の感知を評価するためのマーカーとして,ノードにおいて左右非対称な活性を示す転写エンハンサーANE(asymmetric node enhancer)を用いた8).このエンハンサーはヒトのlefty1遺伝子の制御配列に由来し,マウスはこれと相同な配列をもたないが導入するとクラウン細胞においてその左側で強い活性を示す.ノードに人工水流をかける装置2) を用いて,このマーカー遺伝子を導入したトランスジェニック胚のノードに右向きの流れをあたえて培養したところ,マーカーは右側で強い活性を示すようになり流れの向きにしたがうことがわかった.つぎに,このマーカー遺伝子をPkd2ノックアウト胚に導入したところ,マーカーの活性は左側で低下し左右非対称性が失われていた.これらの結果より,Pkd2はノード流のシグナルを受容するのに必要と考えられた.
また,Pkd2がCa2+チャネルであることから,ノードにおけるCa2+シグナルの関与について検討した.Ca2+シグナルの阻害剤を添加して胚を培養し,さきと同じマーカー遺伝子を導入することにより左右のシグナルが下流に伝達されるかどうかを調べた.その結果,Ca2+シグナル阻害剤であるGd3+,2-APB,または,タプシガルジンをくわえたとき,マーカーの左右非対称性は失われた.これらの結果より,クラウン細胞におけるCa2+シグナルの重要性が示唆された.
3.左右軸の形成においてPkd2は繊毛に局在することが必要である
Pkd2がクラウン細胞にて本当に繊毛において機能しているのかどうかを検討した.まず,Pkd2のC末端に蛍光タンパク質Venusを融合しクラウン細胞にて発現させたところ,繊毛において局在がみられた.また,この融合タンパク質はPkd2ノックアウト胚の左右の異常をレスキューできたことから,機能的にはたらくことも確認された.Pkd2がノードの繊毛に局在することが必要であるかどうかを調べるため,Pkd2が繊毛に局在できなくなるような変異Pkd2トランスジェニックマウスの作製を試みた.これまでの報告を参考に,さまざまな変異を導入したPkd2をノードにおいて発現させ,その局在とPkd2ノックアウト胚の左右の異常のレスキュー,チャネルの性質などについて検討した.Pkd2はN末端に繊毛局在配列をもち,LLC-PK1細胞においてこの配列を欠損するとPkd2は繊毛に局在できなくなることが報告されているが9),ノードにおいてはこの配列に変異を導入したPkd2はノードの繊毛に局在することができ,Pkd2ノックアウト胚の左右の異常もレスキューした.一方,マウスのN-エチル-N-ニトロソ尿素(ENU)による突然変異誘発実験より得られた左右の異常を示す変異Pkd2は10),Ca2+チャネルとしての性質は正常であったがノードの繊毛には局在できなくなっていた.この結果より,左右軸の形成においてはPkd2のノードの繊毛への局在が必要であることが示唆された.
4.左右軸の形成においてノードの周縁部の繊毛が必要である
ノードのクラウン細胞の繊毛が左右軸の形成において必要であることをさらに直接的に示すため,クラウン細胞において特異的に繊毛を形成させることを試みた.繊毛の形成に必要なモータータンパク質Kif3aの変異胚ではノードの全体において繊毛が欠損しノード流がつくれなくなり左右は正常に決定されない1).そこで,クラウン細胞において特異的にKif3aを発現するトランスジェニックマウスを作製し,ノードの周縁部でのみ繊毛をつくらせた.このトランスジェニック胚においてノード流を調べたところ,局所的には渦ができていたが,全体としては左向きの流れが観察された.側板中胚葉において左右マーカーの発現を調べたところ左特異的に発現しており,Kif3aノックアウト胚の左右の異常はレスキューされていた.また,Kif3aノックアウト胚のノードに人工的な右向きの流れをあたえても反応はなかったが,クラウン細胞において特異的にKif3aを発現するトランスジェニック胚ではマーカー遺伝子は右側に発現するようになり,流れに対する反応性の回復することがわかった.これらの結果より,左右軸の形成においてノード流を受容するためにはクラウン細胞の繊毛が必要であると考えられた.
おわりに
からだの左右が決まるしくみの分子基盤について,近年,筆者らの研究室やほかの研究グループの研究により,その多くが明らかになってきたが,ノード流の受容機構についてはモデルが先行し根拠は少なく混沌とした状態にあった.筆者らは,ノード流のセンサーの候補とされていたPkd2に焦点をしぼり,その機能する場所を追究することにより,より確かなことにせまろうとした.今回の結果は,ノード流はノードにある繊毛に局在するPkd2により受容されることを示唆しており(図2),ノードにおける左右非対称性の形成のしくみの解明にむけ大きな一歩といえる.
一方で,まだまだわかっていないことは多い.繊毛はノード流からどのような情報を受け取っているのだろうか.化学物質を受容しているのか,または,流れ自体の物理的な力を感知しているのだろうか.だとすると,どのようなしくみで受け取るのだろう.腎臓細胞においてPkd2はPkd1と複合体を形成し流れの物理的なセンサーとしてはたらくことが報告されているが5),ノードにおけるPkd2のパートナーはPkd1l1と考えられており11),このタンパク質も物理的な刺激を受け取るのに適した構造が予測されているが詳細は不明である.そしてさらに,繊毛が受容したシグナルはどのように下流に伝わり,左右非対称な遺伝子の発現にむすびつくのだろうか.これらの問いに答えるには,これまでこの分野を拓く原動力となった分子遺伝学にくわえ,物理学,イメージング,シミュレーションなど,さまざまな方向から検討していくことが必要となるだろう.
最後に,ノードの細胞にかぎらず多くの細胞は繊毛をもつが,近年,この繊毛が生体においてきわめて重要な役割をはたしており,繊毛の機能が異常となることでさまざまな疾患のひき起こされることがわかってきている.今回の研究成果が,左右形成のしくみの理解にとどまらず,広く細胞の機能一般の理解や疾患の解明につながることを期待したい.
文 献
- Nonaka, S., Tanaka, Y., Okada, Y. et al.: Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell, 95, 829-837 (1998)[PubMed]
- Nonaka, S., Shiratori, H., Saijoh, Y. et al.: Determination of left-right patterning of the mouse embryo by artificial nodal flow. Nature, 418, 96-99 (2002)[PubMed]
- McGrath, J., Somlo, S., Makova, S. et al.: Two populations of node monocilia initiate left-right asymmetry in the mouse. Cell, 114, 61-73 (2003)[PubMed]
- Tanaka, Y., Okada, Y. & Hirokawa, N.: FGF-induced vesicular release of Sonic hedgehog and retinoic acid in leftward nodal flow is critical for left-right determination. Nature, 435, 172-177 (2005)[PubMed]
- Nauli, S. M., Alenghat, F. J., Luo, Y. et al.: Polycystins 1 and 2 mediate mechanosensation in the primary cilium of kidney cells. Nat. Genet., 33, 129-137 (2003)[PubMed]
- Hamada, H., Meno, C., Watanabe, D. et al.: Establishment of vertebrate left-right asymmetry. Nat. Rev. Genet., 3, 103-113 (2002)[PubMed]
- Pennekamp, P., Karcher, C., Fischer, A. et al.: The ion channel polycystin-2 is required for left-right axis determination in mice. Curr. Biol., 12, 938-943 (2002)[PubMed]
- Kawasumi, A., Nakamura, T., Iwai, N. et al. .: Left-right asymmetry in the level of active Nodal protein produced in the node is translated into left-right asymmetry in the lateral plate of mouse embryos. Dev. Biol., 353, 321-330 (2011)[PubMed]
- Geng, L., Okuhara, D., Yu, Z. et al.: Polycystin-2 traffics to cilia independently of polycystin-1 by using an N-terminal RVxP motif. J. Cell Sci., 119, 1383-1395 (2006)[PubMed]
- Ermakov, A., Stevens, J. L., Whitehill, E. et al.: Mouse mutagenesis identifies novel roles for left-right patterning genes in pulmonary, craniofacial, ocular, and limb development. Dev. Dyn., 238, 581-594 (2009)[PubMed]
- Field, S., Riley, K. L., Grimes, D. T. et al.: Pkd1l1 establishes left-right asymmetry and physically interacts with Pkd2. Development, 138, 1131-1142 (2011)[PubMed]
著者プロフィール
略歴:2012年 大阪大学大学院生命機能研究科博士課程 修了,同年より同 特任研究員.
濱田 博司(Hiroshi Hamada)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/hamada/
© 2012 吉場聡子・濱田博司 Licensed under CC 表示 2.1 日本