細菌におけるリポ多糖の修飾の状態とシグナル伝達系との相互フィードバック制御
加藤明宣・Eduardo A. Groisman
(米国Washington大学School of Medicine,Department of Molecular Microbiology)
email:加藤明宣
DOI: 10.7875/first.author.2012.119
Reciprocal control between a bacterium's regulatory system and the modification status of its lipopolysaccharide.
Akinori Kato, H. Deborah Chen, Tammy Latifi, Eduardo A. Groisman
Molecular Cell, 47, 897-908 (2012)
グラム陰性細菌の外膜はリポ多糖におおわれ,その修飾は抗菌剤への抵抗性や宿主の自然免疫からの回避などに重要であることが知られている.しかし,これまで,リポ多糖の修飾の状態が細菌それ自体によりどのように認識されているのかはよくわかっていない.筆者らは,サルモネラ菌が細胞の外部のFe3+に応答してリポ多糖を修飾する際に中心的な役割を担う二成分制御系PmrA-PmrB系について,そのインプットとアウトプットとの関係性に着目した.まず,Fe3+センサーであるPmrBをコードする遺伝子の下流に,内膜に局在するペプチドPmrRのコードされていることが見い出された.つぎに,レギュレーターであるPmrAにより転写の活性化されるリポ多糖修飾遺伝子のうち,とくにリポ多糖を正に荷電するはたらきをもつ4-アミノアラビノース修飾酵素の遺伝子の欠損株において,同時にpmrR遺伝子を欠損させるとPmrA-PmrB系の活性化のレベルが著しく高まったことから,PmrRもリポ多糖修飾酵素を制御していることが示唆された.実際に,PmrRはリピドAの1位をピロリン酸により修飾する膜酵素LpxTと相互作用することでその活性を抑制し,細胞の表層の負電荷を減少させることによりFe3+との結合性を低下させ,Fe3+センサーPmrBを刺激するFe3+の量を減少させることでPmrAにより転写の活性化される遺伝子の転写のレベルを低下させた.これらのことから,ピロリン酸により1位の修飾されたリピドAとFe3+との結合性を基軸とした,リポ多糖の修飾の状態と二成分制御系PmrA-PmrB系のあいだの相互フィードバック制御機構が明らかになった.
グラム陰性細菌の外膜は抗生物質や抗菌剤に対する透過性バリアを形成している1).外膜はタンパク質,内側のリン脂質,外側のリポ多糖から構成されている.細菌は環境変化に応答しリポ多糖のさまざまな部位において種々の化学修飾を行うため,その構造はダイナミックに変化する.リポ多糖の修飾は抗菌剤への抵抗性や宿主の自然免疫からの回避に欠かせないが,その一方で,リポ多糖修飾遺伝子の構成的な発現は胆汁に対し感受性を示すことから,その修飾のレベルは適度な厳密性をもって制御されているものと考えられている.
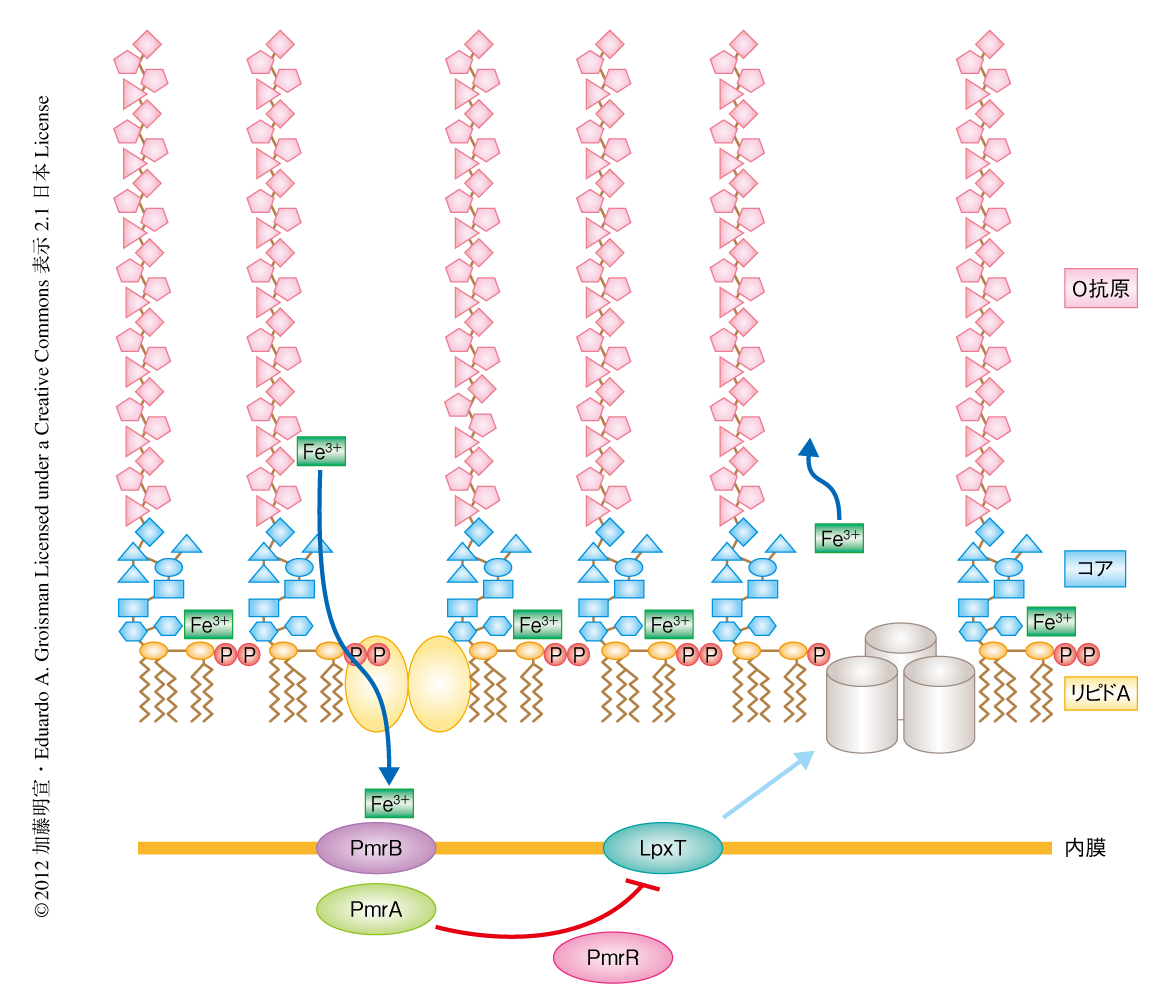
病原細菌であるサルモネラ菌(Salmonella typhimurium)において,二成分制御系PmrA-PmrB系は細胞の外部のFe3+に応答しリポ多糖修飾遺伝子の発現を制御する主要な制御機構である.リポ多糖は内側のリピドA,中間のコア,外側のO抗原から構成され(図1),PmrAに依存的なリポ多糖の修飾はこれらそれぞれの部位において起こる2).たとえば,PmrAにより転写の活性化される遺伝子の産物であるUgdおよびPmrCは,リピドAの1位と4’位を4-アミノアラビノースおよびホスホエタノールアミンにより,それぞれ修飾する.その結果,サルモネラ菌のリピドAはリン酸基による負の荷電が中和され,正の荷電をもつ抗生物質ポリミキシンBや金属イオンFe3+あるいはAl3+に抵抗性を示すようになる.これらリピドA修飾遺伝子を含め,PmrA-PmrB系は7つのリポ多糖修飾遺伝子座(ugd遺伝子,pbgP遺伝子,pmrC遺伝子,pmrG遺伝子,cptA遺伝子,wzzST遺伝子,wzzFepE遺伝子)を直接に制御している.
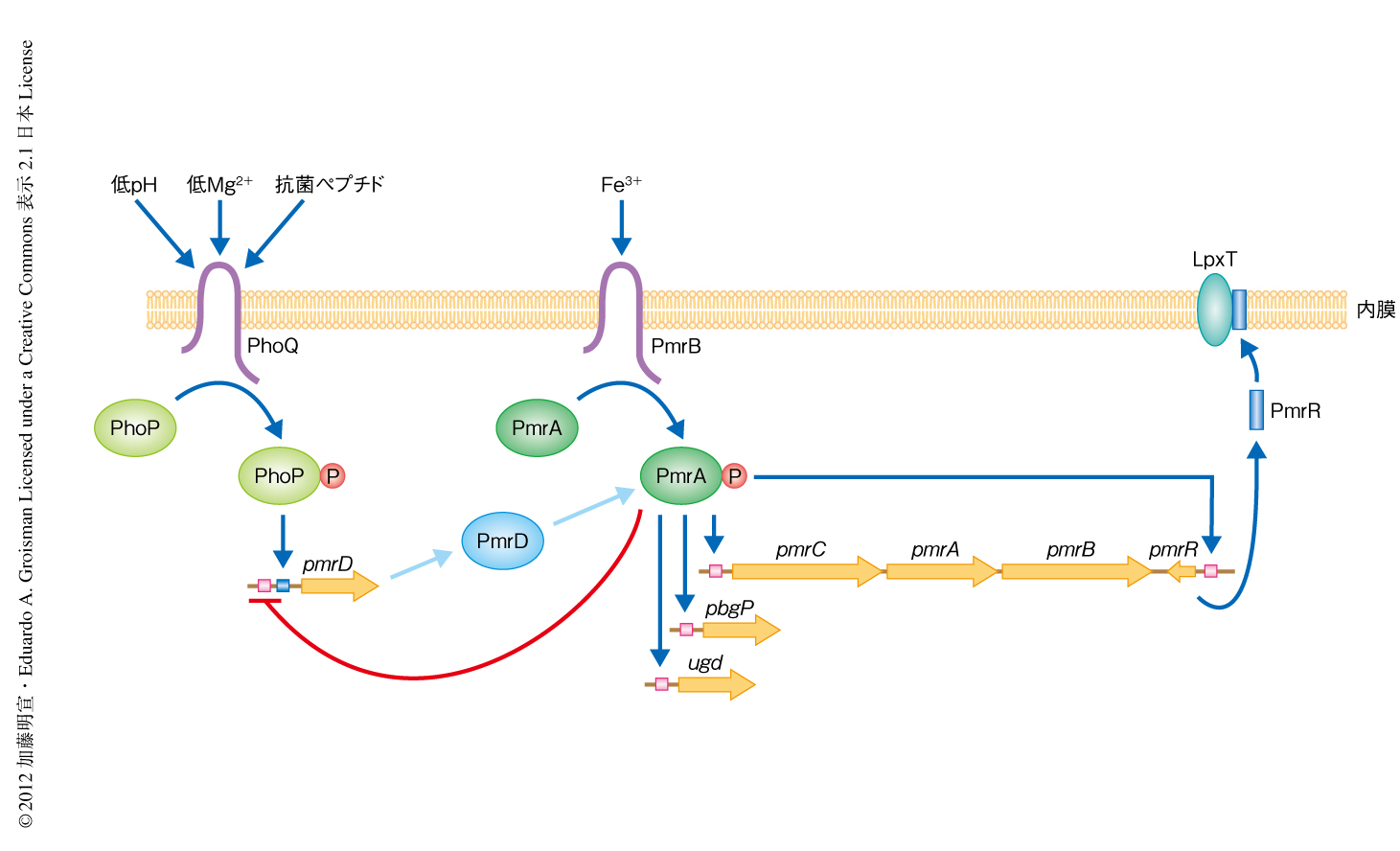
細菌のもつシグナル伝達機構として二成分制御系が知られている.PmrA-PmrB系においては,センサーであるPmrBが細胞の外部のFe3+を感知すると,レギュレーターであるPmrAをリン酸化し,PmrAに依存的なリポ多糖修飾遺伝子の転写は活性化される3)(図2).一方,低Mg2+シグナルもPmrA-PmrB系を活性化する.低Mg2+シグナルを感知する別の二成分制御系,PhoP-PhoQ系が85アミノ酸残基からなるコネクターPmrDを発現させ,これがリン酸化されたPmrAと結合することでPmrBによる脱リン酸化から保護するという分子機構がこれまでに明らかになっている4)(図2).また,低Mg2+かつ高Fe3+の条件では,リン酸化されたPmrAがpmrD遺伝子のプロモーターに結合し負のフィードバック制御を行う5)(図2).
この研究において,筆者らは,細菌がいつどのようにしてリポ多糖の修飾の状態に応答し,リポ多糖修飾遺伝子の産物あるいは活性化のレベルを制御しているのか,その分子機構の解明を試みた.
これまでの実験的な解析やコンピューターによる予測において報告のされていない,PmrAにより活性化される遺伝子プロモーターをpmrB遺伝子のコード領域のすぐ下流に同定し,pmrB遺伝子の方向にむかい転写されるRNAを確認した(図2).この遺伝子プロモーターのもつ,PmrAにより認識されるDNA結合モチーフであるPmrAボックスは,近縁の腸内細菌である大腸菌,肺炎桿菌,Citrobacter koseriのゲノムのpmrB遺伝子の下流においても認められた.このRNAはリボソーム結合部位とそれにつづく30コドンからなるORFを含み,これらの特徴もやはり近縁の腸内細菌において保存されていた.このORFから実際にペプチドが翻訳されていることを検証するため,サルモネラ菌の染色体においてこのORFの終止コドンのまえにFLAGタグを挿入した.PmrA-PmrB系が活性化される条件において培養したサルモネラ菌の抽出液をFLAG抗体アフィニティーカラムにより精製したところ,予測された分子量のペプチドが溶出されたことから,このORFがサルモネラ菌において実際に翻訳されていることが確認された.機能が既知のペプチドあるいはタンパク質の配列とほとんど類似性を示さないこの29アミノ酸残基からなるペプチドはPmrRと命名された.疎水性アミノ酸残基の存在から予測されたように,PmrRは内膜画分に局在することも実験的に示された.
これまで,PmrA-PmrB系が活性化されると,膜酵素LpxTに依存的なリピドAの1位のピロリン酸による修飾が抑制されるという報告がなされていたが6),この抑制に直接にかかわるタンパク質の存在は不明であった.PmrRとLpxTはどちらも内膜に局在すること,後述するように,PmrAに依存的なリピドA修飾遺伝子の欠失した株においてPmrRのはたらきが顕著となることなどから,PmrAが活性化された際にPmrRはLpxTを標的としそのはたらきを抑制する可能性が考えられた.このことを検証するにあたり,大腸菌のツーハイブリッド系や生化学的なアプローチを適用することにより,LpxTとPmrRとのあいだの特異的な相互作用が検出された.つぎに,PmrRがLpxTと相互作用することにより,リピドAの1位のピロリン酸による修飾は抑制されるかどうかを検証した.低Mg2+条件においてPhoP-PhoQ系とPmrA-PmrB系が活性化されると,PhoPに依存的なリポ多糖の修飾とPmrAに依存的なリポ多糖の修飾とが組み合わさり,多種多様な修飾をうけたリピドAが形成される.そこで,これらの修飾の抑制される高Mg2+条件において,PmrRをコードするプラスミドベクターを導入することでPmrRを発現させた野生株と,ベクターのみを導入した野生株からリピドAを単離し,薄層クロマトグラフィーに展開してその修飾のパターンを比較した.その結果,PmrRはLpxTに依存的なリピドAの1位のピロリン酸による修飾を抑制することが確認された.PmrRの発現によるこの抑制はlpxT欠損株において消失したことから,PmrRのもつこの機能はLpxTに依存することが明らかになった.
リピドAを修飾する膜酵素LpxTのPmrRによる抑制は,細胞の表層の負電荷を減少させることにより,サルモネラ菌と正電荷をもつFe3+との静電的な相互作用を抑制することが予測された.実際に,pmrR変異株は野生株と比較してより多くのFe3+と結合した.対照的に,lpxT変異株は野生株より少ないFe3+と結合した.PmrRの発現によりもたらされるFe3+との結合性の低下は,Fe3+センサーPmrBの活性化に利用されるFe3+の量を減少させ,結果として,PmrAにより転写の活性化される遺伝子の転写のレベルの低下につながるものと予測された.そこで,サルモネラ菌をFe3+を含有する培地で生育させてPmrAにより転写の活性化される遺伝子の転写のレベルを測定したところ,pmrR変異株は野生株に比べ高い転写レベルを示したことで,この予測は確認された.
PmrRのほか,PmrAにより転写の活性化される遺伝子の産物もPmrA-PmrB系における負のフィードバック制御にかかわるかどうかを調べたところ,リピドAを正に荷電するはたらきをもつ,Ugdに依存的なリピドAの1位の4-アミノアラビノースによる修飾が重要であることが明らかになった.PmrAにより転写の活性化される遺伝子のmRNAの量は,ugd変異体において野生株に比べ4倍ほど増加していた.これらのmRNAの量はpmrR変異株よりもugd pmrR二重変異体においてさらに増加していたので,ugd遺伝子による負のフィードバック制御はpmrR遺伝子による負のフィードバック制御とは独立していることがわかった.しかし,pmrR遺伝子の欠損の影響はugd遺伝子も同時に欠損しているときもっとも顕著であったことは特筆すべき点であった.また,Ugdに依存的なリピドAの1位の4-アミノアラビノースによる修飾も,細胞の表層におけるFe3+との結合性を減少させることによりPmrA-PmrB系を抑制することが明らかになった.
PmrA-PmrB系のフィードバック制御は,PmrAにより転写の活性化される遺伝子の産物のうち,リピドAの1位のピロリン酸による修飾を標的とするPmrRによりひき起こされていたが,同じくPmrAにより転写の活性化される遺伝子の産物のうち,リポ多糖のほかの領域を修飾するタンパク質によっては生じないようであった.一方,ugd変異体において,PmrAにより転写の活性化される遺伝子のmRNAの量の上昇およびFe3+との結合性の上昇は,lpxT遺伝子の欠損により完全にキャンセルされた.これらのことから,PmrA-PmrB系のPmrRおよびUgdによる2つの負のフィードバックループ,および,リポ多糖へのFe3+の結合には,膜酵素LpxTに依存的にピロリン酸により1位の修飾されたリピドAの形成が不可欠であることが明らかになった.
Fe3+を含む培地に切り替えた20分後においてPmrAにより転写の活性化される遺伝子の転写はすでに起こっていたが,野生型とugd欠損株を比較しても,Fe3+との結合性およびpbgP mRNAの量はほぼ同じ程度であった.Fe3+の添加から20分後にugd変異株が野生株と同様にふるまっていたのは,おそらく,PmrAに依存的なリピドAの修飾は新しく合成されたリポ多糖においてのみ生じ2),Fe3+の添加から20分後ではまだ検出されないくらいゆっくりとした回転速度で進行していることによるものと考えられた.一方,Fe3+を含む培地に切り替えた120分後においては,野生株ではPmrAに依存的なリピドAの修飾が認められ,ugd変異株と比較し,野生株はより少ないFe3+と結合し,より低いpbgP mRNAの量を示した.
今回の研究により,細菌は一定のストレス刺激に連続的にさらされている状態においても,シグナル伝達系の活性化のレベルをつねに微調整するフィードバック制御機構の存在することが明らかになった.この微調整は,シグナル伝達系によりもたらされた細胞の表層の変化(アウトプット)より生じた,活性化シグナル(インプット)へのアクセスの低下により行われていた.より具体的には,サルモネラ菌がリポ多糖の修飾を指揮するPmrA-PmrB系の活性化リガンドであるFe3+との結合性をモニターすることにより,リポ多糖の修飾の状態を認識する分子機構が明らかとなったといえる.この機構は,細胞質における転写制御タンパク質だけで完結する一般的なフィードバック制御機構と5,7),制御のタイミングおよび標的という点で異なっていた.
これまで,二成分制御系を中心とした細菌における病原性の制御の研究などから,PmrRのような新規なペプチド8) あるいは低分子タンパク質9,10) がいくつか報告されている.これらのペプチドは,ゲノムアノテーションにおいて見落とされたものであろうことをふまえると,ゲノムにはユニークな役割と機能をもつ未知のペプチドがまだまだかくされているに違いない.それらの進化や起源の探求も興味深い.今後,この分野のさらなる進展が期待される.さらに,それらのペプチドをもとにした新薬の開発にもつなげていきたい.
略歴:2000年 近畿大学大学院農学研究科博士後期課程 修了,同年 米国Washington大学School of Medicineポストドクトラルフェロー,2002年 同 リサーチアソシエートを経て,2007年より近畿大学大学院農学研究科 講師.
研究テーマ:サルモネラ菌を中心とした近縁の病原細菌におけるシグナル伝達ネットワークの分子機構および進化.機能未知のペプチドの研究,また,ペプチドドラッグへの応用展開も進行中.
Eduardo A. Groisman
米国Yale School of MedicineにてProfessor.
© 2012 加藤明宣・Eduardo A. Groisman Licensed under CC 表示 2.1 日本
(米国Washington大学School of Medicine,Department of Molecular Microbiology)
email:加藤明宣
DOI: 10.7875/first.author.2012.119
Reciprocal control between a bacterium's regulatory system and the modification status of its lipopolysaccharide.
Akinori Kato, H. Deborah Chen, Tammy Latifi, Eduardo A. Groisman
Molecular Cell, 47, 897-908 (2012)
要 約
グラム陰性細菌の外膜はリポ多糖におおわれ,その修飾は抗菌剤への抵抗性や宿主の自然免疫からの回避などに重要であることが知られている.しかし,これまで,リポ多糖の修飾の状態が細菌それ自体によりどのように認識されているのかはよくわかっていない.筆者らは,サルモネラ菌が細胞の外部のFe3+に応答してリポ多糖を修飾する際に中心的な役割を担う二成分制御系PmrA-PmrB系について,そのインプットとアウトプットとの関係性に着目した.まず,Fe3+センサーであるPmrBをコードする遺伝子の下流に,内膜に局在するペプチドPmrRのコードされていることが見い出された.つぎに,レギュレーターであるPmrAにより転写の活性化されるリポ多糖修飾遺伝子のうち,とくにリポ多糖を正に荷電するはたらきをもつ4-アミノアラビノース修飾酵素の遺伝子の欠損株において,同時にpmrR遺伝子を欠損させるとPmrA-PmrB系の活性化のレベルが著しく高まったことから,PmrRもリポ多糖修飾酵素を制御していることが示唆された.実際に,PmrRはリピドAの1位をピロリン酸により修飾する膜酵素LpxTと相互作用することでその活性を抑制し,細胞の表層の負電荷を減少させることによりFe3+との結合性を低下させ,Fe3+センサーPmrBを刺激するFe3+の量を減少させることでPmrAにより転写の活性化される遺伝子の転写のレベルを低下させた.これらのことから,ピロリン酸により1位の修飾されたリピドAとFe3+との結合性を基軸とした,リポ多糖の修飾の状態と二成分制御系PmrA-PmrB系のあいだの相互フィードバック制御機構が明らかになった.
はじめに
グラム陰性細菌の外膜は抗生物質や抗菌剤に対する透過性バリアを形成している1).外膜はタンパク質,内側のリン脂質,外側のリポ多糖から構成されている.細菌は環境変化に応答しリポ多糖のさまざまな部位において種々の化学修飾を行うため,その構造はダイナミックに変化する.リポ多糖の修飾は抗菌剤への抵抗性や宿主の自然免疫からの回避に欠かせないが,その一方で,リポ多糖修飾遺伝子の構成的な発現は胆汁に対し感受性を示すことから,その修飾のレベルは適度な厳密性をもって制御されているものと考えられている.
病原細菌であるサルモネラ菌(Salmonella typhimurium)において,二成分制御系PmrA-PmrB系は細胞の外部のFe3+に応答しリポ多糖修飾遺伝子の発現を制御する主要な制御機構である.リポ多糖は内側のリピドA,中間のコア,外側のO抗原から構成され(図1),PmrAに依存的なリポ多糖の修飾はこれらそれぞれの部位において起こる2).たとえば,PmrAにより転写の活性化される遺伝子の産物であるUgdおよびPmrCは,リピドAの1位と4’位を4-アミノアラビノースおよびホスホエタノールアミンにより,それぞれ修飾する.その結果,サルモネラ菌のリピドAはリン酸基による負の荷電が中和され,正の荷電をもつ抗生物質ポリミキシンBや金属イオンFe3+あるいはAl3+に抵抗性を示すようになる.これらリピドA修飾遺伝子を含め,PmrA-PmrB系は7つのリポ多糖修飾遺伝子座(ugd遺伝子,pbgP遺伝子,pmrC遺伝子,pmrG遺伝子,cptA遺伝子,wzzST遺伝子,wzzFepE遺伝子)を直接に制御している.
細菌のもつシグナル伝達機構として二成分制御系が知られている.PmrA-PmrB系においては,センサーであるPmrBが細胞の外部のFe3+を感知すると,レギュレーターであるPmrAをリン酸化し,PmrAに依存的なリポ多糖修飾遺伝子の転写は活性化される3)(図2).一方,低Mg2+シグナルもPmrA-PmrB系を活性化する.低Mg2+シグナルを感知する別の二成分制御系,PhoP-PhoQ系が85アミノ酸残基からなるコネクターPmrDを発現させ,これがリン酸化されたPmrAと結合することでPmrBによる脱リン酸化から保護するという分子機構がこれまでに明らかになっている4)(図2).また,低Mg2+かつ高Fe3+の条件では,リン酸化されたPmrAがpmrD遺伝子のプロモーターに結合し負のフィードバック制御を行う5)(図2).
この研究において,筆者らは,細菌がいつどのようにしてリポ多糖の修飾の状態に応答し,リポ多糖修飾遺伝子の産物あるいは活性化のレベルを制御しているのか,その分子機構の解明を試みた.
1.PmrAにより転写の活性化される遺伝子にコードされるペプチドPmrRの発見
これまでの実験的な解析やコンピューターによる予測において報告のされていない,PmrAにより活性化される遺伝子プロモーターをpmrB遺伝子のコード領域のすぐ下流に同定し,pmrB遺伝子の方向にむかい転写されるRNAを確認した(図2).この遺伝子プロモーターのもつ,PmrAにより認識されるDNA結合モチーフであるPmrAボックスは,近縁の腸内細菌である大腸菌,肺炎桿菌,Citrobacter koseriのゲノムのpmrB遺伝子の下流においても認められた.このRNAはリボソーム結合部位とそれにつづく30コドンからなるORFを含み,これらの特徴もやはり近縁の腸内細菌において保存されていた.このORFから実際にペプチドが翻訳されていることを検証するため,サルモネラ菌の染色体においてこのORFの終止コドンのまえにFLAGタグを挿入した.PmrA-PmrB系が活性化される条件において培養したサルモネラ菌の抽出液をFLAG抗体アフィニティーカラムにより精製したところ,予測された分子量のペプチドが溶出されたことから,このORFがサルモネラ菌において実際に翻訳されていることが確認された.機能が既知のペプチドあるいはタンパク質の配列とほとんど類似性を示さないこの29アミノ酸残基からなるペプチドはPmrRと命名された.疎水性アミノ酸残基の存在から予測されたように,PmrRは内膜画分に局在することも実験的に示された.
2.PmrRは膜酵素LpxTと相互作用しリピドAの1位のピロリン酸による修飾を抑制する
これまで,PmrA-PmrB系が活性化されると,膜酵素LpxTに依存的なリピドAの1位のピロリン酸による修飾が抑制されるという報告がなされていたが6),この抑制に直接にかかわるタンパク質の存在は不明であった.PmrRとLpxTはどちらも内膜に局在すること,後述するように,PmrAに依存的なリピドA修飾遺伝子の欠失した株においてPmrRのはたらきが顕著となることなどから,PmrAが活性化された際にPmrRはLpxTを標的としそのはたらきを抑制する可能性が考えられた.このことを検証するにあたり,大腸菌のツーハイブリッド系や生化学的なアプローチを適用することにより,LpxTとPmrRとのあいだの特異的な相互作用が検出された.つぎに,PmrRがLpxTと相互作用することにより,リピドAの1位のピロリン酸による修飾は抑制されるかどうかを検証した.低Mg2+条件においてPhoP-PhoQ系とPmrA-PmrB系が活性化されると,PhoPに依存的なリポ多糖の修飾とPmrAに依存的なリポ多糖の修飾とが組み合わさり,多種多様な修飾をうけたリピドAが形成される.そこで,これらの修飾の抑制される高Mg2+条件において,PmrRをコードするプラスミドベクターを導入することでPmrRを発現させた野生株と,ベクターのみを導入した野生株からリピドAを単離し,薄層クロマトグラフィーに展開してその修飾のパターンを比較した.その結果,PmrRはLpxTに依存的なリピドAの1位のピロリン酸による修飾を抑制することが確認された.PmrRの発現によるこの抑制はlpxT欠損株において消失したことから,PmrRのもつこの機能はLpxTに依存することが明らかになった.
3.PmrRはPmrAにより転写の活性化される遺伝子の転写のレベルを低下させる
リピドAを修飾する膜酵素LpxTのPmrRによる抑制は,細胞の表層の負電荷を減少させることにより,サルモネラ菌と正電荷をもつFe3+との静電的な相互作用を抑制することが予測された.実際に,pmrR変異株は野生株と比較してより多くのFe3+と結合した.対照的に,lpxT変異株は野生株より少ないFe3+と結合した.PmrRの発現によりもたらされるFe3+との結合性の低下は,Fe3+センサーPmrBの活性化に利用されるFe3+の量を減少させ,結果として,PmrAにより転写の活性化される遺伝子の転写のレベルの低下につながるものと予測された.そこで,サルモネラ菌をFe3+を含有する培地で生育させてPmrAにより転写の活性化される遺伝子の転写のレベルを測定したところ,pmrR変異株は野生株に比べ高い転写レベルを示したことで,この予測は確認された.
4.リピドAの1位の4-アミノアラビノースによる修飾が阻害されるとPmrAにより転写の活性化される遺伝子の転写のレベルは上昇する
PmrRのほか,PmrAにより転写の活性化される遺伝子の産物もPmrA-PmrB系における負のフィードバック制御にかかわるかどうかを調べたところ,リピドAを正に荷電するはたらきをもつ,Ugdに依存的なリピドAの1位の4-アミノアラビノースによる修飾が重要であることが明らかになった.PmrAにより転写の活性化される遺伝子のmRNAの量は,ugd変異体において野生株に比べ4倍ほど増加していた.これらのmRNAの量はpmrR変異株よりもugd pmrR二重変異体においてさらに増加していたので,ugd遺伝子による負のフィードバック制御はpmrR遺伝子による負のフィードバック制御とは独立していることがわかった.しかし,pmrR遺伝子の欠損の影響はugd遺伝子も同時に欠損しているときもっとも顕著であったことは特筆すべき点であった.また,Ugdに依存的なリピドAの1位の4-アミノアラビノースによる修飾も,細胞の表層におけるFe3+との結合性を減少させることによりPmrA-PmrB系を抑制することが明らかになった.
PmrA-PmrB系のフィードバック制御は,PmrAにより転写の活性化される遺伝子の産物のうち,リピドAの1位のピロリン酸による修飾を標的とするPmrRによりひき起こされていたが,同じくPmrAにより転写の活性化される遺伝子の産物のうち,リポ多糖のほかの領域を修飾するタンパク質によっては生じないようであった.一方,ugd変異体において,PmrAにより転写の活性化される遺伝子のmRNAの量の上昇およびFe3+との結合性の上昇は,lpxT遺伝子の欠損により完全にキャンセルされた.これらのことから,PmrA-PmrB系のPmrRおよびUgdによる2つの負のフィードバックループ,および,リポ多糖へのFe3+の結合には,膜酵素LpxTに依存的にピロリン酸により1位の修飾されたリピドAの形成が不可欠であることが明らかになった.
5.PmrAに依存的なリピドAの修飾によるPmrA-PmrB系のゆっくりとしたフィードバック制御
Fe3+を含む培地に切り替えた20分後においてPmrAにより転写の活性化される遺伝子の転写はすでに起こっていたが,野生型とugd欠損株を比較しても,Fe3+との結合性およびpbgP mRNAの量はほぼ同じ程度であった.Fe3+の添加から20分後にugd変異株が野生株と同様にふるまっていたのは,おそらく,PmrAに依存的なリピドAの修飾は新しく合成されたリポ多糖においてのみ生じ2),Fe3+の添加から20分後ではまだ検出されないくらいゆっくりとした回転速度で進行していることによるものと考えられた.一方,Fe3+を含む培地に切り替えた120分後においては,野生株ではPmrAに依存的なリピドAの修飾が認められ,ugd変異株と比較し,野生株はより少ないFe3+と結合し,より低いpbgP mRNAの量を示した.
おわりに
今回の研究により,細菌は一定のストレス刺激に連続的にさらされている状態においても,シグナル伝達系の活性化のレベルをつねに微調整するフィードバック制御機構の存在することが明らかになった.この微調整は,シグナル伝達系によりもたらされた細胞の表層の変化(アウトプット)より生じた,活性化シグナル(インプット)へのアクセスの低下により行われていた.より具体的には,サルモネラ菌がリポ多糖の修飾を指揮するPmrA-PmrB系の活性化リガンドであるFe3+との結合性をモニターすることにより,リポ多糖の修飾の状態を認識する分子機構が明らかとなったといえる.この機構は,細胞質における転写制御タンパク質だけで完結する一般的なフィードバック制御機構と5,7),制御のタイミングおよび標的という点で異なっていた.
これまで,二成分制御系を中心とした細菌における病原性の制御の研究などから,PmrRのような新規なペプチド8) あるいは低分子タンパク質9,10) がいくつか報告されている.これらのペプチドは,ゲノムアノテーションにおいて見落とされたものであろうことをふまえると,ゲノムにはユニークな役割と機能をもつ未知のペプチドがまだまだかくされているに違いない.それらの進化や起源の探求も興味深い.今後,この分野のさらなる進展が期待される.さらに,それらのペプチドをもとにした新薬の開発にもつなげていきたい.
文 献
- Nikaido, H.: Molecular basis of bacterial outer membrane permeability revisited. Microbiol. Mol. Biol. Rev., 67, 593-656 (2003)[PubMed]
- Raetz, C. R., Reynolds, C M., Trent, M. S. et al.: Lipid A modification systems in gram-negative bacteria. Annu. Rev. Biochem., 76, 295-329 (2007)[PubMed]
- Wosten, M. M., Kox, L. F., Chamnongpol, S. et al.: A signal transduction system that responds to extracellular iron. Cell, 103, 113-125 (2000)[PubMed]
- Kato, A. & Groisman, E. A.: Connecting two-component regulatory systems by a protein that protects a response regulator from dephosphorylation by its cognate sensor. Genes Dev., 18, 2302-2313 (2004)[PubMed]
- Kato, A., Latify, T. & Groisman, E. A.: Closing the loop: the PmrA/PmrB two-component system negatively controls expression of its posttranscriptional activator PmrD. Proc. Natl. Acad. Sci. USA, 100, 4706-4711 (2003)[PubMed]
- Herrera, C. M., Hankins, J. V. & Trent, M. S.: Activation of PmrA inhibits LpxT-dependent phosphorylation of lipid A promoting resistance to antimicrobial peptides. Mol. Microbiol., 76, 1444-1460 (2010)[PubMed]
- Yeo, W. S., Zwir, I., Huang, H. V. et al.: Intrinsic negative feedback governs activation surge in two-component regulatory systems. Mol. Cell, 45, 409-421 (2012)[PubMed]
- Alix, E. & Blanc-Potard, A. B.: Hydrophobic peptides: novel regulators within bacterial membrane. Mol. Microbiol., 72, 5-11 (2009)[PubMed]
- Kato, A., Mitrophanov, A. Y. & Groisman, E. A.: A connector of two-component regulatory systems promotes signal amplification and persistence of expression. Proc. Natl. Acad. Sci. USA, 104, 12063-12068 (2007)[PubMed]
- Mitrophanov, A. Y. & Groisman, E. A.: Signal integration in bacterial two-component regulatory systems. Genes Dev., 22, 2601-2611 (2008)[PubMed]
著者プロフィール
略歴:2000年 近畿大学大学院農学研究科博士後期課程 修了,同年 米国Washington大学School of Medicineポストドクトラルフェロー,2002年 同 リサーチアソシエートを経て,2007年より近畿大学大学院農学研究科 講師.
研究テーマ:サルモネラ菌を中心とした近縁の病原細菌におけるシグナル伝達ネットワークの分子機構および進化.機能未知のペプチドの研究,また,ペプチドドラッグへの応用展開も進行中.
Eduardo A. Groisman
米国Yale School of MedicineにてProfessor.
© 2012 加藤明宣・Eduardo A. Groisman Licensed under CC 表示 2.1 日本