Dicer結合タンパク質はmiRNAの長さとその標的特異性を制御する
福永 流也
(米国Massachusetts大学Medical School,Department of Biochemistry and Molecular Pharmacology)
email:福永流也
DOI: 10.7875/first.author.2012.123
Dicer partner proteins tune the length of mature miRNAs in flies and mammals.
Ryuya Fukunaga, Bo W. Han, Jui-Hung Hung, Jia Xu, Zhiping Weng, Phillip D. Zamore
Cell, 151, 533-546 (2012)
ショウジョウバエにおいて,loquacious遺伝子は選択的スプライシングにより3つの異なるDicer結合タンパク質,Loqs-PA,Loqs-PB,Loqs-PDをコードしている.この研究では,Dicer結合タンパク質の機能の解明を目的とし,特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエを作製し解析した.その結果,Loqs-PBはDicer-1によるmiRNAの産生を,Loqs-PDはDicer-2によるsiRNAの産生を促進することがわかった.さらに,Loqs-PBはDicer-1によるmiRNA前駆体の切断位置を制御し,Dicer-1単独あるいはDicer-1がLoqs-PAと複合体を形成しているときとは異なる長さおよび標的特異性をもつmiRNAを産生することがわかった.さらに,哺乳類においても,Loqs-PBホモログであるTRBPはmiRNAの長さと標的特異性を制御していた.
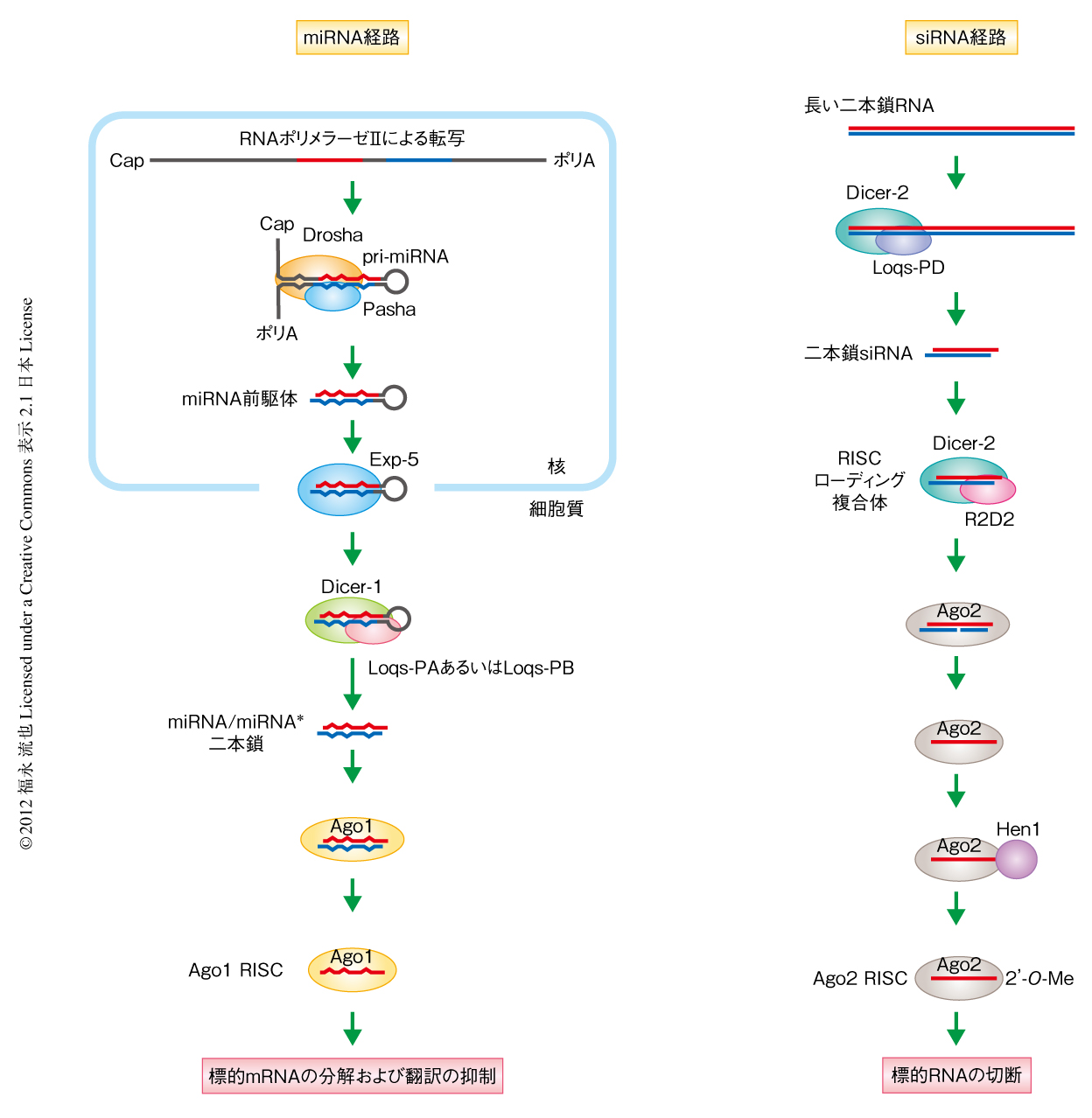
ショウジョウバエでは2つの異なる経路により,約22塩基長のmicroRNA(miRNA),および,21塩基長のsmall interfering RNA(siRNA)が産生される1,2)(図1).また,それぞれの経路に特化した2つのDicer,Dicer-1とDicer-2が存在し,そのいずれもRNAseIIIファミリーに属する.miRNA経路では,同じくRNaseIIIファミリーに属するDroshaとその結合タンパク質Pashaとの複合体がpri-miRNAを切断し約70塩基長のmiRNA前駆体を産生する.miRNA前駆体は細胞質へと輸送されたのち,Dicer-1とその結合タンパク質Loquacious-PA(Loqs-PA)もしくはLoquacious-PB(Loqs-PB)との複合体により切断され,二本鎖miRNAが産生される.二本鎖miRNAはArgonaute1(Ago1)にロードされたのち,一方のRNA鎖が排除されて成熟一本鎖miRNAとAgo1からなるAgo1 RISC(RISC:RNA-induced silencing complex)となり,配列特異的に標的mRNAの翻訳の抑制や不安定化をひき起こす.一方,siRNA経路では,Dicer-2とその結合タンパク質Loquacious-PD(Loqs-PD)との複合体が長い二本鎖RNAを切断し二本鎖siRNAを産生する.産生された二本鎖siRNAは,Loquaciousとはまた別のDicer結合タンパク質であるR2D2と複合体を形成したDicer-2によりArgonaute2(Ago2)にロードされたのち,一方のRNA鎖が排除されて一本鎖成熟siRNAとAgo2からなるAgo2 RISCとなり,配列特異的に標的mRNAの切断をひき起こす(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
このように,miRNA経路およびsiRNA経路にはたらくすべてのRNaseIIIファミリータンパク質,Drosha,Dicer-1,Dicer-2は,パートナータンパク質と結合する.それらのパートナータンパク質,Pasha,Loqs-PA,Loqs-PB,Loqs-PD,R2D2は,2つもしくは3つの二本鎖RNA結合ドメインをもつ(図2).そのようなDroshaやDicerとパートナータンパク質との結合はすべての動物や植物にみられる普遍的な現象である.しかし,これらパートナータンパク質がどのような機能をもつのかは明らかにされていなかった.この研究では,これらの機能の解明をめざしDicerに結合するパートナータンパク質を選択的スプライシングにより生み出すloquacious遺伝子に注目し3-6),おもに遺伝学的な手法および生化学的な手法を用いてLoquaciousのおのおののスプライシングアイソフォームの機能を詳細に解析した.
Loquaciousのおのおののスプライシングアイソフォームの機能を遺伝学的に解析するため,Loqs-PA,Loqs-PB,Loqs-PDをそれぞれ特異的に発現するトランスジェニックショウジョウバエを作製した.さらに,減数分裂組換えを利用して,それらの組合せにより3つのアイソフォームのうち特定の2つ,もしくは,3つすべてを発現するトランスジェニックショウジョウバエも作製した.そして,ショウジョウバエのゲノムにコードされているloquacious遺伝子をノックアウトしたショウジョウバエと,作製したトランスジェニックショウジョウバエとを掛け合わせることにより,すべての組合せのLoquaciousアイソフォームを特異的に発現するショウジョウバエを作製した.loquacious遺伝子をノックアウトしたショウジョウバエは致死であるが7),おのおののLoquaciousアイソフォームがその致死性をレスキューするかどうかを調べたところ,Loqs-PDのみを発現するショウジョウバエは致死であったが,Loqs-PAもしくはLoqs-PBを発現するショウジョウバエは生存できることがわかった.すなわち,Loqs-PAもしくはLoqs-PBはショウジョウバエの生存に必要であった.
Loqs-PAもしくはLoqs-PBを発現するショウジョウバエのオスの妊性を調べたところ,いずれも野生型のショウジョウバエと同様に正常であった.一方で,メスの妊性はLoqs-PBを欠損するショウジョウバエにおいて顕著に低下していた.その分子機構を調べるため卵巣の生殖幹細胞を調べたところ,Loqs-PBを欠損するショウジョウバエにおいて,野生型のショウジョウバエやLoqs-PBを発現するショウジョウバエに比べその数が顕著に減少していた.すなわち,オスの妊性にはLoqs-PAもしくはLoqs-PBが十分であること,一方,メスの妊性や生殖幹細胞の維持にはLoqs-PBが必要十分であることがわかった.
ショウジョウバエの体内におけるsiRNAの量をノーザンブロット法や低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PDを欠損したショウジョウバエでは野生型のショウジョウバエやLoqs-PDを発現するショウジョウバエに比べ減少していた.Loqs-PDがどのようにsiRNAの産生に寄与しているかを調べるため,組換えDicer-2のみ,もしくは,組換えDicer-2と組換えLoqs-PDとの複合体によるin vitroにおけるsiRNA生成反応について,Michaelis-Menten酵素反応解析を行った.その結果,Loqs-PDはDicer-2の代謝回転(kcat値)は変化させず,基質となる二本鎖RNAへの親和性を高める(Km値を低下させる)ことにより,Dicer-2によるsiRNAの生成効率を高めていることがわかった8).
ショウジョウバエの卵巣におけるmiRNAの量をノーザンブロット法や低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PBを欠損したショウジョウバエにおいて,特定のmiRNAの量が野生型のショウジョウバエやLoqs-PBを発現するショウジョウバエに比べ減少していた.Loqs-PBがどのようにmiRNAの産生に寄与しているかを調べるため,組換えDicer-1のみ,組換えDicer-1と組換えLoqs-PAとの複合体,組換えDicer-1と組換えLoqs-PBとの複合体によるin vitroにおけるmiRNA生成反応について,Michaelis-Menten酵素反応解析を行った.その結果,Loqs-PBはDicer-1の代謝回転(kcat値)を高めること,および,基質となるmiRNA前駆体への親和性を高める(Km値を低下させる)ことにより,Dicer-1によるmiRNAの生成効率を高めていることがわかった.また,Loqs-PAもDicer-1の基質となるmiRNA前駆体への親和性を高めていることがわかった.ショウジョウバエの体内におけるmiRNAの産生において,高効率での産生にあたりLoqs-PBを必要としたmiRNAに対しLoqs-PBはDicer-1の代謝回転を上昇させたが,Loqs-PBを必要としないmiRNAに対しLoqs-PBはDicer-1の代謝回転に変化を及ぼさなかったことから,切断のより“むずかしい”miRNAについては,Loqs-PBがDicer-1の代謝回転を上昇させることが,ショウジョウバエの体内における十分な量のmiRNAの産生に重要であることが示唆された.
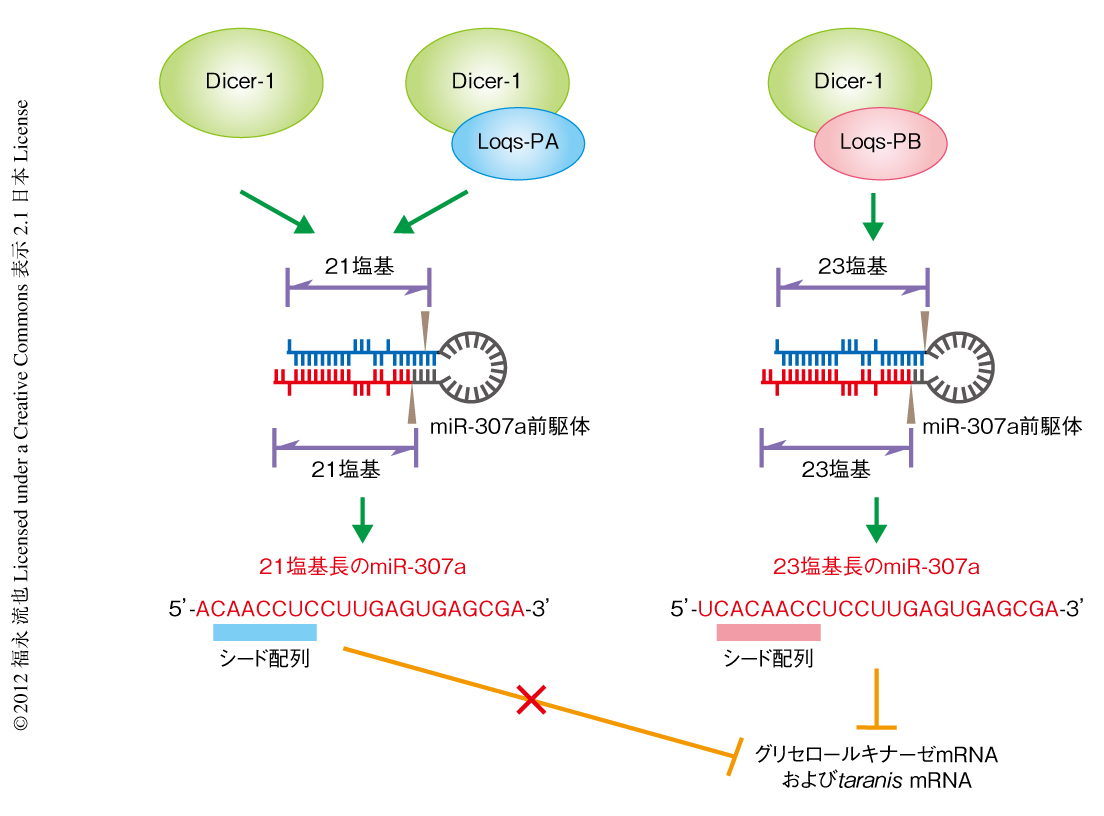
特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエにおいて,卵巣におけるmiRNAの長さを低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PBを欠損したショウジョウバエでは,ある特定のmiRNA(miR-307a,miR-87)が短くなっていること,また,別の特定のmiRNA(miR-316)が長くなっていることが明らかになった.それらのmiRNAの長さの変化はノーザンブロット法によっても確認された.これらの結果を説明するシンプルな仮説として,“Dicer-1がmiRNA前駆体を切断する際にLoqs-PBはその切断位置を制御する”というモデルをたてこれを検証することにした.組換えDicer-1のみ,組換えDicer-1と組換えLoqs-PAとの複合体,組換えDicer-1と組換えLoqs-PBとの複合体による,ショウジョウバエの体内において長さの変化が観察されたmiRNAに対応するmiRNA前駆体に対するin vitroにおける切断反応を行い,生成されたmiRNAの長さを解析した.すると,ショウジョウバエの体内においてみられたのと同様に,miR-307aやmiR-87についてはLoqs-PBがあるとより長いmiRNAが生成され,一方,miR-316についてはLoqs-PBがあるとより短いmiRNAが生成されることが示された.すなわち,さきのモデルの正しいことが証明された(図3).さらに,Loqs-PBにより切断位置の変化を起こすmiRNA前駆体と変化を起こさないmiRNA前駆体について,それらのあいだでいくつかキメラ変異miRNA前駆体を作製してin vitroにおける切断反応を行い解析したところ,切断位置の変化を起こすmiRNA前駆体においては,そのステム領域に変化を起こす要因が含まれていることが明らかになった.
miRNAはその5’末端から数えて2番目から8番目の塩基の配列,“シード配列”をおもに用い,それと配列相補的な標的mRNAに結合し制御することが知られている.ここで,おのおののmiRNAは,対応するmiRNA前駆体の5’側のアームに位置するか3’側のアームに位置するかにより2種類に分けられるが,3’側のアームに位置するものについてはDicerによる切断位置が成熟miRNAの5’末端を規定するので,すなわち,そのシード配列も規定する.実際に,Loqs-PBにより長さの制御されるmiR-307aやmiR-87は3’側のアームに位置するので,それらの長さの異なるmiRNAアイソフォームは異なるシード配列をもつ(図3).miR-307aの長さの異なる2つのmiRNAアイソフォームに対し,それぞれのシード配列に特異的に結合するようなmiRNA結合配列を3’側非翻訳領域にもつルシフェラーゼレポーターをデザインし,培養細胞においておのおののmiRNAアイソフォームが発現抑制をひき起こすかどうかを検証した.その結果,期待どおり,2つのmiRNAアイソフォームはそれぞれに特有の標的特異性をもつことが示された.
さらに,特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエにおいて,卵巣におけるmRNAの量をRNA-seq法やqRT-PCR法により調べた.標準的なmiRNAの標的予測プログラムであるTargetscanにより,miR-307aの長いアイソフォームのもつシード配列とのみ結合すると予測された2つのmRNA,グリセロールキナーゼmRNAおよびtaranis mRNAについて,その量はLoqs-PBを欠損したショウジョウバエにおいて上昇していることがわかった.Loqs-PBを欠損したショウジョウバエでは,miR-307aの長いアイソフォームが減少し短いアイソフォームが上昇していた.グリセロールキナーゼmRNAおよびtaranis mRNAは,野生型のショウジョウバエやLoqs-PBをもつショウジョウバエではmiR-307aの長いアイソフォームにより発現が抑制されているが,その長いアイソフォームを効率よくつくれないLoqs-PBを欠損したショウジョウバエではそれらのmRNAの発現抑制が達成されず,その量が上昇してしまっていることが考えられた.このことを検証するため,この2つのmRNAに由来する3’側非翻訳領域をもつルシフェラーゼレポーターをデザインし,培養細胞においてmiR-307aの2つのアイソフォームにより発現抑制がひき起こされるかどうかを検討した.その結果,miR-307aの長いアイソフォームにより発現は抑制され,短いアイソフォームによっては影響をうけないことがわかった.予測された結合配列に変異を導入すると長いアイソフォームによる発現抑制はみられなくなることも確認された.これらの結果から,グリセロールキナーゼmRNAおよびtaranis mRNAは,miR-307aの長いアイソフォームの標的であるが短いアイソフォームの標的ではないこと,つまり,miR-307aの長さの異なる2つのアイソフォームはショウジョウバエの体内において異なる標的特異性をもつことが示された(図3).
哺乳類のLoqs-PBホモログであるPACTもしくはTRBPをノックアウトしたマウス胚性線維芽細胞における,低分子RNAのハイスループットシーケンシングによる解析,ならびに,ヒトに由来するDicer,PACT,TRBPの組換えタンパク質を用いたin vitroにおけるmiRNA前駆体に対する切断反応の解析から,ショウジョウバエにおけるLoqs-PBと同様に,哺乳類のTRBPもDicerによるmiRNA前駆体の切断位置を制御し,miRNAの長さとシード配列を制御する機能をもつことが明らかになった.すなわち,Dicer結合タンパク質によりmiRNAの長さ,シード配列,標的特異性が制御されていることは,哺乳類においても保存されていることがわかった.
この研究では,ショウジョウバエの遺伝学的および生化学的な解析,培養細胞の解析,次世代シークエンサーを用いた塩基配列の解析など,さまざまな実験手法を用い,また,さらにそれらを互いにうまく相補およびフィードバックさせることにより,“Dicer結合タンパク質はmiRNAの長さ,シード配列,標的特異性を制御する”という新規な概念をともなう現象を発見し検証することができた.今後は,Dicer結合タンパク質は実際にどのようにしてDicerによるmiRNA前駆体の切断位置を制御しているのかにつき,おもに生化学的な解析および結晶構造解析などを用いて明らかにしていきたい.また,どのDicer結合タンパク質がDicerに結合するかにより,同じmiRNA前駆体から,異なる長さ,シード配列,標的特異性をもつmiRNAの産生される分子機構は,おそらく,生物の組織および発生段階において特異的に制御されたmiRNAの産生に寄与している可能性があるが,それについても詳細に検証していきたい.
2007年 東京大学大学院理学系研究科 修了,同年 米国California大学Berkeley校 ポスドクを経て,2009年より米国Massachusetts大学Medical Schoolポスドク.
研究テーマ:非コードsmall RNAによる生体制御システム.
抱負:生化学的な手法,遺伝学的な手法,結晶構造解析と多彩な手法を駆使し,非コードRNAの生成,機能,制御に関してオリジナルな研究を行っていきたい.
© 2012 福永 流也 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Biochemistry and Molecular Pharmacology)
email:福永流也
DOI: 10.7875/first.author.2012.123
Dicer partner proteins tune the length of mature miRNAs in flies and mammals.
Ryuya Fukunaga, Bo W. Han, Jui-Hung Hung, Jia Xu, Zhiping Weng, Phillip D. Zamore
Cell, 151, 533-546 (2012)
要 約
ショウジョウバエにおいて,loquacious遺伝子は選択的スプライシングにより3つの異なるDicer結合タンパク質,Loqs-PA,Loqs-PB,Loqs-PDをコードしている.この研究では,Dicer結合タンパク質の機能の解明を目的とし,特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエを作製し解析した.その結果,Loqs-PBはDicer-1によるmiRNAの産生を,Loqs-PDはDicer-2によるsiRNAの産生を促進することがわかった.さらに,Loqs-PBはDicer-1によるmiRNA前駆体の切断位置を制御し,Dicer-1単独あるいはDicer-1がLoqs-PAと複合体を形成しているときとは異なる長さおよび標的特異性をもつmiRNAを産生することがわかった.さらに,哺乳類においても,Loqs-PBホモログであるTRBPはmiRNAの長さと標的特異性を制御していた.
はじめに
ショウジョウバエでは2つの異なる経路により,約22塩基長のmicroRNA(miRNA),および,21塩基長のsmall interfering RNA(siRNA)が産生される1,2)(図1).また,それぞれの経路に特化した2つのDicer,Dicer-1とDicer-2が存在し,そのいずれもRNAseIIIファミリーに属する.miRNA経路では,同じくRNaseIIIファミリーに属するDroshaとその結合タンパク質Pashaとの複合体がpri-miRNAを切断し約70塩基長のmiRNA前駆体を産生する.miRNA前駆体は細胞質へと輸送されたのち,Dicer-1とその結合タンパク質Loquacious-PA(Loqs-PA)もしくはLoquacious-PB(Loqs-PB)との複合体により切断され,二本鎖miRNAが産生される.二本鎖miRNAはArgonaute1(Ago1)にロードされたのち,一方のRNA鎖が排除されて成熟一本鎖miRNAとAgo1からなるAgo1 RISC(RISC:RNA-induced silencing complex)となり,配列特異的に標的mRNAの翻訳の抑制や不安定化をひき起こす.一方,siRNA経路では,Dicer-2とその結合タンパク質Loquacious-PD(Loqs-PD)との複合体が長い二本鎖RNAを切断し二本鎖siRNAを産生する.産生された二本鎖siRNAは,Loquaciousとはまた別のDicer結合タンパク質であるR2D2と複合体を形成したDicer-2によりArgonaute2(Ago2)にロードされたのち,一方のRNA鎖が排除されて一本鎖成熟siRNAとAgo2からなるAgo2 RISCとなり,配列特異的に標的mRNAの切断をひき起こす(RNAサイレンシングの分子機構については,佐々木 浩・泊 幸秀, 領域融合レビュー, 1, e001, 2012 も参照されたい).
このように,miRNA経路およびsiRNA経路にはたらくすべてのRNaseIIIファミリータンパク質,Drosha,Dicer-1,Dicer-2は,パートナータンパク質と結合する.それらのパートナータンパク質,Pasha,Loqs-PA,Loqs-PB,Loqs-PD,R2D2は,2つもしくは3つの二本鎖RNA結合ドメインをもつ(図2).そのようなDroshaやDicerとパートナータンパク質との結合はすべての動物や植物にみられる普遍的な現象である.しかし,これらパートナータンパク質がどのような機能をもつのかは明らかにされていなかった.この研究では,これらの機能の解明をめざしDicerに結合するパートナータンパク質を選択的スプライシングにより生み出すloquacious遺伝子に注目し3-6),おもに遺伝学的な手法および生化学的な手法を用いてLoquaciousのおのおののスプライシングアイソフォームの機能を詳細に解析した.
1.Loquaciousアイソフォームを特異的に発現するショウジョウバエの作製
Loquaciousのおのおののスプライシングアイソフォームの機能を遺伝学的に解析するため,Loqs-PA,Loqs-PB,Loqs-PDをそれぞれ特異的に発現するトランスジェニックショウジョウバエを作製した.さらに,減数分裂組換えを利用して,それらの組合せにより3つのアイソフォームのうち特定の2つ,もしくは,3つすべてを発現するトランスジェニックショウジョウバエも作製した.そして,ショウジョウバエのゲノムにコードされているloquacious遺伝子をノックアウトしたショウジョウバエと,作製したトランスジェニックショウジョウバエとを掛け合わせることにより,すべての組合せのLoquaciousアイソフォームを特異的に発現するショウジョウバエを作製した.loquacious遺伝子をノックアウトしたショウジョウバエは致死であるが7),おのおののLoquaciousアイソフォームがその致死性をレスキューするかどうかを調べたところ,Loqs-PDのみを発現するショウジョウバエは致死であったが,Loqs-PAもしくはLoqs-PBを発現するショウジョウバエは生存できることがわかった.すなわち,Loqs-PAもしくはLoqs-PBはショウジョウバエの生存に必要であった.
2.Loqs-PBはメスの卵巣における生殖幹細胞の維持に必要十分である
Loqs-PAもしくはLoqs-PBを発現するショウジョウバエのオスの妊性を調べたところ,いずれも野生型のショウジョウバエと同様に正常であった.一方で,メスの妊性はLoqs-PBを欠損するショウジョウバエにおいて顕著に低下していた.その分子機構を調べるため卵巣の生殖幹細胞を調べたところ,Loqs-PBを欠損するショウジョウバエにおいて,野生型のショウジョウバエやLoqs-PBを発現するショウジョウバエに比べその数が顕著に減少していた.すなわち,オスの妊性にはLoqs-PAもしくはLoqs-PBが十分であること,一方,メスの妊性や生殖幹細胞の維持にはLoqs-PBが必要十分であることがわかった.
3.Loqs-PDはDicer-2の基質となる二本鎖RNAへの親和性を高めることによりsiRNAの産生を促進する
ショウジョウバエの体内におけるsiRNAの量をノーザンブロット法や低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PDを欠損したショウジョウバエでは野生型のショウジョウバエやLoqs-PDを発現するショウジョウバエに比べ減少していた.Loqs-PDがどのようにsiRNAの産生に寄与しているかを調べるため,組換えDicer-2のみ,もしくは,組換えDicer-2と組換えLoqs-PDとの複合体によるin vitroにおけるsiRNA生成反応について,Michaelis-Menten酵素反応解析を行った.その結果,Loqs-PDはDicer-2の代謝回転(kcat値)は変化させず,基質となる二本鎖RNAへの親和性を高める(Km値を低下させる)ことにより,Dicer-2によるsiRNAの生成効率を高めていることがわかった8).
4.Loqs-PBはDicer-1の代謝回転と基質となるmiRNA前駆体への親和性を高めることによりmiRNAの産生を促進する
ショウジョウバエの卵巣におけるmiRNAの量をノーザンブロット法や低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PBを欠損したショウジョウバエにおいて,特定のmiRNAの量が野生型のショウジョウバエやLoqs-PBを発現するショウジョウバエに比べ減少していた.Loqs-PBがどのようにmiRNAの産生に寄与しているかを調べるため,組換えDicer-1のみ,組換えDicer-1と組換えLoqs-PAとの複合体,組換えDicer-1と組換えLoqs-PBとの複合体によるin vitroにおけるmiRNA生成反応について,Michaelis-Menten酵素反応解析を行った.その結果,Loqs-PBはDicer-1の代謝回転(kcat値)を高めること,および,基質となるmiRNA前駆体への親和性を高める(Km値を低下させる)ことにより,Dicer-1によるmiRNAの生成効率を高めていることがわかった.また,Loqs-PAもDicer-1の基質となるmiRNA前駆体への親和性を高めていることがわかった.ショウジョウバエの体内におけるmiRNAの産生において,高効率での産生にあたりLoqs-PBを必要としたmiRNAに対しLoqs-PBはDicer-1の代謝回転を上昇させたが,Loqs-PBを必要としないmiRNAに対しLoqs-PBはDicer-1の代謝回転に変化を及ぼさなかったことから,切断のより“むずかしい”miRNAについては,Loqs-PBがDicer-1の代謝回転を上昇させることが,ショウジョウバエの体内における十分な量のmiRNAの産生に重要であることが示唆された.
5.Loqs-PBはmiRNAの長さを制御する
特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエにおいて,卵巣におけるmiRNAの長さを低分子RNAのハイスループットシークエンシングにより調べたところ,Loqs-PBを欠損したショウジョウバエでは,ある特定のmiRNA(miR-307a,miR-87)が短くなっていること,また,別の特定のmiRNA(miR-316)が長くなっていることが明らかになった.それらのmiRNAの長さの変化はノーザンブロット法によっても確認された.これらの結果を説明するシンプルな仮説として,“Dicer-1がmiRNA前駆体を切断する際にLoqs-PBはその切断位置を制御する”というモデルをたてこれを検証することにした.組換えDicer-1のみ,組換えDicer-1と組換えLoqs-PAとの複合体,組換えDicer-1と組換えLoqs-PBとの複合体による,ショウジョウバエの体内において長さの変化が観察されたmiRNAに対応するmiRNA前駆体に対するin vitroにおける切断反応を行い,生成されたmiRNAの長さを解析した.すると,ショウジョウバエの体内においてみられたのと同様に,miR-307aやmiR-87についてはLoqs-PBがあるとより長いmiRNAが生成され,一方,miR-316についてはLoqs-PBがあるとより短いmiRNAが生成されることが示された.すなわち,さきのモデルの正しいことが証明された(図3).さらに,Loqs-PBにより切断位置の変化を起こすmiRNA前駆体と変化を起こさないmiRNA前駆体について,それらのあいだでいくつかキメラ変異miRNA前駆体を作製してin vitroにおける切断反応を行い解析したところ,切断位置の変化を起こすmiRNA前駆体においては,そのステム領域に変化を起こす要因が含まれていることが明らかになった.
6.Loqs-PBはmiRNAの標的特異性を制御する
miRNAはその5’末端から数えて2番目から8番目の塩基の配列,“シード配列”をおもに用い,それと配列相補的な標的mRNAに結合し制御することが知られている.ここで,おのおののmiRNAは,対応するmiRNA前駆体の5’側のアームに位置するか3’側のアームに位置するかにより2種類に分けられるが,3’側のアームに位置するものについてはDicerによる切断位置が成熟miRNAの5’末端を規定するので,すなわち,そのシード配列も規定する.実際に,Loqs-PBにより長さの制御されるmiR-307aやmiR-87は3’側のアームに位置するので,それらの長さの異なるmiRNAアイソフォームは異なるシード配列をもつ(図3).miR-307aの長さの異なる2つのmiRNAアイソフォームに対し,それぞれのシード配列に特異的に結合するようなmiRNA結合配列を3’側非翻訳領域にもつルシフェラーゼレポーターをデザインし,培養細胞においておのおののmiRNAアイソフォームが発現抑制をひき起こすかどうかを検証した.その結果,期待どおり,2つのmiRNAアイソフォームはそれぞれに特有の標的特異性をもつことが示された.
さらに,特定のLoquaciousアイソフォームのみを特異的に発現するトランスジェニックショウジョウバエにおいて,卵巣におけるmRNAの量をRNA-seq法やqRT-PCR法により調べた.標準的なmiRNAの標的予測プログラムであるTargetscanにより,miR-307aの長いアイソフォームのもつシード配列とのみ結合すると予測された2つのmRNA,グリセロールキナーゼmRNAおよびtaranis mRNAについて,その量はLoqs-PBを欠損したショウジョウバエにおいて上昇していることがわかった.Loqs-PBを欠損したショウジョウバエでは,miR-307aの長いアイソフォームが減少し短いアイソフォームが上昇していた.グリセロールキナーゼmRNAおよびtaranis mRNAは,野生型のショウジョウバエやLoqs-PBをもつショウジョウバエではmiR-307aの長いアイソフォームにより発現が抑制されているが,その長いアイソフォームを効率よくつくれないLoqs-PBを欠損したショウジョウバエではそれらのmRNAの発現抑制が達成されず,その量が上昇してしまっていることが考えられた.このことを検証するため,この2つのmRNAに由来する3’側非翻訳領域をもつルシフェラーゼレポーターをデザインし,培養細胞においてmiR-307aの2つのアイソフォームにより発現抑制がひき起こされるかどうかを検討した.その結果,miR-307aの長いアイソフォームにより発現は抑制され,短いアイソフォームによっては影響をうけないことがわかった.予測された結合配列に変異を導入すると長いアイソフォームによる発現抑制はみられなくなることも確認された.これらの結果から,グリセロールキナーゼmRNAおよびtaranis mRNAは,miR-307aの長いアイソフォームの標的であるが短いアイソフォームの標的ではないこと,つまり,miR-307aの長さの異なる2つのアイソフォームはショウジョウバエの体内において異なる標的特異性をもつことが示された(図3).
7.哺乳類においてLoqs-PBのホモログであるTRBPはmiRNAの長さと標的特異性を制御する
哺乳類のLoqs-PBホモログであるPACTもしくはTRBPをノックアウトしたマウス胚性線維芽細胞における,低分子RNAのハイスループットシーケンシングによる解析,ならびに,ヒトに由来するDicer,PACT,TRBPの組換えタンパク質を用いたin vitroにおけるmiRNA前駆体に対する切断反応の解析から,ショウジョウバエにおけるLoqs-PBと同様に,哺乳類のTRBPもDicerによるmiRNA前駆体の切断位置を制御し,miRNAの長さとシード配列を制御する機能をもつことが明らかになった.すなわち,Dicer結合タンパク質によりmiRNAの長さ,シード配列,標的特異性が制御されていることは,哺乳類においても保存されていることがわかった.
おわりに
この研究では,ショウジョウバエの遺伝学的および生化学的な解析,培養細胞の解析,次世代シークエンサーを用いた塩基配列の解析など,さまざまな実験手法を用い,また,さらにそれらを互いにうまく相補およびフィードバックさせることにより,“Dicer結合タンパク質はmiRNAの長さ,シード配列,標的特異性を制御する”という新規な概念をともなう現象を発見し検証することができた.今後は,Dicer結合タンパク質は実際にどのようにしてDicerによるmiRNA前駆体の切断位置を制御しているのかにつき,おもに生化学的な解析および結晶構造解析などを用いて明らかにしていきたい.また,どのDicer結合タンパク質がDicerに結合するかにより,同じmiRNA前駆体から,異なる長さ,シード配列,標的特異性をもつmiRNAの産生される分子機構は,おそらく,生物の組織および発生段階において特異的に制御されたmiRNAの産生に寄与している可能性があるが,それについても詳細に検証していきたい.
文 献
- Ghildiyal, M. & Zamore, P. D.: Small silencing RNAs: an expanding universe. Nat. Rev. Genet., 10, 94-108 (2009)[PubMed]
- Bartel, D. P.: MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 116, 281-297 (2004)[PubMed]
- Saito, K., Ishizuka, A., Siomi, H. et al.: Processing of pre-microRNAs by the Dicer-1-Loquacious complex in Drosophila cells. PLoS Biol., 3, e235 (2005)[PubMed]
- Forstemann, K., Tomari, Y., Du, T. et al.: Normal microRNA maturation and germ-line stem cell maintenance requires Loquacious, a double-stranded RNA-binding domain protein. PLoS Biol., 3, e236 (2005)[PubMed]
- Jiang, F., Ye, X., Liu, X. et al.: Dicer-1 and R3D1-L catalyze microRNA maturation in Drosophila. Genes Dev., 19, 1674-1679 (2005)[PubMed]
- Hartig, J. V., Esslinger, S., Bottcher, R. et al.: Endo-siRNAs depend on a new isoform of loquacious and target artificially introduced, high-copy sequences. EMBO J., 28, 2932-2944 (2009)[PubMed]
- Park, J. K., Liu, X., Strauss, T. J. et al.: The miRNA pathway intrinsically controls self-renewal of Drosophila germline stem cells. Curr Biol., 17, 533-538 (2007)[PubMed]
- Cenik, E. S., Fukunaga, R., Lu, G. et al.: Phosphate and R2D2 restrict the substrate specificity of Dicer-2, an ATP-driven ribonuclease. Mol. Cell, 42, 172-184 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
2007年 東京大学大学院理学系研究科 修了,同年 米国California大学Berkeley校 ポスドクを経て,2009年より米国Massachusetts大学Medical Schoolポスドク.
研究テーマ:非コードsmall RNAによる生体制御システム.
抱負:生化学的な手法,遺伝学的な手法,結晶構造解析と多彩な手法を駆使し,非コードRNAの生成,機能,制御に関してオリジナルな研究を行っていきたい.
© 2012 福永 流也 Licensed under CC 表示 2.1 日本