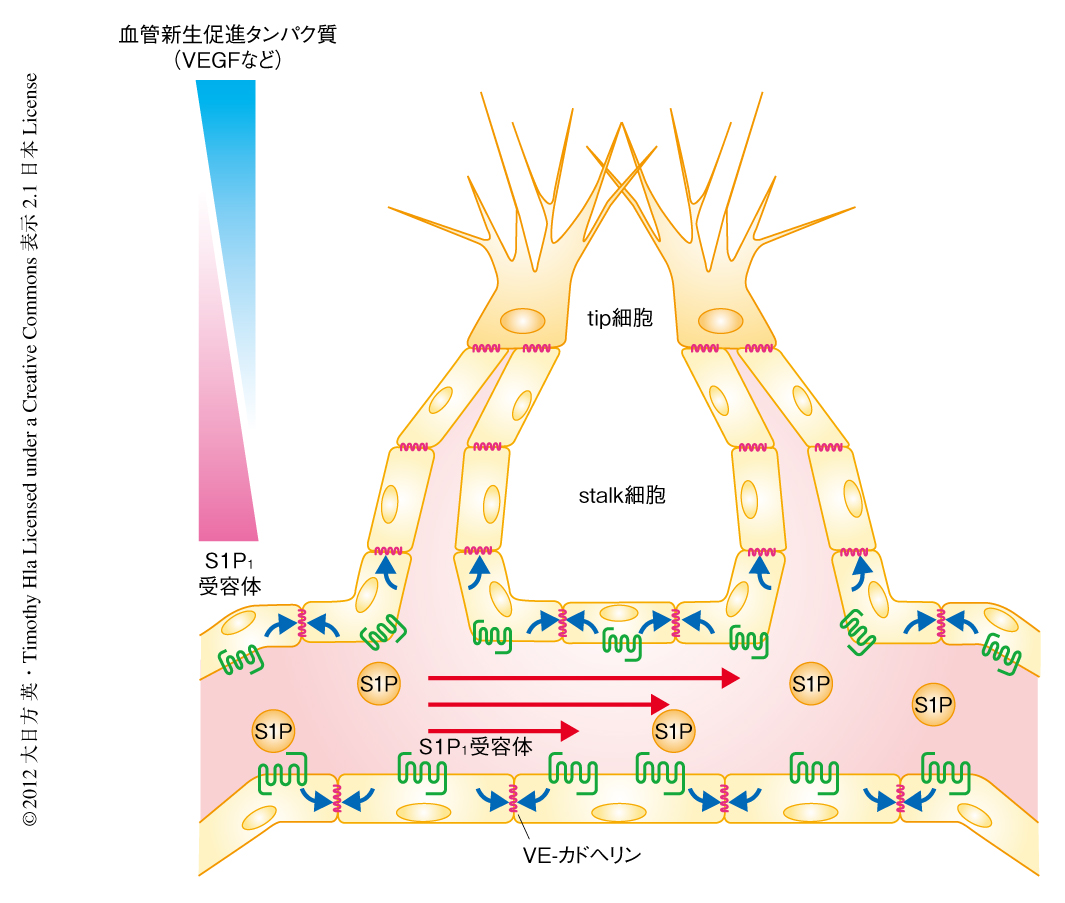
スフィンゴシン1-リン酸の受容体は血流の開始によりもたらされるリガンドと流れ刺激に応答し新生した血管の維持にはたらく
大日方 英・Timothy Hla
(米国Cornell大学Weill Cornell Medical College,Center for Vascular Biology)
email:大日方 英
DOI: 10.7875/first.author.2012.116
Flow-regulated endothelial S1P receptor-1 signaling sustains vascular development.
Bongnam Jung, Hideru Obinata, Sylvain Galvani, Karen Mendelson, Bi-sen Ding, Athanasia Skoura, Bernd Kinzel, Volker Brinkmann, Shahin Rafii, Todd Evans, Timothy Hla
Developmental Cell, 23, 600-610 (2012)
発芽的な血管の新生は階層化された血管網を形成するうえで中心的な役割をはたす.最近の研究により,血管の発芽の開始における分子機構は明らかになってきているのに対し,過剰な血管の発芽を抑制し発芽的な血管新生を終結に導き新生した血管を安定化する分子機構については,これまでほとんど研究されていない.S1P1受容体は血液に存在する生理活性脂質スフィンゴシン1-リン酸の受容体のひとつであり,血管内皮細胞の増殖,遊走,細胞間接着などを制御する.この研究において,筆者らは,S1P1受容体が細胞間の接着結合を強化することにより血管の過剰な発芽を抑制し新生した血管を安定化していることを明らかにした.興味深いことに,S1P1受容体はリガンドであるスフィンゴシン1-リン酸だけでなく,血流のズリ応力によっても活性化されることがわかった.VEGFなど血管新生促進タンパク質が血管の外側から血管の発芽を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答し新生した血管を内側から安定化するものと考えられた.
くまなく全身にはりめぐらされた血管網の形成は生命活動の維持に必要不可欠である.血管の形成は,中胚葉に由来する血管芽細胞が血管内皮細胞に分化して初期の管腔構造を形成する脈管形成,初期の管腔構造から発芽と分岐をくり返して複雑な血管網を形成する血管新生,形成された血管が壁細胞におおわれ安定化される成熟,の3つの過程に大別される.なかでも,血管新生は階層化された血管網を形成するうえで中心的な役割をはたすとともに,その異常は,腫瘍増殖,糖尿病網膜症,虚血性疾患など,さまざまな病態と密接にかかわっている.
血管新生は,血流の不足している組織において低酸素シグナルに応答し産生されるVEGF(vascular endothelial growth factor,血管内皮細胞増殖因子)など血管新生促進タンパク質が,既存の血管から血管内皮細胞の発芽を促すことにより開始される.発芽的な血管新生とよばれるこのプロセスでは,VEGFにより血管内皮細胞のあいだの接着結合がゆるめられ,一部の血管内皮細胞が血管から離脱してtip細胞(血管先端細胞)とよばれる内皮細胞に変化する.tip細胞は糸状仮足を伸ばしながらVEGFの濃度勾配にそって低酸素領域へと遊走していく.tip細胞の後方を,増殖活性のあるstalk細胞(柄細胞)とよばれる内皮細胞が管腔構造を形成しながら追従し,最終的にtip細胞どうしが吻合して新たな血管網が形成されると考えられている1)(図1).このtip細胞とstalk細胞との振り分けにはNotchシグナル伝達系がかかわっており,VEGFの刺激によりNotchリガンドのひとつであるDll4の分泌の高まった細胞がtip細胞へ,分泌されたDll4によりNotch系の活性化された近傍の細胞が側方抑制をうけstalk細胞へと変化することがわかっている1).このように,発芽的な血管新生の開始および維持の分子機構は比較的明らかになっているのに対し,過剰な血管の発芽を抑制し発芽的な血管新生を終結に導き新生した血管を安定化する分子機構についてはほとんど研究されていない.
スフィンゴシン1-リン酸は血液に高濃度で存在する生理活性脂質であり,血液と組織とのあいだに形成されるスフィンゴシン1-リン酸の濃度勾配は血管透過性の制御や免疫系細胞のトラフィッキングに活かされている2).スフィンゴシン1-リン酸の作用は,Gタンパク質共役受容体であり5つのサブタイプからなるS1P1受容体~S1P5受容体を介し発揮される.血管内皮細胞ではS1P1受容体の発現が高く,血管内皮細胞の増殖,遊走,細胞間接着などを制御していることが明らかになっている2).S1P1受容体ノックアウトマウスでは形成された背側大動脈が壁細胞により正常におおわれず安定化されないため,胎生12.5日から胎生14.5日にかけ著しい血液の漏出を起こし胎生致死となる3).したがって,S1P1受容体は胎生期における血管の形成において壁細胞の動員および接着を制御することにより血管の成熟の過程に寄与するが,S1P1受容体ノックアウトマウスにおいて脈管の形成および初期の血管新生に異常は認められないことから,血管新生の主要な制御タンパク質であるとは考えられていなかった.また,S1P1受容体ノックアウトマウスは胎生14.5日までに致死となってしまうことから,とくに出生ののちの血管新生におけるS1P1受容体の役割は十分には検討されていなかった.
この研究では,全身性あるいは血管内皮細胞に特異的にS1P1受容体の欠損および過剰発現を誘導することのできるマウスの系統を確立し,出生ののちの網膜における血管網の形成を観察することにより血管新生におけるS1P1受容体の役割を詳細に検討した.マウスの網膜では,出生ののち7日目ごろまでにかけ,表層部において血管網が中心部から放射状に形成されていくことから,血管網の観察が容易であり発芽的な血管新生の研究にきわめて有用である.その結果,S1P1受容体はVEGFの刺激に拮抗して細胞間の接着結合を強化し,血管の過剰な発芽を抑制することにより新生した血管を維持し安定化するのに重要な役割をはたしていることが明らかになった.興味深いことに,S1P1受容体はリガンドであるスフィンゴシン1-リン酸だけでなく血流のズリ応力によっても活性化されることがわかった.これらのことから,VEGFは血管の外側から血管の発芽を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答し新生した血管を内側から安定化するものと考えられた.
なお,この論文と並行して,Developmental Cell誌の同じ号4),および,同じ月のDevelopment誌に5),ほぼ同様の結果が報告された.これら3つの論文は用いた実験系に相違はあるものの最終的に同じ結論にいたっており,相互に補い合うものであった.ここでは,ほかの2報の結果にも適宜ふれながら解説を進める.
タモキシフェン誘導性に全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスを作製した.また,タモキシフェン誘導性に全身にS1P1受容体を過剰発現させたマウスも作製した.これらのマウスに生後1日目から3日目までタモキシフェンを経口投与し,生後4日目あるいは5日目の網膜における血管網の形成を観察した.その結果,全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスではともに,血管網の形成面積の減少,tip細胞および血管の分岐数の大幅な増加が観察された.これは,血管の発芽が過剰に起こったため血管網が効率よく放射状に広がることのできないことを意味していた.これに対し,S1P1受容体を過剰発現させたマウスではtip細胞および血管の分岐数の減少が観察された.これらの結果から,S1P1受容体の発現量が血管内皮細胞において適切に制御されることが,網膜における血管網の発芽的な血管新生にとり重要であることがわかった.
全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスにおける網膜の血管網の形成の異常は,Dll4ヘテロノックアウトマウスの表現型と非常に類似していた6,7).したがって,S1P1受容体シグナル伝達系がDll4-Notchシグナル伝達系になんらかの影響を及ぼし,tip細胞とstalk細胞との振り分けを制御している可能性が考えられた.しかしながら,この2つのシグナル伝達系のあいだにクロストークはまったく観察されず,S1P1受容体はtip細胞とstalk細胞との振り分けとは別の分子機構により,血管の発芽の過程を制御しているものと考えられた.
S1P1受容体ノックアウトマウスでは背側大動脈が壁細胞により安定化されておらず,その結果,血液の漏出にいたる3).したがって,S1P1受容体は壁細胞の動員および接着の制御に重要であると考えられていた.そこで,全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスおよびS1P1受容体を過剰発現させたマウスにおいて,網膜における血管網の壁細胞による被覆について観察したところ,どのマウスでも血管は壁細胞により正常に被覆されていた.ほぼ同時に出版された論文では,マウスの下肢の血管新生を胎生11.5日のS1P1受容体ノックアウトマウスにおいて観察した結果,網膜と同様に過剰な血管発芽を見い出した5).マウスの下肢では壁細胞による血管被覆が胎生14.5日前後に起こることから,過剰な血管の発芽は壁細胞の動員あるいは接着異常によるものでないことがわかった.また,ほぼ同時に出版されたもうひとつの論文では,S1P1受容体ノックアウトマウスの背側大動脈を詳細に再観察した結果,血管内皮細胞層の過形成およびおびただしい数の微小血管の形成を見い出した4).したがって,S1P1受容体ノックアウトマウスで観察される背側大動脈の成熟の異常は,壁細胞の動員および接着過程そのものに異常があるというよりも,背側大動脈の過剰な発芽が壁細胞の動員をさまたげた結果であると考えられた.以上の結果から,血管内皮細胞に発現するS1P1受容体は,血管内皮細胞に自律的に発芽的な血管新生を抑制的に制御していることが強く示唆された.
S1P1受容体の遺伝子座にLacZをノックインしたマウス3) を利用し,発芽的な血管新生中の網膜の血管網においてS1P1受容体の発現パターンを観察した.その結果,S1P1受容体の発現は血管内皮細胞に限局しており壁細胞やグリア細胞では観察されないこと,また,網膜の中心部に近い血管網で高い発現が観察されるのに対し,発芽的な血管新生の先導部,とくに,tip細胞およびstalk細胞ではほとんど発現は観察されないことを見い出した.したがって,S1P1受容体は血管網が形成され血流が開始された領域において過剰な血管の発芽を抑制する役割をはたしているものと考えられた.
血管内皮細胞に特異的にS1P1受容体を欠損させたマウスの網膜の血管網において,血流および血管の透過性はどのように変化しているかを検討した.血管内皮細胞に特異的に結合するイソレクチン,および,分子量が約200万のFITCデキストランを心臓に注入し3分後に網膜を摘出して観察したところ,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスではイソレクチンは網膜の血管網の先導部まで十分に到達していないこと,また,FITCデキストランが血管の外側に漏出していることを見い出した.これは,これらのマウスの網膜の血管網では血管の透過性が上昇したため血流が十分に確保されていないことを意味した.これを裏づけるように,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは血管網が形成されている網膜の部位ですら依然として低酸素状態におかれていることが観察された.低酸素シグナルはVEGFの産生を促すことから,網膜におけるVEGFの含有量を測定したところこれらのマウスでは有意に上昇していた.また,S1P1受容体の欠損による過剰な血管の発芽はVEGF受容体2の阻害薬により部分的に緩和された.これらのことから,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは形成された血管において血流が十分に確保されないため低酸素状態が解除されず,VEGFの産生が亢進し過剰な血管の発芽にいたるものと考えられた.
S1P1受容体の活性化は血管内皮細胞において細胞間の接着部位へのVE-カドヘリンの集積を促して細胞間の接着結合を強化し,その結果,血管の透過性を減少させることがわかっている.そこで,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスの網膜においてVE-カドヘリンの状態を検討したところ,リン酸化の亢進およびプロテアーゼ処理に対する感受性の上昇が観察された.これらはいずれも細胞間の接着結合がゆるめられていることを意味した.ほぼ同時に出版された論文では,in vitroの系およびゼブラフィッシュの系を用いてさらに解析を進め,S1P1受容体がVEGFの刺激と拮抗的にはたらいてVE-カドヘリンを介した細胞間の接着結合を強化し,過剰な血管の発芽を抑制していることを示した4,5).以上の結果より,S1P1受容体は血管内皮細胞の接着結合を強化することによりVEGFによる過剰な血管発芽を抑制し,新生した血管を安定化して血流の維持にはたらくことが明らかになった.
血流により生じるズリ応力は血管内皮細胞の機能を制御する主要な因子のひとつである8).しかしながら,血管内皮細胞におけるズリ応力の受容の分子機構は必ずしも明らかになっていない.S1P1受容体が血流にさらされている血管網において発現が高いという観察,さらに,血流のズリ応力により血管内皮細胞において惹起されるシグナル伝達系がS1P1受容体のシグナル伝達系と類似していることから,血流のズリ応力の受容においてS1P1受容体のはたす役割を検討した.その結果,層流の刺激により血管内皮細胞において惹起されるERK,Akt,血管内皮型一酸化窒素合成酵素などシグナル伝達タンパク質の活性化,接着結合の形成,血流の向きに対する血管内皮細胞の配向などの応答が,S1P1受容体の薬理学的あるいはRNAi法による阻害により消失することが明らかになった.また,S1P1受容体を介したズリ応力の受容にはリガンドであるスフィンゴシン1-リン酸の結合は必須ではなく,S1P1受容体はリガンドに非依存的に血流のズリ応力による細胞応答を惹起することが明らかになった.
さらに,マウスの大動脈のen faceでの免疫染色により,血管内皮細胞におけるS1P1受容体の局在は層流にさらされている部位と乱流にさらされている部位とで異なることを見い出した.すなわち,層流のもとにある下行大動脈ではS1P1受容体はおもに細胞間の接着部位に局在したが,乱流のもとにある内側大動脈弓ではS1P1受容体は内在化しエンドソームに集積していることが観察された.また,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは下行大動脈における血管内皮型一酸化窒素合成酵素の活性が有意に減少していることが明らかになった.血管内皮型一酸化窒素合成酵素はS1P1受容体の下流におけるエフェクタータンパク質のひとつであり,NOの産生を介し血管平滑筋の弛緩や炎症反応の抑制にはたらくことが知られている9).
以上の結果より,S1P1受容体は生理活性脂質スフィンゴシン1-リン酸の受容体としてだけではなく,血管内皮細胞における血流のズリ応力の受容においても重要な役割をはたすことが示唆された.
この研究では,VEGFは血管の外側から発芽的な血管新生を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答して血管内皮細胞のあいだの接着結合を強化し,新生した血管を内側から安定化する役割をはたすことが明らかになった(図1).発芽的な血管新生を抑制的に制御し新生した血管を安定化に導く新たな分子機構として,非常に意義深い知見であると考えられる.
興味深いことに,S1P1受容体は血管内皮細胞における血流のズリ応力の受容においても重要な役割をはたすことが示唆された.S1P1受容体それ自体が血流のズリ応力のプライマリーセンサーとしてはたらいているのか,あるいは,ほかのプライマリーセンサーを補助するかたちではたらいているのかは現時点で不明であるが,血流のズリ応力の受容は血管の炎症の制御という観点からも非常に興味深く,今後の重要な研究課題である.
血管新生の制御はさまざまな病態の治療,とくに,腫瘍の増殖の抑制という点で非常に重要な課題となっている.すでに抗血管新生薬として抗VEGF抗体の臨床応用が試みられており,加齢黄斑変性においては著明な効果を示すものの,腫瘍の増殖の抑制においては残念ながら期待されたほどの効果は得られていない1).この研究により,新生した血管の安定化における分子機構の一端が明らかになったことで,今後,抗VEGF抗体とS1P1受容体拮抗薬の併用などさまざまな治験が進み,種々の病態における血管新生のよりよい制御が可能となることを期待したい.
略歴:2000年 東京大学大学院医学系研究科 中途退学,同年 群馬大学医学部 助手,2006年 東京大学大学院医学系研究科にて博士号取得,2009年 米国Connecticut大学Health Centerポスドク研究員,同年 米国Cornell大学Weill Cornell Medical Collegeポスドク研究員を経て,2012年より同インストラクター.
研究テーマ:血管の恒常性の維持におけるS1P1受容体の役割.
抱負:血流のズリ応力の受容機構を明らかにしたい.
Timothy Hla
米国Cornell大学Weill Cornell Medical College教授.
研究室URL:http://weill.cornell.edu/research/researcher/thla/
© 2012 大日方 英・Timothy Hla Licensed under CC 表示 2.1 日本
(米国Cornell大学Weill Cornell Medical College,Center for Vascular Biology)
email:大日方 英
DOI: 10.7875/first.author.2012.116
Flow-regulated endothelial S1P receptor-1 signaling sustains vascular development.
Bongnam Jung, Hideru Obinata, Sylvain Galvani, Karen Mendelson, Bi-sen Ding, Athanasia Skoura, Bernd Kinzel, Volker Brinkmann, Shahin Rafii, Todd Evans, Timothy Hla
Developmental Cell, 23, 600-610 (2012)
要 約
発芽的な血管の新生は階層化された血管網を形成するうえで中心的な役割をはたす.最近の研究により,血管の発芽の開始における分子機構は明らかになってきているのに対し,過剰な血管の発芽を抑制し発芽的な血管新生を終結に導き新生した血管を安定化する分子機構については,これまでほとんど研究されていない.S1P1受容体は血液に存在する生理活性脂質スフィンゴシン1-リン酸の受容体のひとつであり,血管内皮細胞の増殖,遊走,細胞間接着などを制御する.この研究において,筆者らは,S1P1受容体が細胞間の接着結合を強化することにより血管の過剰な発芽を抑制し新生した血管を安定化していることを明らかにした.興味深いことに,S1P1受容体はリガンドであるスフィンゴシン1-リン酸だけでなく,血流のズリ応力によっても活性化されることがわかった.VEGFなど血管新生促進タンパク質が血管の外側から血管の発芽を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答し新生した血管を内側から安定化するものと考えられた.
はじめに
くまなく全身にはりめぐらされた血管網の形成は生命活動の維持に必要不可欠である.血管の形成は,中胚葉に由来する血管芽細胞が血管内皮細胞に分化して初期の管腔構造を形成する脈管形成,初期の管腔構造から発芽と分岐をくり返して複雑な血管網を形成する血管新生,形成された血管が壁細胞におおわれ安定化される成熟,の3つの過程に大別される.なかでも,血管新生は階層化された血管網を形成するうえで中心的な役割をはたすとともに,その異常は,腫瘍増殖,糖尿病網膜症,虚血性疾患など,さまざまな病態と密接にかかわっている.
血管新生は,血流の不足している組織において低酸素シグナルに応答し産生されるVEGF(vascular endothelial growth factor,血管内皮細胞増殖因子)など血管新生促進タンパク質が,既存の血管から血管内皮細胞の発芽を促すことにより開始される.発芽的な血管新生とよばれるこのプロセスでは,VEGFにより血管内皮細胞のあいだの接着結合がゆるめられ,一部の血管内皮細胞が血管から離脱してtip細胞(血管先端細胞)とよばれる内皮細胞に変化する.tip細胞は糸状仮足を伸ばしながらVEGFの濃度勾配にそって低酸素領域へと遊走していく.tip細胞の後方を,増殖活性のあるstalk細胞(柄細胞)とよばれる内皮細胞が管腔構造を形成しながら追従し,最終的にtip細胞どうしが吻合して新たな血管網が形成されると考えられている1)(図1).このtip細胞とstalk細胞との振り分けにはNotchシグナル伝達系がかかわっており,VEGFの刺激によりNotchリガンドのひとつであるDll4の分泌の高まった細胞がtip細胞へ,分泌されたDll4によりNotch系の活性化された近傍の細胞が側方抑制をうけstalk細胞へと変化することがわかっている1).このように,発芽的な血管新生の開始および維持の分子機構は比較的明らかになっているのに対し,過剰な血管の発芽を抑制し発芽的な血管新生を終結に導き新生した血管を安定化する分子機構についてはほとんど研究されていない.
スフィンゴシン1-リン酸は血液に高濃度で存在する生理活性脂質であり,血液と組織とのあいだに形成されるスフィンゴシン1-リン酸の濃度勾配は血管透過性の制御や免疫系細胞のトラフィッキングに活かされている2).スフィンゴシン1-リン酸の作用は,Gタンパク質共役受容体であり5つのサブタイプからなるS1P1受容体~S1P5受容体を介し発揮される.血管内皮細胞ではS1P1受容体の発現が高く,血管内皮細胞の増殖,遊走,細胞間接着などを制御していることが明らかになっている2).S1P1受容体ノックアウトマウスでは形成された背側大動脈が壁細胞により正常におおわれず安定化されないため,胎生12.5日から胎生14.5日にかけ著しい血液の漏出を起こし胎生致死となる3).したがって,S1P1受容体は胎生期における血管の形成において壁細胞の動員および接着を制御することにより血管の成熟の過程に寄与するが,S1P1受容体ノックアウトマウスにおいて脈管の形成および初期の血管新生に異常は認められないことから,血管新生の主要な制御タンパク質であるとは考えられていなかった.また,S1P1受容体ノックアウトマウスは胎生14.5日までに致死となってしまうことから,とくに出生ののちの血管新生におけるS1P1受容体の役割は十分には検討されていなかった.
この研究では,全身性あるいは血管内皮細胞に特異的にS1P1受容体の欠損および過剰発現を誘導することのできるマウスの系統を確立し,出生ののちの網膜における血管網の形成を観察することにより血管新生におけるS1P1受容体の役割を詳細に検討した.マウスの網膜では,出生ののち7日目ごろまでにかけ,表層部において血管網が中心部から放射状に形成されていくことから,血管網の観察が容易であり発芽的な血管新生の研究にきわめて有用である.その結果,S1P1受容体はVEGFの刺激に拮抗して細胞間の接着結合を強化し,血管の過剰な発芽を抑制することにより新生した血管を維持し安定化するのに重要な役割をはたしていることが明らかになった.興味深いことに,S1P1受容体はリガンドであるスフィンゴシン1-リン酸だけでなく血流のズリ応力によっても活性化されることがわかった.これらのことから,VEGFは血管の外側から血管の発芽を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答し新生した血管を内側から安定化するものと考えられた.
なお,この論文と並行して,Developmental Cell誌の同じ号4),および,同じ月のDevelopment誌に5),ほぼ同様の結果が報告された.これら3つの論文は用いた実験系に相違はあるものの最終的に同じ結論にいたっており,相互に補い合うものであった.ここでは,ほかの2報の結果にも適宜ふれながら解説を進める.
1.血管内皮細胞に発現するS1P1受容体は網膜における正常な血管網の形成に必須である
タモキシフェン誘導性に全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスを作製した.また,タモキシフェン誘導性に全身にS1P1受容体を過剰発現させたマウスも作製した.これらのマウスに生後1日目から3日目までタモキシフェンを経口投与し,生後4日目あるいは5日目の網膜における血管網の形成を観察した.その結果,全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスではともに,血管網の形成面積の減少,tip細胞および血管の分岐数の大幅な増加が観察された.これは,血管の発芽が過剰に起こったため血管網が効率よく放射状に広がることのできないことを意味していた.これに対し,S1P1受容体を過剰発現させたマウスではtip細胞および血管の分岐数の減少が観察された.これらの結果から,S1P1受容体の発現量が血管内皮細胞において適切に制御されることが,網膜における血管網の発芽的な血管新生にとり重要であることがわかった.
全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスにおける網膜の血管網の形成の異常は,Dll4ヘテロノックアウトマウスの表現型と非常に類似していた6,7).したがって,S1P1受容体シグナル伝達系がDll4-Notchシグナル伝達系になんらかの影響を及ぼし,tip細胞とstalk細胞との振り分けを制御している可能性が考えられた.しかしながら,この2つのシグナル伝達系のあいだにクロストークはまったく観察されず,S1P1受容体はtip細胞とstalk細胞との振り分けとは別の分子機構により,血管の発芽の過程を制御しているものと考えられた.
2.S1P1受容体は血管内皮細胞に自律的に発芽的な血管新生を制御する
S1P1受容体ノックアウトマウスでは背側大動脈が壁細胞により安定化されておらず,その結果,血液の漏出にいたる3).したがって,S1P1受容体は壁細胞の動員および接着の制御に重要であると考えられていた.そこで,全身あるいは血管内皮細胞に特異的にS1P1受容体を欠損させたマウスおよびS1P1受容体を過剰発現させたマウスにおいて,網膜における血管網の壁細胞による被覆について観察したところ,どのマウスでも血管は壁細胞により正常に被覆されていた.ほぼ同時に出版された論文では,マウスの下肢の血管新生を胎生11.5日のS1P1受容体ノックアウトマウスにおいて観察した結果,網膜と同様に過剰な血管発芽を見い出した5).マウスの下肢では壁細胞による血管被覆が胎生14.5日前後に起こることから,過剰な血管の発芽は壁細胞の動員あるいは接着異常によるものでないことがわかった.また,ほぼ同時に出版されたもうひとつの論文では,S1P1受容体ノックアウトマウスの背側大動脈を詳細に再観察した結果,血管内皮細胞層の過形成およびおびただしい数の微小血管の形成を見い出した4).したがって,S1P1受容体ノックアウトマウスで観察される背側大動脈の成熟の異常は,壁細胞の動員および接着過程そのものに異常があるというよりも,背側大動脈の過剰な発芽が壁細胞の動員をさまたげた結果であると考えられた.以上の結果から,血管内皮細胞に発現するS1P1受容体は,血管内皮細胞に自律的に発芽的な血管新生を抑制的に制御していることが強く示唆された.
3.発芽的な血管新生中の網膜の血管網におけるS1P1受容体の発現パターン
S1P1受容体の遺伝子座にLacZをノックインしたマウス3) を利用し,発芽的な血管新生中の網膜の血管網においてS1P1受容体の発現パターンを観察した.その結果,S1P1受容体の発現は血管内皮細胞に限局しており壁細胞やグリア細胞では観察されないこと,また,網膜の中心部に近い血管網で高い発現が観察されるのに対し,発芽的な血管新生の先導部,とくに,tip細胞およびstalk細胞ではほとんど発現は観察されないことを見い出した.したがって,S1P1受容体は血管網が形成され血流が開始された領域において過剰な血管の発芽を抑制する役割をはたしているものと考えられた.
4.S1P1受容体は血管内皮細胞の接着結合を強化することで新生した血管を安定化する
血管内皮細胞に特異的にS1P1受容体を欠損させたマウスの網膜の血管網において,血流および血管の透過性はどのように変化しているかを検討した.血管内皮細胞に特異的に結合するイソレクチン,および,分子量が約200万のFITCデキストランを心臓に注入し3分後に網膜を摘出して観察したところ,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスではイソレクチンは網膜の血管網の先導部まで十分に到達していないこと,また,FITCデキストランが血管の外側に漏出していることを見い出した.これは,これらのマウスの網膜の血管網では血管の透過性が上昇したため血流が十分に確保されていないことを意味した.これを裏づけるように,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは血管網が形成されている網膜の部位ですら依然として低酸素状態におかれていることが観察された.低酸素シグナルはVEGFの産生を促すことから,網膜におけるVEGFの含有量を測定したところこれらのマウスでは有意に上昇していた.また,S1P1受容体の欠損による過剰な血管の発芽はVEGF受容体2の阻害薬により部分的に緩和された.これらのことから,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは形成された血管において血流が十分に確保されないため低酸素状態が解除されず,VEGFの産生が亢進し過剰な血管の発芽にいたるものと考えられた.
S1P1受容体の活性化は血管内皮細胞において細胞間の接着部位へのVE-カドヘリンの集積を促して細胞間の接着結合を強化し,その結果,血管の透過性を減少させることがわかっている.そこで,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスの網膜においてVE-カドヘリンの状態を検討したところ,リン酸化の亢進およびプロテアーゼ処理に対する感受性の上昇が観察された.これらはいずれも細胞間の接着結合がゆるめられていることを意味した.ほぼ同時に出版された論文では,in vitroの系およびゼブラフィッシュの系を用いてさらに解析を進め,S1P1受容体がVEGFの刺激と拮抗的にはたらいてVE-カドヘリンを介した細胞間の接着結合を強化し,過剰な血管の発芽を抑制していることを示した4,5).以上の結果より,S1P1受容体は血管内皮細胞の接着結合を強化することによりVEGFによる過剰な血管発芽を抑制し,新生した血管を安定化して血流の維持にはたらくことが明らかになった.
5.S1P1受容体は血管内皮細胞における血流のズリ応力の受容に重要な役割をはたす
血流により生じるズリ応力は血管内皮細胞の機能を制御する主要な因子のひとつである8).しかしながら,血管内皮細胞におけるズリ応力の受容の分子機構は必ずしも明らかになっていない.S1P1受容体が血流にさらされている血管網において発現が高いという観察,さらに,血流のズリ応力により血管内皮細胞において惹起されるシグナル伝達系がS1P1受容体のシグナル伝達系と類似していることから,血流のズリ応力の受容においてS1P1受容体のはたす役割を検討した.その結果,層流の刺激により血管内皮細胞において惹起されるERK,Akt,血管内皮型一酸化窒素合成酵素などシグナル伝達タンパク質の活性化,接着結合の形成,血流の向きに対する血管内皮細胞の配向などの応答が,S1P1受容体の薬理学的あるいはRNAi法による阻害により消失することが明らかになった.また,S1P1受容体を介したズリ応力の受容にはリガンドであるスフィンゴシン1-リン酸の結合は必須ではなく,S1P1受容体はリガンドに非依存的に血流のズリ応力による細胞応答を惹起することが明らかになった.
さらに,マウスの大動脈のen faceでの免疫染色により,血管内皮細胞におけるS1P1受容体の局在は層流にさらされている部位と乱流にさらされている部位とで異なることを見い出した.すなわち,層流のもとにある下行大動脈ではS1P1受容体はおもに細胞間の接着部位に局在したが,乱流のもとにある内側大動脈弓ではS1P1受容体は内在化しエンドソームに集積していることが観察された.また,血管内皮細胞に特異的にS1P1受容体を欠損させたマウスでは下行大動脈における血管内皮型一酸化窒素合成酵素の活性が有意に減少していることが明らかになった.血管内皮型一酸化窒素合成酵素はS1P1受容体の下流におけるエフェクタータンパク質のひとつであり,NOの産生を介し血管平滑筋の弛緩や炎症反応の抑制にはたらくことが知られている9).
以上の結果より,S1P1受容体は生理活性脂質スフィンゴシン1-リン酸の受容体としてだけではなく,血管内皮細胞における血流のズリ応力の受容においても重要な役割をはたすことが示唆された.
おわりに
この研究では,VEGFは血管の外側から発芽的な血管新生を促すのに対し,S1P1受容体は血流の開始によりもたらされる血液のスフィンゴシン1-リン酸と血流のズリ応力に応答して血管内皮細胞のあいだの接着結合を強化し,新生した血管を内側から安定化する役割をはたすことが明らかになった(図1).発芽的な血管新生を抑制的に制御し新生した血管を安定化に導く新たな分子機構として,非常に意義深い知見であると考えられる.
興味深いことに,S1P1受容体は血管内皮細胞における血流のズリ応力の受容においても重要な役割をはたすことが示唆された.S1P1受容体それ自体が血流のズリ応力のプライマリーセンサーとしてはたらいているのか,あるいは,ほかのプライマリーセンサーを補助するかたちではたらいているのかは現時点で不明であるが,血流のズリ応力の受容は血管の炎症の制御という観点からも非常に興味深く,今後の重要な研究課題である.
血管新生の制御はさまざまな病態の治療,とくに,腫瘍の増殖の抑制という点で非常に重要な課題となっている.すでに抗血管新生薬として抗VEGF抗体の臨床応用が試みられており,加齢黄斑変性においては著明な効果を示すものの,腫瘍の増殖の抑制においては残念ながら期待されたほどの効果は得られていない1).この研究により,新生した血管の安定化における分子機構の一端が明らかになったことで,今後,抗VEGF抗体とS1P1受容体拮抗薬の併用などさまざまな治験が進み,種々の病態における血管新生のよりよい制御が可能となることを期待したい.
文 献
- Carmeliet, P. & Jain, R. K.: Molecular mechanisms and clinical applications of angiogenesis. Nature, 473, 298-307 (2011)[PubMed]
- Obinata, H. & Hla, T.: Sphingosine 1-phosphate in coagulation and inflammation. Semin. Immunopathol., 34, 73-91 (2012)[PubMed]
- Liu, Y., Wada, R., Yamashita, T. et al.: Edg-1, the G protein-coupled receptor for sphingosine-1-phosphate, is essential for vascular maturation. J. Clin. Invest., 106, 951-961 (2000)[PubMed]
- Gaengel, K., Niaudet, C., Hagikura, K. et al.: The sphingosine-1-phosphate receptor S1PR1 restricts sprouting angiogenesis by regulating the interplay between VE-Cadherin and VEGFR2. Dev. Cell, 23, 587-599 (2012)[PubMed]
- Shoham, A. B., Malkinson, G., Krief, S. et al.: S1P1 inhibits sprouting angiogenesis during vascular development. Development, 139, 3859-3869 (2012)[PubMed]
- Hellstrom, M., Phng, L. K., Hofmann, J. J. et al.: Dll4 signalling through Notch1 regulates formation of tip cells during angiogenesis. Nature, 445, 776-780 (2007)[PubMed]
- Suchting, S., Freitas, C., le Noble, F. et al.: The Notch ligand Delta-like 4 negatively regulates endothelial tip cell formation and vessel branching. Proc. Natl. Acad. Sci. USA, 104, 3225-3230 (2007)[PubMed]
- Hahn, C. & Schwartz, M. A.: Mechanotransduction in vascular physiology and atherogenesis. Nat. Rev. Mol. Cell Biol., 10, 53-62 (2009)[PubMed]
- Forstermann, U. & Sessa, W. C.: Nitric oxide synthases: regulation and function. Eur. Heart J., 33, 829-837 (2012)[PubMed]
著者プロフィール
略歴:2000年 東京大学大学院医学系研究科 中途退学,同年 群馬大学医学部 助手,2006年 東京大学大学院医学系研究科にて博士号取得,2009年 米国Connecticut大学Health Centerポスドク研究員,同年 米国Cornell大学Weill Cornell Medical Collegeポスドク研究員を経て,2012年より同インストラクター.
研究テーマ:血管の恒常性の維持におけるS1P1受容体の役割.
抱負:血流のズリ応力の受容機構を明らかにしたい.
Timothy Hla
米国Cornell大学Weill Cornell Medical College教授.
研究室URL:http://weill.cornell.edu/research/researcher/thla/
© 2012 大日方 英・Timothy Hla Licensed under CC 表示 2.1 日本