RPAはヒストンシャペロンFACTをリクルートしヌクレオソームを形成するDNAへのHSF1の結合を介助する
藤本充章・中井 彰
(山口大学大学院医学系研究科 医化学分野)
email:藤本充章,中井 彰
DOI: 10.7875/first.author.2012.115
RPA assists HSF1 access to nucleosomal DNA by recruiting histone chaperone FACT.
Mitsuaki Fujimoto, Eiichi Takaki, Ryosuke Takii, Ke Tan, Ramachandran Prakasam, Naoki Hayashida, Shun-ichiro Iemura, Tohru Natsume, Akira Nakai
Molecular Cell, 48, 182-194 (2012)
すべての細胞は熱ストレスにより熱ショック応答をひき起こす.この応答はHSFによる急速で顕著な転写の亢進をともなうため,転写制御機構のモデルとして解析されてきた.ショウジョウバエのHSP70遺伝子の転写開始点の周辺は,ショウジョウバエに特異的なGAGA因子があらかじめ結合することによりヌクレオソームを形成していない.そのため,熱ストレスにより活性化したHSFがすみやかに結合し転写を亢進することができる.一方,高等動物細胞のHSP70遺伝子のプロモーター領域がヌクレオソームを形成しないしくみは不明であった.筆者らは,HSF1がDNAの複製および修復に関連するタンパク質RPA,および,ヒストンシャペロンFACTと複合体を形成することにより,非ストレス状態においてヌクレオソームを形成するDNAに安定に結合することを見い出した.この複合体の形成は,タンパク質ホメオスタシス容量の維持,および,がん細胞の増殖に必要であることも明らかにした.これらの結果は,遺伝子発現制御の基盤となる,転写因子がヌクレオソームを形成するDNAにアクセスするしくみを明確に示していた.
細胞には外界からのストレスや遺伝的な要因などによりタンパク質のミスフォールディングが生じても,ホメオスタシスを維持するためのしくみが備わっている.そのなかでも重要なのが,熱ショック応答とよばれる転写制御を介する機構である.これは,タンパク質のフォールディングと分解を助ける熱ショックタンパク質(heat shock prorein:HSP)などをコードする遺伝子の転写を誘導することにより,増加した異常なタンパク質を再フォールディングまたは分解により適切に処理してタンパク質のホメオスタシスを維持するしくみである1-3).つまり,異常なタンパク質の負荷に対しタンパク質のホメオスタシスを一定に保つことができる容量(タンパク質ホメオスタシス容量)は,熱ショック応答により制御されている.この制御機構を凌駕してミスフォールディングしたタンパク質の負荷は,老化や老化と関連した,いわゆるミスフォールディング病の進行と密接に関連している4).また,がん細胞はこの制御機構を強く発揮させ,それを利用することでストレス状態においても増殖できることが知られている5).
熱ショック応答を制御するのが熱ショック因子(heat shock factor:HSF)とよばれる転写因子であり,そのうちHSF1はHSP70などの熱ショックタンパク質をコードする遺伝子のプロモーターに結合することによりその転写を亢進する6,7).一般に,DNAはヒストンと複合体を形成してヌクレオソームとよばれる構造を形成しているため,通常,転写因子はDNAに結合できない8).したがって,転写因子HSF1がヌクレオソームを形成するDNAに最初に結合するしくみの解明は,タンパク質ホメオスタシス容量を制御する基本的な過程であるにもかかわらず,長いあいだ未解明のままであった.筆者らは,HSF1と相互作用するタンパク質のネットワーク解析を足がかりとし,HSF1とRPA(replication protein A)との複合体がヒストンシャペロンFACT(facilitates chromatin transcription)をリクルートすることにより,ヌクレオソームを形成するDNAにアクセスすることを明らかにした.また,このHSF1-RPA複合体はタンパク質ホメオスタシス容量を維持するだけでなく,がん細胞の増殖にも必要であることを明らかにした.
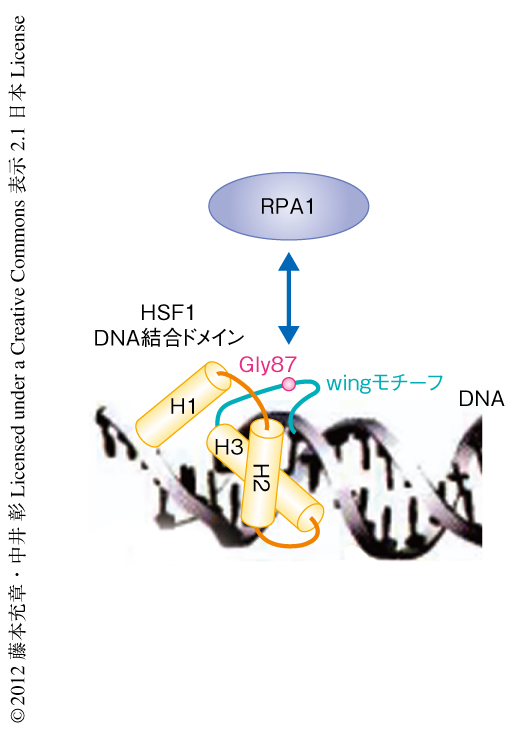
転写因子HSF1の転写制御機構を詳細に解析するため,HSF1を含むタンパク質複合体を精製した.FLAGタグを付加したHSF1をHEK293細胞に発現させ,熱ショックをあたえない場合,熱ショックをあたえたとき,熱ショックをあたえたのち,細胞抽出液を調製し,抗FLAG抗体より共沈降するタンパク質を質量分析法により同定した.その結果,HSF1に結合する30のタンパク質を同定することができた.マウス胎仔線維芽細胞においてこれらをノックダウンし,熱ショックののちのHSP70の発現変化を調べた.9個のタンパク質のノックダウンにより発現抑制,2個のタンパク質のノックダウンにより発現亢進がみられ,全体で約40%ものタンパク質がHSP70の発現に関与していることが示唆された.ノックダウンにより発現抑制のみられたタンパク質のうち,DNAの複製,修復,組換えなどDNA代謝を担うことが知られているRPAに着目し,HSF1とRPAとの相互作用を詳細に調べた.RPAはRPA1,RPA2,RPA3からなる複合体で,核に局在することが知られている.免疫沈降実験により,RPA1,RPA2,RPA3は熱ショックの有無にかかわらずHSF1と複合体を形成することが確認された.さらに,GSTプルダウン法により,HSF1がRPA1と直接に相互作用することがわかった.この相互作用は,HSF1のDNA結合ドメインとPRA1の一本鎖DNA結合ドメインを介していた.HSF1のDNA結合ドメインはwinged helix-turn-helix構造をとるが9),PRA1はそのなかでも13アミノ酸残基からなる決まった構造をとらないwingモチーフに結合することがわかった.87番目のグリシン残基に点変異を導入したHSF1はRPA1と相互作用しなかったが,このグリシン残基はwingモチーフのなかで唯一,HSF1において酵母からヒトまで保存されていた(図1).
HSF1はHSP70遺伝子などの熱ショック遺伝子のプロモーターに結合し転写量の制御にはたらく.ショウジョウバエのHSP70遺伝子の解析から,非ストレス状態においてはHSP70遺伝子の転写開始点の数十塩基下流にRNAポリメラーゼIIが停止した状態で存在しており,熱ショックをあたえるとHSP70遺伝子の転写が急激に起こることが知られている8).マウス胎仔線維芽細胞においてRPA1の量を減少させると非ストレス状態でもHSP70の発現低下が観察されたことから,HSF1とRPA1がHSP70遺伝子のプロモーター領域に存在する熱ショック応答配列に結合するかどうかをクロマチン免疫沈降法により調べた.その結果,HSF1とRPA1は非ストレス状態でも熱ショック応答配列に結合することがわかった.驚いたことに,RPA1をノックダウンするとHSF1は熱ショック応答配列へほとんど結合できなくなった.内在性のHSF1をRPA1と相互作用しない変異体と置換すると,この変異HSF1もRPA1も熱ショック応答配列に結合できなくなった.つまり,HSF1はRPA1と複合体を形成することによりHSP70遺伝子のプロモーターに結合できるようになることが明らかになった.RPA1のノックダウンによりHSP70遺伝子のプロモーター領域におけるヒストンH3およびヒストンH2Bの量は増加し,クロマチン構造をゆるめるヒストン修飾である,ヒストンH3の4番目のリジン残基のトリメチル化,ヒストンH3の9番目のリジン残基のアセチル化,ヒストンH3の27番目のリジン残基のアセチル化は減少した.さらに,転写開始点の下流に停止したRNAポリメラーゼIIはほとんど認められなくなった.以上の結果は,HSF1-RPA複合体がクロマチン構造をゆるめ,RNAポリメラーゼIIの動員に関与していることを示していた.
RPA1は一本鎖DNAに結合することが知られているが,その性質によりヒストンを直接的に除去することはできない.これまでに,出芽酵母のRPA1はヒストンH2A-ヒストンH2B二量体を除去するヒストンシャペロン複合体FACTと結合することが知られている10).そこで,ヒトのRPA1がFACT(SPT16とSSRP1とのヘテロ二量体)と相互作用するかどうかを免疫沈降法により検討したところ,RPA1とFACTは複合体を形成することがわかった.さらに,SPT16をノックダウンするとHSP70遺伝子のプロモーターへのHSF1の結合は減少し,ヒストンの量が増加するとともにクロマチン構造をゆるめるヒストン修飾は低下した.つまり,ヌクレオソームを形成するDNAへのHSF1-RPA複合体の結合は,一部はFACTによるヒストンの除去によることがわかった.
HSF1-RPA複合体によるヒストンの除去,および,それにともなうDNAへの安定な結合が一般的なしくみかどうかを明らかにするため,DNAマイクロアレイ解析によりHSF1あるいはRPAの標的となる遺伝子を同定した.興味深いことに,HSF1のノックダウンにより発現低下した遺伝子(564遺伝子)のうち,70%はRPA1のノックダウンによっても発現低下した.そのうち5つの遺伝子のプロモーター領域を解析したところ,すべてにHSF1-RPA1複合体が結合していた.HSF1をノックダウンした細胞に野生型HSF1を再導入するとそれらの遺伝子の発現はもとのレベルにまで回復したが,RPA1と相互作用しない変異HSF1を導入してもそれらの遺伝子の発現はまったく変わらなかった.これらの結果は,一般にHSF1を介する遺伝子発現にHSF1-RPA複合体が関与していることを示していた.
HSF1は正常な細胞の増殖には関与しないが,がんの発生および進展に関与しており,とくに,ヒトの乳がん細胞をはじめとするさまざまながん細胞株の増殖に重要であることが知られている5).筆者らも,悪性黒色腫細胞におけるHSF1のノックダウンはその増殖を顕著に抑制することを示している11).今回,HSF1をノックダウンした悪性黒色腫細胞に野生型HSF1を再導入するとその増殖は回復するが,RPA1と相互作用しない変異HSF1導入しても増殖はまったく回復しないことが明らかにされた.これらの細胞をヌードマウスへ移植すると,野生型HSF1をもつ悪性黒色腫細胞は腫瘍を形成したが,RPA1と相互作用しない変異HSF1をもつ細胞はほとんど腫瘍を形成しなかった.以上の結果は,HSF1-RPA複合体はがん細胞の増殖に必要であることを示していた.
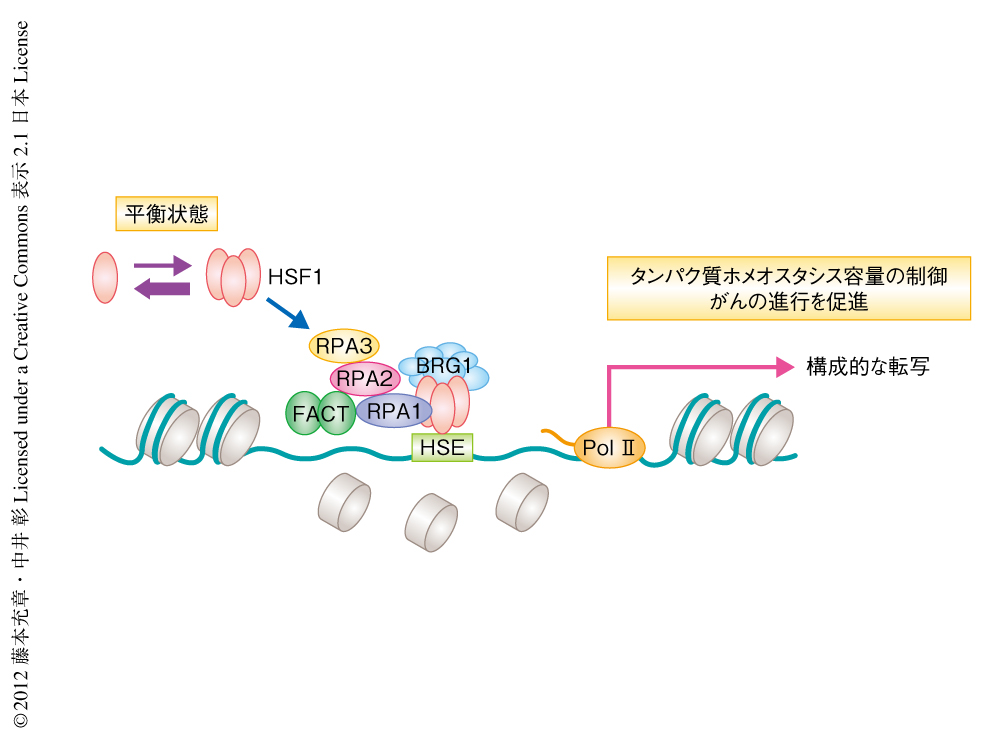
HSF1による熱ショック応答の研究の歴史は古く,とくにショウジョウバエをモデルとした研究が精力的に進められてきた.それによると,GAGA因子によりあらかじめHSP70遺伝子のプロモーター領域に存在するヒストンは除去され,HSF1はストレス状態においてのみDNAに結合し転写制御を行うとされていた.しかし最近では,ストレスのない状態における培養細胞やマウス個体でもHSF1がつねにDNAに結合することにより,タンパク質ホメオスタシス容量を保ち老化や老化と関連する疾患の進行を抑制していることが示唆されてきた.一般に,転写因子がヌクレオソームを形成するDNAに安定に結合するしくみについてはよく知られていない.DNAはヒストンに約2回巻きつくことでヌクレオソーム構造を形成しているが,この構造は流動的でDNAが巻きついては離れることをくり返している.そのため,転写因子がヒストンの離れたDNAと結合したとしても,すぐにヒストンと競合し除去される.筆者らは,転写因子HSF1がヒストンを除去するヒストンシャペロンFACTをリクルートすることにより,ヌクレオソームを形成するDNAに安定に結合することをはじめて明らかにした(図2).
ヒトのさまざまながん組織において熱ショックタンパク質の発現の上昇していることが知られている.最近,その転写制御を担うHSF1の発現も,前立腺がん,肝がん,乳がんなどで亢進していることが明らかになってきた.さらに,さまざまな組織に由来するがん細胞の増殖がHSF1に依存していることが示され,HSF1ががん治療のターゲットとして注目をあつめている.今回の解析により,HSF1とRPA1との相互作用ががん治療のターゲットとして有望であることが示された.この相互作用を断ち切る化合物を見い出すことにより,がん細胞で特異的に増殖を阻害できる可能性が示唆された.
略歴:2000年 北海道大学大学院薬学研究科博士課程 修了,2001年 米国Emory大学 ポスドク,2002年 山口大学医学部 助手を経て,2005年より同 講師(現 大学院医学系研究科 講師).
研究テーマ:転写因子HSF1による転写制御機構.
抱負:HSF1による転写制御の全貌を明らかにし,がんや神経変性疾患に有効な薬の開発に貢献したい.
中井 彰(Akira Nakai)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds22.cc.yamaguchi-u.ac.jp/~seika2/
© 2012 藤本充章・中井 彰 Licensed under CC 表示 2.1 日本
(山口大学大学院医学系研究科 医化学分野)
email:藤本充章,中井 彰
DOI: 10.7875/first.author.2012.115
RPA assists HSF1 access to nucleosomal DNA by recruiting histone chaperone FACT.
Mitsuaki Fujimoto, Eiichi Takaki, Ryosuke Takii, Ke Tan, Ramachandran Prakasam, Naoki Hayashida, Shun-ichiro Iemura, Tohru Natsume, Akira Nakai
Molecular Cell, 48, 182-194 (2012)
要 約
すべての細胞は熱ストレスにより熱ショック応答をひき起こす.この応答はHSFによる急速で顕著な転写の亢進をともなうため,転写制御機構のモデルとして解析されてきた.ショウジョウバエのHSP70遺伝子の転写開始点の周辺は,ショウジョウバエに特異的なGAGA因子があらかじめ結合することによりヌクレオソームを形成していない.そのため,熱ストレスにより活性化したHSFがすみやかに結合し転写を亢進することができる.一方,高等動物細胞のHSP70遺伝子のプロモーター領域がヌクレオソームを形成しないしくみは不明であった.筆者らは,HSF1がDNAの複製および修復に関連するタンパク質RPA,および,ヒストンシャペロンFACTと複合体を形成することにより,非ストレス状態においてヌクレオソームを形成するDNAに安定に結合することを見い出した.この複合体の形成は,タンパク質ホメオスタシス容量の維持,および,がん細胞の増殖に必要であることも明らかにした.これらの結果は,遺伝子発現制御の基盤となる,転写因子がヌクレオソームを形成するDNAにアクセスするしくみを明確に示していた.
はじめに
細胞には外界からのストレスや遺伝的な要因などによりタンパク質のミスフォールディングが生じても,ホメオスタシスを維持するためのしくみが備わっている.そのなかでも重要なのが,熱ショック応答とよばれる転写制御を介する機構である.これは,タンパク質のフォールディングと分解を助ける熱ショックタンパク質(heat shock prorein:HSP)などをコードする遺伝子の転写を誘導することにより,増加した異常なタンパク質を再フォールディングまたは分解により適切に処理してタンパク質のホメオスタシスを維持するしくみである1-3).つまり,異常なタンパク質の負荷に対しタンパク質のホメオスタシスを一定に保つことができる容量(タンパク質ホメオスタシス容量)は,熱ショック応答により制御されている.この制御機構を凌駕してミスフォールディングしたタンパク質の負荷は,老化や老化と関連した,いわゆるミスフォールディング病の進行と密接に関連している4).また,がん細胞はこの制御機構を強く発揮させ,それを利用することでストレス状態においても増殖できることが知られている5).
熱ショック応答を制御するのが熱ショック因子(heat shock factor:HSF)とよばれる転写因子であり,そのうちHSF1はHSP70などの熱ショックタンパク質をコードする遺伝子のプロモーターに結合することによりその転写を亢進する6,7).一般に,DNAはヒストンと複合体を形成してヌクレオソームとよばれる構造を形成しているため,通常,転写因子はDNAに結合できない8).したがって,転写因子HSF1がヌクレオソームを形成するDNAに最初に結合するしくみの解明は,タンパク質ホメオスタシス容量を制御する基本的な過程であるにもかかわらず,長いあいだ未解明のままであった.筆者らは,HSF1と相互作用するタンパク質のネットワーク解析を足がかりとし,HSF1とRPA(replication protein A)との複合体がヒストンシャペロンFACT(facilitates chromatin transcription)をリクルートすることにより,ヌクレオソームを形成するDNAにアクセスすることを明らかにした.また,このHSF1-RPA複合体はタンパク質ホメオスタシス容量を維持するだけでなく,がん細胞の増殖にも必要であることを明らかにした.
1.HSF1はRPA1と相互作用する
転写因子HSF1の転写制御機構を詳細に解析するため,HSF1を含むタンパク質複合体を精製した.FLAGタグを付加したHSF1をHEK293細胞に発現させ,熱ショックをあたえない場合,熱ショックをあたえたとき,熱ショックをあたえたのち,細胞抽出液を調製し,抗FLAG抗体より共沈降するタンパク質を質量分析法により同定した.その結果,HSF1に結合する30のタンパク質を同定することができた.マウス胎仔線維芽細胞においてこれらをノックダウンし,熱ショックののちのHSP70の発現変化を調べた.9個のタンパク質のノックダウンにより発現抑制,2個のタンパク質のノックダウンにより発現亢進がみられ,全体で約40%ものタンパク質がHSP70の発現に関与していることが示唆された.ノックダウンにより発現抑制のみられたタンパク質のうち,DNAの複製,修復,組換えなどDNA代謝を担うことが知られているRPAに着目し,HSF1とRPAとの相互作用を詳細に調べた.RPAはRPA1,RPA2,RPA3からなる複合体で,核に局在することが知られている.免疫沈降実験により,RPA1,RPA2,RPA3は熱ショックの有無にかかわらずHSF1と複合体を形成することが確認された.さらに,GSTプルダウン法により,HSF1がRPA1と直接に相互作用することがわかった.この相互作用は,HSF1のDNA結合ドメインとPRA1の一本鎖DNA結合ドメインを介していた.HSF1のDNA結合ドメインはwinged helix-turn-helix構造をとるが9),PRA1はそのなかでも13アミノ酸残基からなる決まった構造をとらないwingモチーフに結合することがわかった.87番目のグリシン残基に点変異を導入したHSF1はRPA1と相互作用しなかったが,このグリシン残基はwingモチーフのなかで唯一,HSF1において酵母からヒトまで保存されていた(図1).
2.RPA1はHSF1がHSP70遺伝子のプロモーターにアクセスするため必要である
HSF1はHSP70遺伝子などの熱ショック遺伝子のプロモーターに結合し転写量の制御にはたらく.ショウジョウバエのHSP70遺伝子の解析から,非ストレス状態においてはHSP70遺伝子の転写開始点の数十塩基下流にRNAポリメラーゼIIが停止した状態で存在しており,熱ショックをあたえるとHSP70遺伝子の転写が急激に起こることが知られている8).マウス胎仔線維芽細胞においてRPA1の量を減少させると非ストレス状態でもHSP70の発現低下が観察されたことから,HSF1とRPA1がHSP70遺伝子のプロモーター領域に存在する熱ショック応答配列に結合するかどうかをクロマチン免疫沈降法により調べた.その結果,HSF1とRPA1は非ストレス状態でも熱ショック応答配列に結合することがわかった.驚いたことに,RPA1をノックダウンするとHSF1は熱ショック応答配列へほとんど結合できなくなった.内在性のHSF1をRPA1と相互作用しない変異体と置換すると,この変異HSF1もRPA1も熱ショック応答配列に結合できなくなった.つまり,HSF1はRPA1と複合体を形成することによりHSP70遺伝子のプロモーターに結合できるようになることが明らかになった.RPA1のノックダウンによりHSP70遺伝子のプロモーター領域におけるヒストンH3およびヒストンH2Bの量は増加し,クロマチン構造をゆるめるヒストン修飾である,ヒストンH3の4番目のリジン残基のトリメチル化,ヒストンH3の9番目のリジン残基のアセチル化,ヒストンH3の27番目のリジン残基のアセチル化は減少した.さらに,転写開始点の下流に停止したRNAポリメラーゼIIはほとんど認められなくなった.以上の結果は,HSF1-RPA複合体がクロマチン構造をゆるめ,RNAポリメラーゼIIの動員に関与していることを示していた.
3.HSF1-RPA複合体はヒストンを除去するはたらきをもつFACTをリクルートする
RPA1は一本鎖DNAに結合することが知られているが,その性質によりヒストンを直接的に除去することはできない.これまでに,出芽酵母のRPA1はヒストンH2A-ヒストンH2B二量体を除去するヒストンシャペロン複合体FACTと結合することが知られている10).そこで,ヒトのRPA1がFACT(SPT16とSSRP1とのヘテロ二量体)と相互作用するかどうかを免疫沈降法により検討したところ,RPA1とFACTは複合体を形成することがわかった.さらに,SPT16をノックダウンするとHSP70遺伝子のプロモーターへのHSF1の結合は減少し,ヒストンの量が増加するとともにクロマチン構造をゆるめるヒストン修飾は低下した.つまり,ヌクレオソームを形成するDNAへのHSF1-RPA複合体の結合は,一部はFACTによるヒストンの除去によることがわかった.
4.HSF1-RPA複合体は腫瘍の形成に必要である
HSF1-RPA複合体によるヒストンの除去,および,それにともなうDNAへの安定な結合が一般的なしくみかどうかを明らかにするため,DNAマイクロアレイ解析によりHSF1あるいはRPAの標的となる遺伝子を同定した.興味深いことに,HSF1のノックダウンにより発現低下した遺伝子(564遺伝子)のうち,70%はRPA1のノックダウンによっても発現低下した.そのうち5つの遺伝子のプロモーター領域を解析したところ,すべてにHSF1-RPA1複合体が結合していた.HSF1をノックダウンした細胞に野生型HSF1を再導入するとそれらの遺伝子の発現はもとのレベルにまで回復したが,RPA1と相互作用しない変異HSF1を導入してもそれらの遺伝子の発現はまったく変わらなかった.これらの結果は,一般にHSF1を介する遺伝子発現にHSF1-RPA複合体が関与していることを示していた.
HSF1は正常な細胞の増殖には関与しないが,がんの発生および進展に関与しており,とくに,ヒトの乳がん細胞をはじめとするさまざまながん細胞株の増殖に重要であることが知られている5).筆者らも,悪性黒色腫細胞におけるHSF1のノックダウンはその増殖を顕著に抑制することを示している11).今回,HSF1をノックダウンした悪性黒色腫細胞に野生型HSF1を再導入するとその増殖は回復するが,RPA1と相互作用しない変異HSF1導入しても増殖はまったく回復しないことが明らかにされた.これらの細胞をヌードマウスへ移植すると,野生型HSF1をもつ悪性黒色腫細胞は腫瘍を形成したが,RPA1と相互作用しない変異HSF1をもつ細胞はほとんど腫瘍を形成しなかった.以上の結果は,HSF1-RPA複合体はがん細胞の増殖に必要であることを示していた.
おわりに
HSF1による熱ショック応答の研究の歴史は古く,とくにショウジョウバエをモデルとした研究が精力的に進められてきた.それによると,GAGA因子によりあらかじめHSP70遺伝子のプロモーター領域に存在するヒストンは除去され,HSF1はストレス状態においてのみDNAに結合し転写制御を行うとされていた.しかし最近では,ストレスのない状態における培養細胞やマウス個体でもHSF1がつねにDNAに結合することにより,タンパク質ホメオスタシス容量を保ち老化や老化と関連する疾患の進行を抑制していることが示唆されてきた.一般に,転写因子がヌクレオソームを形成するDNAに安定に結合するしくみについてはよく知られていない.DNAはヒストンに約2回巻きつくことでヌクレオソーム構造を形成しているが,この構造は流動的でDNAが巻きついては離れることをくり返している.そのため,転写因子がヒストンの離れたDNAと結合したとしても,すぐにヒストンと競合し除去される.筆者らは,転写因子HSF1がヒストンを除去するヒストンシャペロンFACTをリクルートすることにより,ヌクレオソームを形成するDNAに安定に結合することをはじめて明らかにした(図2).
ヒトのさまざまながん組織において熱ショックタンパク質の発現の上昇していることが知られている.最近,その転写制御を担うHSF1の発現も,前立腺がん,肝がん,乳がんなどで亢進していることが明らかになってきた.さらに,さまざまな組織に由来するがん細胞の増殖がHSF1に依存していることが示され,HSF1ががん治療のターゲットとして注目をあつめている.今回の解析により,HSF1とRPA1との相互作用ががん治療のターゲットとして有望であることが示された.この相互作用を断ち切る化合物を見い出すことにより,がん細胞で特異的に増殖を阻害できる可能性が示唆された.
文 献
- Richter, K., Haslbeck, K. M. & Buchner, J.: The heat shock response: life on the verge of death. Mol. Cell, 40, 253-266 (2010)[PubMed]
- Hayashida, N., Fujimoto, M., Tan, K. et al.: Heat shock factor 1 ameliorates proteotoxicity in cooperation with the transcription factor NFAT. EMBO J., 29, 3459-3469 (2010)[PubMed]
- Shinkawa, T., Tan, K., Fujimoto, M. et al.: Heat shock factor 2 is required for maintaining proteostasis against febrile-range thermal stress and polyglutamine aggregation. Mol. Biol. Cell, 22, 357-383 (2011)[PubMed]
- Morimoto, R. I.: Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes Dev., 22, 1427-1438 (2008)[PubMed]
- Dai, C., Whitesell, L., Rogers, A. B. et al.: Heat shock factor 1 is a powerful multifaceted modifier of carcinogenesis. Cell, 130, 1005-1018 (2007)[PubMed]
- Wu, C.: Heat shock transcription factors: structure and regulation. Annu. Rev. Cell Dev. Biol., 11, 441-469 (1995)[PubMed]
- Fujimoto, M. & Nakai, A.: The heat shock factor family and adaptation to proteotoxic stress. FEBS J., 277, 4112-4125 (2010)[PubMed]
- Fuda, N. J., Ardehali, M. B. & Lis, J. T.: Defining mechanisms that regulate RNA polymerase II transcription in vivo. Nature, 461, 186-192 (2009)[PubMed]
- Littlefield, O. & Nelson, H. C.: A new use for the 'wing' of the 'winged' helix-turn-helix motif in the HSF-DNA cocrystal. Nat. Struct. Biol., 6, 464-470 (1999)[PubMed]
- VanDemark, A. P., Blanksma, M., Ferris, E. et al.: The structure of the yFACT Pob3-M domain, its interaction with the DNA replication factor RPA, and a potential role in nucleosome deposition. Mol. Cell, 22, 363-374 (2006)[PubMed]
- Nakamura, Y., Fujimoto, M., Hayashida, N. et al.: Silencing HSF1 by short hairpin RNA decreases cell proliferation and enhances sensitivity to hyperthermia in human melanoma cell line. J. Dermatol. Sci., 60, 187-192 (2010)[PubMed]
著者プロフィール
略歴:2000年 北海道大学大学院薬学研究科博士課程 修了,2001年 米国Emory大学 ポスドク,2002年 山口大学医学部 助手を経て,2005年より同 講師(現 大学院医学系研究科 講師).
研究テーマ:転写因子HSF1による転写制御機構.
抱負:HSF1による転写制御の全貌を明らかにし,がんや神経変性疾患に有効な薬の開発に貢献したい.
中井 彰(Akira Nakai)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds22.cc.yamaguchi-u.ac.jp/~seika2/
© 2012 藤本充章・中井 彰 Licensed under CC 表示 2.1 日本