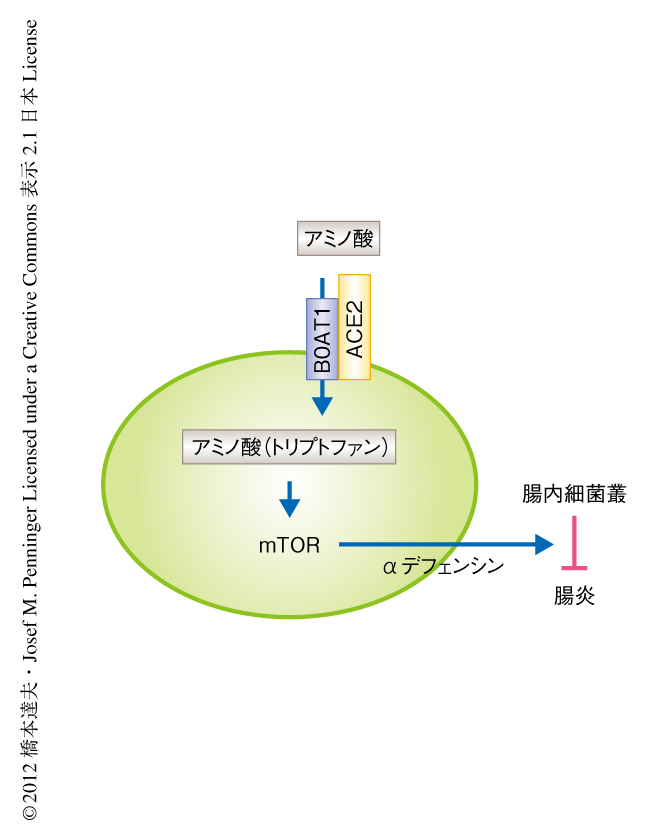
ACE2はアミノ酸の吸収を制御することにより腸内環境を維持し腸炎にならないようにしている
橋本達夫・Josef M. Penninger
(オーストリアInstitute of Molecular Biotechnology:IMBA)
email:橋本達夫
DOI: 10.7875/first.author.2012.112
ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation.
Tatsuo Hashimoto, Thomas Perlot, Ateequr Rehman, Jean Trichereau, Hiroaki Ishiguro, Magdalena Paolino, Verena Sigl, Toshikatsu Hanada, Reiko Hanada, Simone Lipinski, Birgit Wild, Simone M. R. Camargo, Dustin Singer, Andreas Richter, Keiji Kuba, Akiyoshi Fukamizu, Stefan Schreiber, Hans Clevers, Francois Verrey, Philip Rosenstiel, Josef M. Penninger
Nature, 487, 477-481 (2012)
栄養不良は世界では主要な死因であり,多くの場合,下痢や腸炎をともなう.これまで,かたよったアミノ酸の摂取が腸内環境にどのような影響をあたえているのか,よくわかっていなかった.一方,ACE2はおもに血圧や電解質を制御するレニン-アンジオテンシン系の一因子であり,これを負に制御している.今回,筆者らは,ACE2が小腸においてアミノ酸の吸収を制御しており,抗菌ペプチドの発現を維持することにより腸内環境を整え,腸炎にならないようにしていることを明らかにした.すなわち,ACE2ノックアウトマウスは実験的に腸炎をひき起こした際にその程度が重篤であり,この腸炎はトリプトファンあるいはニコチンアミドの投与により軽減した.ACE2ノックアウトマウスの小腸上皮ではmTORシグナルが減弱しており,αデフェンシンなど抗菌ペプチドの発現が極端に低下していた.この減少はトリプトファンあるいはニコチンアミドの投与により回復した.腸内細菌叢の解析を行ったところ,ACE2ノックアウトマウスの腸内細菌叢は野生型マウスのものとは異なっており,トリプトファンあるいはニコチンアミドの投与により野生型マウスに近いものとなることがわかった.さらに,無菌マウスを用いた解析では,ACE2ノックアウトマウスの腸内細菌叢を移植すると野生型マウスの腸内細菌叢を移植したときより重篤な腸炎を起こすことがわかった.この論文により,高血圧や慢性腎臓病の分野でなじみの深いレニン-アンジオテンシン系が,アミノ酸の吸収を制御し腸内環境を整えているという予想外の分子機構が明らかにされた.
100年以上もまえから研究されてきたレニン-アンジオテンシン系は,ACE(angiotensin-converting enzyme,アンジオテンシン変換酵素)により正に,そして,ACE2により負に制御されている1-3).ACE2にはアンジオテンシンを触媒しアンジオテンシンIIの作用を負に制御する作用のほか,最近になり,小腸上皮において中性アミノ酸輸送体の発現を制御する作用をもっていることが報告された4,5).しかし,その個体における機能は不明であった.
ACE2ノックアウトマウスにデキストラン硫酸ナトリウムの投与により実験的な腸炎を起こすと,野生型マウスと比べ体重の減少や下痢がひどく,組織においては炎症細胞の浸潤や陰窩障害が認められ,重篤な腸炎を呈していた.同様の所見は,2,4,6-トリニトロベンゼンスルホン酸の投与による実験的な腸炎でもみられた.この腸炎がACE2の触媒作用によるものかどうかを検討するため,ACE2ノックアウトマウスにACE2タンパク質を投与して腸炎の程度を比較したが,重篤な腸炎は軽減しなかった.さらに,1型アンジオテンシンII受容体とACE2とのダブルノックアウトマウスは,ACE2ノックアウトマウスと同じ程度の実験的な腸炎を呈した.このことから,ACE2の触媒作用ではない別の作用がこの腸炎を制御しているものと考えられた.どの組織のACE2がこの腸炎を制御しているのかを検討するため骨髄移植を行ったが,骨髄に由来する細胞が関与しているという結果は得られなかった.したがって,骨髄とは異なる組織のACE2がこの実験的な腸炎を制御しているものと考えられた.
ACE2ノックアウトマウスにおける中性アミノ酸の血中濃度は野生型マウスに比べ低く,とくに,トリプトファンの濃度は顕著に低下していた.ACE2は,ACEに相同性をもつ領域と,Collectrinと相同性をもつ領域から構成されるユニークなタンパク質である.Collectrinノックアウトマウスでは腎臓において中性アミノ酸輸送体が機能しなくなっており,アミノ酸の再吸収が行われない6).Collectrinは腎臓の尿細管において中性アミノ酸輸送体と結合しアミノ酸の再吸収を行っているのである.一方,小腸ではACE2が中性アミノ酸輸送体と結合している4).CollectrinノックアウトマウスもACE2ノックアウトマウスもトリプトファンの血中濃度は低いが,Collectrinノックアウトマウスでは実験的な腸炎は重篤にはならなかった.
そこで,小腸におけるアミノ酸の吸収がACE2ノックアウトマウスにおける実験的な腸炎増悪の分子機構であると考え,無タンパク食の負荷を行った.その結果,ACE2ノックアウトマウス,野生型マウスとも同じレベルの腸炎を呈し,また,摂食量に差はなかった.ACE2ノックアウトマウスにおいて血中濃度が顕著に低下しているトリプトファンをグリシンとのジペプチドのかたちで投与すると,トリプトファンの血中濃度が回復しただけでなく,実験的な腸炎も軽減していた.さらに,野生型マウスにおける無トリプトファン食の負荷により顕著な実験的な腸炎を認めた.これらのことから,ACE2の欠損による腸管の局所におけるトリプトファンの吸収障害が腸炎を発症しやすくしているものと考えられた.
実験的な腸炎を起こしたのちのACE2ノックアウトマウスにおける小腸上皮の増殖活性や細胞死の程度は,野生型マウスと同じ程度であった.しかしながら,ACE2ノックアウトマウスの小腸上皮ではαデフェンシンなどいくつかの抗菌ペプチドの発現が顕著に低下していた.さらに,無トリプトファン食の負荷を行った野生型マウスの小腸上皮でも同様に,抗菌ペプチドの発現が顕著に低下していた.一方,トリプトファンあるいはその代謝産物であるニコチンアミドを経口投与すると,抗菌ペプチドの発現はACE2ノックアウトマウスでも野生型マウスでも上昇した.これらの結果は,食餌に由来するトリプトファンが小腸上皮における抗菌ペプチドの発現を制御していることを示していた.
さらに,アミノ酸やニコチンアミドによる刺激の下流にあるmTORの活性がACE2ノックアウトマウスの小腸上皮では顕著に低下しており,これはトリプトファンの経口投与により回復した.野生型マウスのmTOR活性をラパマイシンの投与により阻害すると小腸上皮における抗菌ペプチドの発現は低下し,そののち起こした実験的な腸炎は増悪した.mTORの短期的な阻害はマウスの実験的な腸炎において抗炎症作用を呈したが7),炎症性の腸疾患を対象とした臨床試験ではmTOR阻害剤は必ずしもいい結果を残していない8).トリプトファンおよびニコチンアミドの投与はmTORの活性を増強することにより抗菌ペプチドの発現を増強し,腸炎を発症しにくくしているものと考えられた.
小腸におけるACE2によるトリプトファンの吸収は,大腸における腸炎にどのように影響しているのだろうか? すでに,小腸において分泌されたαデフェンシンは大腸にまで届き9),そこで腸内細菌叢を変化させることがわかっている10).そこで,ACE2ノックアウトマウスの腸内細菌叢に対し16S rRNA系統解析を行い,野生型マウスの腸内細菌叢と比較した.ACE2ノックアウトマウスの回腸の末端における腸内細菌叢は野生型マウスとは明らかに異なっており,系統樹の解析でも明らかに異なった分布を示していた.ラパマイシンを投与してmTORの活性を阻害した野生型マウスの腸内細菌叢も対照のマウスと比べ変化していた.重要なことは,トリプトファンあるいはその代謝産物であるニコチンアミドを経口投与したところ,ACE2ノックアウトマウスの腸内細菌叢は野生型マウスの腸内細菌叢に近い分布を示したことである.このことは,トリプトファンの均衡のくずれが腸内細菌叢を変化させうることを示していた.抗菌剤の投与により腸内細菌叢をくずしたあとでは,ACE2ノックアウトマウスと野生型マウスとで実験的な腸炎の程度に違いを認めなかった.さらに,ACE2ノックアウトマウスあるいは野生型マウスの腸内細菌叢を移植した無菌マウスでは,ACE2ノックアウトマウスの腸内細菌叢を移植した無菌マウスにおいて実験的な腸炎の程度は重篤であった.
以上の結果から,栄養不良やトリプトファンの欠乏により下痢や腸炎の起こる分子機構はつぎのように考えられた(図1).トリプトファンは小腸上皮において,ACE2と結合したB0AT1などの中性アミノ酸輸送体により吸収される.その結果,mTORが活性化され,αデフェンシンなど抗菌ペプチドの発現が増強し,腸内細菌叢が影響をうける.変化した腸内細菌叢は腸炎の程度を左右する.ここで重要なのは,必須アミノ酸であるトリプトファンとその代謝産物であるニコチンアミドが腸内細菌叢や腸炎の程度を制御していることである.世界では10億人にのぼる人々が栄養不良であり,そこから生じる腸炎や下痢はしばしば死をまねく.くわえて,悪液質,神経性食思不振症,アミノ酸吸収障害など,腸管における慢性的な炎症状態が臨床において問題となっている.この論文は,タンパク質の不足が腸炎や下痢をひき起こすまったく予想外の分子機構を証明した.それは,血圧や酸化ストレスを制御しているレニン-アンジオテンシン系とアミノ酸代謝とのクロストークと,アミノ酸代謝と自然免疫との直接的なリンクであった.
略歴:2003年 横浜市立大学大学院医学研究科 修了,同年 横浜市立大学医学部 助手,2008年 オーストリアInstitute of Molecular Biotechnology(IMBA)ポスドクを経て,2011年より横浜市立大学医学部 助教.
研究テーマ:レニン-アンジオテンシン系の病態生理学的解析,慢性腎臓病の栄養療法,腎臓の再生.
抱負:ワクワクをかたちに.
Josef M. Penninger
オーストリアInstitute of Molecular Biotechnology(IMBA)所長.
研究室URL:http://www.imba.oeaw.ac.at/research/josef-penninger/
© 2012 橋本達夫・Josef M. Penninger Licensed under CC 表示 2.1 日本
(オーストリアInstitute of Molecular Biotechnology:IMBA)
email:橋本達夫
DOI: 10.7875/first.author.2012.112
ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation.
Tatsuo Hashimoto, Thomas Perlot, Ateequr Rehman, Jean Trichereau, Hiroaki Ishiguro, Magdalena Paolino, Verena Sigl, Toshikatsu Hanada, Reiko Hanada, Simone Lipinski, Birgit Wild, Simone M. R. Camargo, Dustin Singer, Andreas Richter, Keiji Kuba, Akiyoshi Fukamizu, Stefan Schreiber, Hans Clevers, Francois Verrey, Philip Rosenstiel, Josef M. Penninger
Nature, 487, 477-481 (2012)
要 約
栄養不良は世界では主要な死因であり,多くの場合,下痢や腸炎をともなう.これまで,かたよったアミノ酸の摂取が腸内環境にどのような影響をあたえているのか,よくわかっていなかった.一方,ACE2はおもに血圧や電解質を制御するレニン-アンジオテンシン系の一因子であり,これを負に制御している.今回,筆者らは,ACE2が小腸においてアミノ酸の吸収を制御しており,抗菌ペプチドの発現を維持することにより腸内環境を整え,腸炎にならないようにしていることを明らかにした.すなわち,ACE2ノックアウトマウスは実験的に腸炎をひき起こした際にその程度が重篤であり,この腸炎はトリプトファンあるいはニコチンアミドの投与により軽減した.ACE2ノックアウトマウスの小腸上皮ではmTORシグナルが減弱しており,αデフェンシンなど抗菌ペプチドの発現が極端に低下していた.この減少はトリプトファンあるいはニコチンアミドの投与により回復した.腸内細菌叢の解析を行ったところ,ACE2ノックアウトマウスの腸内細菌叢は野生型マウスのものとは異なっており,トリプトファンあるいはニコチンアミドの投与により野生型マウスに近いものとなることがわかった.さらに,無菌マウスを用いた解析では,ACE2ノックアウトマウスの腸内細菌叢を移植すると野生型マウスの腸内細菌叢を移植したときより重篤な腸炎を起こすことがわかった.この論文により,高血圧や慢性腎臓病の分野でなじみの深いレニン-アンジオテンシン系が,アミノ酸の吸収を制御し腸内環境を整えているという予想外の分子機構が明らかにされた.
はじめに
100年以上もまえから研究されてきたレニン-アンジオテンシン系は,ACE(angiotensin-converting enzyme,アンジオテンシン変換酵素)により正に,そして,ACE2により負に制御されている1-3).ACE2にはアンジオテンシンを触媒しアンジオテンシンIIの作用を負に制御する作用のほか,最近になり,小腸上皮において中性アミノ酸輸送体の発現を制御する作用をもっていることが報告された4,5).しかし,その個体における機能は不明であった.
1.ACE2を欠損すると実験的な腸炎は重篤になる
ACE2ノックアウトマウスにデキストラン硫酸ナトリウムの投与により実験的な腸炎を起こすと,野生型マウスと比べ体重の減少や下痢がひどく,組織においては炎症細胞の浸潤や陰窩障害が認められ,重篤な腸炎を呈していた.同様の所見は,2,4,6-トリニトロベンゼンスルホン酸の投与による実験的な腸炎でもみられた.この腸炎がACE2の触媒作用によるものかどうかを検討するため,ACE2ノックアウトマウスにACE2タンパク質を投与して腸炎の程度を比較したが,重篤な腸炎は軽減しなかった.さらに,1型アンジオテンシンII受容体とACE2とのダブルノックアウトマウスは,ACE2ノックアウトマウスと同じ程度の実験的な腸炎を呈した.このことから,ACE2の触媒作用ではない別の作用がこの腸炎を制御しているものと考えられた.どの組織のACE2がこの腸炎を制御しているのかを検討するため骨髄移植を行ったが,骨髄に由来する細胞が関与しているという結果は得られなかった.したがって,骨髄とは異なる組織のACE2がこの実験的な腸炎を制御しているものと考えられた.
2.腸管におけるACE2によるアミノ酸の吸収が腸炎の分子機構である
ACE2ノックアウトマウスにおける中性アミノ酸の血中濃度は野生型マウスに比べ低く,とくに,トリプトファンの濃度は顕著に低下していた.ACE2は,ACEに相同性をもつ領域と,Collectrinと相同性をもつ領域から構成されるユニークなタンパク質である.Collectrinノックアウトマウスでは腎臓において中性アミノ酸輸送体が機能しなくなっており,アミノ酸の再吸収が行われない6).Collectrinは腎臓の尿細管において中性アミノ酸輸送体と結合しアミノ酸の再吸収を行っているのである.一方,小腸ではACE2が中性アミノ酸輸送体と結合している4).CollectrinノックアウトマウスもACE2ノックアウトマウスもトリプトファンの血中濃度は低いが,Collectrinノックアウトマウスでは実験的な腸炎は重篤にはならなかった.
そこで,小腸におけるアミノ酸の吸収がACE2ノックアウトマウスにおける実験的な腸炎増悪の分子機構であると考え,無タンパク食の負荷を行った.その結果,ACE2ノックアウトマウス,野生型マウスとも同じレベルの腸炎を呈し,また,摂食量に差はなかった.ACE2ノックアウトマウスにおいて血中濃度が顕著に低下しているトリプトファンをグリシンとのジペプチドのかたちで投与すると,トリプトファンの血中濃度が回復しただけでなく,実験的な腸炎も軽減していた.さらに,野生型マウスにおける無トリプトファン食の負荷により顕著な実験的な腸炎を認めた.これらのことから,ACE2の欠損による腸管の局所におけるトリプトファンの吸収障害が腸炎を発症しやすくしているものと考えられた.
実験的な腸炎を起こしたのちのACE2ノックアウトマウスにおける小腸上皮の増殖活性や細胞死の程度は,野生型マウスと同じ程度であった.しかしながら,ACE2ノックアウトマウスの小腸上皮ではαデフェンシンなどいくつかの抗菌ペプチドの発現が顕著に低下していた.さらに,無トリプトファン食の負荷を行った野生型マウスの小腸上皮でも同様に,抗菌ペプチドの発現が顕著に低下していた.一方,トリプトファンあるいはその代謝産物であるニコチンアミドを経口投与すると,抗菌ペプチドの発現はACE2ノックアウトマウスでも野生型マウスでも上昇した.これらの結果は,食餌に由来するトリプトファンが小腸上皮における抗菌ペプチドの発現を制御していることを示していた.
さらに,アミノ酸やニコチンアミドによる刺激の下流にあるmTORの活性がACE2ノックアウトマウスの小腸上皮では顕著に低下しており,これはトリプトファンの経口投与により回復した.野生型マウスのmTOR活性をラパマイシンの投与により阻害すると小腸上皮における抗菌ペプチドの発現は低下し,そののち起こした実験的な腸炎は増悪した.mTORの短期的な阻害はマウスの実験的な腸炎において抗炎症作用を呈したが7),炎症性の腸疾患を対象とした臨床試験ではmTOR阻害剤は必ずしもいい結果を残していない8).トリプトファンおよびニコチンアミドの投与はmTORの活性を増強することにより抗菌ペプチドの発現を増強し,腸炎を発症しにくくしているものと考えられた.
3.ACE2の欠損により腸内細菌叢は変化しそれにより腸炎の程度が決定される
小腸におけるACE2によるトリプトファンの吸収は,大腸における腸炎にどのように影響しているのだろうか? すでに,小腸において分泌されたαデフェンシンは大腸にまで届き9),そこで腸内細菌叢を変化させることがわかっている10).そこで,ACE2ノックアウトマウスの腸内細菌叢に対し16S rRNA系統解析を行い,野生型マウスの腸内細菌叢と比較した.ACE2ノックアウトマウスの回腸の末端における腸内細菌叢は野生型マウスとは明らかに異なっており,系統樹の解析でも明らかに異なった分布を示していた.ラパマイシンを投与してmTORの活性を阻害した野生型マウスの腸内細菌叢も対照のマウスと比べ変化していた.重要なことは,トリプトファンあるいはその代謝産物であるニコチンアミドを経口投与したところ,ACE2ノックアウトマウスの腸内細菌叢は野生型マウスの腸内細菌叢に近い分布を示したことである.このことは,トリプトファンの均衡のくずれが腸内細菌叢を変化させうることを示していた.抗菌剤の投与により腸内細菌叢をくずしたあとでは,ACE2ノックアウトマウスと野生型マウスとで実験的な腸炎の程度に違いを認めなかった.さらに,ACE2ノックアウトマウスあるいは野生型マウスの腸内細菌叢を移植した無菌マウスでは,ACE2ノックアウトマウスの腸内細菌叢を移植した無菌マウスにおいて実験的な腸炎の程度は重篤であった.
おわりに
以上の結果から,栄養不良やトリプトファンの欠乏により下痢や腸炎の起こる分子機構はつぎのように考えられた(図1).トリプトファンは小腸上皮において,ACE2と結合したB0AT1などの中性アミノ酸輸送体により吸収される.その結果,mTORが活性化され,αデフェンシンなど抗菌ペプチドの発現が増強し,腸内細菌叢が影響をうける.変化した腸内細菌叢は腸炎の程度を左右する.ここで重要なのは,必須アミノ酸であるトリプトファンとその代謝産物であるニコチンアミドが腸内細菌叢や腸炎の程度を制御していることである.世界では10億人にのぼる人々が栄養不良であり,そこから生じる腸炎や下痢はしばしば死をまねく.くわえて,悪液質,神経性食思不振症,アミノ酸吸収障害など,腸管における慢性的な炎症状態が臨床において問題となっている.この論文は,タンパク質の不足が腸炎や下痢をひき起こすまったく予想外の分子機構を証明した.それは,血圧や酸化ストレスを制御しているレニン-アンジオテンシン系とアミノ酸代謝とのクロストークと,アミノ酸代謝と自然免疫との直接的なリンクであった.
文 献
- Crackower, M. A., Sarao, R., Oudit, G. Y. et al.: Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature, 417, 822-828 (2002)[PubMed]
- Imai, Y., Kuba, K., Rao, S. et al.: Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature, 436, 112-116 (2005)[PubMed]
- Kuba, K., Imai, Y., Rao, S. et al.: A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat. Med., 11, 875-879 (2005)[PubMed]
- Camargo, S. M., Singer, D., Makrides, V. et al.: Tissue-specific amino acid transporter partners ACE2 and collectrin differentially interact with hartnup mutations. Gastroenterology, 136, 872-882 (2009)[PubMed]
- Kowalczuk, S., Broer, A., Tietze, N. et al.: A protein complex in the brush-border membrane explains a Hartnup disorder allele. FASEB J., 22, 2880-2887 (2008)[PubMed]
- Danilczyk, U., Sarao, R., Remy, C. et al.: Essential role for collectrin in renal amino acid transport. Nature, 444, 1088-1091 (2006)[PubMed]
- Farkas, S., Hornung, M., Sattler, C. et al.: Rapamycin decreases leukocyte migration in vivo and effectively reduces experimentally induced chronic colitis. Int. J. Colorectal Dis., 21, 747-753 (2006)[PubMed]
- Reinisch, W., Panes, J., Lemann, M. et al.: A multicenter, randomized, double-blind trial of everolimus versus azathioprine and placebo to maintain steroid-induced remission in patients with moderate-to-severe active Crohn’s disease. Am. J. Gastroenterol., 103, 2284-2292 (2008)[PubMed]
- Mastroianni, J. R. & Ouellette, A. J.: α-defensins in enteric innate immunity: functional Paneth cell α-defensins inmouse colonic lumen. J. Biol. Chem., 284, 27848-27856 (2009)[PubMed]
- Salzman, N. H., Hung, K., Haribhai, D. et al.: Enteric defensins are essential regulators of intestinal microbial ecology. Nat. Immunol., 11, 76-83 (2010)[PubMed]
著者プロフィール
略歴:2003年 横浜市立大学大学院医学研究科 修了,同年 横浜市立大学医学部 助手,2008年 オーストリアInstitute of Molecular Biotechnology(IMBA)ポスドクを経て,2011年より横浜市立大学医学部 助教.
研究テーマ:レニン-アンジオテンシン系の病態生理学的解析,慢性腎臓病の栄養療法,腎臓の再生.
抱負:ワクワクをかたちに.
Josef M. Penninger
オーストリアInstitute of Molecular Biotechnology(IMBA)所長.
研究室URL:http://www.imba.oeaw.ac.at/research/josef-penninger/
© 2012 橋本達夫・Josef M. Penninger Licensed under CC 表示 2.1 日本