非古典的Wntシグナル経路はニッチェにおいて造血幹細胞の維持にはたらく
杉村 竜一
(米国Stowers Institute for Medical Research)
email:杉村竜一
DOI: 10.7875/first.author.2012.105
Noncanonical Wnt signaling maintains hematopoietic stem cells in the niche.
Ryohichi Sugimura, Xi C. He, Aparna Venkatraman, Fumio Arai, Andrew Box, Craig Semerad, Jeffrey S. Haug, Lai Peng, Xiao-bo Zhong, Toshio Suda, Linheng Li
Cell, 150, 351-365 (2012)
血液をつくる造血幹細胞は,幹細胞を理解するためのモデルとしてだけでなく,臨床への応用やがんの理解および治療をめざすうえでも重要な研究対象である.近年の研究により造血幹細胞の存在する場所や制御の分子機構はしだいに明らかになってきたが,造血幹細胞の分化の階層性や骨髄における挙動など,研究の進歩にともない一筋縄ではいかない複雑な側面も明らかになってきた.筆者らは,Wntシグナル伝達系に注目することにより,非古典的Wntシグナル経路が造血幹細胞の維持にはたらくこと,さらに,造血幹細胞の活性化において非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えが起こることを示した.このことは,造血幹細胞の複雑な挙動を理解するには,そこで起こっているイベントをリアルタイムで観察することが重要であることを示唆した.将来的には,各種のシグナル伝達系のダイナミックな制御を追究することにより,造血幹細胞あるいはほかの幹細胞のさらなる理解および応用につながることが期待される.
ヒトの骨髄において造血幹細胞は1日あたり数千億個のペースで血液細胞を産生している.生涯にわたり血液細胞を供給するため,造血幹細胞の維持と活性化にともなう増殖および分化のバランスは非常に重要である.このバランスの制御は骨髄においてニッチェとよばれる微小環境でなされている.ニッチェのコンセプトは1978年に提唱されたが,実際の証明はそののち20年間もなされないままであった.筆者らの研究室とほかの研究室は,独立して,造血幹細胞は骨内膜ニッチェに存在していることを報告した1,2).さらに筆者らは,免疫染色法や生細胞イメージング法を用いて,造血幹細胞は骨内膜ニッチェにおいてN-カドヘリン陽性の骨芽細胞と接し静止期にとどめられていることを発見した3).造血幹細胞はストレスなどにより活性化されると血管周囲ニッチェへと移動して自己複製する(図1).しかし,静止期の造血幹細胞が骨内膜ニッチェにおいて維持され,必要に応じ活性化される機構はながらくの疑問であった.
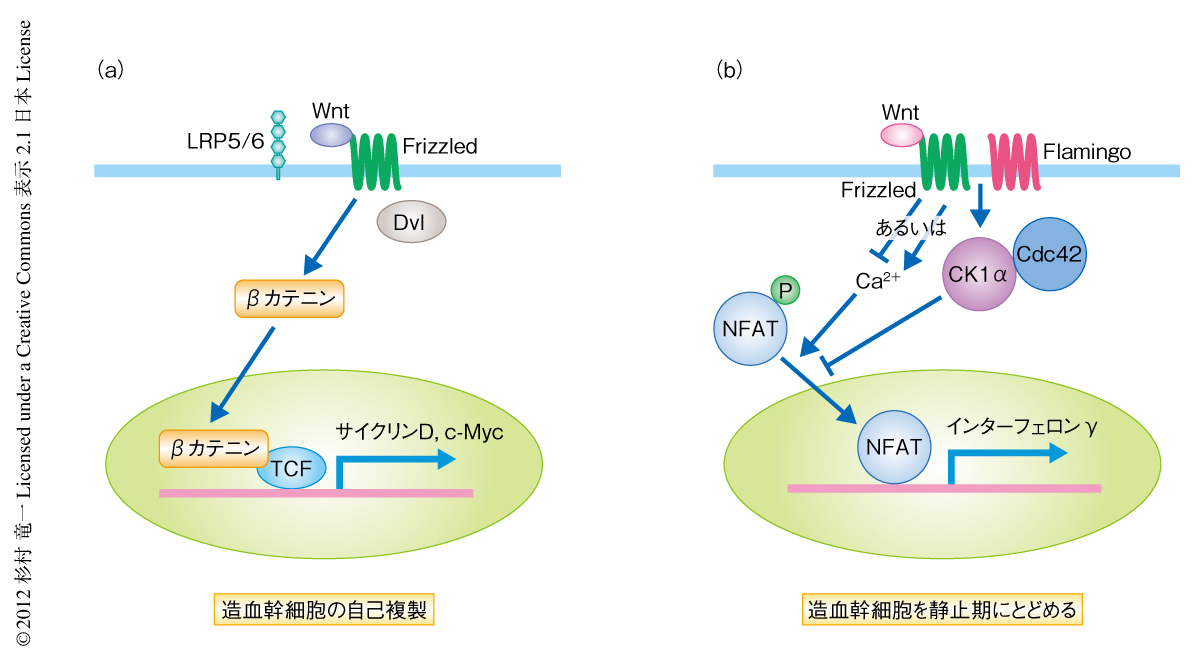
近年,静止期にある幹細胞と活性化された幹細胞とは異なるニッチェに存在し,それぞれのニッチェにおいてシグナル伝達系のバランスにより制御されているというモデルが提唱された.そのようなシグナル伝達系のひとつにWntシグナル伝達系があげられる.Wntシグナル伝達経路は古典的(canonical)経路と非古典的(non-canonical)経路とに分類される.古典的Wntシグナル経路はβカテニンを介して核においてTCF-LEF複合体とともに遺伝子の転写制御を行い,造血幹細胞の自己複製を制御する.非古典的Wntシグナル経路は細胞の極性,細胞内Ca2+濃度,転写因子NFATの核への移行を制御する.培養系においては,非古典的Wntシグナル経路は古典的Wntシグナル経路を阻害することによりマウスやヒトにて造血幹細胞の維持にはたらくと示唆されているが,生体における機能は不明であった4)(図2).また,造血幹細胞における古典的Wntシグナル経路と非古典的Wntシグナル経路とのクロストークが生体において生じているのかどうかも明らかでなかった.筆者らは,ノックアウトマウス,RNA塩基配列決定法や3次元イメージング法を用いて,非古典的Wntシグナル経路が造血幹細胞を静止状態にとどめ,造血幹細胞の活性化においては非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えの起こることを明らかにした.
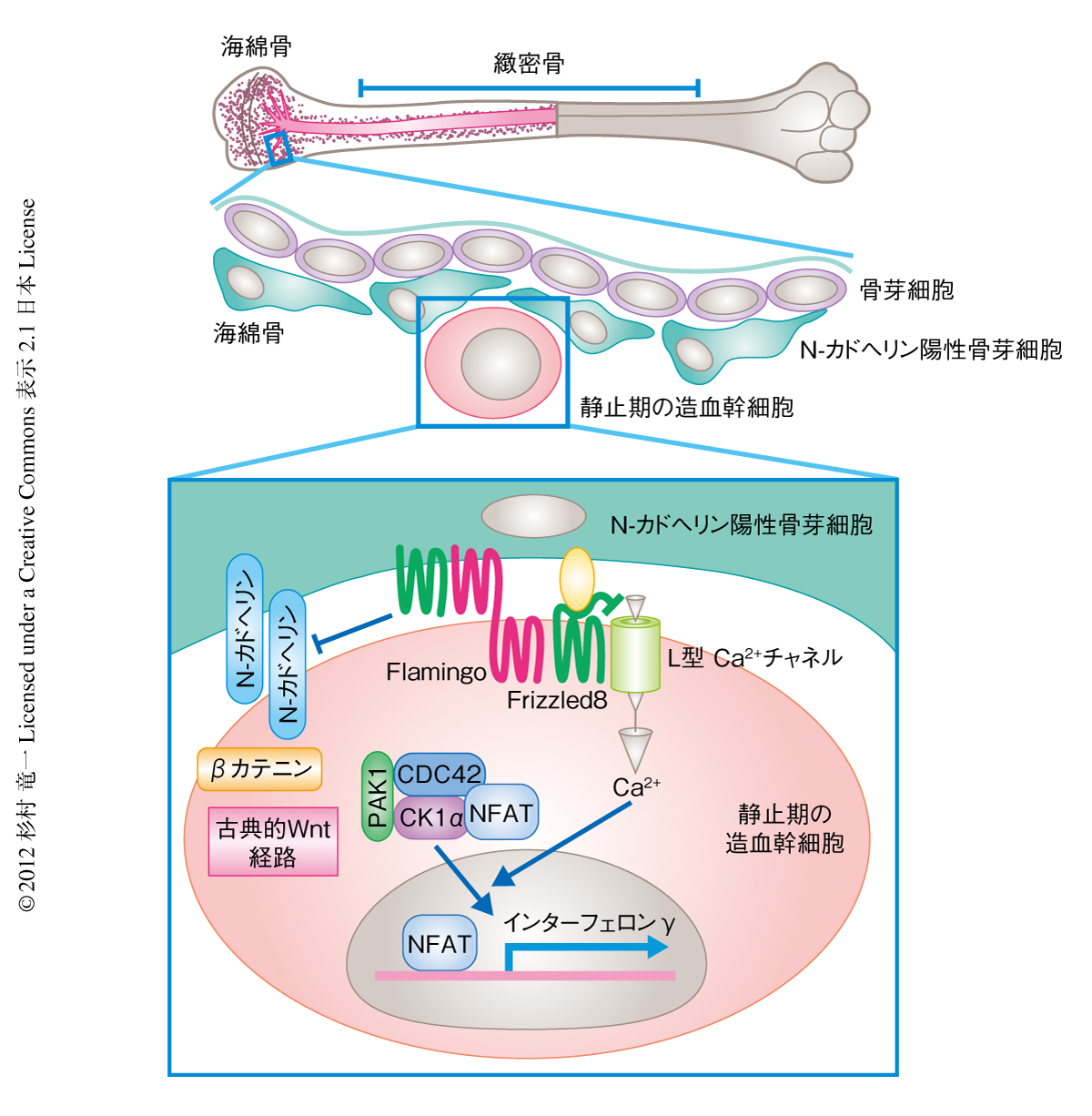
非古典的Wntシグナル経路の受容体であるFlamingoとFrizzled8は,静止期の造血幹細胞に発現していることに注目した5).体性幹細胞はニッチェにおいて細胞周期G0期に維持されており,ストレスに応じて活性化される.このように静止期にある体性幹細胞は,ローダミンの排出能が弱陽性となることや,GFPにより標識したヒストンH2Bを長期間にわたり保持することにより検出できる.そして,GFP標識ヒストンH2Bの長期の保持能をもつ静止期の造血幹細胞においては,FlamingoとFrizzled8が発現していることが確認された.既知のニッチェである血管内皮細胞やネスチン陽性の間葉系幹細胞は骨髄のいたるところにみられたのに対し,N-カドヘリン陽性の骨芽細胞および静止期の造血幹細胞は海綿骨に限局してみられた.さらに,3次元イメージング法により,FlamingoとFrizzled8は静止期の造血幹細胞とN-カドヘリン陽性の骨芽細胞との接着面に局在していることが観察された.このことは,N-カドヘリン陽性の骨芽細胞が静止期の造血幹細胞のニッチェであるとするこれまでの報告と一致しており6),また,FlamingoとFrizzled8は静止期の造血幹細胞においてなんらかの機能をもつことが示唆された.
Flamingoがそのカドヘリンドメインにより静止期の造血幹細胞とN-カドヘリン陽性の骨芽細胞とを接着し,Frizzled8をその接着面へとリクルートすることが観察された.FlamingoノックアウトマウスではFrizzled8のリクルートは阻害されていた.逆に,Frizzled8ノックアウトマウスではFlamingoの局在は変化していなかった.このことから,静止期の造血幹細胞においてFlamingoはFrizzled8をN-カドヘリン陽性の骨芽細胞と向かい合った面に局在させることにより,N-カドヘリン陽性の骨芽細胞から放出されるWntリガンドを受容するのを助けているものと考えられた.
造血幹細胞のニッチェから放出されるWntリガンドを網羅的に解析するため,RNA塩基配列決定法を用いた.単離された血管内皮細胞,間葉系幹細胞,成熟した骨芽細胞,N-カドヘリン陽性の骨芽細胞から,それぞれRNAを抽出しcDNAライブラリーを作製したのち,次世代シークエンサーにてWntリガンドの遺伝子の発現解析を行った.その結果,古典的Wntシグナル経路のリガンドの発現はこれらのニッチェにおいて非常に低かった.くわえて,N-カドヘリン陽性の骨芽細胞は非古典的Wntシグナル経路のリガンド,Wnt4,Wnt5a,Wnt5b,Wnt6,Wnt11,Wnt16を発現しており,古典的Wntシグナル経路はDkkやSfrpなどの阻害タンパク質の発現により抑制されていることを発見した.
5-フルオロウラシルは分裂期の細胞を死滅させることにより静止期の造血幹細胞を活性化させることから,造血幹細胞へのストレスのモデルとして使用されている.造血幹細胞を活性化させるためこの5-フルオロウラシルを投与すると,N-カドヘリン陽性の骨芽細胞は非古典的Wntシグナル経路のリガンドや阻害タンパク質を発現せずに古典的シグナル経路のWntリガンドであるWnt7bを高発現するようになり,非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えがみられた.このことから,ニッチェにおいて,古典的Wntシグナル経路と非古典的Wntシグナル経路とを,恒常状態あるいはストレス状態と状況に応じ使い分けていることが明らかになった.さらに,ニッチェにおけるWntシグナル経路の切替えに応じ,造血幹細胞においても古典的Wntシグナル経路の指標となるβカテニン活性の上昇がみられ,Wntシグナル経路の切替えと造血幹細胞の活性化との相関が示唆された.
非古典的Wntシグナル経路の生体における機能を明らかにするため,FlamingoノックアウトマウスおよびFrizzled8ノックアウトマウスを作製したところ,これらのノックアウトマウスは造血幹細胞,ひきつづいて,造血前駆細胞の減少を示した.造血幹細胞の機能を調べるため,単離した造血幹細胞の移植による長期造血能のアッセイを行ったところ,その低下がみられた.また,これらのノックアウトマウスの造血幹細胞ではGFP標識ヒストンH2Bの長期の保持能はほとんど消失しており,残存していたヒストンH2Bの長期保持能をもつ造血幹細胞は,骨内膜ニッチェに存在するN-カドヘリン陽性の骨芽細胞から離れた場所にあった.さらに,これらGFP標識ヒストンH2Bの長期の保持能をもつ造血幹細胞においては,GFPの蛍光強度が低下していた.これらのことから,FlamingoとFrizzled8は造血幹細胞を静止期にとどめるはたらきをもつものと示唆された.
つぎに,FlamingoとFrizzled8を介した非古典的Wntシグナル経路の細胞におけるシグナル伝達経路を明らかにするため,Ca2+-NFAT経路に注目した.Frizzled8をノックアウトすると造血幹細胞におけるCa2+濃度が上昇した.Frizzled8は造血幹細胞に発現するL型Ca2+チャネルと共局在していたことから,Frizzled8はGタンパク質共役受容体としてL型Ca2+チャネルを遮断しているものと考えられた.このことから,周囲と比べCa2+濃度が40倍も高い骨内膜にある造血幹細胞は,非古典的Wntシグナル経路により細胞毒となるCa2+濃度を低く抑えているものと考えられた.Ca2+-NFAT経路においてCa2+の下流にあると考えられているCdc42-CK1α複合体も,Frizzled8ノックアウトマウスでは細胞質から核に局在するようになった.野生型マウスの静止期の造血幹細胞においてNFATはCdc42-CK1α複合体とともに細胞質に局在しており,FlamingoとFrizzled8をそれぞれshRNAによりノックダウンするとNFATの核への移行がみられた.さらに,FlamingoとFrizzled8を欠損した造血幹細胞ではNFATの下流の標的であるインターフェロンγの発現上昇がみられた.インターフェロンγは造血幹細胞を活性化させることが知られている.よって,非古典的Wntシグナル経路はNFATの核への移行を阻害することにより造血幹細胞を静止期にとどめていると考えられた.また,βカテニンを介した古典的Wntシグナル経路が非古典的Wntシグナル経路により抑制されることも示された.このことから,非古典的Wntシグナル経路と古典的Wntシグナル経路のバランスにより造血幹細胞の活性が制御されていることが示唆された(図3).
今回の報告は,非古典的Wntシグナル経路が海綿骨の骨内膜ニッチェにおいて造血幹細胞を静止期にとどめるはたらきをもつことを明らかにした.さらには,古典的Wntシグナル経路と非古典的Wntシグナル経路とのバランスが幹細胞を制御するという新たなコンセプトを提示した.造血幹細胞における古典的Wntシグナル経路の機能についてはまだ議論があり,これからも研究の余地はある.たとえば,βカテニンおよびγカテニンをノックアウトしたマウスは,造血幹細胞の恒常的な状態や移植ののちの造血機能に影響はみられなかった7).しかし,このノックアウトマウスでは古典的Wntシグナル経路の構成タンパク質であるTCF1をノックアウトしたマウスと異なり,T細胞の発生に影響のなかったこと,さらに,培養条件においてGSK3の阻害剤とPtenの欠損(あるいは,SCFによるAkt経路の活性化)との組合せにより造血幹細胞を増殖できることから8),GSK3の下流においてβカテニン(や,γカテニン)をバイパスするようなシグナル伝達経路の存在や,ほかのシグナル伝達経路とのクロストークの重要性が考えられる.
従来の古典的Wntシグナル経路にくわえ,非古典的Wntシグナル経路も含めたダイナミックな造血幹細胞の制御の存在することは,ニッチェにおいて幹細胞が複雑な機構により制御されていることを示唆している.しかし,幹細胞の静止状態あるいは活性化をつかさどるニッチェが骨髄において別々の領域に存在するという可能性を考えると,Wntシグナル経路の使い分けは非常に理にかなっていると考えられる.また,いったん活性化された造血幹細胞がどれくらいの頻度あるいは程度で静止期にもどるのか,そこでもWntシグナル経路の切替えが起こっているのかどうかは興味深い.くわえて,近年,報告されたCAR細胞やシュワン細胞などさまざまなニッチェ細胞や9,10),シグナル伝達系の研究の進展もあわせて,造血幹細胞の制御への理解は大きく進歩している.培養した造血幹細胞の移植への応用やがん幹細胞への理解を深めるためにも,この分野の今後の研究が期待される.
シグナルの出所であるニッチェ細胞や幹細胞における,下流の経路を含めたシグナル伝達系のダイナミクスをリアルタイムに追究することで,複雑な幹細胞の挙動や分化の階層性にクリアな説明をあたえられるものと期待する.また,造血幹細胞や骨髄ニッチェの局所的な関連を全体的に制御するような全身性のシグナル伝達系の存在,すなわち,ほかの臓器との関連も考えられる.これらのコンセプトは皮膚や神経,腸などほかの幹細胞についても応用できる可能性があり,今後の研究が待たれる.
略歴:米国Stowers Institute for Medical Researchにて博士課程 在学中.
研究テーマ:シグナル伝達系による幹細胞の制御のダイナミクス.
抱負:全身の幹細胞と組織との相互作用を追究することで,幹細胞が統一して制御されている機構を解明したい.
© 2012 杉村 竜一 Licensed under CC 表示 2.1 日本
(米国Stowers Institute for Medical Research)
email:杉村竜一
DOI: 10.7875/first.author.2012.105
Noncanonical Wnt signaling maintains hematopoietic stem cells in the niche.
Ryohichi Sugimura, Xi C. He, Aparna Venkatraman, Fumio Arai, Andrew Box, Craig Semerad, Jeffrey S. Haug, Lai Peng, Xiao-bo Zhong, Toshio Suda, Linheng Li
Cell, 150, 351-365 (2012)
要 約
血液をつくる造血幹細胞は,幹細胞を理解するためのモデルとしてだけでなく,臨床への応用やがんの理解および治療をめざすうえでも重要な研究対象である.近年の研究により造血幹細胞の存在する場所や制御の分子機構はしだいに明らかになってきたが,造血幹細胞の分化の階層性や骨髄における挙動など,研究の進歩にともない一筋縄ではいかない複雑な側面も明らかになってきた.筆者らは,Wntシグナル伝達系に注目することにより,非古典的Wntシグナル経路が造血幹細胞の維持にはたらくこと,さらに,造血幹細胞の活性化において非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えが起こることを示した.このことは,造血幹細胞の複雑な挙動を理解するには,そこで起こっているイベントをリアルタイムで観察することが重要であることを示唆した.将来的には,各種のシグナル伝達系のダイナミックな制御を追究することにより,造血幹細胞あるいはほかの幹細胞のさらなる理解および応用につながることが期待される.
はじめに
ヒトの骨髄において造血幹細胞は1日あたり数千億個のペースで血液細胞を産生している.生涯にわたり血液細胞を供給するため,造血幹細胞の維持と活性化にともなう増殖および分化のバランスは非常に重要である.このバランスの制御は骨髄においてニッチェとよばれる微小環境でなされている.ニッチェのコンセプトは1978年に提唱されたが,実際の証明はそののち20年間もなされないままであった.筆者らの研究室とほかの研究室は,独立して,造血幹細胞は骨内膜ニッチェに存在していることを報告した1,2).さらに筆者らは,免疫染色法や生細胞イメージング法を用いて,造血幹細胞は骨内膜ニッチェにおいてN-カドヘリン陽性の骨芽細胞と接し静止期にとどめられていることを発見した3).造血幹細胞はストレスなどにより活性化されると血管周囲ニッチェへと移動して自己複製する(図1).しかし,静止期の造血幹細胞が骨内膜ニッチェにおいて維持され,必要に応じ活性化される機構はながらくの疑問であった.
近年,静止期にある幹細胞と活性化された幹細胞とは異なるニッチェに存在し,それぞれのニッチェにおいてシグナル伝達系のバランスにより制御されているというモデルが提唱された.そのようなシグナル伝達系のひとつにWntシグナル伝達系があげられる.Wntシグナル伝達経路は古典的(canonical)経路と非古典的(non-canonical)経路とに分類される.古典的Wntシグナル経路はβカテニンを介して核においてTCF-LEF複合体とともに遺伝子の転写制御を行い,造血幹細胞の自己複製を制御する.非古典的Wntシグナル経路は細胞の極性,細胞内Ca2+濃度,転写因子NFATの核への移行を制御する.培養系においては,非古典的Wntシグナル経路は古典的Wntシグナル経路を阻害することによりマウスやヒトにて造血幹細胞の維持にはたらくと示唆されているが,生体における機能は不明であった4)(図2).また,造血幹細胞における古典的Wntシグナル経路と非古典的Wntシグナル経路とのクロストークが生体において生じているのかどうかも明らかでなかった.筆者らは,ノックアウトマウス,RNA塩基配列決定法や3次元イメージング法を用いて,非古典的Wntシグナル経路が造血幹細胞を静止状態にとどめ,造血幹細胞の活性化においては非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えの起こることを明らかにした.
1.非古典的Wntシグナル経路の受容体は静止期の造血幹細胞に発現している
非古典的Wntシグナル経路の受容体であるFlamingoとFrizzled8は,静止期の造血幹細胞に発現していることに注目した5).体性幹細胞はニッチェにおいて細胞周期G0期に維持されており,ストレスに応じて活性化される.このように静止期にある体性幹細胞は,ローダミンの排出能が弱陽性となることや,GFPにより標識したヒストンH2Bを長期間にわたり保持することにより検出できる.そして,GFP標識ヒストンH2Bの長期の保持能をもつ静止期の造血幹細胞においては,FlamingoとFrizzled8が発現していることが確認された.既知のニッチェである血管内皮細胞やネスチン陽性の間葉系幹細胞は骨髄のいたるところにみられたのに対し,N-カドヘリン陽性の骨芽細胞および静止期の造血幹細胞は海綿骨に限局してみられた.さらに,3次元イメージング法により,FlamingoとFrizzled8は静止期の造血幹細胞とN-カドヘリン陽性の骨芽細胞との接着面に局在していることが観察された.このことは,N-カドヘリン陽性の骨芽細胞が静止期の造血幹細胞のニッチェであるとするこれまでの報告と一致しており6),また,FlamingoとFrizzled8は静止期の造血幹細胞においてなんらかの機能をもつことが示唆された.
Flamingoがそのカドヘリンドメインにより静止期の造血幹細胞とN-カドヘリン陽性の骨芽細胞とを接着し,Frizzled8をその接着面へとリクルートすることが観察された.FlamingoノックアウトマウスではFrizzled8のリクルートは阻害されていた.逆に,Frizzled8ノックアウトマウスではFlamingoの局在は変化していなかった.このことから,静止期の造血幹細胞においてFlamingoはFrizzled8をN-カドヘリン陽性の骨芽細胞と向かい合った面に局在させることにより,N-カドヘリン陽性の骨芽細胞から放出されるWntリガンドを受容するのを助けているものと考えられた.
2.Wntシグナル経路の切替えが造血幹細胞を制御している
造血幹細胞のニッチェから放出されるWntリガンドを網羅的に解析するため,RNA塩基配列決定法を用いた.単離された血管内皮細胞,間葉系幹細胞,成熟した骨芽細胞,N-カドヘリン陽性の骨芽細胞から,それぞれRNAを抽出しcDNAライブラリーを作製したのち,次世代シークエンサーにてWntリガンドの遺伝子の発現解析を行った.その結果,古典的Wntシグナル経路のリガンドの発現はこれらのニッチェにおいて非常に低かった.くわえて,N-カドヘリン陽性の骨芽細胞は非古典的Wntシグナル経路のリガンド,Wnt4,Wnt5a,Wnt5b,Wnt6,Wnt11,Wnt16を発現しており,古典的Wntシグナル経路はDkkやSfrpなどの阻害タンパク質の発現により抑制されていることを発見した.
5-フルオロウラシルは分裂期の細胞を死滅させることにより静止期の造血幹細胞を活性化させることから,造血幹細胞へのストレスのモデルとして使用されている.造血幹細胞を活性化させるためこの5-フルオロウラシルを投与すると,N-カドヘリン陽性の骨芽細胞は非古典的Wntシグナル経路のリガンドや阻害タンパク質を発現せずに古典的シグナル経路のWntリガンドであるWnt7bを高発現するようになり,非古典的Wntシグナル経路から古典的Wntシグナル経路への切替えがみられた.このことから,ニッチェにおいて,古典的Wntシグナル経路と非古典的Wntシグナル経路とを,恒常状態あるいはストレス状態と状況に応じ使い分けていることが明らかになった.さらに,ニッチェにおけるWntシグナル経路の切替えに応じ,造血幹細胞においても古典的Wntシグナル経路の指標となるβカテニン活性の上昇がみられ,Wntシグナル経路の切替えと造血幹細胞の活性化との相関が示唆された.
3.FlamingoとFrizzled8は造血幹細胞を静止期にとどめる
非古典的Wntシグナル経路の生体における機能を明らかにするため,FlamingoノックアウトマウスおよびFrizzled8ノックアウトマウスを作製したところ,これらのノックアウトマウスは造血幹細胞,ひきつづいて,造血前駆細胞の減少を示した.造血幹細胞の機能を調べるため,単離した造血幹細胞の移植による長期造血能のアッセイを行ったところ,その低下がみられた.また,これらのノックアウトマウスの造血幹細胞ではGFP標識ヒストンH2Bの長期の保持能はほとんど消失しており,残存していたヒストンH2Bの長期保持能をもつ造血幹細胞は,骨内膜ニッチェに存在するN-カドヘリン陽性の骨芽細胞から離れた場所にあった.さらに,これらGFP標識ヒストンH2Bの長期の保持能をもつ造血幹細胞においては,GFPの蛍光強度が低下していた.これらのことから,FlamingoとFrizzled8は造血幹細胞を静止期にとどめるはたらきをもつものと示唆された.
つぎに,FlamingoとFrizzled8を介した非古典的Wntシグナル経路の細胞におけるシグナル伝達経路を明らかにするため,Ca2+-NFAT経路に注目した.Frizzled8をノックアウトすると造血幹細胞におけるCa2+濃度が上昇した.Frizzled8は造血幹細胞に発現するL型Ca2+チャネルと共局在していたことから,Frizzled8はGタンパク質共役受容体としてL型Ca2+チャネルを遮断しているものと考えられた.このことから,周囲と比べCa2+濃度が40倍も高い骨内膜にある造血幹細胞は,非古典的Wntシグナル経路により細胞毒となるCa2+濃度を低く抑えているものと考えられた.Ca2+-NFAT経路においてCa2+の下流にあると考えられているCdc42-CK1α複合体も,Frizzled8ノックアウトマウスでは細胞質から核に局在するようになった.野生型マウスの静止期の造血幹細胞においてNFATはCdc42-CK1α複合体とともに細胞質に局在しており,FlamingoとFrizzled8をそれぞれshRNAによりノックダウンするとNFATの核への移行がみられた.さらに,FlamingoとFrizzled8を欠損した造血幹細胞ではNFATの下流の標的であるインターフェロンγの発現上昇がみられた.インターフェロンγは造血幹細胞を活性化させることが知られている.よって,非古典的Wntシグナル経路はNFATの核への移行を阻害することにより造血幹細胞を静止期にとどめていると考えられた.また,βカテニンを介した古典的Wntシグナル経路が非古典的Wntシグナル経路により抑制されることも示された.このことから,非古典的Wntシグナル経路と古典的Wntシグナル経路のバランスにより造血幹細胞の活性が制御されていることが示唆された(図3).
おわりに
今回の報告は,非古典的Wntシグナル経路が海綿骨の骨内膜ニッチェにおいて造血幹細胞を静止期にとどめるはたらきをもつことを明らかにした.さらには,古典的Wntシグナル経路と非古典的Wntシグナル経路とのバランスが幹細胞を制御するという新たなコンセプトを提示した.造血幹細胞における古典的Wntシグナル経路の機能についてはまだ議論があり,これからも研究の余地はある.たとえば,βカテニンおよびγカテニンをノックアウトしたマウスは,造血幹細胞の恒常的な状態や移植ののちの造血機能に影響はみられなかった7).しかし,このノックアウトマウスでは古典的Wntシグナル経路の構成タンパク質であるTCF1をノックアウトしたマウスと異なり,T細胞の発生に影響のなかったこと,さらに,培養条件においてGSK3の阻害剤とPtenの欠損(あるいは,SCFによるAkt経路の活性化)との組合せにより造血幹細胞を増殖できることから8),GSK3の下流においてβカテニン(や,γカテニン)をバイパスするようなシグナル伝達経路の存在や,ほかのシグナル伝達経路とのクロストークの重要性が考えられる.
従来の古典的Wntシグナル経路にくわえ,非古典的Wntシグナル経路も含めたダイナミックな造血幹細胞の制御の存在することは,ニッチェにおいて幹細胞が複雑な機構により制御されていることを示唆している.しかし,幹細胞の静止状態あるいは活性化をつかさどるニッチェが骨髄において別々の領域に存在するという可能性を考えると,Wntシグナル経路の使い分けは非常に理にかなっていると考えられる.また,いったん活性化された造血幹細胞がどれくらいの頻度あるいは程度で静止期にもどるのか,そこでもWntシグナル経路の切替えが起こっているのかどうかは興味深い.くわえて,近年,報告されたCAR細胞やシュワン細胞などさまざまなニッチェ細胞や9,10),シグナル伝達系の研究の進展もあわせて,造血幹細胞の制御への理解は大きく進歩している.培養した造血幹細胞の移植への応用やがん幹細胞への理解を深めるためにも,この分野の今後の研究が期待される.
シグナルの出所であるニッチェ細胞や幹細胞における,下流の経路を含めたシグナル伝達系のダイナミクスをリアルタイムに追究することで,複雑な幹細胞の挙動や分化の階層性にクリアな説明をあたえられるものと期待する.また,造血幹細胞や骨髄ニッチェの局所的な関連を全体的に制御するような全身性のシグナル伝達系の存在,すなわち,ほかの臓器との関連も考えられる.これらのコンセプトは皮膚や神経,腸などほかの幹細胞についても応用できる可能性があり,今後の研究が待たれる.
文 献
- Zhang, J., Niu, C., Ye, L. et al.: Identification of the haematopoietic stem cell niche and control of the niche size. Nature, 425, 836-841 (2003)[PubMed]
- Calvi, L. M., Adams, G. B., Weibrecht, K. W. et al.: Osteoblastic cells regulate the haematopoietic stem cell niche. Nature, 425, 841-846 (2003)[PubMed]
- Xie, Y., Yin, T., Wiegraebe, W. et al.: Detection of functional haematopoietic stem cell niche using real-time imaging. Nature, 457, 97-101 (2009)[PubMed]
- Nemeth, M. J., Topol, L., Anderson, S. M. et al.: Wnt5a inhibits canonical Wnt signaling in hematopoietic stem cells and enhances repopulation. Proc. Natl. Acad. Sci. USA, 39, 15436-13441 (2007)[PubMed]
- Akashi, K., He, X., Chen, J. et al.: Transcriptional accessibility for genes of multiple tissues and hematopoietic lineages is hierarchically controlled during early hematopoiesis. Blood, 101, 383-389 (2003)[PubMed]
- Arai, F., Hirao, A., Ohmura, M. et al.: Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell, 118, 149-161 (2004)[PubMed]
- Kock, U., Wilson, A., Cobas, M. et al.: Simultaneous loss of β- and γ-catenin does not perturb hematopoiesis or lymphopoiesis. Blood, 111, 160-164 (2008)[PubMed]
- Perry, J. M., He, X. C., Sugimura, R. et al.: Cooperation between both Wnt/β-catenin and PTEN/PI3K/Akt signaling promotes primitive hematopoietic stem cell self-renewal and expansion. Genes Dev., 25, 1928-1942 (2011)[PubMed]
- Sugiyama, T., Kohara, H., Noda, M. et al.: Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity, 6, 977-988 (2006)[PubMed]
- Yamazaki, S., Ema, H., Karlsson, G. et al.: Nonmyelinating Schwann cells maintain hematopoietic stem cell hibernation in the bone marrow niche. Cell, 147, 1146-1158 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:米国Stowers Institute for Medical Researchにて博士課程 在学中.
研究テーマ:シグナル伝達系による幹細胞の制御のダイナミクス.
抱負:全身の幹細胞と組織との相互作用を追究することで,幹細胞が統一して制御されている機構を解明したい.
© 2012 杉村 竜一 Licensed under CC 表示 2.1 日本