バイオセンサーにより明らかにされた染色体分離におけるセパラーゼの異なる2つの役割
進藤軌久・広田 亨
(がん研究会がん研究所 実験病理部)
email:進藤軌久,広田 亨
DOI: 10.7875/first.author.2012.104
Separase sensor reveals dual roles for separase coordinating cohesin cleavage and cdk1 inhibition.
Norihisa Shindo, Kazuki Kumada, Toru Hirota
Developmental Cell, 23, 112-123 (2012)
染色体が正常に分離するためには,姉妹染色分体の結合の解除と,それにつづく,姉妹染色分体の紡錘体極の方向への引き離しが協調的に起こる必要がある.筆者らは,姉妹染色分体の結合の解除に必須のプロテアーゼであるセパラーゼの活性を可視化するバイオセンサーを開発することにより,この2つのイベントが協調して起こる機構の一端を明らかにした.まず,セパラーゼの活性は染色体分離の直前に急激に上昇し,その急激な上昇は染色体に限局していることを見い出した.このようなセパラーゼの活性化の特徴は,セパラーゼの抑制タンパク質であるsecurinとサイクリンB1に依存していることがわかった.さらに,セパラーゼはプロテアーゼとして活性化したのち,サイクリンB1-cdk1複合体のキナーゼ活性を抑制することにより,姉妹染色分体の紡錘体極の方向への引き離しを促進していた.したがって,染色体分離の際にセパラーゼが異なる2つの役割をはたすことにより,姉妹染色分体の結合の解除とその紡錘体極の方向への引き離しが適切なタイミングで協調的に起こっているものと考えられた.
哺乳類の染色体の分離は同期性が非常に高い.つまり,すべての姉妹染色分体がほぼ同時に分離しはじめ,約1分間のごく短時間のうちに分離を完了する.染色体の分離は複雑でダイナミックな現象だが,その過程は姉妹染色分体の結合の解除と,それにつづく,姉妹染色分体の紡錘体極の方向への引き離しという2つの素過程に分解して考えることができる1).姉妹染色分体の結合はセパラーゼ(separase)とよばれるプロテアーゼが染色体をつなぎとめているコヒーシンを分解することにより解除され2),一方の姉妹染色分体の紡錘体極の方向への引き離しはサイクリン依存性キナーゼcdk1の活性の低下に依存していることが知られている3).同期的で瞬間的な染色体の分離を可能にするためには,この2つのイベントが協調的に,すべての染色体において同時多発的に進行する必要がある.
コヒーシンを分解するセパラーゼはsecurinとサイクリンB1により制御されている.このsecurinとサイクリンB1は,10分間ほど持続する分裂期中期をつうじAPC/C(anaphase-promoting complex/cyclosome,後期促進複合体/サイクロソーム)によりゆっくりと分解されている4).このように抑制タンパク質がゆっくりと分解される過程において,セパラーゼの活性もゆっくりと上昇しているのだろうか.あるいは,抑制タンパク質が分解されている状態であっても,セパラーゼの活性は抑制されつづけているのだろうか.哺乳類の染色体分離の同期性の高さを考慮すると後者の可能性が高いが,もしそうだとしたら,それを可能にしている機構はどのようなものなのか.このような問題を整理するため,まず,セパラーゼのバイオセンサーを開発し,実際に細胞においてセパラーゼの活性を可視化することにした.
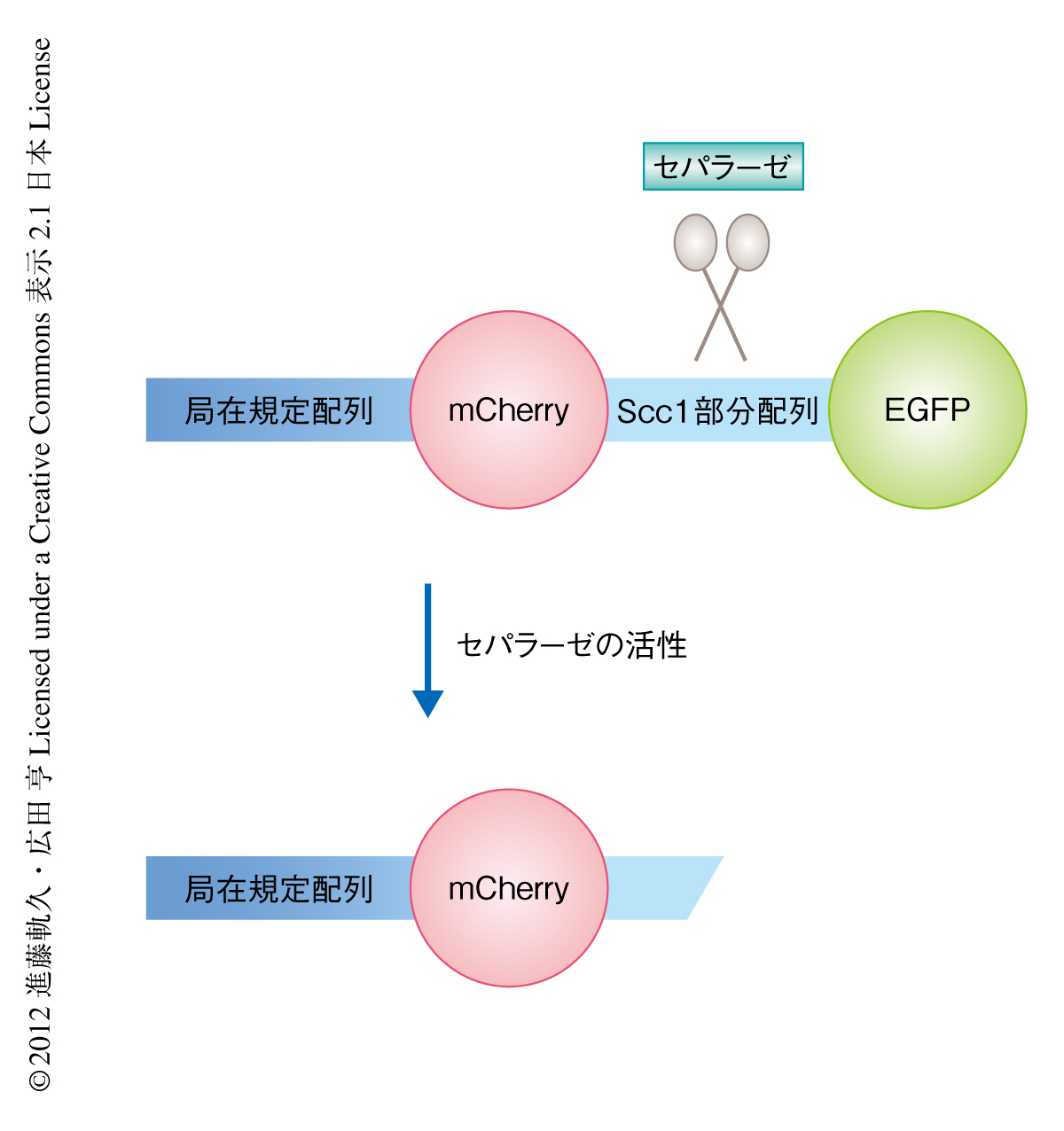
細胞においてセパラーゼの活性を可視化するためのバイオセンサーを開発した(図1).セパラーゼの基質であるScc1の部分配列を赤色の蛍光タンパク質mCherryと緑色の蛍光タンパク質EGFPとのあいだに挿入し,さらに,この融合タンパク質の局在を規定する局在規定配列をmCherryの側に融合させた.局在規定配列としてヒストンH2Bを使用すると染色体全体におけるセパラーゼ活性が測定でき,CENP-Bを用いるとセントロメアにおけるセパラーゼ活性が測定できる.
このバイオセンサーを用いた解析の結果,セパラーゼは染色体分離の直前に,セントロメアだけでなく染色体全体において急激に活性化していた.一方,染色体以外の領域に局在するようにしたバイオセンサーでは,染色体分離の前後で強い活性は検出されなかった.以上の結果から,分裂期中期のあいだセパラーゼの活性は抑制されつづけており,染色体分離の直前に急激に活性化し,しかも,その活性化は染色体に限局していることが明らかになった.
セパラーゼの抑制タンパク質であるsecurinとサイクリンB1がAPC/Cによりゆっくりと分解される分裂期中期において,セパラーゼの活性が抑制されつづける機構はどのようなものなのだろうか.分裂期の細胞抽出液に対し抗セパラーゼ抗体を用いて免疫沈降実験を行ったところ,セパラーゼにはsecurinがおもに結合しており,サイクリンB1はあまり結合していなかった.さらに,上清には大量のsecurinが残っていたことから,分裂期の細胞にはセパラーゼに対し過剰量のsecurinが存在していることが示唆された.つぎに,分裂期中期から後期にかけて同調培養系を用いて同様の免疫沈降実験を行ったところ,上清のsecurinはゆっくりと分解されていたが,セパラーゼと結合しているsecurinは後期の開始まで分解されず安定に存在していた.同様の結果はゲルろ過クロマトグラフィーによっても確認された.したがって,過剰量のsecurinがAPC/Cに対する“緩衝剤”のような役割をはたし,安定してセパラーゼに結合しつづける少量のsecurinによりセパラーゼの活性抑制が保たれているものと考えられた.
以上の結果はsecurinの重要性を示唆していたが,哺乳類細胞はsecurinがなくても問題なく生存できるという報告も数多くある.もうひとつのセパラーゼの抑制タンパク質であるサイクリンB1については,詳細な生化学的な解析により,ヒトのセパラーゼに対してそのSer1126(マウスでは,Ser1121)のリン酸化に依存してサイクリンB1が結合し活性を抑制することが報告されている5).しかし,サイクリンB1によるセパラーゼの活性抑制が重要になるのは限定的な条件においてのみという報告も多数あり,その生理学的な意義には議論の余地があった.
筆者らは,これまでの報告がセパラーゼの活性化を姉妹染色分体の分離により評価していた点に着目し,開発したバイオセンサーを用いてセパラーゼの活性を評価することによりこの問題に決着をつけることができるのではないかと考えた.サイクリンB1によるセパラーゼの活性抑制の意義を調べるため,サイクリンB1に結合できないセパラーゼの変異体を発現する細胞株を樹立した.このとき,この変異セパラーゼの発現レベルを生理的な条件に近づけるためにBACトランスジーン法を用いた.バイオセンサーにより変異セパラーゼのみを発現する細胞(内在性のセパラーゼはRNAi法により除去した)の染色体におけるセパラーゼ活性を測定したところ,野生型のセパラーゼを発現した細胞と同じキネティックスを示し,染色体分離のまえの分裂期中期において活性はみられなかった.したがって,染色体分離の以前のサイクリンB1によるセパラーゼの活性抑制は,securinが存在しているかぎり重要ではないと考えられた.
さらに,サイクリンB1に結合できない変異セパラーゼのみを発現する細胞において,securinをRNAi法により除去すると正常な染色体の分離は阻害され,長い分裂期中期をへて姉妹染色分体がバラバラに散在するという現象がみられた.この細胞におけるセパラーゼ活性をバイオセンサーにより測定したところ,核膜の崩壊の直後からすでに染色体において弱い活性が検出されはじめ,そのまま活性は上昇することなく一定のままであり,正常な染色体分離のときのセパラーゼ活性の約2%にしかならなかった.セパラーゼの染色体への局在量を調べたところ,securinもサイクリンB1も結合していないセパラーゼは染色体への局在量が極端に低下しており,これが染色体において検出された非常に弱いセパラーゼ活性の一因と考えられた.securinとサイクリンB1のいずれか片方がセパラーゼと結合している条件ではセパラーゼの染色体への局在は正常であったので,セパラーゼの活性抑制と染色体への局在は,securinの存在下ではsecurin,securinの非存在下ではサイクリンB1が制御しているものと考えられた.
securinの存在のもとではセパラーゼとサイクリンB1との結合は必要ないのだろうか.興味深いことに,サイクリンB1と結合できない変異セパラーゼのみを発現する細胞では,染色体分離ののちの紡錘体極の方向への引き離しの速度が遅くなっていることがわかった.さらに,通常の細胞において,セパラーゼとサイクリンB1との結合は染色体分離ののち増加していることがわかった.紡錘体極の方向への引き離しはサイクリンB1-cdk1複合体のキナーゼ活性の低下に依存していること,また,セパラーゼがサイクリンB1-cdk1複合体の活性を抑制するというin vitroにおける解析の報告があることを考慮すると6),染色体分離ののちセパラーゼがサイクリンB1と結合することによりcdk1の活性を抑制している可能性が考えられた.染色体分離ののちの細胞抽出液において,セパラーゼと結合しているサイクリンB1はごく一部であったが,セパラーゼと結合しているサイクリンB1-cdk1複合体の活性は抑制されていた.また,cdk1の基質であり染色体分離の際に脱リン酸化されることの知られている基質のリン酸化状態を調べたところ,サイクリンB1と結合できない変異セパラーゼのみを発現した細胞では高いリン酸化状態のままであった.また,この細胞をcdk1の阻害剤により処理すると,染色体分離ののちの紡錘体極の方向への染色体の移動速度は正常にもどった.したがって,セパラーゼは染色体分離の際にコヒーシンの分解のみならず,サイクリンB1-cdk1複合体のキナーゼ活性の抑制を行うことにより染色体の紡錘体極の方向への引き離しを促進していることが明らかになった.
おわりに
この研究では,染色体をつなぎとめているコヒーシンを染色体分離の際に分解するプロテアーゼとして知られていたセパラーゼの活性化のキネティックスを,セパラーゼの活性を可視化するバイオセンサーを用いて詳細に調べた.その過程で,セパラーゼが染色体分離の際に,コヒーシンの分解という役割のほか,もうひとつの重要な役割を担っていることをつきとめた.サイクリンB1と結合できない変異セパラーゼについてはいくつかの先行研究が存在していたが,内在性の野生型セパラーゼが発現したままであったり,変異セパラーゼが過剰発現したりしていたため,セパラーゼがサイクリンB1-cdk1複合体のキナーゼ活性を抑制する効果を見落としてしまっていたものと考えられる.この研究では,BACトランスジーン法を用いて内在性のプロモーターにより変異セパラーゼの発現を制御し,さらに,RNAi法により内在性のセパラーゼを除去したうえで解析を行ったため,セパラーゼによるcdk1の活性抑制の効果を見い出すことができた.さらに,セパラーゼとサイクリンB1との結合が染色体の分離ののち増加することを見い出した点も重要であり,この研究をまとめるうえでの大きな推進力となった.
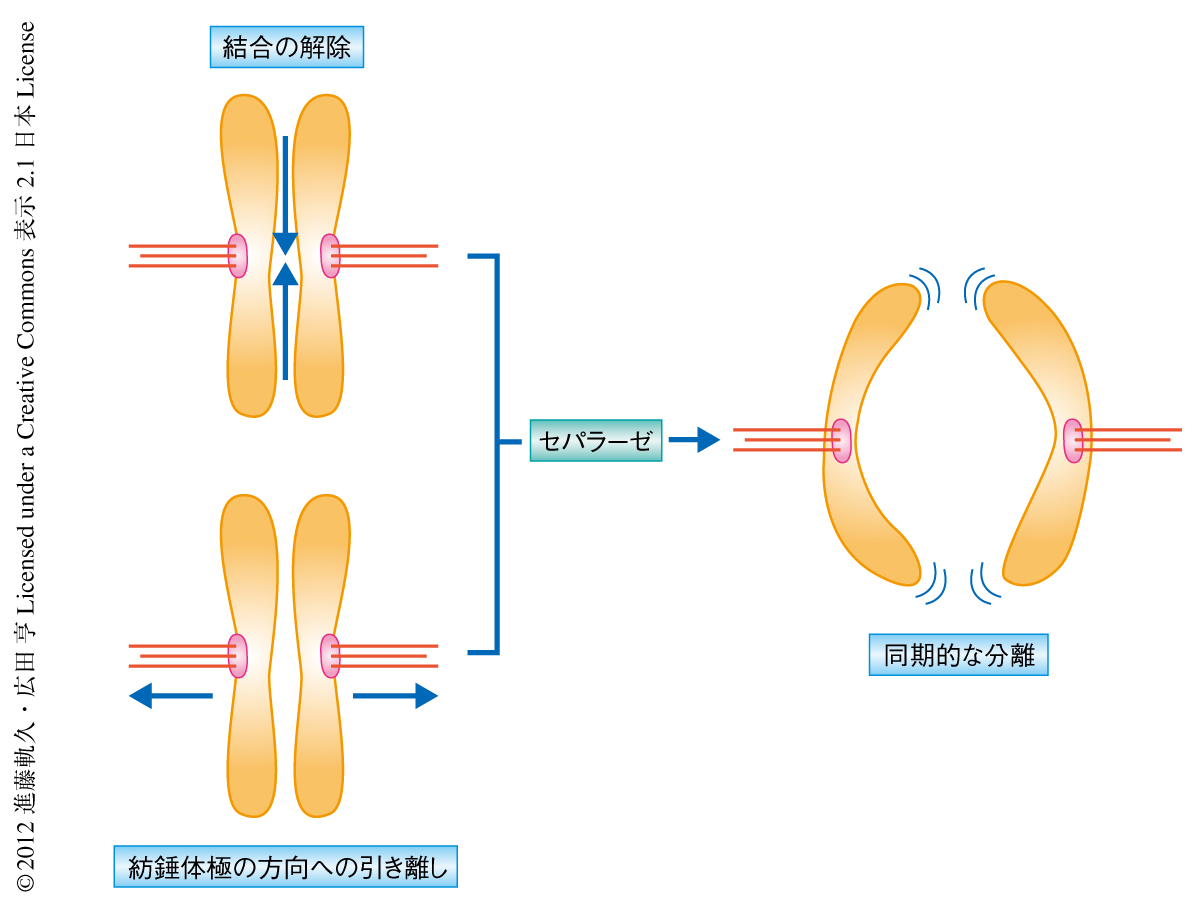
染色体分離の開始はAPC/CによるサイクリンB1の分解と密接な関係があるが,哺乳類細胞においては染色体分離の開始の際には分解開始の時点の約2割のサイクリンB1が残存している.この研究では,この残存したサイクリンB1-cdk1複合体の活性をセパラーゼが直接かつ局所的に抑制することにより,染色体の紡錘体極の方向への移動を促進していることを示した.サイクリンB1-cdk1複合体の活性抑制を染色体分離の際にセパラーゼがアシストする機構は,出芽酵母においてもFEAR経路として知られており,ホスファターゼであるCdc14がセパラーゼに依存して核小体から放出されることによりcdk1の基質の脱リン酸化を促進している.しかし,この出芽酵母のCdc14と同じ役割をもつタンパク質は哺乳類においてみつかっていない.おそらく,哺乳類においては,ゲノムサイズと細胞サイズの増大とともに,コヒーシンの分解とcdk1の活性抑制とをひとつのタンパク質が担当することに利点があったのかもしれない.そして,染色体分離の2つの素過程をひとつのタンパク質が制御することにより,確実で同期的な染色体の分離が可能になったのであろう(図2).
今後は,セパラーゼの活性がすべての染色体において瞬時に上昇する機構と,がん細胞においてセパラーゼの制御の異常が染色体の不安定性をひき起こす機構の解明が,課題になると考えている.
略歴:2005年 早稲田大学大学院理工学研究科 修了,同年 オーストラリアAdelaide大学 博士研究員を経て,2008年よりがん研究会がん研究所 博士研究員.
研究テーマ:染色体分離の機構.
抱負:どうしたらこんなおもしろい研究ができるの?と,いわれるくらいおもしろい研究ができるようになりたい.
広田 亨(Toru Hirota)
がん研究会がん研究所 部長.
研究室URL:http://www.jfcr.or.jp/tci/exppathol/index.html
© 2012 進藤軌久・広田 亨 Licensed under CC 表示 2.1 日本
(がん研究会がん研究所 実験病理部)
email:進藤軌久,広田 亨
DOI: 10.7875/first.author.2012.104
Separase sensor reveals dual roles for separase coordinating cohesin cleavage and cdk1 inhibition.
Norihisa Shindo, Kazuki Kumada, Toru Hirota
Developmental Cell, 23, 112-123 (2012)
要 約
染色体が正常に分離するためには,姉妹染色分体の結合の解除と,それにつづく,姉妹染色分体の紡錘体極の方向への引き離しが協調的に起こる必要がある.筆者らは,姉妹染色分体の結合の解除に必須のプロテアーゼであるセパラーゼの活性を可視化するバイオセンサーを開発することにより,この2つのイベントが協調して起こる機構の一端を明らかにした.まず,セパラーゼの活性は染色体分離の直前に急激に上昇し,その急激な上昇は染色体に限局していることを見い出した.このようなセパラーゼの活性化の特徴は,セパラーゼの抑制タンパク質であるsecurinとサイクリンB1に依存していることがわかった.さらに,セパラーゼはプロテアーゼとして活性化したのち,サイクリンB1-cdk1複合体のキナーゼ活性を抑制することにより,姉妹染色分体の紡錘体極の方向への引き離しを促進していた.したがって,染色体分離の際にセパラーゼが異なる2つの役割をはたすことにより,姉妹染色分体の結合の解除とその紡錘体極の方向への引き離しが適切なタイミングで協調的に起こっているものと考えられた.
はじめに
哺乳類の染色体の分離は同期性が非常に高い.つまり,すべての姉妹染色分体がほぼ同時に分離しはじめ,約1分間のごく短時間のうちに分離を完了する.染色体の分離は複雑でダイナミックな現象だが,その過程は姉妹染色分体の結合の解除と,それにつづく,姉妹染色分体の紡錘体極の方向への引き離しという2つの素過程に分解して考えることができる1).姉妹染色分体の結合はセパラーゼ(separase)とよばれるプロテアーゼが染色体をつなぎとめているコヒーシンを分解することにより解除され2),一方の姉妹染色分体の紡錘体極の方向への引き離しはサイクリン依存性キナーゼcdk1の活性の低下に依存していることが知られている3).同期的で瞬間的な染色体の分離を可能にするためには,この2つのイベントが協調的に,すべての染色体において同時多発的に進行する必要がある.
コヒーシンを分解するセパラーゼはsecurinとサイクリンB1により制御されている.このsecurinとサイクリンB1は,10分間ほど持続する分裂期中期をつうじAPC/C(anaphase-promoting complex/cyclosome,後期促進複合体/サイクロソーム)によりゆっくりと分解されている4).このように抑制タンパク質がゆっくりと分解される過程において,セパラーゼの活性もゆっくりと上昇しているのだろうか.あるいは,抑制タンパク質が分解されている状態であっても,セパラーゼの活性は抑制されつづけているのだろうか.哺乳類の染色体分離の同期性の高さを考慮すると後者の可能性が高いが,もしそうだとしたら,それを可能にしている機構はどのようなものなのか.このような問題を整理するため,まず,セパラーゼのバイオセンサーを開発し,実際に細胞においてセパラーゼの活性を可視化することにした.
1.セパラーゼの活性の可視化
細胞においてセパラーゼの活性を可視化するためのバイオセンサーを開発した(図1).セパラーゼの基質であるScc1の部分配列を赤色の蛍光タンパク質mCherryと緑色の蛍光タンパク質EGFPとのあいだに挿入し,さらに,この融合タンパク質の局在を規定する局在規定配列をmCherryの側に融合させた.局在規定配列としてヒストンH2Bを使用すると染色体全体におけるセパラーゼ活性が測定でき,CENP-Bを用いるとセントロメアにおけるセパラーゼ活性が測定できる.
このバイオセンサーを用いた解析の結果,セパラーゼは染色体分離の直前に,セントロメアだけでなく染色体全体において急激に活性化していた.一方,染色体以外の領域に局在するようにしたバイオセンサーでは,染色体分離の前後で強い活性は検出されなかった.以上の結果から,分裂期中期のあいだセパラーゼの活性は抑制されつづけており,染色体分離の直前に急激に活性化し,しかも,その活性化は染色体に限局していることが明らかになった.
2.分裂期中期におけるセパラーゼの活性抑制
セパラーゼの抑制タンパク質であるsecurinとサイクリンB1がAPC/Cによりゆっくりと分解される分裂期中期において,セパラーゼの活性が抑制されつづける機構はどのようなものなのだろうか.分裂期の細胞抽出液に対し抗セパラーゼ抗体を用いて免疫沈降実験を行ったところ,セパラーゼにはsecurinがおもに結合しており,サイクリンB1はあまり結合していなかった.さらに,上清には大量のsecurinが残っていたことから,分裂期の細胞にはセパラーゼに対し過剰量のsecurinが存在していることが示唆された.つぎに,分裂期中期から後期にかけて同調培養系を用いて同様の免疫沈降実験を行ったところ,上清のsecurinはゆっくりと分解されていたが,セパラーゼと結合しているsecurinは後期の開始まで分解されず安定に存在していた.同様の結果はゲルろ過クロマトグラフィーによっても確認された.したがって,過剰量のsecurinがAPC/Cに対する“緩衝剤”のような役割をはたし,安定してセパラーゼに結合しつづける少量のsecurinによりセパラーゼの活性抑制が保たれているものと考えられた.
3.染色体分離の以前のサイクリンB1によるセパラーゼの活性抑制の意義
以上の結果はsecurinの重要性を示唆していたが,哺乳類細胞はsecurinがなくても問題なく生存できるという報告も数多くある.もうひとつのセパラーゼの抑制タンパク質であるサイクリンB1については,詳細な生化学的な解析により,ヒトのセパラーゼに対してそのSer1126(マウスでは,Ser1121)のリン酸化に依存してサイクリンB1が結合し活性を抑制することが報告されている5).しかし,サイクリンB1によるセパラーゼの活性抑制が重要になるのは限定的な条件においてのみという報告も多数あり,その生理学的な意義には議論の余地があった.
筆者らは,これまでの報告がセパラーゼの活性化を姉妹染色分体の分離により評価していた点に着目し,開発したバイオセンサーを用いてセパラーゼの活性を評価することによりこの問題に決着をつけることができるのではないかと考えた.サイクリンB1によるセパラーゼの活性抑制の意義を調べるため,サイクリンB1に結合できないセパラーゼの変異体を発現する細胞株を樹立した.このとき,この変異セパラーゼの発現レベルを生理的な条件に近づけるためにBACトランスジーン法を用いた.バイオセンサーにより変異セパラーゼのみを発現する細胞(内在性のセパラーゼはRNAi法により除去した)の染色体におけるセパラーゼ活性を測定したところ,野生型のセパラーゼを発現した細胞と同じキネティックスを示し,染色体分離のまえの分裂期中期において活性はみられなかった.したがって,染色体分離の以前のサイクリンB1によるセパラーゼの活性抑制は,securinが存在しているかぎり重要ではないと考えられた.
4.securinとサイクリンB1の結合していないセパラーゼの染色体への局在
さらに,サイクリンB1に結合できない変異セパラーゼのみを発現する細胞において,securinをRNAi法により除去すると正常な染色体の分離は阻害され,長い分裂期中期をへて姉妹染色分体がバラバラに散在するという現象がみられた.この細胞におけるセパラーゼ活性をバイオセンサーにより測定したところ,核膜の崩壊の直後からすでに染色体において弱い活性が検出されはじめ,そのまま活性は上昇することなく一定のままであり,正常な染色体分離のときのセパラーゼ活性の約2%にしかならなかった.セパラーゼの染色体への局在量を調べたところ,securinもサイクリンB1も結合していないセパラーゼは染色体への局在量が極端に低下しており,これが染色体において検出された非常に弱いセパラーゼ活性の一因と考えられた.securinとサイクリンB1のいずれか片方がセパラーゼと結合している条件ではセパラーゼの染色体への局在は正常であったので,セパラーゼの活性抑制と染色体への局在は,securinの存在下ではsecurin,securinの非存在下ではサイクリンB1が制御しているものと考えられた.
5.染色体分離ののちのセパラーゼとサイクリンB1との結合の重要性
securinの存在のもとではセパラーゼとサイクリンB1との結合は必要ないのだろうか.興味深いことに,サイクリンB1と結合できない変異セパラーゼのみを発現する細胞では,染色体分離ののちの紡錘体極の方向への引き離しの速度が遅くなっていることがわかった.さらに,通常の細胞において,セパラーゼとサイクリンB1との結合は染色体分離ののち増加していることがわかった.紡錘体極の方向への引き離しはサイクリンB1-cdk1複合体のキナーゼ活性の低下に依存していること,また,セパラーゼがサイクリンB1-cdk1複合体の活性を抑制するというin vitroにおける解析の報告があることを考慮すると6),染色体分離ののちセパラーゼがサイクリンB1と結合することによりcdk1の活性を抑制している可能性が考えられた.染色体分離ののちの細胞抽出液において,セパラーゼと結合しているサイクリンB1はごく一部であったが,セパラーゼと結合しているサイクリンB1-cdk1複合体の活性は抑制されていた.また,cdk1の基質であり染色体分離の際に脱リン酸化されることの知られている基質のリン酸化状態を調べたところ,サイクリンB1と結合できない変異セパラーゼのみを発現した細胞では高いリン酸化状態のままであった.また,この細胞をcdk1の阻害剤により処理すると,染色体分離ののちの紡錘体極の方向への染色体の移動速度は正常にもどった.したがって,セパラーゼは染色体分離の際にコヒーシンの分解のみならず,サイクリンB1-cdk1複合体のキナーゼ活性の抑制を行うことにより染色体の紡錘体極の方向への引き離しを促進していることが明らかになった.
おわりに
この研究では,染色体をつなぎとめているコヒーシンを染色体分離の際に分解するプロテアーゼとして知られていたセパラーゼの活性化のキネティックスを,セパラーゼの活性を可視化するバイオセンサーを用いて詳細に調べた.その過程で,セパラーゼが染色体分離の際に,コヒーシンの分解という役割のほか,もうひとつの重要な役割を担っていることをつきとめた.サイクリンB1と結合できない変異セパラーゼについてはいくつかの先行研究が存在していたが,内在性の野生型セパラーゼが発現したままであったり,変異セパラーゼが過剰発現したりしていたため,セパラーゼがサイクリンB1-cdk1複合体のキナーゼ活性を抑制する効果を見落としてしまっていたものと考えられる.この研究では,BACトランスジーン法を用いて内在性のプロモーターにより変異セパラーゼの発現を制御し,さらに,RNAi法により内在性のセパラーゼを除去したうえで解析を行ったため,セパラーゼによるcdk1の活性抑制の効果を見い出すことができた.さらに,セパラーゼとサイクリンB1との結合が染色体の分離ののち増加することを見い出した点も重要であり,この研究をまとめるうえでの大きな推進力となった.
染色体分離の開始はAPC/CによるサイクリンB1の分解と密接な関係があるが,哺乳類細胞においては染色体分離の開始の際には分解開始の時点の約2割のサイクリンB1が残存している.この研究では,この残存したサイクリンB1-cdk1複合体の活性をセパラーゼが直接かつ局所的に抑制することにより,染色体の紡錘体極の方向への移動を促進していることを示した.サイクリンB1-cdk1複合体の活性抑制を染色体分離の際にセパラーゼがアシストする機構は,出芽酵母においてもFEAR経路として知られており,ホスファターゼであるCdc14がセパラーゼに依存して核小体から放出されることによりcdk1の基質の脱リン酸化を促進している.しかし,この出芽酵母のCdc14と同じ役割をもつタンパク質は哺乳類においてみつかっていない.おそらく,哺乳類においては,ゲノムサイズと細胞サイズの増大とともに,コヒーシンの分解とcdk1の活性抑制とをひとつのタンパク質が担当することに利点があったのかもしれない.そして,染色体分離の2つの素過程をひとつのタンパク質が制御することにより,確実で同期的な染色体の分離が可能になったのであろう(図2).
今後は,セパラーゼの活性がすべての染色体において瞬時に上昇する機構と,がん細胞においてセパラーゼの制御の異常が染色体の不安定性をひき起こす機構の解明が,課題になると考えている.
文 献
- Oliveira, R. A. & Nasmyth, K.: Getting through anaphase: splitting the sisters and beyond. Biochem. Soc. Trans., 38, 1639-1644 (2010)[PubMed]
- Uhlmann, F., Wernic, D., Poupart, M. A. et al.: Cleavage of cohesin by the CD clan protease separin triggers anaphase in yeast. Cell 103, 375-386 (2000)[PubMed]
- Wolf, F., Wandke, C., Isenberg, N. et al.: Dose-dependent effects of stable cyclin B1 on progression through mitosis in human cells. EMBO J., 25, 2802-2813 (2006)[PubMed]
- Clute, P. & Pines, J.: Temporal and spatial control of cyclin B1 destruction in metaphase. Nat. Cell Biol., 1, 82-87 (1999)[PubMed]
- Stemmann, O., Zou, H., Gerber, S. A. et al.: Dual inhibition of sister chromatid separation at metaphase. Cell, 107, 715-726 (2001)[PubMed]
- Gorr, I. H., Boos, D. & Stemmann, O.: Mutual inhibition of separase and Cdk1 by two-step complex formation. Mol. Cell, 19, 135-141 (2005)[PubMed]
著者プロフィール
略歴:2005年 早稲田大学大学院理工学研究科 修了,同年 オーストラリアAdelaide大学 博士研究員を経て,2008年よりがん研究会がん研究所 博士研究員.
研究テーマ:染色体分離の機構.
抱負:どうしたらこんなおもしろい研究ができるの?と,いわれるくらいおもしろい研究ができるようになりたい.
広田 亨(Toru Hirota)
がん研究会がん研究所 部長.
研究室URL:http://www.jfcr.or.jp/tci/exppathol/index.html
© 2012 進藤軌久・広田 亨 Licensed under CC 表示 2.1 日本