GBPはインターフェロンγにより誘導され病原性の寄生虫トキソプラズマを破壊する
山本雅裕・竹田 潔
(大阪大学免疫学フロンティア研究センター 粘膜免疫学研究室)
email:山本雅裕
DOI: 10.7875/first.author.2012.102
A cluster of interferon-γ-inducible p65 GTPases plays a critical role in host defense against Toxoplasma gondii.
Masahiro Yamamoto, Megumi Okuyama, Ji Su Ma, Taishi Kimura, Naganori Kamiyama, Hiroyuki Saiga, Jun Ohshima, Miwa Sasai, Hisako Kayama, Toru Okamoto, David C.S. Huang, Dominique Soldati-Favre, Kyoji Horie, Junji Takeda, Kiyoshi Takeda
Immunity, 37, 302-313 (2012)
インターフェロンγは細胞に寄生する病原体に対する宿主の応答に必須のサイトカインである.インターフェロンγにより自然免疫を担当する細胞を刺激すると約2000種類の遺伝子が誘導され,その産物にはGBPとよばれるGTPaseが含まれる.GBPは非常に相同性の高い13個からなるファミリーを形成しており,マウスにおいては6個と7個がそれぞれ第3染色体と第5染色体に分かれて並んでコードされている.第3染色体にコードされるGBPファミリーをすべて染色体工学的な手法により欠損させたマウスを作製し,細胞に寄生する病原体のひとつである寄生虫トキソプラズマに対する応答を解析した.野生型マウスと比較して,第3染色体にコードされるGBPファミリーを欠損したマウス,および,それに由来するマクロファージはトキソプラズマの感染に対する感受性が高まっていた.このことから,GBPはインターフェロンγに依存的に誘導され病原性の寄生虫トキソプラズマに対する防御タンパク質として機能することが判明した.
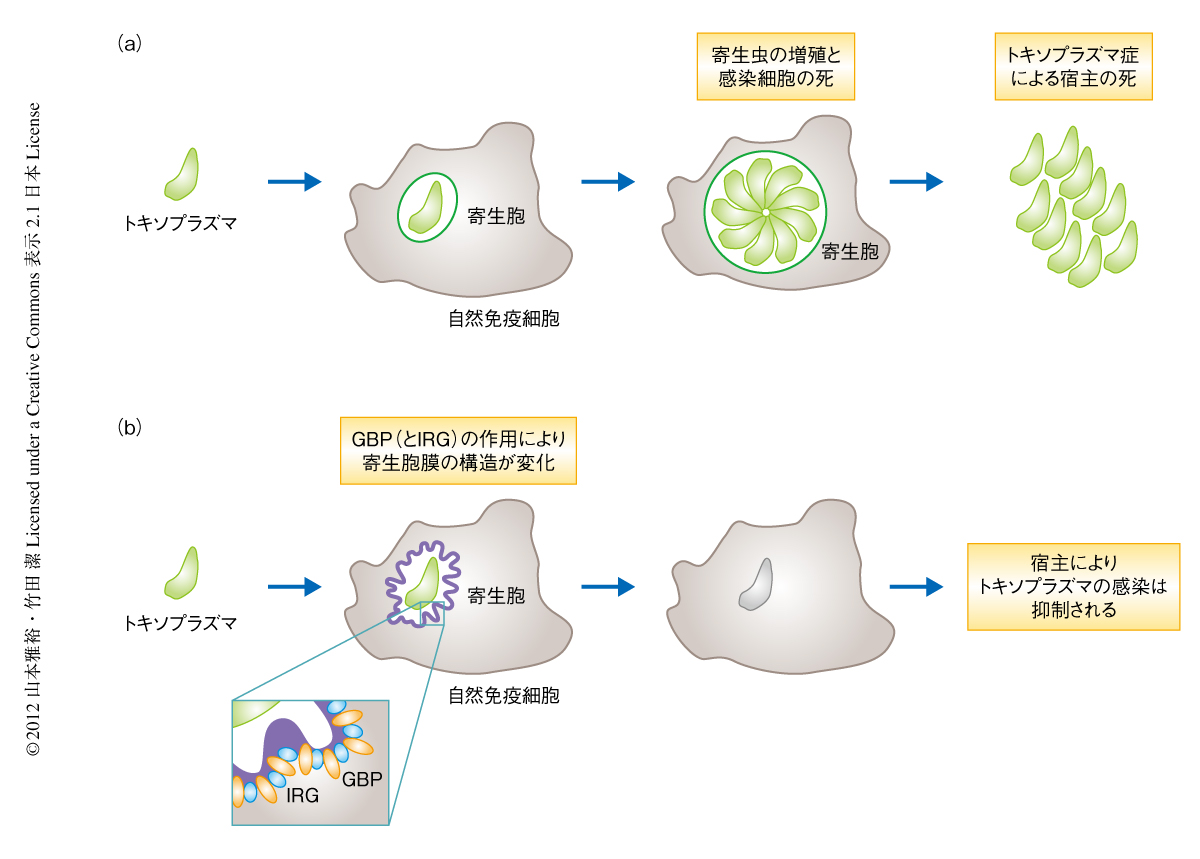
トキソプラズマはネコを終宿主とする病原性の寄生虫である(図1a).中間宿主はヒトを含むほぼすべての恒温動物であり,ヒトにかぎっていえば,全世界の人口のうちの約1/3,数十億人に感染し,わが国だけでも数千万人に感染していると試算されている.健常人では一過性の発熱などを除きほとんど症状のないことからトキソプラズマは日和見病原体として扱われているが,AIDS患者や抗がん剤を投与されている患者など免疫不全者においてはトキソプラズマ症をひき起こす1).近年,わが国において,ガーデニングの流行や非加熱の生肉食の増加などライフスタイルの欧米化にともない,とりわけ妊婦がトキソプラズマに感染し,その結果,胎児に胎盤を介してトキソプラズマが感染して流産する,あるいは,新生児が水頭症に罹患した状態で生まれるなど非常に予後の不良な疾患(先天性トキソプラズマ症)をひき起こすなどが急増し社会問題化しつつある.また最近は,統合失調症の発病にトキソプラズマの感染が関連するとの報告もなされている.
トキソプラズマはマラリア症の原因病原体であるマラリア原虫などと同じ胞子虫類原虫に分類され,宿主の細胞でのみ増殖の可能な偏性細胞内寄生生物である.トキソプラズマはすべての有核細胞に感染が可能で,赤血球および肝細胞にしか感染できないマラリア原虫とは比較にならないぐらい多種多様の細胞が標的細胞となることが,非常に多くの感染者のいる原因のひとつであると考えられる2).トキソプラズマは細胞に感染すると“寄生胞”とよばれるオルガネラを形成し,そこで宿主から栄養分を摂取することにより効率的に増殖する3)(図1b).それに対し,宿主はインターフェロンγというT細胞やナチュラルキラー細胞などの免疫細胞からおもに分泌されるサイトカインを使い寄生胞の内部のトキソプラズマを破壊することが,約30年前から示唆されていた4).しかし,インターフェロンγそれ自体には病原体を直接的に破壊するような構造はなく,インターフェロンγがどのようにトキソプラズマを破壊しているのかについては長いあいだ不明のままであった.
筆者らは,インターフェロンγがマクロファージや線維芽細胞など自然免疫を担当する細胞に作用し,約2000種類ものエフェクタータンパク質の発現を誘導することに着目した.そのなかには,トキソプラズマの寄生胞の周辺に集まるGBP(p65 guanylate-binding protein)とよばれるGTPaseがある.これは13個のファミリータンパク質からなり,宿主のトキソプラズマに対する免疫応答になんらかの役割をはたしていると考えられていたが,その機能は不明であった5).通常,ある特定の遺伝子の役割を調べるには1つの遺伝子を欠損させたマウスを作製して解析するが,GBPの場合,ファミリータンパク質それぞれの相同性が非常に高く,1つの遺伝子を欠損させても非常によく似た別のGBPファミリー遺伝子がその機能を補う(相補する)ことが予想された.そこで,GBPファミリー遺伝子が6個と7個に分かれて異なる染色体の非常に狭い領域に存在することを利用し,染色体工学的な手法を用いて第3染色体に存在する6個すべてのGBPファミリー遺伝子を欠損した第3染色体GBPノックアウトマウスを作製した.
第3染色体GBPノックアウトマウスと野生型マウスにトキソプラズマを感染させて生存率をみたところ,第3染色体GBPノックアウトマウスはトキソプラズマ感染に対し非常に弱くなっていることがわかった.また,トキソプラズマに感染したマウスにおける感染の拡大を,トキソプラズマから発する発光を指標に生体イメージング装置により計測したところ,第3染色体GBPノックアウトマウスでは野生型マウスと比べトキソプラズマが劇的に増殖していることが判明した.生体におけるトキソプラズマの感染細胞であり自然免疫を担当する細胞のひとつであるマクロファージを単離し,トキソプラズマを感染させてその増殖を検討した.インターフェロンγにより野生型マクロファージを処理すると濃度に依存してトキソプラズマの増殖は抑制されたが,第3染色体GBPノックアウトマウスに由来するマクロファージではインターフェロンγの処理によりトキソプラズマの増殖を抑制できないことが見い出された.このことから,インターフェロンγにより誘導されるGBPがマクロファージにおいてトキソプラズマの増殖をさまたげることが,生体におけるトキソプラズマに対する感染防御反応に重要であることがわかった.
第3染色体GBPノックアウトマウスに由来するマクロファージがトキソプラズマの増殖を抑制できないことの分子機構を解析した.第3染色体にコードされる6個のGBPファミリータンパク質のうち,Gbp1とGbp7は活性酸素の誘導に必須の複合体の構成タンパク質であるp47phoxやp91phoxと結合し,さらに,タンパク質分解にはたらくオートファジーに関連するタンパク質Atg4bと結合することが以前に報告されていた6).そこでまず,インターフェロンγに依存的な活性酸素の産生について検討したところ,野生型マクロファージと第3染色体GBPノックアウトマウスに由来するマクロファージとのあいだで差は認められなかった.また,Atg4bは野生型マクロファージにおいてトキソプラズマの感染により動員されていたが,第3染色体GBPノックアウトマウスに由来するマクロファージにおいても同様にこれが認められたことから,トキソプラズマの増殖を抑制できないのは活性酸素やオートファジーに関連する応答に異常のあることが原因ではないことが示唆された.さらに,トキソプラズマの排除に必須の炎症性サイトカインであるインターロイキン12の産生や一酸化窒素の産生に関しても,野生型マクロファージと第3染色体GBPノックアウトマウスに由来するマクロファージとのあいだに差は認められなかったことから,これらもトキソプラズマの数の減少には関与しないことが示唆された.
インターフェロンγの刺激により,細胞に感染したトキソプラズマの増殖が阻止されるだけでなく,トキソプラズマは殺傷されることが知られている.インターフェロンγに依存的な殺傷については,トキソプラズマの寄生胞膜の構造が破壊されていることが報告されている7).そこで,電子顕微鏡によりトキソプラズマの感染した野生型マクロファージおよび第3染色体GBPノックアウトマウスに由来するマクロファージにおけるトキソプラズマの状態を比較した.その結果,インターフェロンγにより刺激した野生型マクロファージではトキソプラズマの寄生胞膜が激しく波打ち,その構造が著しく破壊されていたが,第3染色体GBPノックアウトマウスに由来するマクロファージではインターフェロンγによる処理をしてもそのような寄生胞膜の構造の変化は認められなかった.このことから,GBPはマクロファージにおいてトキソプラズマの寄生胞膜の構造を破壊しトキソプラズマを殺傷する機能をもつことが示唆された.
では,GBPどのようにしてはトキソプラズマの寄生胞膜を破壊するのか? 以前から寄生胞膜の破壊についての機能が示唆されていた,GBPとは異なるファミリーに属するGTPaseであるIRG(immunity-related p47 GTPase)の動態について8),野生型マクロファージおよび第3染色体GBPノックアウトマウスに由来するマクロファージにおいて比較した.すると,野生型マクロファージではIRGがトキソプラズマに蓄積するのに対し,第3染色体GBPノックアウトマウスに由来するマクロファージではIRGの蓄積が著しく減少していることがわかった.また,GBPとIRGの局在について野生型マクロファージにおいて検討したところ,どちらもトキソプラズマに蓄積し,さらに,GBPとIRGは結合していた.これらのことから,GBPはIRGをトキソプラズマに蓄積させることでその寄生胞膜を破壊し増殖を阻害していることが示唆された.以上のことから,インターフェロンγにより誘導されるトキソプラズマに対する感染防御機構において,GBPが重要な役割をはたしていることを明らかになった(図2).
今回の論文では,以下に述べる方法論的および概念的な点が特筆に価する.まず,クラスターを形成しているため通常の遺伝子ノックアウト法では複数を欠損させることが不可能な遺伝子の解析において,染色体工学的な手法を用いクラスターを丸ごと欠損させることによりその解析を可能にしたことは,方法論的にあまり前例がなく,クラスターを形成するほかの遺伝子の今後の解析のためのフレームワークを提供した.また,インターフェロンγに依存的なトキソプラズマの数の減少には,“増殖の阻止”と“殺傷”という概念的に異なる2つの現象が混在している.インターフェロンγにより誘導される一酸化窒素やトリプトファン分解酵素(増殖に必須のアミノ酸であるトリプトファンが分解されることで増殖が阻害される)により,トキソプラズマの増殖が阻止され,結果として,ひとつひとつの寄生胞に含まれるトキソプラズマの数が減少することが“増殖の阻止”である.一方,トキソプラズマの感染率が低下することもインターフェロンγに依存的なトキソプラズマの数の減少に重要であるが,これは,トキソプラズマが感染の直後にインターフェロンγに依存して寄生胞膜を破壊され,そののち,トキソプラズマそれ自体が分解されるために起こること(つまり,持続して感染できない)であり,これが“殺傷”である9).第3染色体にコードされるGBPファミリーを欠損したマクロファージではインターフェロンγに依存的なトキソプラズマの増殖の阻止はそれほど影響をうけず,それより,トキソプラズマの感染率の低下がみられ,また,寄生胞膜の破壊も起こっていなかったことを考えると,GBPはインターフェロンγに依存的なトキソプラズマの“殺傷”の担うタンパク質であることが示唆された.
今後の期待としては,GBPの機能を人為的に高めることにより,わが国で症例報告の急増しているトキソプラズマ症に対し新たな治療戦略を提供することが可能であることにとどまらず,寄生胞はトキソプラズマにかぎらずマラリア原虫においても形成されることから,GBPがマラリア原虫の感染防御に関与している可能性も非常に高い.マラリア症の発病におけるGBPの役割の解明は今後の重要な研究課題である.
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 同 助手,2010年 同 准教授を経て,2012年より大阪大学微生物病研究所 独立准教授.
研究テーマ:病原性寄生虫と宿主との免疫学的な相互作用.
抱負:病原体を調べれば調べるほど,宿主のなかで生き残るための巧妙かつ精緻な戦略に驚かされる.今後も,病原性寄生虫と宿主との攻防を双方の視点から解析することにより,新しい免疫寄生虫学のフィールドを切り開きたい.
竹田 潔(Kiyoshi Takeda)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2012 山本雅裕・竹田 潔 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 粘膜免疫学研究室)
email:山本雅裕
DOI: 10.7875/first.author.2012.102
A cluster of interferon-γ-inducible p65 GTPases plays a critical role in host defense against Toxoplasma gondii.
Masahiro Yamamoto, Megumi Okuyama, Ji Su Ma, Taishi Kimura, Naganori Kamiyama, Hiroyuki Saiga, Jun Ohshima, Miwa Sasai, Hisako Kayama, Toru Okamoto, David C.S. Huang, Dominique Soldati-Favre, Kyoji Horie, Junji Takeda, Kiyoshi Takeda
Immunity, 37, 302-313 (2012)
要 約
インターフェロンγは細胞に寄生する病原体に対する宿主の応答に必須のサイトカインである.インターフェロンγにより自然免疫を担当する細胞を刺激すると約2000種類の遺伝子が誘導され,その産物にはGBPとよばれるGTPaseが含まれる.GBPは非常に相同性の高い13個からなるファミリーを形成しており,マウスにおいては6個と7個がそれぞれ第3染色体と第5染色体に分かれて並んでコードされている.第3染色体にコードされるGBPファミリーをすべて染色体工学的な手法により欠損させたマウスを作製し,細胞に寄生する病原体のひとつである寄生虫トキソプラズマに対する応答を解析した.野生型マウスと比較して,第3染色体にコードされるGBPファミリーを欠損したマウス,および,それに由来するマクロファージはトキソプラズマの感染に対する感受性が高まっていた.このことから,GBPはインターフェロンγに依存的に誘導され病原性の寄生虫トキソプラズマに対する防御タンパク質として機能することが判明した.
はじめに
トキソプラズマはネコを終宿主とする病原性の寄生虫である(図1a).中間宿主はヒトを含むほぼすべての恒温動物であり,ヒトにかぎっていえば,全世界の人口のうちの約1/3,数十億人に感染し,わが国だけでも数千万人に感染していると試算されている.健常人では一過性の発熱などを除きほとんど症状のないことからトキソプラズマは日和見病原体として扱われているが,AIDS患者や抗がん剤を投与されている患者など免疫不全者においてはトキソプラズマ症をひき起こす1).近年,わが国において,ガーデニングの流行や非加熱の生肉食の増加などライフスタイルの欧米化にともない,とりわけ妊婦がトキソプラズマに感染し,その結果,胎児に胎盤を介してトキソプラズマが感染して流産する,あるいは,新生児が水頭症に罹患した状態で生まれるなど非常に予後の不良な疾患(先天性トキソプラズマ症)をひき起こすなどが急増し社会問題化しつつある.また最近は,統合失調症の発病にトキソプラズマの感染が関連するとの報告もなされている.
トキソプラズマはマラリア症の原因病原体であるマラリア原虫などと同じ胞子虫類原虫に分類され,宿主の細胞でのみ増殖の可能な偏性細胞内寄生生物である.トキソプラズマはすべての有核細胞に感染が可能で,赤血球および肝細胞にしか感染できないマラリア原虫とは比較にならないぐらい多種多様の細胞が標的細胞となることが,非常に多くの感染者のいる原因のひとつであると考えられる2).トキソプラズマは細胞に感染すると“寄生胞”とよばれるオルガネラを形成し,そこで宿主から栄養分を摂取することにより効率的に増殖する3)(図1b).それに対し,宿主はインターフェロンγというT細胞やナチュラルキラー細胞などの免疫細胞からおもに分泌されるサイトカインを使い寄生胞の内部のトキソプラズマを破壊することが,約30年前から示唆されていた4).しかし,インターフェロンγそれ自体には病原体を直接的に破壊するような構造はなく,インターフェロンγがどのようにトキソプラズマを破壊しているのかについては長いあいだ不明のままであった.
1.第3染色体にコードされるGBPファミリーを欠損したマウスの作製
筆者らは,インターフェロンγがマクロファージや線維芽細胞など自然免疫を担当する細胞に作用し,約2000種類ものエフェクタータンパク質の発現を誘導することに着目した.そのなかには,トキソプラズマの寄生胞の周辺に集まるGBP(p65 guanylate-binding protein)とよばれるGTPaseがある.これは13個のファミリータンパク質からなり,宿主のトキソプラズマに対する免疫応答になんらかの役割をはたしていると考えられていたが,その機能は不明であった5).通常,ある特定の遺伝子の役割を調べるには1つの遺伝子を欠損させたマウスを作製して解析するが,GBPの場合,ファミリータンパク質それぞれの相同性が非常に高く,1つの遺伝子を欠損させても非常によく似た別のGBPファミリー遺伝子がその機能を補う(相補する)ことが予想された.そこで,GBPファミリー遺伝子が6個と7個に分かれて異なる染色体の非常に狭い領域に存在することを利用し,染色体工学的な手法を用いて第3染色体に存在する6個すべてのGBPファミリー遺伝子を欠損した第3染色体GBPノックアウトマウスを作製した.
2.第3染色体にコードされるGBPファミリーを欠損したマウスはトキソプラズマに高感受性となる
第3染色体GBPノックアウトマウスと野生型マウスにトキソプラズマを感染させて生存率をみたところ,第3染色体GBPノックアウトマウスはトキソプラズマ感染に対し非常に弱くなっていることがわかった.また,トキソプラズマに感染したマウスにおける感染の拡大を,トキソプラズマから発する発光を指標に生体イメージング装置により計測したところ,第3染色体GBPノックアウトマウスでは野生型マウスと比べトキソプラズマが劇的に増殖していることが判明した.生体におけるトキソプラズマの感染細胞であり自然免疫を担当する細胞のひとつであるマクロファージを単離し,トキソプラズマを感染させてその増殖を検討した.インターフェロンγにより野生型マクロファージを処理すると濃度に依存してトキソプラズマの増殖は抑制されたが,第3染色体GBPノックアウトマウスに由来するマクロファージではインターフェロンγの処理によりトキソプラズマの増殖を抑制できないことが見い出された.このことから,インターフェロンγにより誘導されるGBPがマクロファージにおいてトキソプラズマの増殖をさまたげることが,生体におけるトキソプラズマに対する感染防御反応に重要であることがわかった.
第3染色体GBPノックアウトマウスに由来するマクロファージがトキソプラズマの増殖を抑制できないことの分子機構を解析した.第3染色体にコードされる6個のGBPファミリータンパク質のうち,Gbp1とGbp7は活性酸素の誘導に必須の複合体の構成タンパク質であるp47phoxやp91phoxと結合し,さらに,タンパク質分解にはたらくオートファジーに関連するタンパク質Atg4bと結合することが以前に報告されていた6).そこでまず,インターフェロンγに依存的な活性酸素の産生について検討したところ,野生型マクロファージと第3染色体GBPノックアウトマウスに由来するマクロファージとのあいだで差は認められなかった.また,Atg4bは野生型マクロファージにおいてトキソプラズマの感染により動員されていたが,第3染色体GBPノックアウトマウスに由来するマクロファージにおいても同様にこれが認められたことから,トキソプラズマの増殖を抑制できないのは活性酸素やオートファジーに関連する応答に異常のあることが原因ではないことが示唆された.さらに,トキソプラズマの排除に必須の炎症性サイトカインであるインターロイキン12の産生や一酸化窒素の産生に関しても,野生型マクロファージと第3染色体GBPノックアウトマウスに由来するマクロファージとのあいだに差は認められなかったことから,これらもトキソプラズマの数の減少には関与しないことが示唆された.
3.第3染色体にコードされるGBPファミリーを欠損したマクロファージではトキソプラズマの寄生胞は破壊されない
インターフェロンγの刺激により,細胞に感染したトキソプラズマの増殖が阻止されるだけでなく,トキソプラズマは殺傷されることが知られている.インターフェロンγに依存的な殺傷については,トキソプラズマの寄生胞膜の構造が破壊されていることが報告されている7).そこで,電子顕微鏡によりトキソプラズマの感染した野生型マクロファージおよび第3染色体GBPノックアウトマウスに由来するマクロファージにおけるトキソプラズマの状態を比較した.その結果,インターフェロンγにより刺激した野生型マクロファージではトキソプラズマの寄生胞膜が激しく波打ち,その構造が著しく破壊されていたが,第3染色体GBPノックアウトマウスに由来するマクロファージではインターフェロンγによる処理をしてもそのような寄生胞膜の構造の変化は認められなかった.このことから,GBPはマクロファージにおいてトキソプラズマの寄生胞膜の構造を破壊しトキソプラズマを殺傷する機能をもつことが示唆された.
では,GBPどのようにしてはトキソプラズマの寄生胞膜を破壊するのか? 以前から寄生胞膜の破壊についての機能が示唆されていた,GBPとは異なるファミリーに属するGTPaseであるIRG(immunity-related p47 GTPase)の動態について8),野生型マクロファージおよび第3染色体GBPノックアウトマウスに由来するマクロファージにおいて比較した.すると,野生型マクロファージではIRGがトキソプラズマに蓄積するのに対し,第3染色体GBPノックアウトマウスに由来するマクロファージではIRGの蓄積が著しく減少していることがわかった.また,GBPとIRGの局在について野生型マクロファージにおいて検討したところ,どちらもトキソプラズマに蓄積し,さらに,GBPとIRGは結合していた.これらのことから,GBPはIRGをトキソプラズマに蓄積させることでその寄生胞膜を破壊し増殖を阻害していることが示唆された.以上のことから,インターフェロンγにより誘導されるトキソプラズマに対する感染防御機構において,GBPが重要な役割をはたしていることを明らかになった(図2).
おわりに
今回の論文では,以下に述べる方法論的および概念的な点が特筆に価する.まず,クラスターを形成しているため通常の遺伝子ノックアウト法では複数を欠損させることが不可能な遺伝子の解析において,染色体工学的な手法を用いクラスターを丸ごと欠損させることによりその解析を可能にしたことは,方法論的にあまり前例がなく,クラスターを形成するほかの遺伝子の今後の解析のためのフレームワークを提供した.また,インターフェロンγに依存的なトキソプラズマの数の減少には,“増殖の阻止”と“殺傷”という概念的に異なる2つの現象が混在している.インターフェロンγにより誘導される一酸化窒素やトリプトファン分解酵素(増殖に必須のアミノ酸であるトリプトファンが分解されることで増殖が阻害される)により,トキソプラズマの増殖が阻止され,結果として,ひとつひとつの寄生胞に含まれるトキソプラズマの数が減少することが“増殖の阻止”である.一方,トキソプラズマの感染率が低下することもインターフェロンγに依存的なトキソプラズマの数の減少に重要であるが,これは,トキソプラズマが感染の直後にインターフェロンγに依存して寄生胞膜を破壊され,そののち,トキソプラズマそれ自体が分解されるために起こること(つまり,持続して感染できない)であり,これが“殺傷”である9).第3染色体にコードされるGBPファミリーを欠損したマクロファージではインターフェロンγに依存的なトキソプラズマの増殖の阻止はそれほど影響をうけず,それより,トキソプラズマの感染率の低下がみられ,また,寄生胞膜の破壊も起こっていなかったことを考えると,GBPはインターフェロンγに依存的なトキソプラズマの“殺傷”の担うタンパク質であることが示唆された.
今後の期待としては,GBPの機能を人為的に高めることにより,わが国で症例報告の急増しているトキソプラズマ症に対し新たな治療戦略を提供することが可能であることにとどまらず,寄生胞はトキソプラズマにかぎらずマラリア原虫においても形成されることから,GBPがマラリア原虫の感染防御に関与している可能性も非常に高い.マラリア症の発病におけるGBPの役割の解明は今後の重要な研究課題である.
文 献
- Israelski, D. M. & Remington, J. S.: Toxoplasmosis in patients with cancer. Clin. Infect. Dis., 17(Suppl.)2, S423-S435 (1993)[PubMed]
- Boothroyd, J. C.: Toxoplasma gondii: 25 years and 25 major advances for the field. Int. J. Parasitol., 39, 935-946 (2009)[PubMed]
- Boothroyd, J. C. & Dubremetz, J. F.: Kiss and spit: the dual roles of Toxoplasma rhoptries. Nat. Rev. Microbiol., 6, 79-88 (2008)[PubMed]
- Suzuki, Y., Orellana, M. A., Schreiber, R. D. et al.: Interferon-γ: the major mediator of resistance against Toxoplasma gondii. Science, 240, 516-518 (1988)[PubMed]
- Degrandi, D., Konermann, C., Beuter-Gunia, C. et al.: Extensive characterization of IFN-induced GTPases mGBP1 to mGBP10 involved in host defense. J. Immunol., 179, 7729-7740 (2007)[PubMed]
- Kim, B. H., Shenoy, A. R., Kumar, P. et al.: A family of IFN-γ-inducible 65-kD GTPases protects against bacterial infection. Science, 332, 717-721 (2011)[PubMed]
- Ling, Y. M., Shaw, M. H., Ayala, C. et al.: Vacuolar and plasma membrane stripping and autophagic elimination of Toxoplasma gondii in primed effector macrophages. J. Exp. Med., 203, 2063-2071 (2006)[PubMed]
- Zhao, Z., Fux, B., Goodwin, M. et al.: Autophagosome-independent essential function for the autophagy protein Atg5 in cellular immunity to intracellular pathogens. Cell Host Microbe, 4, 458-469 (2008)[PubMed]
- Zhao, Y., Ferguson, D. J., Wilson, D. C. et al.: Virulent Toxoplasma gondii evade immunity-related GTPase-mediated parasite vacuole disruption within primed macrophages. J. Immunol., 182, 3775-3781 (2009)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 同 助手,2010年 同 准教授を経て,2012年より大阪大学微生物病研究所 独立准教授.
研究テーマ:病原性寄生虫と宿主との免疫学的な相互作用.
抱負:病原体を調べれば調べるほど,宿主のなかで生き残るための巧妙かつ精緻な戦略に驚かされる.今後も,病原性寄生虫と宿主との攻防を双方の視点から解析することにより,新しい免疫寄生虫学のフィールドを切り開きたい.
竹田 潔(Kiyoshi Takeda)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2012 山本雅裕・竹田 潔 Licensed under CC 表示 2.1 日本