細胞質ポリアデニル化複合体による樹状突起における翻訳と神経可塑性の双方向性の制御
宇田川 剛1・Sharon A. Swanger 2・Joel D. Richter 1
(1米国Massachusetts大学Medical School,Program in Molecular Medicine,2米国Emory大学School of Medicine,Department of Cell Biology)
email:宇田川 剛
DOI: 10.7875/first.author.2012.096
Bidirectional control of mRNA translation and synaptic plasticity by the cytoplasmic polyadenylation complex.
Tsuyoshi Udagawa, Sharon A. Swanger, Koichi Takeuchi, Jong Heon Kim, Vijayalaxmi Nalavadi, Jihae Shin, Lori J. Lorenz, R. Suzanne Zukin, Gary J. Bassell, Joel D. Richter
Molecular Cell, 47, 253-266 (2012)
樹状突起における翻訳制御はある種の神経可塑性や学習と記憶に必須である.CPEBは樹状突起において翻訳を制御する配列特異的なRNA結合タンパク質である.筆者らは,樹状突起においてCPEBを介しmRNAのポリアデニル化を制御する細胞質ポリアデニル化複合体の構成タンパク質として,ポリAポリメラーゼGld2,デアデニラーゼPARN,翻訳阻害タンパク質Ngdを同定した.シナプスへの刺激は樹状突起におけるCPEBのリン酸化,PARNの細胞質ポリアデニル化複合体からの放出,mRNAのポリアデニル化を誘導した.Gld2によりポリアデニル化の制御されるmRNAをスクリーニングすることにより,NMDA受容体のサブユニットであるNR2AをコードするmRNAを含む100以上のmRNAを同定した.さらに,Gld2とNgdは樹状突起におけるNR2Aの翻訳をそれぞれ促進あるいは抑制することが示された.in vivoにおけるGld2のノックダウンは海馬歯状回のシナプスにおいて翻訳に依存的な長期増強を抑制し,反対に,Ngdのノックダウンは長期増強を亢進することが示された.これらの結果は,樹状突起における局所的なmRNAのポリアデニル化と,Gld2およびNgdによる双方向性の翻訳制御が,海馬におけるシナプス可塑性に中心的な役割をはたしていることを示した.
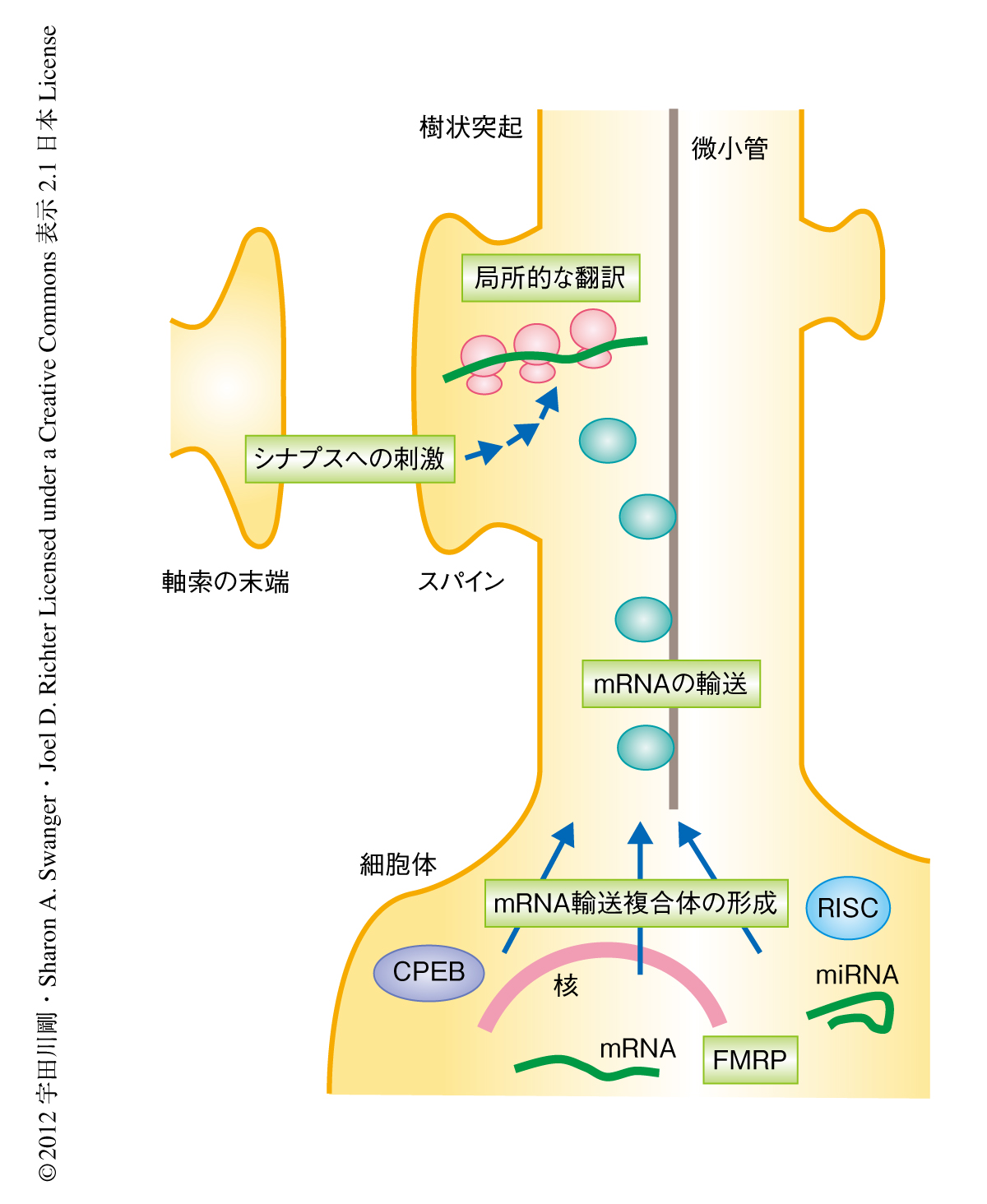
翻訳の空間的な制御は多様な細胞機能において種をこえ重要である.ニューロンにおいては,経験により誘導されるシナプス結合性の制御(シナプス可塑性)が学習と記憶の基盤になっていると考えられている.この制御にはシナプスへの刺激に応じた新規のタンパク質合成が必要とされ,シナプスあるいはその近傍における局所的かつ特異的な翻訳がこれに関与するものと考えられている1,2)(図1).CPEBはそのような翻訳制御を行うRNA結合タンパク質のひとつと考えられる.CPEBはアフリカツメガエルの卵母細胞において特異的なmRNAの3’側非翻訳領域に結合し,そのポリアデニル化を制御することにより翻訳レベルにおいて減数分裂を制御することが知られている.哺乳類では海馬において高い発現を示し,実際に,CPEBノックアウトマウスはある種のシナプス可塑性および学習と記憶に異常をきたす3-5).しかしながら,ニューロンにおいてCPEBがどのように翻訳を制御しているのか,また,CPEBによるmRNAのポリアデニル化の制御がシナプス可塑性において必要とされるのかどうかについては不明であった.筆者らは,樹状突起において,CPEBを含む細胞質ポリアデニル化複合体の同定,局所的な翻訳の制御機構,ポリアデニル化により制御されるmRNAの同定,in vivoにおけるシナプス可塑性への影響を解析した.
CPEBを含む複合体の構成タンパク質について,マウスの脳における分布を免疫染色および生化学的に調製したシナプス画分を用いて調べたところ,CPEB,Gld2,PARN,Neuroguidin(Ngd),CPSF,Symplekinといった,アフリカツメガエルにおいて同定されていた細胞質ポリアデニル化複合体を構成するタンパク質が海馬の樹状突起およびシナプス画分に存在することが示された.また,免疫沈降によりこれらのタンパク質が複合体を形成していることも示された.海馬培養ニューロンを用いた共染色では,これらのタンパク質が樹状突起や樹状突起スパイン(シナプス後部)において共局在していることが示された.これらの結果から,CPEBを含む細胞質ポリアデニル化複合体がシナプスにおける局所的な翻訳を制御している可能性が示唆された.
細胞質ポリアデニル化複合体による局所的な翻訳制御機構を明らかにするため,その構成タンパク質のシナプスへの刺激に応じた変化を解析した.海馬培養ニューロンをNMDAにより刺激し,抗リン酸化CPEB抗体と抗CPEB抗体により免疫染色して定量的な解析を行ったところ,樹状突起においてNMDAによる刺激によりCPEBのリン酸化が誘導されることがわかった.さらに,同じ刺激による細胞質ポリアデニル化複合体の構成タンパク質の共局在を解析したところ,PARNとCPEBおよびSymplekinとの共局在が低下したことから,NMDAによる刺激によりCPEBがリン酸化されると,PARNは細胞質ポリアデニル化複合体から放出されることが示唆された.また,オリゴdTプローブを用いたin situハイブリダイゼーションにより,樹状突起においてNMDAによる刺激に応じたポリAの量の増加がみられた.これらの結果は,細胞質ポリアデニル化複合体がNMDAによる刺激に応じて局所的に再構成され,特異的なmRNAのポリアデニル化,および,翻訳の促進を誘導することを示唆した.さらに,海馬培養ニューロンにおいてGld2をノックダウンするとポリAの量は低下した.このことは,Gld2は樹状突起においてmRNAのポリアデニル化を担うポリAポリメラーゼのひとつであることを示していた.
ニューロンにおいてGld2によりポリアデニル化の制御されるmRNAを同定するため,以下のようなスクリーニングを行った.まず,対照となる海馬培養ニューロンとGld2をノックダウンした海馬培養ニューロンを調製した.それぞれのニューロンから全RNAを抽出し,これらを常温でポリU-SepharoseカラムにロードしてmRNAだけを結合させた.つづいて,50℃の緩衝液でカラムを洗浄しポリA鎖が50ヌクレオチド以下のmRNAを除いた.最後に,65℃の緩衝液で長いポリA鎖をもつmRNAだけを溶出した.対照となる全RNAと,Gld2をノックダウンしたニューロンの全RNAと65℃溶出画分を用いてマイクロアレイ解析を行った.その結果,Gld2をノックダウンしたニューロンの65℃溶出画分でのみ発現の低下しているmRNA,すなわち,Gld2のノックダウンによりポリA鎖が短縮したと考えられる100以上のmRNAが同定された.これらのうち,28のmRNAはシナプス可塑性や神経疾患に関与する遺伝子をコードしていた.
同定されたGld2の標的となるmRNAのうち,シナプス可塑性において非常に重要なNMDA受容体のサブユニットNR2AをコードするmRNAについて,さらに解析を行った.まず,NR2 mRNAは細胞体だけでなく樹状突起にも局在することがin situハイブリダイゼーションにより示され,NR2 mRNAは局所的な翻訳制御をうける可能性が考えられた.NR2Aの定量的な免疫染色を行ったところ,樹状突起におけるNR2Aのタンパク質量はGld2のノックダウンにより低下した.一方,細胞体におけるNR2Aのタンパク質量およびmRNA量は一定であった.また,PCR法によるポリA鎖長の解析により,NR2 mRNAのポリアデニル化はGld2により促進されること,さらに,NMDAによる刺激や長期増強(long-term potentiation:LTP)を惹起するグリシンによる刺激はNR2 mRNAのポリアデニル化を誘導することが示された.これらの結果は,Gld2がNR2 mRNAのポリアデニル化および翻訳を局所的に制御していることを示唆した.さらに,細胞質ポリアデニル化複合体の構成タンパク質のうち翻訳阻害タンパク質であるNgdをノックダウンした場合には,Gld2のノックダウンとは反対に,NR2 mRNAの樹状突起における翻訳は促進された.以上の結果は,細胞質ポリアデニル化複合体の構成タンパク質であるGld2とNgdはNR2 mRNAの翻訳を双方向に制御することを示しており,シナプス可塑性において細胞質ポリアデニル化複合体が重要な役割をはたすことを強く示唆した.
CPEBノックアウトマウスでは海馬のシャッファー側枝-CA1シナプスにおけるシータバースト刺激により誘導される長期増強が阻害される3).この長期増強はNMDA受容体からのシグナル伝達を必要とし,翻訳に依存的である.また,海馬CA1において長期増強を誘導する刺激はNMDA受容体に依存的にCPEBをリン酸化することが知られている6).しかしながら,これまでのところmRNAのポリアデニル化とシナプス可塑性との直接的な因果関係については明らかにされていない.そこで,細胞質ポリアデニル化複合体の構成タンパク質であるGld2,PARN,Ngdに対するshRNAを発現するレンチウイルスをラットの海馬に導入し,シナプス可塑性への影響を調べた.レンチウイルスの定位的な注入により,注入ののち2週間でそれぞれのタンパク質のノックダウンが海馬歯状回においてとくに顕著に確認された.そこで,この部位を用いてシータバースト刺激により惹起される長期増強を記録した.まず,タンパク質合成阻害剤アニソマイシンを用いた実験により,この長期増強はタンパク質合成に依存的であることが示された.Gld2のノックダウンでは長期増強はアニソマイシンによる処理と同様に阻害された.このことは,Gld2によるmRNAのポリアデニル化がシナプス可塑性に必要とされることを示していた.PARNのノックダウンは長期増強に影響を及ぼさなかったが,細胞質ポリアデニル化複合体に含まれるもうひとつの翻訳抑制タンパク質であるNgdのノックダウンでは長期増強は亢進した.また,Gld2のノックダウンとNgdのノックダウンは成熟型の樹状突起スパインをそれぞれ減少あるいは増加させた.これらの結果は,細胞質ポリアデニル化複合体の構成タンパク質であるGld2とNgdは海馬におけるシナプス可塑性および形態を双方向に制御していることを示していた.
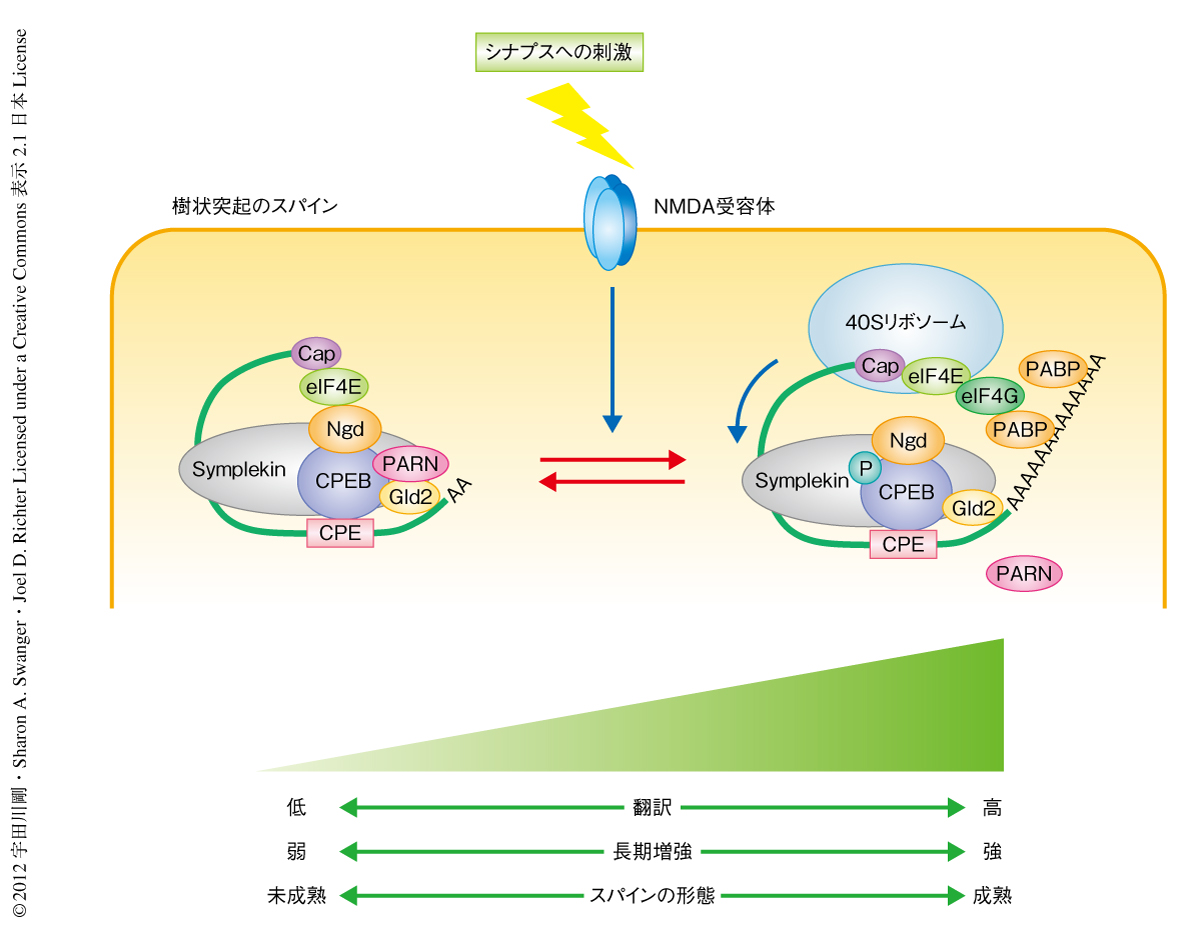
シナプス可塑性や学習と記憶におけるタンパク質合成の重要性は古くから知られていたが,シナプスにおける特異的なmRNAの翻訳制御機構が明らかにされた例はほとんどない.筆者らは,アフルカツメガエルにおいて減数分裂を制御するCPEBが,ニューロンでは樹状突起において局所的にmRNAのポリアデニル化および翻訳を制御することを示し,それが実際に,シナプス可塑性の双方向性の制御に重要な役割をはたしていることを示した(図2).また,ポリAポリメラーゼであるGld2により制御されるmRNAを網羅的に同定し,そのうちのひとつ,NMDA受容体のサブユニットであるNR2AをコードするmRNAの翻訳が双方向性に制御されていることを示した(図2).しかしながら,樹状突起において翻訳制御を担うと考えられるRNA結合タンパク質は,脆弱X症候群の原因となるFMRPや,そのほかのCPEBファミリータンパク質など,多数が存在する7).また,CPEBはGld2だけでなく,別のポリAポリメラーゼGld4を介した翻訳制御も担う8).異なるシナプスへの刺激に応じて,このような複雑な翻訳制御ネットワークがどのように制御されているかを解明することが今後の課題となる.
略歴:2004年 東京大学大学院新領域創成科学研究科 修了,米国Kansas州立大学 研究員,米国Massachusetts大学Medical School研究員を経て,2012年より名古屋大学大学院医学系研究科 特任助教.
関心事:翻訳制御によるさまざまな生体機能の制御.現在はおもに,神経可塑性,学習と記憶の翻訳制御や神経疾患.
Sharon A. Swanger
米国Emory大学School of Medicine研究員.
Joel D. Richter
米国Massachusetts大学Medical School教授.
© 2012 宇田川 剛・Sharon A. Swanger・Joel D. Richter Licensed under CC 表示 2.1 日本
(1米国Massachusetts大学Medical School,Program in Molecular Medicine,2米国Emory大学School of Medicine,Department of Cell Biology)
email:宇田川 剛
DOI: 10.7875/first.author.2012.096
Bidirectional control of mRNA translation and synaptic plasticity by the cytoplasmic polyadenylation complex.
Tsuyoshi Udagawa, Sharon A. Swanger, Koichi Takeuchi, Jong Heon Kim, Vijayalaxmi Nalavadi, Jihae Shin, Lori J. Lorenz, R. Suzanne Zukin, Gary J. Bassell, Joel D. Richter
Molecular Cell, 47, 253-266 (2012)
要 約
樹状突起における翻訳制御はある種の神経可塑性や学習と記憶に必須である.CPEBは樹状突起において翻訳を制御する配列特異的なRNA結合タンパク質である.筆者らは,樹状突起においてCPEBを介しmRNAのポリアデニル化を制御する細胞質ポリアデニル化複合体の構成タンパク質として,ポリAポリメラーゼGld2,デアデニラーゼPARN,翻訳阻害タンパク質Ngdを同定した.シナプスへの刺激は樹状突起におけるCPEBのリン酸化,PARNの細胞質ポリアデニル化複合体からの放出,mRNAのポリアデニル化を誘導した.Gld2によりポリアデニル化の制御されるmRNAをスクリーニングすることにより,NMDA受容体のサブユニットであるNR2AをコードするmRNAを含む100以上のmRNAを同定した.さらに,Gld2とNgdは樹状突起におけるNR2Aの翻訳をそれぞれ促進あるいは抑制することが示された.in vivoにおけるGld2のノックダウンは海馬歯状回のシナプスにおいて翻訳に依存的な長期増強を抑制し,反対に,Ngdのノックダウンは長期増強を亢進することが示された.これらの結果は,樹状突起における局所的なmRNAのポリアデニル化と,Gld2およびNgdによる双方向性の翻訳制御が,海馬におけるシナプス可塑性に中心的な役割をはたしていることを示した.
はじめに
翻訳の空間的な制御は多様な細胞機能において種をこえ重要である.ニューロンにおいては,経験により誘導されるシナプス結合性の制御(シナプス可塑性)が学習と記憶の基盤になっていると考えられている.この制御にはシナプスへの刺激に応じた新規のタンパク質合成が必要とされ,シナプスあるいはその近傍における局所的かつ特異的な翻訳がこれに関与するものと考えられている1,2)(図1).CPEBはそのような翻訳制御を行うRNA結合タンパク質のひとつと考えられる.CPEBはアフリカツメガエルの卵母細胞において特異的なmRNAの3’側非翻訳領域に結合し,そのポリアデニル化を制御することにより翻訳レベルにおいて減数分裂を制御することが知られている.哺乳類では海馬において高い発現を示し,実際に,CPEBノックアウトマウスはある種のシナプス可塑性および学習と記憶に異常をきたす3-5).しかしながら,ニューロンにおいてCPEBがどのように翻訳を制御しているのか,また,CPEBによるmRNAのポリアデニル化の制御がシナプス可塑性において必要とされるのかどうかについては不明であった.筆者らは,樹状突起において,CPEBを含む細胞質ポリアデニル化複合体の同定,局所的な翻訳の制御機構,ポリアデニル化により制御されるmRNAの同定,in vivoにおけるシナプス可塑性への影響を解析した.
1.樹状突起における細胞質ポリアデニル化複合体の同定
CPEBを含む複合体の構成タンパク質について,マウスの脳における分布を免疫染色および生化学的に調製したシナプス画分を用いて調べたところ,CPEB,Gld2,PARN,Neuroguidin(Ngd),CPSF,Symplekinといった,アフリカツメガエルにおいて同定されていた細胞質ポリアデニル化複合体を構成するタンパク質が海馬の樹状突起およびシナプス画分に存在することが示された.また,免疫沈降によりこれらのタンパク質が複合体を形成していることも示された.海馬培養ニューロンを用いた共染色では,これらのタンパク質が樹状突起や樹状突起スパイン(シナプス後部)において共局在していることが示された.これらの結果から,CPEBを含む細胞質ポリアデニル化複合体がシナプスにおける局所的な翻訳を制御している可能性が示唆された.
2.シナプスへの刺激はCPEBのリン酸化,PARNのポリアデニル化複合体からの放出,mRNAのポリアデニル化を誘導する
細胞質ポリアデニル化複合体による局所的な翻訳制御機構を明らかにするため,その構成タンパク質のシナプスへの刺激に応じた変化を解析した.海馬培養ニューロンをNMDAにより刺激し,抗リン酸化CPEB抗体と抗CPEB抗体により免疫染色して定量的な解析を行ったところ,樹状突起においてNMDAによる刺激によりCPEBのリン酸化が誘導されることがわかった.さらに,同じ刺激による細胞質ポリアデニル化複合体の構成タンパク質の共局在を解析したところ,PARNとCPEBおよびSymplekinとの共局在が低下したことから,NMDAによる刺激によりCPEBがリン酸化されると,PARNは細胞質ポリアデニル化複合体から放出されることが示唆された.また,オリゴdTプローブを用いたin situハイブリダイゼーションにより,樹状突起においてNMDAによる刺激に応じたポリAの量の増加がみられた.これらの結果は,細胞質ポリアデニル化複合体がNMDAによる刺激に応じて局所的に再構成され,特異的なmRNAのポリアデニル化,および,翻訳の促進を誘導することを示唆した.さらに,海馬培養ニューロンにおいてGld2をノックダウンするとポリAの量は低下した.このことは,Gld2は樹状突起においてmRNAのポリアデニル化を担うポリAポリメラーゼのひとつであることを示していた.
3.ポリAポリメラーゼGld2により制御されるmRNAの同定
ニューロンにおいてGld2によりポリアデニル化の制御されるmRNAを同定するため,以下のようなスクリーニングを行った.まず,対照となる海馬培養ニューロンとGld2をノックダウンした海馬培養ニューロンを調製した.それぞれのニューロンから全RNAを抽出し,これらを常温でポリU-SepharoseカラムにロードしてmRNAだけを結合させた.つづいて,50℃の緩衝液でカラムを洗浄しポリA鎖が50ヌクレオチド以下のmRNAを除いた.最後に,65℃の緩衝液で長いポリA鎖をもつmRNAだけを溶出した.対照となる全RNAと,Gld2をノックダウンしたニューロンの全RNAと65℃溶出画分を用いてマイクロアレイ解析を行った.その結果,Gld2をノックダウンしたニューロンの65℃溶出画分でのみ発現の低下しているmRNA,すなわち,Gld2のノックダウンによりポリA鎖が短縮したと考えられる100以上のmRNAが同定された.これらのうち,28のmRNAはシナプス可塑性や神経疾患に関与する遺伝子をコードしていた.
4.Gld2とNgdはNMDA受容体のサブユニットをコードするmRNAの局所的な翻訳を制御する
同定されたGld2の標的となるmRNAのうち,シナプス可塑性において非常に重要なNMDA受容体のサブユニットNR2AをコードするmRNAについて,さらに解析を行った.まず,NR2 mRNAは細胞体だけでなく樹状突起にも局在することがin situハイブリダイゼーションにより示され,NR2 mRNAは局所的な翻訳制御をうける可能性が考えられた.NR2Aの定量的な免疫染色を行ったところ,樹状突起におけるNR2Aのタンパク質量はGld2のノックダウンにより低下した.一方,細胞体におけるNR2Aのタンパク質量およびmRNA量は一定であった.また,PCR法によるポリA鎖長の解析により,NR2 mRNAのポリアデニル化はGld2により促進されること,さらに,NMDAによる刺激や長期増強(long-term potentiation:LTP)を惹起するグリシンによる刺激はNR2 mRNAのポリアデニル化を誘導することが示された.これらの結果は,Gld2がNR2 mRNAのポリアデニル化および翻訳を局所的に制御していることを示唆した.さらに,細胞質ポリアデニル化複合体の構成タンパク質のうち翻訳阻害タンパク質であるNgdをノックダウンした場合には,Gld2のノックダウンとは反対に,NR2 mRNAの樹状突起における翻訳は促進された.以上の結果は,細胞質ポリアデニル化複合体の構成タンパク質であるGld2とNgdはNR2 mRNAの翻訳を双方向に制御することを示しており,シナプス可塑性において細胞質ポリアデニル化複合体が重要な役割をはたすことを強く示唆した.
5.Gld2とNgdは海馬におけるシナプス可塑性および形態を双方向に制御する
CPEBノックアウトマウスでは海馬のシャッファー側枝-CA1シナプスにおけるシータバースト刺激により誘導される長期増強が阻害される3).この長期増強はNMDA受容体からのシグナル伝達を必要とし,翻訳に依存的である.また,海馬CA1において長期増強を誘導する刺激はNMDA受容体に依存的にCPEBをリン酸化することが知られている6).しかしながら,これまでのところmRNAのポリアデニル化とシナプス可塑性との直接的な因果関係については明らかにされていない.そこで,細胞質ポリアデニル化複合体の構成タンパク質であるGld2,PARN,Ngdに対するshRNAを発現するレンチウイルスをラットの海馬に導入し,シナプス可塑性への影響を調べた.レンチウイルスの定位的な注入により,注入ののち2週間でそれぞれのタンパク質のノックダウンが海馬歯状回においてとくに顕著に確認された.そこで,この部位を用いてシータバースト刺激により惹起される長期増強を記録した.まず,タンパク質合成阻害剤アニソマイシンを用いた実験により,この長期増強はタンパク質合成に依存的であることが示された.Gld2のノックダウンでは長期増強はアニソマイシンによる処理と同様に阻害された.このことは,Gld2によるmRNAのポリアデニル化がシナプス可塑性に必要とされることを示していた.PARNのノックダウンは長期増強に影響を及ぼさなかったが,細胞質ポリアデニル化複合体に含まれるもうひとつの翻訳抑制タンパク質であるNgdのノックダウンでは長期増強は亢進した.また,Gld2のノックダウンとNgdのノックダウンは成熟型の樹状突起スパインをそれぞれ減少あるいは増加させた.これらの結果は,細胞質ポリアデニル化複合体の構成タンパク質であるGld2とNgdは海馬におけるシナプス可塑性および形態を双方向に制御していることを示していた.
おわりに
シナプス可塑性や学習と記憶におけるタンパク質合成の重要性は古くから知られていたが,シナプスにおける特異的なmRNAの翻訳制御機構が明らかにされた例はほとんどない.筆者らは,アフルカツメガエルにおいて減数分裂を制御するCPEBが,ニューロンでは樹状突起において局所的にmRNAのポリアデニル化および翻訳を制御することを示し,それが実際に,シナプス可塑性の双方向性の制御に重要な役割をはたしていることを示した(図2).また,ポリAポリメラーゼであるGld2により制御されるmRNAを網羅的に同定し,そのうちのひとつ,NMDA受容体のサブユニットであるNR2AをコードするmRNAの翻訳が双方向性に制御されていることを示した(図2).しかしながら,樹状突起において翻訳制御を担うと考えられるRNA結合タンパク質は,脆弱X症候群の原因となるFMRPや,そのほかのCPEBファミリータンパク質など,多数が存在する7).また,CPEBはGld2だけでなく,別のポリAポリメラーゼGld4を介した翻訳制御も担う8).異なるシナプスへの刺激に応じて,このような複雑な翻訳制御ネットワークがどのように制御されているかを解明することが今後の課題となる.
文 献
- Kandel, E. R.: The molecular biology of memory storage: a dialogue between genes and synapses. Science, 294, 1030-1038 (2001)[PubMed]
- Sutton, M. A. & Schuman, E. M.: Dendritic protein synthesis, synaptic plasticity, and memory. Cell, 127, 49-58 (2006)[PubMed]
- Alarcon, J. M., Hodgman, R., Theis, M. et al.: Selective modulation of some forms of schaffer collateral-CA1 synaptic plasticity in mice with a disruption of the CPEB-1 gene. Learn. Mem., 11, 318-327 (2004)[PubMed]
- Berger-Sweeney, J., Zearfoss, N. R. & Richter, J. D.: Reduced extinction of hippocampal-dependent memories in CPEB knockout mice. Learn. Mem., 13, 4-7 (2006)[PubMed]
- Richter, J. D.: CPEB: a life in translation. Trends Biochem. Sci., 32, 279-285 (2007)[PubMed]
- Atkins, C. M., Davare, M. A., Oh, M. C. et al.: Bidirectional regulation of cytoplasmic polyadenylation element-binding protein phosphorylation by Ca2+/Calmodulin-dependent protein kinase II and protein phosphatase I during hippocampal long-term potentiation. J. Neurosci., 25, 5604-5610 (2005)[PubMed]
- Darnell, J. C. & Richter, J. D.: Cytoplasmic RNA-binding proteins and the control of complex brain function. Cold Spring Harb. Perspect. Biol., 4, a012344 (2012)[PubMed]
- Burns, D. M., d'Ambrogio, A., Nottrott, S. et al.: CPEB and two poly(A) polymerases control miR-122 stability and p53 mRNA translation. Nature, 473, 105-108 (2011)[PubMed]
著者プロフィール
略歴:2004年 東京大学大学院新領域創成科学研究科 修了,米国Kansas州立大学 研究員,米国Massachusetts大学Medical School研究員を経て,2012年より名古屋大学大学院医学系研究科 特任助教.
関心事:翻訳制御によるさまざまな生体機能の制御.現在はおもに,神経可塑性,学習と記憶の翻訳制御や神経疾患.
Sharon A. Swanger
米国Emory大学School of Medicine研究員.
Joel D. Richter
米国Massachusetts大学Medical School教授.
© 2012 宇田川 剛・Sharon A. Swanger・Joel D. Richter Licensed under CC 表示 2.1 日本