DNAポリメラーゼηによるリン酸ジエステル結合の形成の過程を観察する
中村照也1・山縣ゆり子1・Wei Yang 2
(1熊本大学大学院生命科学研究部 機能分子構造解析学,2米国NIH National Institute of Diabetes & Digestive & Kidney Diseases,Laboratory of Molecular Biology)
email:中村照也,山縣ゆり子
DOI: 10.7875/first.author.2012.097
Watching DNA polymeraseη make a phosphodiester bond.
Teruya Nakamura, Ye Zhao, Yuriko Yamagata, Yue-jin Hua, Wei Yang
Nature, 487, 196-201 (2012)
DNA合成反応は生命現象の根幹ともいえる酵素反応であり,これまで,X線結晶構造解析や反応速度解析をはじめとするさまざまな手法により研究されてきた.DNAポリメラーゼは2つのMg2+を必要とする2金属イオン機構によりヌクレオチド転移反応を行うとされているが,その反応過程の全体を可視化した例はない.この研究では,時分割X線結晶学によりヒトのDNAポリメラーゼηがリン酸ジエステル結合を形成する過程を観察した.まず,真の基質であるdATPを用いているが反応は起こらない状態にあるDNAポリメラーゼη-DNA-dATP複合体の結晶をpH 6.0,Ca2+存在下において調製し,この結晶をpH 7.0,Mg2+存在下に移行して反応を開始させた.反応の停止は結晶を凍結することにより行い,反応の開始から300秒後まで,約40秒の間隔で中間体の構造を決定した.dATPと2つのMg2+が反応開始位置にきたのち,DNAプライマー鎖の末端の3'-OH基が脱プロトン化をうけて,糖のコンフォメーションを変えながらリン酸ジエステル結合を形成していく過程が明らかになった.さらに,第3のMg2+が反応中間体を安定化するようすが観察されたが,これは,これまで想定されてきた2金属イオン機構では認められていない,DNAポリメラーゼにおける共通の特徴なのかもしれない.
DNAポリメラーゼはヌクレオチド転移反応を触媒してDNAを合成する酵素であり,DNA鋳型鎖の塩基と相補的なdNTPを取り込み,DNAプライマー鎖の末端の3’-OH基とdNTPのαリン原子とのあいだにリン酸ジエステル結合を形成し,dNTPのαリン原子とβリン原子とのあいだの結合を切断する.その結果,DNA鎖は1ヌクレオチド分だけ伸長し,ピロリン酸が遊離する.この反応は,2つのMg2+に依存的な,5価のリン中間体をへたSN2反応により進行すると考えられており1),すべてのDNAポリメラーゼとRNAポリメラーゼ,また,多くのヌクレアーゼはこれとよく似た機構により反応を触媒することが示唆されている.
DNA合成反応に関する研究は,これまで,反応速度解析,X線結晶構造解析,計算化学などの手法により行われてきた.X線結晶構造解析では,反応の起こらないdNTPアナログや反応を阻害するCa2+などを用いたときのDNAポリメラーゼの構造から反応機構が推定されてきた.また,DNAポリメラーゼの結晶にdNTPをくわえると結晶内においてDNA合成反応の起こることが報告されているが,実際のDNA合成反応の過程を可視化した例はまだない.その理由として,DNAポリメラーゼにかぎらず酵素の結晶内における反応を詳細に追跡するには酵素反応は一般にきわめて速いこと,結晶内に詰まっている酵素が同じタイミングで一斉に反応を行う状態をつくりだすのが困難なこと,酵素反応の進行により結晶が壊れること,などがあげられる.
筆者らは,DNAポリメラーゼのなかでも複製型のDNAポリメラーゼと比べ反応速度が遅く2,3),反応のときの構造の変化が小さい4),という特徴をもつヒトのDNAポリメラーゼηに注目した.このDNAポリメラーゼηは,紫外線により生じる損傷のひとつであるチミン二量体が存在するとDNA合成反応が停止してしまう複製型のDNAポリメラーゼに代わり,その損傷を乗り越えてDNA合成反応を行うことのできる特殊なDNAポリメラーゼである.DNAポリメラーゼηをコードする遺伝子の変異は,紫外線による皮膚がんの発症率に顕著な上昇のみられる色素性乾皮症の原因のひとつともなっている5).DNAポリメラーゼηの触媒ドメイン,DNA,基質のアナログdNTPからなる複合体の構造は1.8Å分解能で決定され,DNAポリメラーゼηがDNA損傷部位であるチミン二量体を安定化しながら複製するしくみが明らかにされている6).今回,筆者らは,DNAポリメラーゼηの結晶において酵素反応は比較的ゆっくりと進行することを見い出し,時分割X線結晶学を用いてDNAポリメラーゼηによるリン酸ジエステル結合の形成の過程を観察した.
結晶内における反応を行うにあたり,まず,真の基質を用いるが反応の起こらない状態にある結晶構造を得る必要があった.溶液におけるDNAポリメラーゼηのヌクレオチド転移活性は,pH 6.0ではきわめて低いが,pHの上昇(pH 8.0まで)とともに高くなる.また,1 mMのCa2+存在下ではその活性は完全に阻害されることから,DNAポリメラーゼη,DNA,dATPからなる複合体の結晶をpH 6.0,Ca2+存在下において調製した.0.9 mMのMg2+存在下に0.1 mMでもCa2+が含まれると,1 mMのMg2+存在下と比べ1/3程度の活性しか示さなくなったことから,金属イオンの結合部位であるAサイトとBサイトの両方にMg2+が結合してはじめて活性の発揮されることがわかった.
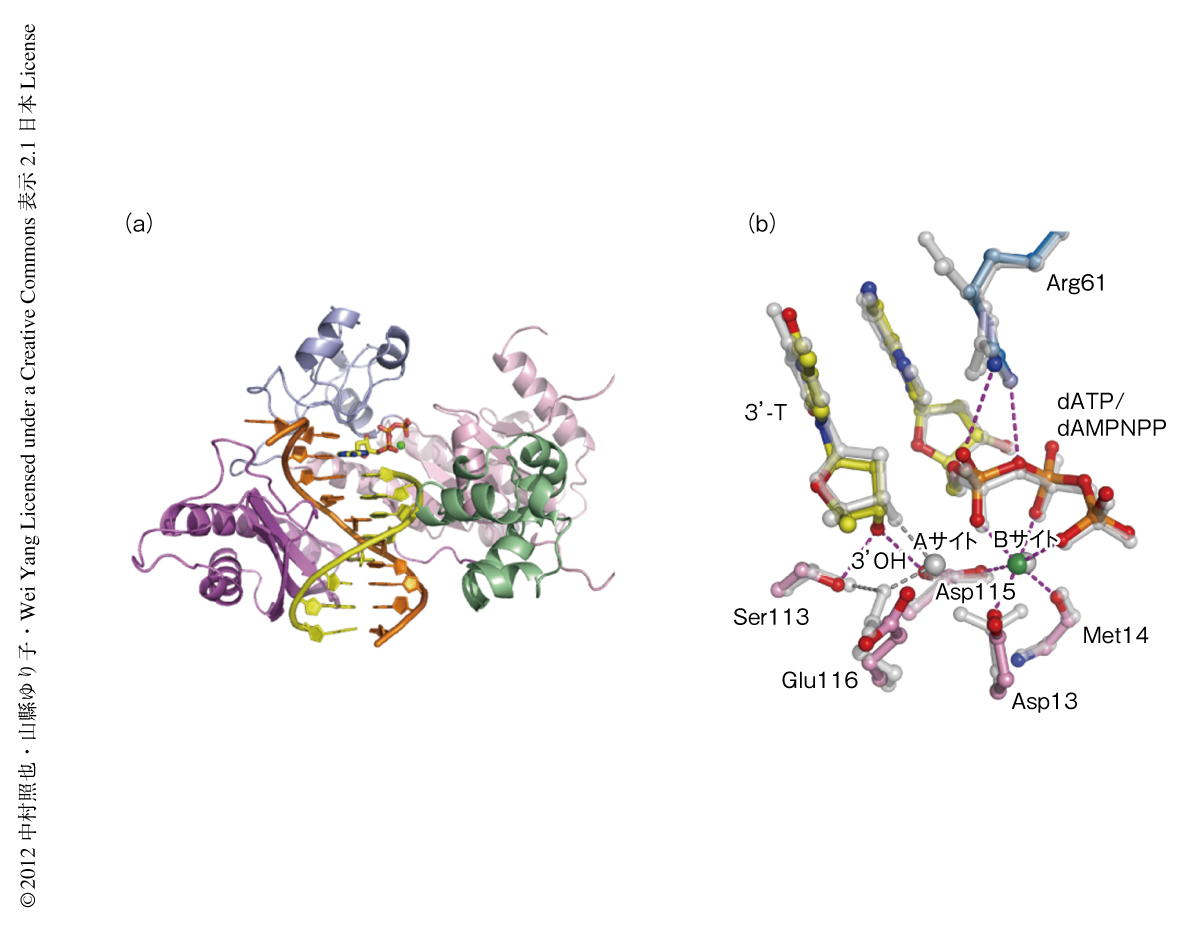
DNAポリメラーゼη-DNA-dATP-Ca2+の構造を1.50Å分解能で決定した(PDB ID:4ECQ).金属イオンの結合部位であるBサイトにはCa2+が結合しており,dATPおよびDNAポリメラーゼηの活性残基と6配位構造を形成していたが,もうひとつの金属イオンの結合部位であるAサイトには金属イオンに相当する電子密度はほとんどみられず,予想したとおり,ヌクレオチド転移反応の起こっていないDNAポリメラーゼηの構造が得られた(図1).この構造は,さきに報告のあるDNAポリメラーゼη,DNA,反応の起こらないdATPアナログであるdAMPNPP,Mg2+からなる複合体の構造6)(PDB ID:3MR2)と似ていたが,Aサイトに金属イオンが結合していないため,DNAプライマー鎖の末端の3’-OH基がdATPから離れてSer113およびAsp115と水素結合を形成していて,活性残基であるAsp13とGlu116も異なったコンフォメーションをとっていた.また,dAMPNPPが真の基質であるdATPと代わることで,Arg61はαリン酸と安定した水素結合を形成していた.このDNAポリメラーゼη-DNA-dATP-Ca2+の構造を基底構造とよぶ.
ヌクレオチド転移反応は,DNAポリメラーゼηの結晶をpH 6.8もしくはpH 7.0,1 mM Mg2+溶液に浸漬することで開始させ,40秒から300秒まで約40秒の間隔で結晶を液体窒素で凍結することで反応を停止させた.X線回折強度データは1.50Å~1.95Å分解能で収集した.反応の進行は3’-OH基およびdATPのαリン酸の周辺における電子密度の変化により確認し,反応時間の経過とともに3’-OH基とdATPのαリン原子とのあいだにリン酸ジエステル結合の形成されていくようすが明らかになった.結晶内における反応は溶液の状態と比べ約20~100倍も遅く,これは結晶内では分子の運動が制限されていることがおもな原因だと考えられた.
反応時間ごとの構造の変化をみていったところ,40秒以内にMg2+がAサイトに結合し,Bサイトでは約50%のCa2+がMg2+と置き換わることにより,3’-OH基とdATPが近づき反応開始位置にきていた.この構造は,DNAポリメラーゼη-DNA-dAMPNPP-Mg2+の構造6)(PDB ID:3MR2)とほとんど同じであり,リン酸ジエステル結合の形成もまだみられていなかったため,反応前構造とよぶ.リン酸ジエステル結合の形成は80秒後からみられ,200秒後の時点では約60~70%が完了し,200秒後から300秒後にはプラトーに達した.反応速度は140秒後くらいから減少したが,これは結晶内において逆反応の起こっていることが考えられた.また,結晶内のごく一部のDNAが反応ののちにトランスローケーションを起こしたため,反応の後期には電子密度の強度の減少する結果が得られた.
230秒後のαリン酸の周辺における電子密度は,いっけん,5価のリンの遷移状態の構造にみえたが,精密化を行うとαリン酸の周辺には残差電子密度がみられた.また,高エネルギーかつ不安定な遷移状態の性質を考慮し,反応時間ごとの構造は,反応前構造と反応後構造(リン酸ジエステル結合の形成ののちの構造)の割合を反応曲線をもとに変えることによりうまく精密化することができた.たとえば,230秒後の構造(1.52Å分解能,PDB ID:4ECV)は40%の反応前構造と60%の反応後構造により精密化した.反応の前後の構造の比較から,3’-OH基がdATPに0.5Å近づき,糖のコンフォメーションが反応前のC2’-endo型から反応後のC3’-endo型へと変わりながら,リン酸ジエステル結合の形成されることがわかった.リン酸ジエステル結合が形成されたのち,dATPのαリン原子は1.4Å移動し,Arg61がdATPから解離するとともに,そこに新たなMg2+の結合するようすが明らかになった.
Aファミリー,Bファミリー,Xファミリーに属するDNAポリメラーゼの結晶構造では,DNAプライマー鎖の3’末端の糖のコンフォメーションはC3’-endo型(A型)である.この構造は浅いマイナー溝を形成し,DNAポリメラーゼがdNTPを選択する際に重要であると考えられている.一方,DNAポリメラーゼηを含むYファミリーのDNAポリメラーゼではDNAプライマー鎖の3’末端の糖はC2’-endo型の構造をとっている4).今回のDNAポリメラーゼηの基底構造および反応前構造ではDNAプライマー鎖の3’末端の糖のコンフォメーションはC2’-endo型であったが,リン酸ジエステル結合の形成がはじまると,糖のC2’原子とdATPの酸素原子のあいだに生じる立体障害をさけるようにC3’-endo型へと変わった.また,DNAプライマー鎖の3’末端をC3’-endo型の構造をとるリボヌクレオチドに置換してDNAポリメラーゼηの活性を測定したところ,通常のデオキシリボヌクレオチドの場合と同等の活性を示した.これらのことから,DNAの複製においてDNAプライマー鎖の3’末端がC3’-endo型の構造をとることが重要であることが示された.
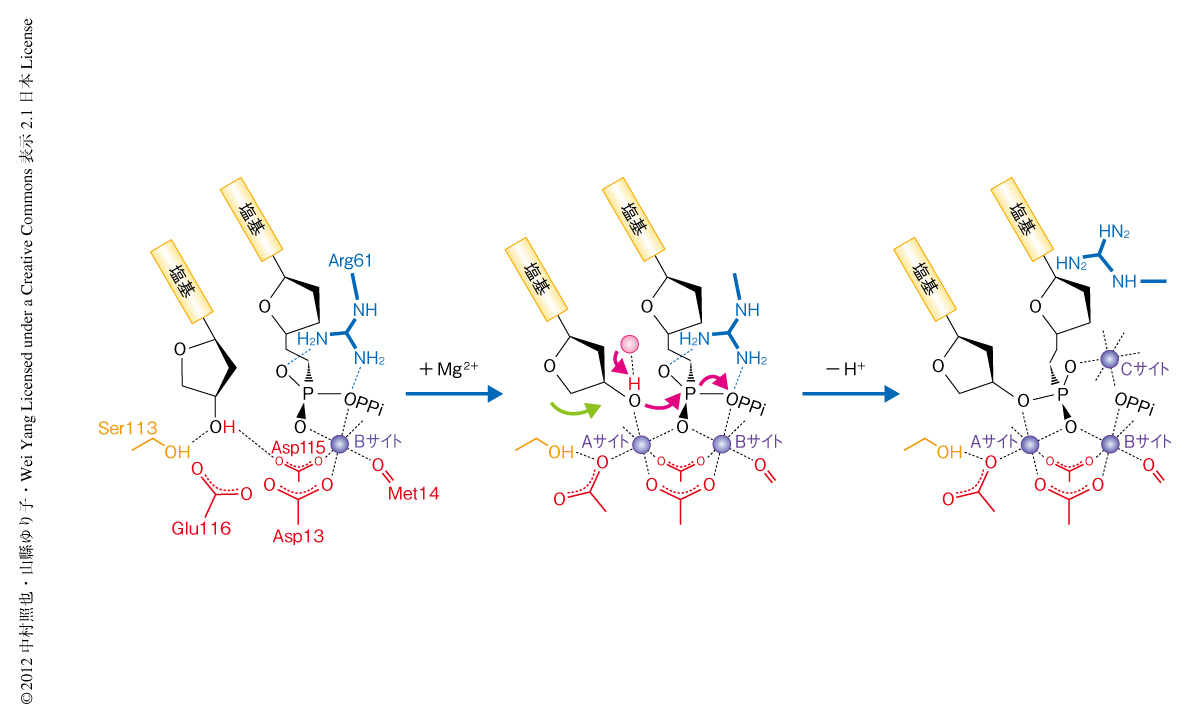
活性部位の動きが明らかになる一方で,予期しなかった2つの電子密度のピークが観察された.ひとつは3’-OH基から水素結合をとる距離に位置し,80秒後に強く現われ,140秒後を境に著しい減少がみられた.この電子密度は,DNAポリメラーゼη-DNA-dAMPNPP-Mg2+の構造6)(PDB ID:3MR2)でも同じ位置に安定して結合していた水分子であると判断できた.80秒後の構造ではこの水分子は3’-OH基およびdATPのO4’と水素結合を形成していたが,反応ののちにはC3’-endo型に構造の変化した糖と立体障害を起こすため,リン酸ジエステル結合の形成とともにこの水分子は遊離していった.観察された電子密度の変化はこのようすをとらえているといえた.ヌクレオチド転移反応では3’-OH基が脱プロトン化をうけたのちdATPのαリン原子に対し求核攻撃を行うとされており,水分子による脱プロトン化を介した反応機構はほかのDNAポリメラーゼでも報告されている7,8).DNAポリメラーゼηの場合は,この水分子以外に,Ser113が3’-OH基と水素結合を形成していたが,このSer残基をAla残基に置換したDNAポリメラーゼη変異体の活性を測定したところ反応速度定数kcatにほとんど影響はみられなかった.これらの結果から,この水分子はAサイトのMg2+および3’-OH基が反応開始位置にきたあとに3’-OH基と結合してプロトンを引き抜き,リン酸ジエステル結合の形成が起こるという機構を提案した.
もうひとつの電子密度のピークは,AサイトおよびBサイトの反対側のdATPのαリン酸と非常に近い距離に位置し,140秒後から観察された.1.52Å分解能の230秒後の構造から結合距離の短い6配位構造をとっていることがわかり,この電子密度はMg2+であると判断した.この第3のMg2+は反応の進行とともにdATPから遊離するArg61と置き換わり,反応ののち生じる2つの反応生成物に架橋していることから,反応の遷移状態で生じる負電荷を中和し,反応生成物であるピロリン酸のプロトン化を手助けしているものと考えられた.
リン酸転移酵素では活性部位に3つの金属イオンの結合している構造が多くみられる.たとえば,エンドヌクレアーゼIVの基質複合体と反応生成物との複合体にみられる3つのZn2+の空間配置は9),今回のDNAポリメラーゼηの3つのMg2+を連想させ,グループIイントロンにおいても化学プローブを用いた実験により3つの金属イオンが同様の配置において触媒することが提案されている10).しかしながら,グループIイントロンの結晶構造において第3の金属イオンが観察されていないのは11),反応中のみに関与するというその一過的な性質によるものなのかもしれない.
これまで,DNAポリメラーゼによるヌクレオチド転移反応にかぎらず,ほとんどの酵素反応の機構は,基質のアナログや活性を失った変異型酵素などを用いそれぞれの反応段階を模した構造から推測されてきた.また,結晶内において反応を行うことで反応中間体をとらえた例も報告されているが,反応過程の全体を詳細に追跡した例はなかった.この研究では,DNAポリメラーゼηの結晶における遅い反応を利用し,反応中間体の構造をより高い時間分解能かつ空間分解能で決定していき,ヌクレオチド転移反応の過程をリアルタイムかつ原子レベルで観察することに成功した(図2).今回,明らかにした反応機構のなかでも,第3のMg2+が関与することは,これまで想定されてきた2金属イオン機構では確認されていない,DNAポリメラーゼのもつ共通の特徴なのかもしれない.
略歴:2006年より熊本大学大学院生命科学研究部 助教.2010年 熊本大学大学院薬学教育部にて博士号取得.
研究テーマ:核酸にはたらくタンパク質の構造生物学.
山縣 ゆり子(Yuriko Yamagata)
熊本大学大学院生命科学研究部 教授.
Wei Yang
米国NIH National Institute of Diabetes & Digestive & Kidney Diseases主任研究員.
© 2012 中村照也・山縣ゆり子・Wei Yang Licensed under CC 表示 2.1 日本
(1熊本大学大学院生命科学研究部 機能分子構造解析学,2米国NIH National Institute of Diabetes & Digestive & Kidney Diseases,Laboratory of Molecular Biology)
email:中村照也,山縣ゆり子
DOI: 10.7875/first.author.2012.097
Watching DNA polymeraseη make a phosphodiester bond.
Teruya Nakamura, Ye Zhao, Yuriko Yamagata, Yue-jin Hua, Wei Yang
Nature, 487, 196-201 (2012)
要 約
DNA合成反応は生命現象の根幹ともいえる酵素反応であり,これまで,X線結晶構造解析や反応速度解析をはじめとするさまざまな手法により研究されてきた.DNAポリメラーゼは2つのMg2+を必要とする2金属イオン機構によりヌクレオチド転移反応を行うとされているが,その反応過程の全体を可視化した例はない.この研究では,時分割X線結晶学によりヒトのDNAポリメラーゼηがリン酸ジエステル結合を形成する過程を観察した.まず,真の基質であるdATPを用いているが反応は起こらない状態にあるDNAポリメラーゼη-DNA-dATP複合体の結晶をpH 6.0,Ca2+存在下において調製し,この結晶をpH 7.0,Mg2+存在下に移行して反応を開始させた.反応の停止は結晶を凍結することにより行い,反応の開始から300秒後まで,約40秒の間隔で中間体の構造を決定した.dATPと2つのMg2+が反応開始位置にきたのち,DNAプライマー鎖の末端の3'-OH基が脱プロトン化をうけて,糖のコンフォメーションを変えながらリン酸ジエステル結合を形成していく過程が明らかになった.さらに,第3のMg2+が反応中間体を安定化するようすが観察されたが,これは,これまで想定されてきた2金属イオン機構では認められていない,DNAポリメラーゼにおける共通の特徴なのかもしれない.
はじめに
DNAポリメラーゼはヌクレオチド転移反応を触媒してDNAを合成する酵素であり,DNA鋳型鎖の塩基と相補的なdNTPを取り込み,DNAプライマー鎖の末端の3’-OH基とdNTPのαリン原子とのあいだにリン酸ジエステル結合を形成し,dNTPのαリン原子とβリン原子とのあいだの結合を切断する.その結果,DNA鎖は1ヌクレオチド分だけ伸長し,ピロリン酸が遊離する.この反応は,2つのMg2+に依存的な,5価のリン中間体をへたSN2反応により進行すると考えられており1),すべてのDNAポリメラーゼとRNAポリメラーゼ,また,多くのヌクレアーゼはこれとよく似た機構により反応を触媒することが示唆されている.
DNA合成反応に関する研究は,これまで,反応速度解析,X線結晶構造解析,計算化学などの手法により行われてきた.X線結晶構造解析では,反応の起こらないdNTPアナログや反応を阻害するCa2+などを用いたときのDNAポリメラーゼの構造から反応機構が推定されてきた.また,DNAポリメラーゼの結晶にdNTPをくわえると結晶内においてDNA合成反応の起こることが報告されているが,実際のDNA合成反応の過程を可視化した例はまだない.その理由として,DNAポリメラーゼにかぎらず酵素の結晶内における反応を詳細に追跡するには酵素反応は一般にきわめて速いこと,結晶内に詰まっている酵素が同じタイミングで一斉に反応を行う状態をつくりだすのが困難なこと,酵素反応の進行により結晶が壊れること,などがあげられる.
筆者らは,DNAポリメラーゼのなかでも複製型のDNAポリメラーゼと比べ反応速度が遅く2,3),反応のときの構造の変化が小さい4),という特徴をもつヒトのDNAポリメラーゼηに注目した.このDNAポリメラーゼηは,紫外線により生じる損傷のひとつであるチミン二量体が存在するとDNA合成反応が停止してしまう複製型のDNAポリメラーゼに代わり,その損傷を乗り越えてDNA合成反応を行うことのできる特殊なDNAポリメラーゼである.DNAポリメラーゼηをコードする遺伝子の変異は,紫外線による皮膚がんの発症率に顕著な上昇のみられる色素性乾皮症の原因のひとつともなっている5).DNAポリメラーゼηの触媒ドメイン,DNA,基質のアナログdNTPからなる複合体の構造は1.8Å分解能で決定され,DNAポリメラーゼηがDNA損傷部位であるチミン二量体を安定化しながら複製するしくみが明らかにされている6).今回,筆者らは,DNAポリメラーゼηの結晶において酵素反応は比較的ゆっくりと進行することを見い出し,時分割X線結晶学を用いてDNAポリメラーゼηによるリン酸ジエステル結合の形成の過程を観察した.
1.DNAポリメラーゼηの基底構造
結晶内における反応を行うにあたり,まず,真の基質を用いるが反応の起こらない状態にある結晶構造を得る必要があった.溶液におけるDNAポリメラーゼηのヌクレオチド転移活性は,pH 6.0ではきわめて低いが,pHの上昇(pH 8.0まで)とともに高くなる.また,1 mMのCa2+存在下ではその活性は完全に阻害されることから,DNAポリメラーゼη,DNA,dATPからなる複合体の結晶をpH 6.0,Ca2+存在下において調製した.0.9 mMのMg2+存在下に0.1 mMでもCa2+が含まれると,1 mMのMg2+存在下と比べ1/3程度の活性しか示さなくなったことから,金属イオンの結合部位であるAサイトとBサイトの両方にMg2+が結合してはじめて活性の発揮されることがわかった.
DNAポリメラーゼη-DNA-dATP-Ca2+の構造を1.50Å分解能で決定した(PDB ID:4ECQ).金属イオンの結合部位であるBサイトにはCa2+が結合しており,dATPおよびDNAポリメラーゼηの活性残基と6配位構造を形成していたが,もうひとつの金属イオンの結合部位であるAサイトには金属イオンに相当する電子密度はほとんどみられず,予想したとおり,ヌクレオチド転移反応の起こっていないDNAポリメラーゼηの構造が得られた(図1).この構造は,さきに報告のあるDNAポリメラーゼη,DNA,反応の起こらないdATPアナログであるdAMPNPP,Mg2+からなる複合体の構造6)(PDB ID:3MR2)と似ていたが,Aサイトに金属イオンが結合していないため,DNAプライマー鎖の末端の3’-OH基がdATPから離れてSer113およびAsp115と水素結合を形成していて,活性残基であるAsp13とGlu116も異なったコンフォメーションをとっていた.また,dAMPNPPが真の基質であるdATPと代わることで,Arg61はαリン酸と安定した水素結合を形成していた.このDNAポリメラーゼη-DNA-dATP-Ca2+の構造を基底構造とよぶ.
2.結晶内におけるヌクレオチド転移反応
ヌクレオチド転移反応は,DNAポリメラーゼηの結晶をpH 6.8もしくはpH 7.0,1 mM Mg2+溶液に浸漬することで開始させ,40秒から300秒まで約40秒の間隔で結晶を液体窒素で凍結することで反応を停止させた.X線回折強度データは1.50Å~1.95Å分解能で収集した.反応の進行は3’-OH基およびdATPのαリン酸の周辺における電子密度の変化により確認し,反応時間の経過とともに3’-OH基とdATPのαリン原子とのあいだにリン酸ジエステル結合の形成されていくようすが明らかになった.結晶内における反応は溶液の状態と比べ約20~100倍も遅く,これは結晶内では分子の運動が制限されていることがおもな原因だと考えられた.
反応時間ごとの構造の変化をみていったところ,40秒以内にMg2+がAサイトに結合し,Bサイトでは約50%のCa2+がMg2+と置き換わることにより,3’-OH基とdATPが近づき反応開始位置にきていた.この構造は,DNAポリメラーゼη-DNA-dAMPNPP-Mg2+の構造6)(PDB ID:3MR2)とほとんど同じであり,リン酸ジエステル結合の形成もまだみられていなかったため,反応前構造とよぶ.リン酸ジエステル結合の形成は80秒後からみられ,200秒後の時点では約60~70%が完了し,200秒後から300秒後にはプラトーに達した.反応速度は140秒後くらいから減少したが,これは結晶内において逆反応の起こっていることが考えられた.また,結晶内のごく一部のDNAが反応ののちにトランスローケーションを起こしたため,反応の後期には電子密度の強度の減少する結果が得られた.
230秒後のαリン酸の周辺における電子密度は,いっけん,5価のリンの遷移状態の構造にみえたが,精密化を行うとαリン酸の周辺には残差電子密度がみられた.また,高エネルギーかつ不安定な遷移状態の性質を考慮し,反応時間ごとの構造は,反応前構造と反応後構造(リン酸ジエステル結合の形成ののちの構造)の割合を反応曲線をもとに変えることによりうまく精密化することができた.たとえば,230秒後の構造(1.52Å分解能,PDB ID:4ECV)は40%の反応前構造と60%の反応後構造により精密化した.反応の前後の構造の比較から,3’-OH基がdATPに0.5Å近づき,糖のコンフォメーションが反応前のC2’-endo型から反応後のC3’-endo型へと変わりながら,リン酸ジエステル結合の形成されることがわかった.リン酸ジエステル結合が形成されたのち,dATPのαリン原子は1.4Å移動し,Arg61がdATPから解離するとともに,そこに新たなMg2+の結合するようすが明らかになった.
Aファミリー,Bファミリー,Xファミリーに属するDNAポリメラーゼの結晶構造では,DNAプライマー鎖の3’末端の糖のコンフォメーションはC3’-endo型(A型)である.この構造は浅いマイナー溝を形成し,DNAポリメラーゼがdNTPを選択する際に重要であると考えられている.一方,DNAポリメラーゼηを含むYファミリーのDNAポリメラーゼではDNAプライマー鎖の3’末端の糖はC2’-endo型の構造をとっている4).今回のDNAポリメラーゼηの基底構造および反応前構造ではDNAプライマー鎖の3’末端の糖のコンフォメーションはC2’-endo型であったが,リン酸ジエステル結合の形成がはじまると,糖のC2’原子とdATPの酸素原子のあいだに生じる立体障害をさけるようにC3’-endo型へと変わった.また,DNAプライマー鎖の3’末端をC3’-endo型の構造をとるリボヌクレオチドに置換してDNAポリメラーゼηの活性を測定したところ,通常のデオキシリボヌクレオチドの場合と同等の活性を示した.これらのことから,DNAの複製においてDNAプライマー鎖の3’末端がC3’-endo型の構造をとることが重要であることが示された.
3.一過的に現われる水分子の役割
活性部位の動きが明らかになる一方で,予期しなかった2つの電子密度のピークが観察された.ひとつは3’-OH基から水素結合をとる距離に位置し,80秒後に強く現われ,140秒後を境に著しい減少がみられた.この電子密度は,DNAポリメラーゼη-DNA-dAMPNPP-Mg2+の構造6)(PDB ID:3MR2)でも同じ位置に安定して結合していた水分子であると判断できた.80秒後の構造ではこの水分子は3’-OH基およびdATPのO4’と水素結合を形成していたが,反応ののちにはC3’-endo型に構造の変化した糖と立体障害を起こすため,リン酸ジエステル結合の形成とともにこの水分子は遊離していった.観察された電子密度の変化はこのようすをとらえているといえた.ヌクレオチド転移反応では3’-OH基が脱プロトン化をうけたのちdATPのαリン原子に対し求核攻撃を行うとされており,水分子による脱プロトン化を介した反応機構はほかのDNAポリメラーゼでも報告されている7,8).DNAポリメラーゼηの場合は,この水分子以外に,Ser113が3’-OH基と水素結合を形成していたが,このSer残基をAla残基に置換したDNAポリメラーゼη変異体の活性を測定したところ反応速度定数kcatにほとんど影響はみられなかった.これらの結果から,この水分子はAサイトのMg2+および3’-OH基が反応開始位置にきたあとに3’-OH基と結合してプロトンを引き抜き,リン酸ジエステル結合の形成が起こるという機構を提案した.
4.第3の金属イオンの役割
もうひとつの電子密度のピークは,AサイトおよびBサイトの反対側のdATPのαリン酸と非常に近い距離に位置し,140秒後から観察された.1.52Å分解能の230秒後の構造から結合距離の短い6配位構造をとっていることがわかり,この電子密度はMg2+であると判断した.この第3のMg2+は反応の進行とともにdATPから遊離するArg61と置き換わり,反応ののち生じる2つの反応生成物に架橋していることから,反応の遷移状態で生じる負電荷を中和し,反応生成物であるピロリン酸のプロトン化を手助けしているものと考えられた.
リン酸転移酵素では活性部位に3つの金属イオンの結合している構造が多くみられる.たとえば,エンドヌクレアーゼIVの基質複合体と反応生成物との複合体にみられる3つのZn2+の空間配置は9),今回のDNAポリメラーゼηの3つのMg2+を連想させ,グループIイントロンにおいても化学プローブを用いた実験により3つの金属イオンが同様の配置において触媒することが提案されている10).しかしながら,グループIイントロンの結晶構造において第3の金属イオンが観察されていないのは11),反応中のみに関与するというその一過的な性質によるものなのかもしれない.
おわりに
これまで,DNAポリメラーゼによるヌクレオチド転移反応にかぎらず,ほとんどの酵素反応の機構は,基質のアナログや活性を失った変異型酵素などを用いそれぞれの反応段階を模した構造から推測されてきた.また,結晶内において反応を行うことで反応中間体をとらえた例も報告されているが,反応過程の全体を詳細に追跡した例はなかった.この研究では,DNAポリメラーゼηの結晶における遅い反応を利用し,反応中間体の構造をより高い時間分解能かつ空間分解能で決定していき,ヌクレオチド転移反応の過程をリアルタイムかつ原子レベルで観察することに成功した(図2).今回,明らかにした反応機構のなかでも,第3のMg2+が関与することは,これまで想定されてきた2金属イオン機構では確認されていない,DNAポリメラーゼのもつ共通の特徴なのかもしれない.
文 献
- Brody, R. S. & Frey, P. A.: Unambiguous determination of the stereochemistry of nucleotidyl transfer catalyzed by DNA polymerase I from Escherichia coli. Biochemistry, 20, 1245-1252 (1981)[PubMed]
- Patel, S. S., Wong, I. & Johnson, K. A.: Pre-steady-state kinetic analysis of processive DNA replication including complete characterization of an exonuclease-deficient mutant. Biochemistry, 30, 511-525 (1991)[PubMed]
- Wong, I., Patel, S. S. & Johnson, K. A.: An induced-fit kinetic mechanism for DNA replication fidelity: direct measurement by single-turnover kinetics. Biochemistry, 30, 526-537 (1991)[PubMed]
- Yang, W. & Woodgate, R.: What a difference a decade makes: insights into translesion DNA synthesis. Proc. Natl Acad. Sci. USA, 104, 15591-15598 (2007)[PubMed]
- Masutani, C., Kusumoto, R., Yamada, A. et al.: The XPV (xeroderma pigmentosum variant) gene encodes human DNA polymerase η. Nature, 399, 700-704 (1999)[PubMed]
- Biertumpfel, C., Zhao, Y., Kondo, Y. et al.: Structure and mechanism of human DNA polymerase η. Nature, 465, 1044-1048 (2010)[PubMed]
- Wang, L., Broyde, S., Zhang, Y.: Polymerase-tailored variations in the watermediated and substrate-assisted mechanism for nucleotidyl transfer: insights from a study of T7 DNA polymerase. J. Mol. Biol., 389, 787-796 (2009)[PubMed]
- Wang, L., Yu, X., Hu, P. et al.: A water-mediated and substrateassisted catalytic mechanism for Sulfolobus solfataricus DNA polymerase IV. J. Am. Chem. Soc., 129, 4731-4737 (2007)[PubMed]
- Garcin, E. D., Hosfield, D. J., Desai, S. A. et al.: DNA apurinic-apyrimidinic site binding and excision by endonuclease IV. Nat. Struct. Mol. Biol., 15, 515-522 (2008)[PubMed]
- Shan, S., Yoshida, A., Sun, S. et al.: Three metal ions at the active site of the Tetrahymena group I ribozyme. Proc. Natl. Acad. Sci. USA, 96, 12299-12304 (1999)[PubMed]
- Stahley, M. R. & Strobel, S. A.: Structural evidence for a two-metal-ion mechanism of group I intron splicing. Science, 309, 1587-1590 (2005)[PubMed]
著者プロフィール
略歴:2006年より熊本大学大学院生命科学研究部 助教.2010年 熊本大学大学院薬学教育部にて博士号取得.
研究テーマ:核酸にはたらくタンパク質の構造生物学.
山縣 ゆり子(Yuriko Yamagata)
熊本大学大学院生命科学研究部 教授.
Wei Yang
米国NIH National Institute of Diabetes & Digestive & Kidney Diseases主任研究員.
© 2012 中村照也・山縣ゆり子・Wei Yang Licensed under CC 表示 2.1 日本