線虫の生殖細胞におけるpiRNAの役割
白山 昌樹
(米国Massachusetts大学Medical School,Program in Molecular Medicine)
email:白山昌樹
DOI: 10.7875/first.author.2012.094
piRNAs initiate an epigenetic memory of nonself RNA in the C. elegans germline.
Masaki Shirayama, Meetu Seth, Heng-Chi Lee, Weifeng Gu, Takao Ishidate, Darryl Conte, Craig C. Mello
Cell, 150, 65-77 (2012)
生殖細胞の恒常性を乱す要素のひとつに外来の遺伝因子の侵入がある.生物はこれらの“非自己”遺伝因子を認識しその発現を抑制するため,さまざまな防御機構を生み出してきた.RNAi機構は酵母からヒトにいたるまで広く保存されており,おもに外来のRNAを除去することによりゲノムの防御機構としての役割を担う.筆者らは,外来の遺伝子を含む導入遺伝子が染色体に1コピーだけ組み込まれた場合でも,線虫の生殖細胞により“非自己”と認識されその発現が安定的に抑制されることを発見した.遺伝子の発現抑制の情報は染色体に記憶されることで子孫へとエピジェネティックに伝わり,その過程にはsmall RNAが関与していたことから,この生物学的な現象をRNA epigenetic silencing,RNAeと名づけた.RNAeはsmall RNAの一種piRNAにより誘導され,そのエピジェネティックな遺伝子の発現抑制にはRNAiと共通した分子機構が利用されていた.筆者らの研究の結果は,線虫は生殖細胞に存在するすべての“自己”RNAの情報をsmall RNAというかたちで記憶しており,外見からは“自己”と区別のつかない外来のRNAの侵略をうけた場合でも,その目録に照会することで“非自己”と認識し遺伝子の発現抑制を誘導する可能性を示唆した.
piRNAは動物の生殖細胞において特異的に発現するsmall RNAの一種で,これまでさまざまなモデル生物を用いてトランスポゾンの抑制に機能していることが明らかにされてきた1).しかし,piRNAはトランスポゾンの抑制のためだけに存在しているわけではない.とくに線虫では,およそ16,000個あるとされるpiRNAの大部分はトランスポゾンの抑制に関与しておらず,その生殖細胞における役割は大きな謎であった2,3).最近,線虫におけるpiRNAの新たな機能とその下流の分子機構に関連し,6本の論文が筆者らを含む4つのグループからほぼ同時に発表された4-6).これらの論文に共通したメッセージを一言で表現すると,“線虫のpiRNAは遺伝子のエピジェネティックな発現抑制を誘導する”となる.ここでは,piRNAによりひき起こされるユニークな生命現象,RNAe(RNA epigenetic silencing)の発見とその役割について,筆者らの研究成果を概説する.
筆者らの研究グループは,モデル生物として線虫を用い,おもに遺伝学的な手法を駆使することで広範な生命現象を個体レベルおよび分子レベルで解明することをめざしている.その手法のひとつとして,外来の遺伝子(組換え遺伝子)を線虫に導入しその表現型を観察することにより遺伝子の機能を解析する方法を用いている.
線虫に外来の遺伝子を導入することは容易であり,その生殖腺に極細の注射針を突き刺してプラスミドDNAを注入するだけである.しかし,導入されたプラスミドがそのまま核に到達することはなく,そのほとんどは細胞質において互いに結合することで50~300コピーからなるひとつの巨大な染色体様の構造(extrachromosomal array,染色体外配列)を形成する.そののち,この染色体外配列は卵の形成のときに核へと取り込まれ,忠実性には欠けるものの,ある頻度で複製と分配をくり返しながら次世代へと伝達される.
染色体外配列にある外来の遺伝子は,その過剰な発現が線虫にとり有害でないかぎり体細胞においてほぼ例外なく発現するのに対し,生殖細胞においてはその発現は非常に強く抑制されている.この生殖細胞に特異的な発現抑制は,染色体外配列に存在するくり返し配列と遺伝子の過剰なコピー数に原因のあることは簡単に推察されるが,そのくわしい分子機構についてはいまだ明らかにされていない.
発現抑制の分子機構はともかく,実際問題として外来の遺伝子を生殖細胞において安定的に発現させるためには,導入する遺伝子のコピー数をなるべく低くする(理想的には,1コピーとする)ことが鍵であることが知られていた.しかし,実際に線虫の染色体に1コピーの遺伝子を組み込むMosSCI法が確立されたのは,マイクロインジェクションによる形質転換法の発見からおよそ20年がたってからだった7).このMosSCI法は,染色体の特定の部位に組み込まれた外来のトランスポゾンを人工的に活性化させることにより染色体DNAの二本鎖切断を誘導し,相同遺伝子組換えを利用して染色体外配列に存在する外来の遺伝子を1コピーのみ染色体に取り込む技術である.
MosSCI法の確立により生殖細胞において組換え遺伝子を発現させることは格段に容易になった.しかしながら,筆者らのグループは比較的早い段階で,この技術を用いて得られたすべての形質転換株が生殖細胞において組換え遺伝子を発現するわけではないことに気づいた.組換え遺伝子の発現がみられない形質転換株でも,組換え遺伝子は染色体の予想された部位に1コピーのみ取り込まれていたが,染色体外配列の形成や相同遺伝子組換えの過程において組換え遺伝子にさまざまな変異が導入されることが考えられたので,この現象の重要性をすぐに認識することはできなかった.その認識のきっかけとなったのは,cdk-1遺伝子やcsr-1遺伝子のように生殖細胞と体細胞の両方で発現している遺伝子を生殖細胞に導入した際に,すべての形質転換株がこれらの遺伝子を体細胞において発現しているのにもかかわらず,生殖細胞ではその発現が抑制されているという観察結果であった.当然ながら,このことは組換え遺伝子それ自体に潜在的な発現能のあることを示していた.
それでは,なぜ同一の塩基配列をもつ組換え遺伝子が染色体の同じ部位に1コピーのみ導入されているにもかかわらず,ある形質転換体では安定的に発現し,別の形質転換体では発現が抑制されるのだろうか.
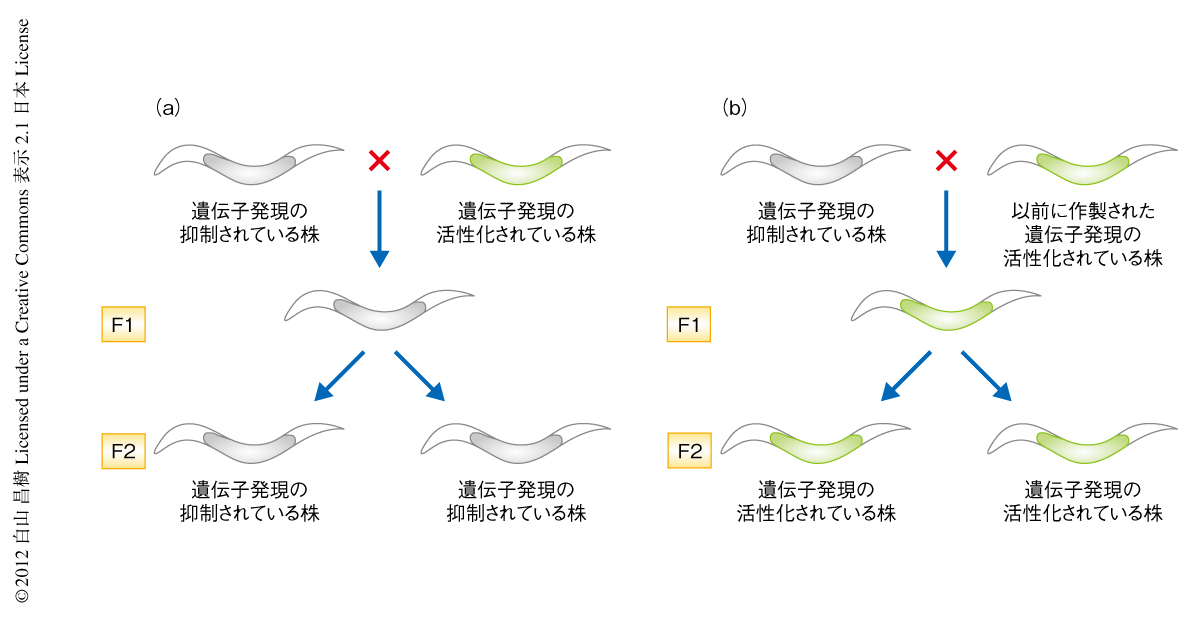
ある遺伝子の発現が活性化している株に,発現の抑制されている株を掛けあわせると,そのすべての子孫の株においてその遺伝子の発現は抑制され,再び発現が観察されることはなかった(図1a).このことは,発現の抑制されている遺伝子の表現型が優性であり,いちど発現が抑制されると,その状態が世代をこえて安定的に維持されることを示していた.さらに,発現の活性化している遺伝子と抑制されている遺伝子とが異なる染色体にあっても同様な結果が得られたことから,なんらかの抑制因子がトランスに作用していることが考えられた.
発現の活性化している株と発現の抑制されている株では,遺伝子型こそ同じだが表現型が逆であるため,単純に遺伝子型を表記するだけでは混乱が生じる.のちに,この発現の抑制にRNAの関与が認められたことから,筆者らは,この両者を区別するため,発現の抑制されている対立遺伝子型をRNAe(RNA epigenetic silencing)と名づけることにした(RNAeという新たな用語を導入するにあたっては,線虫遺伝学の祖であるBrenner博士の許可と助言を得た).
RNAeの特徴を具体的な例をあげて説明する.MosSCI法を用いた形質転換法により,発現の活性化しているgfp::csr-1(+) の株と発現の抑制されたgfp::csr-1(RNAe) の株の両方が得られる(gfp遺伝子は,蛍光タンパク質GFPをコードする外来の遺伝子).それぞれの表現型は非常に安定しているにもかかわらず,gfp::csr-1(+) からgfp::csr-1(RNAe),または,gfp::csr-1(RNAe) からgfp::csr-1(+) へとそれぞれ変換することが可能である.染色体IIに挿入されたgfp::csr-1(+) LGIIの株と染色体IVに挿入されたgfp::csr-1(RNAe) LGIVの株とを掛けあわせることにより,gfp::csr-1(+) LGIIの発現は抑制される.さらに,野生株と掛けあわせることでgfp::csr-1(RNAe) LGIVを取り除いたあとでも,gfp::csr-1(+) LGIIの発現は抑制されつづける(gfp::csr-1(RNAe) へと変換されている).逆に,gfp::csr-1(RNAe) の株をRNAiに必須ないくつかの遺伝子の変異株と掛けあわせることにより,gfp::csr-1(+) へと変換することも可能である.
組換え遺伝子が生殖細胞においてRNAeを誘導するにはある条件が必要であった.それは,組換え遺伝子の一部に線虫のもつ遺伝子の配列とは異なる外来の塩基配列(たとえば,gfp遺伝子など)を含んでいることであった.このことは,線虫が自己の遺伝子と外来の遺伝子とをなんらかの方法で識別している可能性を示唆した.一般に,生物は“自己”RNAと“非自己”RNAとを識別する際に,2本鎖RNAや5’-三リン酸など,外来のRNAのもついくつかの物理的な特徴を認識している.gfp遺伝子を含む転写産物(mRNA)に線虫の遺伝子に由来する転写産物と区別しうる特徴があるのだろうか.この問題が解決されるにあたっては,RNAeと酷似した(のちに,同一と判明)生命現象が筆者らの研究室において偶然に観察されていたという幸運があった.
small RNAの一種であるpiRNAは動物の進化にて保存されており,おもにトランスポゾンの抑制に関与している1).piRNAの配列はmRNAと同様に,染色体を構成するDNAの塩基配列により決定されるため,RNAiにみられるよう2本鎖RNAに応じオーダーメイドのようにsmall RNAをつくりだすような柔軟性は,少なくとも最初に標的RNAを認識するステップではみられない.さらに,線虫のpiRNAに関して興味深いことは,生殖腺には約16,000種類のpiRNAが発現しているにもかかわらず,ただひとつのトランスポゾンを除いて,その標的となりうるような転写産物がみつからなかったことである2,3).約16,000種類のpiRNAが,それらの塩基配列と相補的な配列を“偶然に”もつ外来のRNAの侵入に備えて生殖細胞に常駐しているのだとすれば,ゲノムの防御機構としてはあまりにも非効率である.
そこで,まずレポーター遺伝子を用いることでこの問題の解決の糸口を探った.piRNAの標的部位をレポーター遺伝子に人工的に導入することで,その発現がpiRNAによりどのように抑制されるかを調べる手法である.この実験においてレポーター遺伝子の発現は確かに抑制されたのだが,不思議なことに,この発現の抑制された株をpiRNAの失われた変異株と掛けあわせてもレポーター遺伝子の発現が回復することはなかった.このことは,レポーター遺伝子の発現抑制はpiRNAに依存していない可能性を示唆し,この方面での研究はしばらくのあいだ頓挫した.
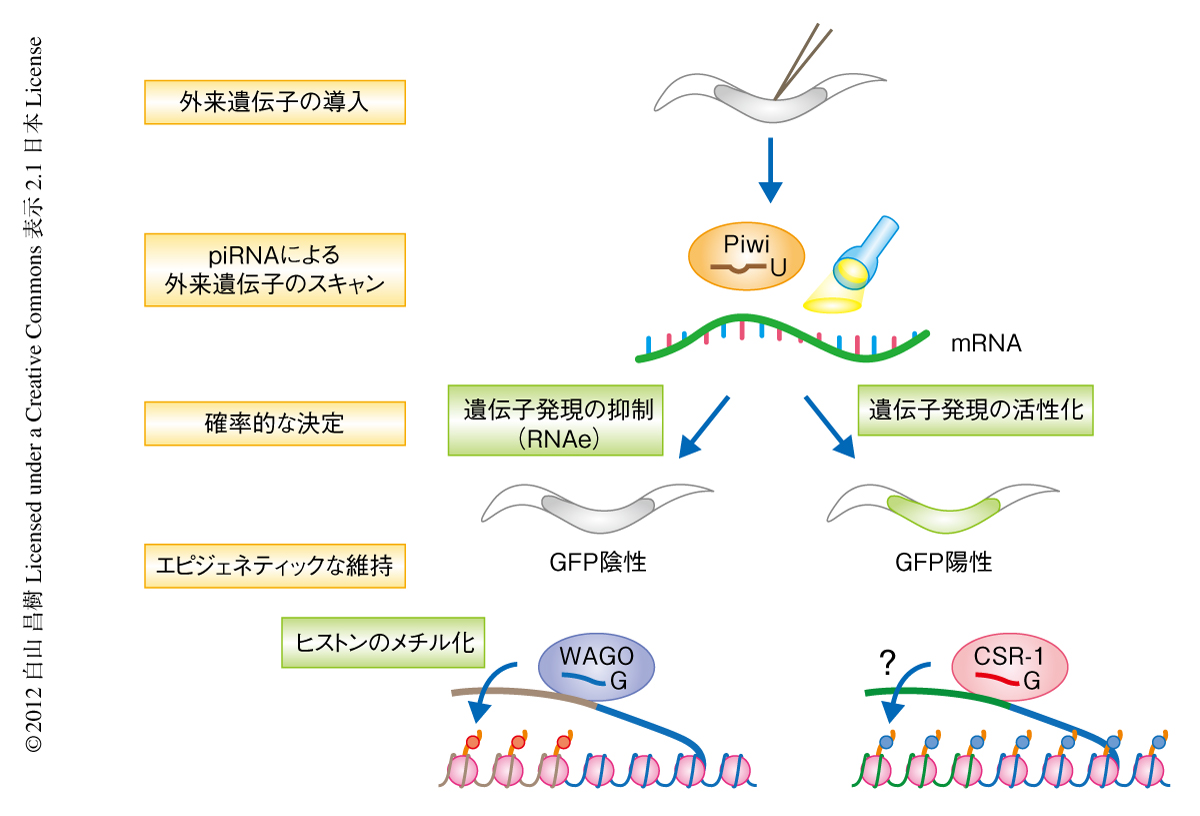
外来の遺伝子を生殖細胞に導入するとその発現はRNAiの下流因子に依存して永久的に抑制されたこと(RNAe)と,piRNAのレポーター遺伝子も,piRNAとの因果関係は明確でないにしろ,その発現が永久的に抑制されたことから,この2つの現象を結びつけるひとつの仮説が導きだされた.この両方の実験系において,piRNAは発現抑制の開始のみに関与しており,RNAiに類似した分子機構がその維持をひきうけているのではないかというものある.この仮説にはひとつ解決しなければならない問題があった.gfp遺伝子の塩基配列を認識するpiRNAがひとつもみつからなかったことである.このことから,piRNAがミスマッチを許容してその標的RNA(gfp遺伝子)を認識しているのではないかという新たな仮説が生まれた.ここまで議論が煮詰まってくると,あとは実験をして確認するだけであった.幸いにして,これらの仮説はすべて正しいことがわかった.piRNAがRNAeを誘導していたのである(図2).
実は,piRNAが標的RNAを認識するうえでミスマッチを許容すると,gfp遺伝子のみならず,おそらく生殖細胞に存在するほぼすべてのRNAを認識しうることになる.つまり,これが正しいと仮定すると,piRNAは線虫のもつほとんどの“自己”RNAを認識しその発現を抑制することになるが,そのようなことは明らかに起こっていない.なぜ“自己”RNAはpiRNAの探索からのがれられるのだろうか.まだこの疑問に対する明確な答えは得られていないが,これまで遺伝学的な手法により“抗抑制因子”(anti-silencing因子)の存在が予想されており,それがpiRNAによる“自己”RNAの認識を抑制していると考えている.
さきに説明したように,RNAeにより発現の抑制されているgfp(RNAe) は,発現の活性化しているgfp(+) に対し優性にはたらくので,両者を掛けあわせるとその発現は抑制される(図1a).驚くべきことに,数年前に作製された形質転換株に含まれるgfp遺伝子は,gfp(RNAe) と掛け合わせると,抑制されたgfp(RNAe) に対し優性にはたらきその発現を脱抑制した(図1b).このことは,この数年前に作製された形質転換株になんらかの抗抑制因子が存在し,gfp(RNAe) に対しトランスにはたらくことで遺伝子の発現の脱抑制を行っている可能性を示唆した.
抗抑制因子としてどのようなものが想定されるだろうか.この疑問に対しても過去の研究成果がそのヒントをあたえてくれた.線虫の生殖細胞のもつほぼすべてのRNAは,RNA依存性RNAポリメラーゼの活性にその産生を依存する2つのグループのsmall RNA,WAGO 22GとCSR-1 22Gのどちらかにより認識されている8,9).線虫にとり好ましくない偽遺伝子に由来するRNAやトランスポゾンに由来するRNAなどはWAGO 22Gにより認識され,RNAiと一部が共通な分子機構によりその発現は抑制される.一方,線虫がその生育に必要なRNA(アクチンをコードするmRNAなど)はCSR-1 22Gにより認識されているが,奇妙なことに,それらの標的RNAはCSR-1 22Gにより発現の抑制をうけない.このことから,CSR-1 22Gは標的RNAの発現を制御するために存在しているのではなく,むしろ,自己RNAの記憶としての役割を担っている可能性が推察された.つまり,線虫の生殖細胞に存在するRNAは,small RNAにより発現の抑制されるものと抑制されないものとに仕分けされているのである.
実際に,RNAeにより発現の抑制されたgfp::cdk-1株のsmall RNAを遺伝子クローニングしたところ,連続した同一のmRNAであるにもかかわらず,WAGO 22Gはgfp遺伝子の領域のみ限定して蓄積しており,cdk-1遺伝子の領域にはCSR-1 22Gが蓄積していた.このことは,piRNAが“非自己”RNA(gfp遺伝子)の領域のみを認識してWAGO 22Gの産生を誘導し,“自己”RNA(cdk-1遺伝子)の領域ではCSR-1 22GがpiRNAに依存したWAGO 22Gの蓄積を阻害しているという仮説を支持した.MosSCI法による形質転換株においてRNAe現象が偶発的に観察されたのは,gfp遺伝子においてpiRNAにより誘導されたWAGO 22Gとcdk-1遺伝子から侵略してきたCSR-1 22Gとが,その優位性を争って起こった結果なのかもしれない.
筆者らは,今回の論文において,piRNAが生殖細胞において発現するすべてのRNAをスキャンしているという仮説を提唱した(図2).この仮説は抗抑制因子の存在なくしては成り立たない.CSR-1 22Gは本当に抗抑制因子として機能しているのか,現在,さまざまな角度からこの魅力的な仮説の検証実験を行っているところである.
RNAeは,もともとはRNA epigenetic silencingではなく,RNA evolutional consequenceから誕生した言葉である.これは,RNAe現象を発見した当初,その生物学的な意義を推察する過程において筆者らのビジョンをそのまま反映させるために用いたものである.RNAeは,RNAiと同様に,ゲノムの防御機構として機能している可能性が高いと思われる.しかし,外来の遺伝子が生殖細胞に取り込まれたとき,piRNAがRNAeを誘導するかしないかを偶発的に決定することにより均一な集団における遺伝子の発現に多様性を導入し,個体レベルでの環境への適応能力の向上に寄与していることは十分に考えられる.piRNAのおもな標的であるトランスポゾンも進化の促進に寄与していることが考えられている.生物が環境の変化に応じてpiRNAの活性を微調整することで,トランスポゾンの破壊的な増殖を抑制しつつ,都合よくゲノムの操作に利用していることもあるかもしれない.いずれにせよ,piRNAがゲノムの防御と同時に,その進化にも関与していることは十分に考えられる.
今回,幸いにして筆者らの研究室から2報の論文がCell誌に掲載された.研究のあいだは,ほかの研究室との激しい競争に直面した反面,比較的初期の段階から研究室どうしが積極的な情報交換を行った結果,互いのストーリーの信頼性が向上したことも事実である.米国での研究生活は,論文を書くうえで明確なビジョンをもつことの重要性とともに,コミュニケーションの必要性をも教えてくれている.
略歴:東京大学大学院理学系研究科 修了,米国Massachusetts大学Medical School助教授.
研究テーマ:線虫をモデル生物とした遺伝学的な解析.研究テーマにしばられず,なるべく生命現象の意義を探るような研究ができればと心がけている.
© 2012 白山 昌樹 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Program in Molecular Medicine)
email:白山昌樹
DOI: 10.7875/first.author.2012.094
piRNAs initiate an epigenetic memory of nonself RNA in the C. elegans germline.
Masaki Shirayama, Meetu Seth, Heng-Chi Lee, Weifeng Gu, Takao Ishidate, Darryl Conte, Craig C. Mello
Cell, 150, 65-77 (2012)
要 約
生殖細胞の恒常性を乱す要素のひとつに外来の遺伝因子の侵入がある.生物はこれらの“非自己”遺伝因子を認識しその発現を抑制するため,さまざまな防御機構を生み出してきた.RNAi機構は酵母からヒトにいたるまで広く保存されており,おもに外来のRNAを除去することによりゲノムの防御機構としての役割を担う.筆者らは,外来の遺伝子を含む導入遺伝子が染色体に1コピーだけ組み込まれた場合でも,線虫の生殖細胞により“非自己”と認識されその発現が安定的に抑制されることを発見した.遺伝子の発現抑制の情報は染色体に記憶されることで子孫へとエピジェネティックに伝わり,その過程にはsmall RNAが関与していたことから,この生物学的な現象をRNA epigenetic silencing,RNAeと名づけた.RNAeはsmall RNAの一種piRNAにより誘導され,そのエピジェネティックな遺伝子の発現抑制にはRNAiと共通した分子機構が利用されていた.筆者らの研究の結果は,線虫は生殖細胞に存在するすべての“自己”RNAの情報をsmall RNAというかたちで記憶しており,外見からは“自己”と区別のつかない外来のRNAの侵略をうけた場合でも,その目録に照会することで“非自己”と認識し遺伝子の発現抑制を誘導する可能性を示唆した.
はじめに
piRNAは動物の生殖細胞において特異的に発現するsmall RNAの一種で,これまでさまざまなモデル生物を用いてトランスポゾンの抑制に機能していることが明らかにされてきた1).しかし,piRNAはトランスポゾンの抑制のためだけに存在しているわけではない.とくに線虫では,およそ16,000個あるとされるpiRNAの大部分はトランスポゾンの抑制に関与しておらず,その生殖細胞における役割は大きな謎であった2,3).最近,線虫におけるpiRNAの新たな機能とその下流の分子機構に関連し,6本の論文が筆者らを含む4つのグループからほぼ同時に発表された4-6).これらの論文に共通したメッセージを一言で表現すると,“線虫のpiRNAは遺伝子のエピジェネティックな発現抑制を誘導する”となる.ここでは,piRNAによりひき起こされるユニークな生命現象,RNAe(RNA epigenetic silencing)の発見とその役割について,筆者らの研究成果を概説する.
1.線虫の生殖細胞では外来の遺伝子の発現は抑制されている
筆者らの研究グループは,モデル生物として線虫を用い,おもに遺伝学的な手法を駆使することで広範な生命現象を個体レベルおよび分子レベルで解明することをめざしている.その手法のひとつとして,外来の遺伝子(組換え遺伝子)を線虫に導入しその表現型を観察することにより遺伝子の機能を解析する方法を用いている.
線虫に外来の遺伝子を導入することは容易であり,その生殖腺に極細の注射針を突き刺してプラスミドDNAを注入するだけである.しかし,導入されたプラスミドがそのまま核に到達することはなく,そのほとんどは細胞質において互いに結合することで50~300コピーからなるひとつの巨大な染色体様の構造(extrachromosomal array,染色体外配列)を形成する.そののち,この染色体外配列は卵の形成のときに核へと取り込まれ,忠実性には欠けるものの,ある頻度で複製と分配をくり返しながら次世代へと伝達される.
染色体外配列にある外来の遺伝子は,その過剰な発現が線虫にとり有害でないかぎり体細胞においてほぼ例外なく発現するのに対し,生殖細胞においてはその発現は非常に強く抑制されている.この生殖細胞に特異的な発現抑制は,染色体外配列に存在するくり返し配列と遺伝子の過剰なコピー数に原因のあることは簡単に推察されるが,そのくわしい分子機構についてはいまだ明らかにされていない.
発現抑制の分子機構はともかく,実際問題として外来の遺伝子を生殖細胞において安定的に発現させるためには,導入する遺伝子のコピー数をなるべく低くする(理想的には,1コピーとする)ことが鍵であることが知られていた.しかし,実際に線虫の染色体に1コピーの遺伝子を組み込むMosSCI法が確立されたのは,マイクロインジェクションによる形質転換法の発見からおよそ20年がたってからだった7).このMosSCI法は,染色体の特定の部位に組み込まれた外来のトランスポゾンを人工的に活性化させることにより染色体DNAの二本鎖切断を誘導し,相同遺伝子組換えを利用して染色体外配列に存在する外来の遺伝子を1コピーのみ染色体に取り込む技術である.
2.線虫の生殖細胞では1コピーの外来の遺伝子でもその発現は抑制される
MosSCI法の確立により生殖細胞において組換え遺伝子を発現させることは格段に容易になった.しかしながら,筆者らのグループは比較的早い段階で,この技術を用いて得られたすべての形質転換株が生殖細胞において組換え遺伝子を発現するわけではないことに気づいた.組換え遺伝子の発現がみられない形質転換株でも,組換え遺伝子は染色体の予想された部位に1コピーのみ取り込まれていたが,染色体外配列の形成や相同遺伝子組換えの過程において組換え遺伝子にさまざまな変異が導入されることが考えられたので,この現象の重要性をすぐに認識することはできなかった.その認識のきっかけとなったのは,cdk-1遺伝子やcsr-1遺伝子のように生殖細胞と体細胞の両方で発現している遺伝子を生殖細胞に導入した際に,すべての形質転換株がこれらの遺伝子を体細胞において発現しているのにもかかわらず,生殖細胞ではその発現が抑制されているという観察結果であった.当然ながら,このことは組換え遺伝子それ自体に潜在的な発現能のあることを示していた.
それでは,なぜ同一の塩基配列をもつ組換え遺伝子が染色体の同じ部位に1コピーのみ導入されているにもかかわらず,ある形質転換体では安定的に発現し,別の形質転換体では発現が抑制されるのだろうか.
3.RNAeの発見
ある遺伝子の発現が活性化している株に,発現の抑制されている株を掛けあわせると,そのすべての子孫の株においてその遺伝子の発現は抑制され,再び発現が観察されることはなかった(図1a).このことは,発現の抑制されている遺伝子の表現型が優性であり,いちど発現が抑制されると,その状態が世代をこえて安定的に維持されることを示していた.さらに,発現の活性化している遺伝子と抑制されている遺伝子とが異なる染色体にあっても同様な結果が得られたことから,なんらかの抑制因子がトランスに作用していることが考えられた.
発現の活性化している株と発現の抑制されている株では,遺伝子型こそ同じだが表現型が逆であるため,単純に遺伝子型を表記するだけでは混乱が生じる.のちに,この発現の抑制にRNAの関与が認められたことから,筆者らは,この両者を区別するため,発現の抑制されている対立遺伝子型をRNAe(RNA epigenetic silencing)と名づけることにした(RNAeという新たな用語を導入するにあたっては,線虫遺伝学の祖であるBrenner博士の許可と助言を得た).
RNAeの特徴を具体的な例をあげて説明する.MosSCI法を用いた形質転換法により,発現の活性化しているgfp::csr-1(+) の株と発現の抑制されたgfp::csr-1(RNAe) の株の両方が得られる(gfp遺伝子は,蛍光タンパク質GFPをコードする外来の遺伝子).それぞれの表現型は非常に安定しているにもかかわらず,gfp::csr-1(+) からgfp::csr-1(RNAe),または,gfp::csr-1(RNAe) からgfp::csr-1(+) へとそれぞれ変換することが可能である.染色体IIに挿入されたgfp::csr-1(+) LGIIの株と染色体IVに挿入されたgfp::csr-1(RNAe) LGIVの株とを掛けあわせることにより,gfp::csr-1(+) LGIIの発現は抑制される.さらに,野生株と掛けあわせることでgfp::csr-1(RNAe) LGIVを取り除いたあとでも,gfp::csr-1(+) LGIIの発現は抑制されつづける(gfp::csr-1(RNAe) へと変換されている).逆に,gfp::csr-1(RNAe) の株をRNAiに必須ないくつかの遺伝子の変異株と掛けあわせることにより,gfp::csr-1(+) へと変換することも可能である.
4.外来の遺伝子はどのように認識されるのか
組換え遺伝子が生殖細胞においてRNAeを誘導するにはある条件が必要であった.それは,組換え遺伝子の一部に線虫のもつ遺伝子の配列とは異なる外来の塩基配列(たとえば,gfp遺伝子など)を含んでいることであった.このことは,線虫が自己の遺伝子と外来の遺伝子とをなんらかの方法で識別している可能性を示唆した.一般に,生物は“自己”RNAと“非自己”RNAとを識別する際に,2本鎖RNAや5’-三リン酸など,外来のRNAのもついくつかの物理的な特徴を認識している.gfp遺伝子を含む転写産物(mRNA)に線虫の遺伝子に由来する転写産物と区別しうる特徴があるのだろうか.この問題が解決されるにあたっては,RNAeと酷似した(のちに,同一と判明)生命現象が筆者らの研究室において偶然に観察されていたという幸運があった.
5.RNAe meets piRNA (and vice-versa)
small RNAの一種であるpiRNAは動物の進化にて保存されており,おもにトランスポゾンの抑制に関与している1).piRNAの配列はmRNAと同様に,染色体を構成するDNAの塩基配列により決定されるため,RNAiにみられるよう2本鎖RNAに応じオーダーメイドのようにsmall RNAをつくりだすような柔軟性は,少なくとも最初に標的RNAを認識するステップではみられない.さらに,線虫のpiRNAに関して興味深いことは,生殖腺には約16,000種類のpiRNAが発現しているにもかかわらず,ただひとつのトランスポゾンを除いて,その標的となりうるような転写産物がみつからなかったことである2,3).約16,000種類のpiRNAが,それらの塩基配列と相補的な配列を“偶然に”もつ外来のRNAの侵入に備えて生殖細胞に常駐しているのだとすれば,ゲノムの防御機構としてはあまりにも非効率である.
そこで,まずレポーター遺伝子を用いることでこの問題の解決の糸口を探った.piRNAの標的部位をレポーター遺伝子に人工的に導入することで,その発現がpiRNAによりどのように抑制されるかを調べる手法である.この実験においてレポーター遺伝子の発現は確かに抑制されたのだが,不思議なことに,この発現の抑制された株をpiRNAの失われた変異株と掛けあわせてもレポーター遺伝子の発現が回復することはなかった.このことは,レポーター遺伝子の発現抑制はpiRNAに依存していない可能性を示唆し,この方面での研究はしばらくのあいだ頓挫した.
外来の遺伝子を生殖細胞に導入するとその発現はRNAiの下流因子に依存して永久的に抑制されたこと(RNAe)と,piRNAのレポーター遺伝子も,piRNAとの因果関係は明確でないにしろ,その発現が永久的に抑制されたことから,この2つの現象を結びつけるひとつの仮説が導きだされた.この両方の実験系において,piRNAは発現抑制の開始のみに関与しており,RNAiに類似した分子機構がその維持をひきうけているのではないかというものある.この仮説にはひとつ解決しなければならない問題があった.gfp遺伝子の塩基配列を認識するpiRNAがひとつもみつからなかったことである.このことから,piRNAがミスマッチを許容してその標的RNA(gfp遺伝子)を認識しているのではないかという新たな仮説が生まれた.ここまで議論が煮詰まってくると,あとは実験をして確認するだけであった.幸いにして,これらの仮説はすべて正しいことがわかった.piRNAがRNAeを誘導していたのである(図2).
6.抗抑制因子の存在が予想される
実は,piRNAが標的RNAを認識するうえでミスマッチを許容すると,gfp遺伝子のみならず,おそらく生殖細胞に存在するほぼすべてのRNAを認識しうることになる.つまり,これが正しいと仮定すると,piRNAは線虫のもつほとんどの“自己”RNAを認識しその発現を抑制することになるが,そのようなことは明らかに起こっていない.なぜ“自己”RNAはpiRNAの探索からのがれられるのだろうか.まだこの疑問に対する明確な答えは得られていないが,これまで遺伝学的な手法により“抗抑制因子”(anti-silencing因子)の存在が予想されており,それがpiRNAによる“自己”RNAの認識を抑制していると考えている.
さきに説明したように,RNAeにより発現の抑制されているgfp(RNAe) は,発現の活性化しているgfp(+) に対し優性にはたらくので,両者を掛けあわせるとその発現は抑制される(図1a).驚くべきことに,数年前に作製された形質転換株に含まれるgfp遺伝子は,gfp(RNAe) と掛け合わせると,抑制されたgfp(RNAe) に対し優性にはたらきその発現を脱抑制した(図1b).このことは,この数年前に作製された形質転換株になんらかの抗抑制因子が存在し,gfp(RNAe) に対しトランスにはたらくことで遺伝子の発現の脱抑制を行っている可能性を示唆した.
7.自己RNAと非自己RNAの目録としての役割を担うsmall RNA
抗抑制因子としてどのようなものが想定されるだろうか.この疑問に対しても過去の研究成果がそのヒントをあたえてくれた.線虫の生殖細胞のもつほぼすべてのRNAは,RNA依存性RNAポリメラーゼの活性にその産生を依存する2つのグループのsmall RNA,WAGO 22GとCSR-1 22Gのどちらかにより認識されている8,9).線虫にとり好ましくない偽遺伝子に由来するRNAやトランスポゾンに由来するRNAなどはWAGO 22Gにより認識され,RNAiと一部が共通な分子機構によりその発現は抑制される.一方,線虫がその生育に必要なRNA(アクチンをコードするmRNAなど)はCSR-1 22Gにより認識されているが,奇妙なことに,それらの標的RNAはCSR-1 22Gにより発現の抑制をうけない.このことから,CSR-1 22Gは標的RNAの発現を制御するために存在しているのではなく,むしろ,自己RNAの記憶としての役割を担っている可能性が推察された.つまり,線虫の生殖細胞に存在するRNAは,small RNAにより発現の抑制されるものと抑制されないものとに仕分けされているのである.
実際に,RNAeにより発現の抑制されたgfp::cdk-1株のsmall RNAを遺伝子クローニングしたところ,連続した同一のmRNAであるにもかかわらず,WAGO 22Gはgfp遺伝子の領域のみ限定して蓄積しており,cdk-1遺伝子の領域にはCSR-1 22Gが蓄積していた.このことは,piRNAが“非自己”RNA(gfp遺伝子)の領域のみを認識してWAGO 22Gの産生を誘導し,“自己”RNA(cdk-1遺伝子)の領域ではCSR-1 22GがpiRNAに依存したWAGO 22Gの蓄積を阻害しているという仮説を支持した.MosSCI法による形質転換株においてRNAe現象が偶発的に観察されたのは,gfp遺伝子においてpiRNAにより誘導されたWAGO 22Gとcdk-1遺伝子から侵略してきたCSR-1 22Gとが,その優位性を争って起こった結果なのかもしれない.
筆者らは,今回の論文において,piRNAが生殖細胞において発現するすべてのRNAをスキャンしているという仮説を提唱した(図2).この仮説は抗抑制因子の存在なくしては成り立たない.CSR-1 22Gは本当に抗抑制因子として機能しているのか,現在,さまざまな角度からこの魅力的な仮説の検証実験を行っているところである.
おわりに
RNAeは,もともとはRNA epigenetic silencingではなく,RNA evolutional consequenceから誕生した言葉である.これは,RNAe現象を発見した当初,その生物学的な意義を推察する過程において筆者らのビジョンをそのまま反映させるために用いたものである.RNAeは,RNAiと同様に,ゲノムの防御機構として機能している可能性が高いと思われる.しかし,外来の遺伝子が生殖細胞に取り込まれたとき,piRNAがRNAeを誘導するかしないかを偶発的に決定することにより均一な集団における遺伝子の発現に多様性を導入し,個体レベルでの環境への適応能力の向上に寄与していることは十分に考えられる.piRNAのおもな標的であるトランスポゾンも進化の促進に寄与していることが考えられている.生物が環境の変化に応じてpiRNAの活性を微調整することで,トランスポゾンの破壊的な増殖を抑制しつつ,都合よくゲノムの操作に利用していることもあるかもしれない.いずれにせよ,piRNAがゲノムの防御と同時に,その進化にも関与していることは十分に考えられる.
今回,幸いにして筆者らの研究室から2報の論文がCell誌に掲載された.研究のあいだは,ほかの研究室との激しい競争に直面した反面,比較的初期の段階から研究室どうしが積極的な情報交換を行った結果,互いのストーリーの信頼性が向上したことも事実である.米国での研究生活は,論文を書くうえで明確なビジョンをもつことの重要性とともに,コミュニケーションの必要性をも教えてくれている.
文 献
- Siomi, M. C., Sato, K., Pezic, D. et al.: PIWI-interacting small RNAs: the vanguard of genome defence. Nat. Rev. Mol. Cell Biol., 12, 246-258 (2011)[PubMed]
- Batista, P. J., Ruby, J. G., Claycomb, J. M. et al.: PRG-1 and 21U-RNAs interact to form the piRNA complex required for fertility in C. elegans. Mol. Cell, 31, 67-78 (2008)[PubMed]
- Das, P. P., Bagijn, M. P., Goldstein, L. D. et al.: Piwi and piRNAs act upstream of an endogenous siRNA pathway to suppress Tc3 transposon mobility in the Caenorhabditis elegans germline. Mol. Cell, 31, 79-90 (2009)[PubMed]
- Bagijn, M. P., Goldstein, L. D, Sapetschnig, A. et al.: Function, targets, and evolution of Caenorhabditis elegans piRNAs. Science, 337, 574-578 (2012)[PubMed]
- Ashe, A., Sapetschnig, A., Weick, E. M. et al.: piRNAs can trigger a multigenerational epigenetic memory in the germline of C. elegans. Cell, 150, 88-99 (2012)[PubMed]
- Lee. H. C., Gu, W., Shirayama, M. et al.: C. elegans piRNAs mediate the genome-wide surveillance of germline transcripts. Cell, 150, 78-87 (2012)[PubMed]
- Frokjaer-Jensen, C., Davis, M. W., Hopkins, C. E. et al.: Single-copy insertion of transgenes in Caenorhabditis elegans. Nat. Genet., 40, 1375-1383 (2008)[PubMed]
- Gu, W., Shirayama, M., Conte, D., Jr. et al.: Distinct argonaute-mediated 22G-RNA pathways direct genome surveillance in the C. elegans germline. Mol. Cell, 36, 231-244 (2009)[PubMed]
- Claycomb, J. M., Batista, P. J., Pang, K. M. et al.: The Argonaute CSR-1 and its 22G-RNA cofactors are required for holocentric chromosome segregation. Cell, 139, 123-123 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院理学系研究科 修了,米国Massachusetts大学Medical School助教授.
研究テーマ:線虫をモデル生物とした遺伝学的な解析.研究テーマにしばられず,なるべく生命現象の意義を探るような研究ができればと心がけている.
© 2012 白山 昌樹 Licensed under CC 表示 2.1 日本