時計タンパク質CRYを標的とする化合物の同定
廣田 毅
(米国California大学San Diego校Division of Biological Sciences)
email:廣田 毅
DOI: 10.7875/first.author.2012.093
Identification of small molecule activators of cryptochrome.
Tsuyoshi Hirota, Jae Wook Lee, Peter C. St. John, Mariko Sawa, Keiko Iwaisako, Takako Noguchi, Pagkapol Y. Pongsawakul, Tim Sonntag, David K. Welsh, David A. Brenner, Francis J. Doyle, III, Peter G. Schultz, Steve A. Kay
Science, 337, 1094-1097 (2012)
概日時計は睡眠や覚醒など,さまざまな生理現象にみられる約1日の周期をもつ概日リズムを制御しており,その機能障害は代謝疾患をはじめ多くの疾患と関連している.そのため,概日時計の機能を制御する薬剤はこれらの疾患を治療する助けとなりうるが,概日時計の中核を構成する時計タンパク質に直接的に作用する薬剤はほとんど知られていない.筆者らは,ヒト培養細胞を用いた薬剤スクリーニングから概日時計の機能を制御する新たな化合物を同定しKL001と名づけた.KL001は時計タンパク質であるCRYと特異的に結合してそのプロテアソームを介する分解を抑制し,概日時計の周期を延長させた.さらに,CRY1とCRY2の2つのアイソフォームは概日時計において類似した役割をはたしていることを数理モデルと組み合わせることにより明らかにするとともに,マウスの肝細胞においてKL001はグルカゴンによる糖新生の誘発を抑制することを見い出した.KL001はCRYの関与する生理現象を研究するための有用なツールとなるだけでなく,糖尿病の治療に新たな手がかりをあたえるかもしれない.
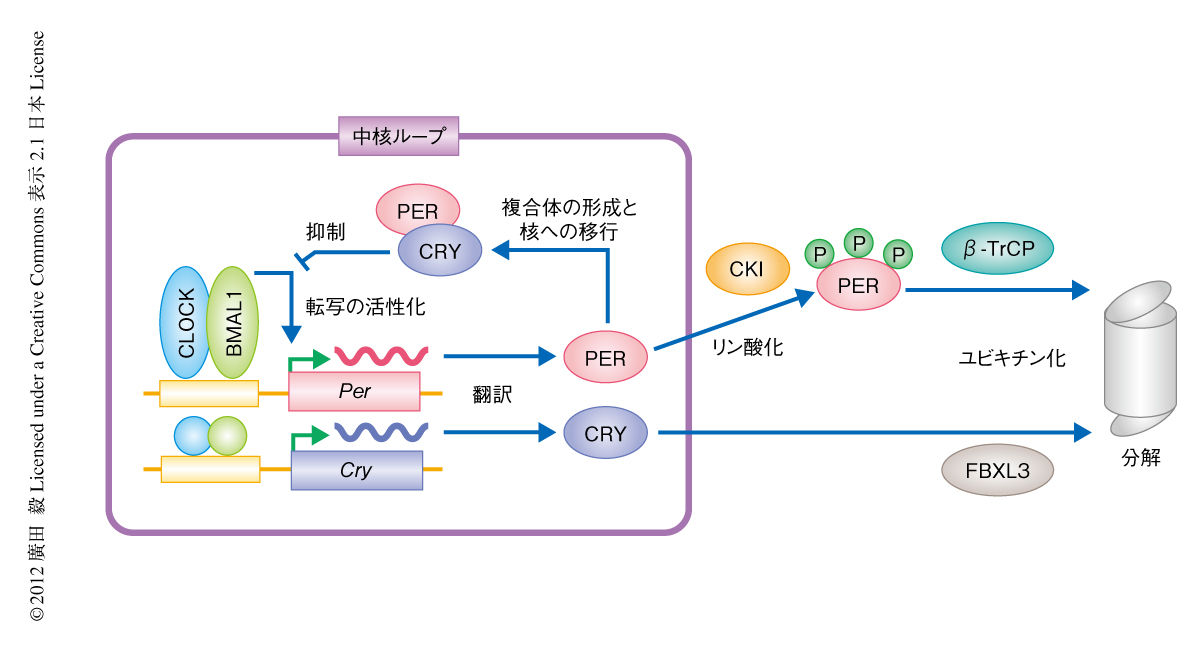
これまでの遺伝学的および分子生物学的な研究から,概日時計の基本骨格を構成する分子が同定されてきた.哺乳類においては,時計遺伝子であるperiod遺伝子(Per1遺伝子とPer2遺伝子)およびcryptochrome遺伝子(Cry1遺伝子とCry2遺伝子)の転写および翻訳を介したフィードバックループが概日時計の中核を形成すると考えられている1).すなわち,CLOCKとBMAL1からなるヘテロ二量体が転写因子としてPer遺伝子およびCry遺伝子の転写を活性化し,翻訳されたPERとCRYが複合体の形成および核への移行をへてCLOCK-BMAL1ヘテロ二量体による転写の活性化を抑制する(図1).このループが1日に約1周することで,代謝律速酵素などの遺伝子の転写制御を介し生理現象における概日リズムが生み出される.なお,シアノバクテリアのもつ時計タンパク質KaiCのリン酸化リズムのように2),転写および翻訳を必要としない概日時計の機構は哺乳類にも存在することが最近になり発見された3).このペルオキシレドキシン酵素の酸化還元のリズムが時計遺伝子の転写および翻訳により生じるリズムとどのように関係しているのかは今後の課題である.
時計遺伝子の発現量は約1日の周期で増減をくり返すため,その転写制御領域にルシフェラーゼをレポーターとして連結することにより(Per2遺伝子レポーターおよびBmal1遺伝子レポーターがよく用いられる),発光量の経時変化として概日リズムを測定することができる.さらに,概日時計の機構は全身の個々の細胞に備わっていることから,マウスの個体を使わなくても培養細胞において研究を行うことが可能である1).筆者らは,発光レポーターをもつヒト培養細胞を用いて概日リズムをハイスループットで測定する系を確立し,RNAi法や薬剤を用いたスクリーニングを行うことで概日時計に関与する分子を探索してきた4-7).とくに,薬剤を用いるアプローチはケミカルバイオロジーとよばれ,ユニークな生理活性をもつ化合物は生理現象の分子機構を解き明かすためのプローブとなるだけでなく,創薬の起点にもなりうる.筆者ら,および,ほかのグループによる薬剤スクリーニングから,概日時計の周期を変化させる数十種類の化合物が見い出されてきた5-9).興味深いことに,周期の延長をひき起こす化合物の大部分はカゼインキナーゼIδ(CKIδ)あるいはCKIεを阻害する.たとえば,筆者らが見い出したロングデイシンは,CKIδだけでなくCKIαおよびERK2を並行して阻害することにより非常に強い周期の延長効果を示す6).CKIδおよびCKIεはPERをリン酸化して分解に導くことがすでに知られており1)(図1),その重要性が裏づけられたことになる.しかし,ほかの既知(および,未知)の時計タンパク質に作用する化合物は存在しないのか,という課題が残っていた.
概日時計の周期に影響をあたえる新たな化合物を同定するため,Bmal1遺伝子レポーターを組み込んだヒトU2OS培養細胞を用いて約6万種類の化合物の効果を解析した.具体的には,約200枚の384ウェルプレートに細胞をまき,1ウェルごとに異なる化合物を投与したのち,2時間おきに4日間にわたり細胞の概日リズムを測定した.その結果,KL001~KL003と命名した,構造のよく似た3種類の化合物(図2)が,いずれも用量に依存して概日時計の周期の延長を導くことを見い出した.すなわち,この化合物をあたえればあたえるほど,細胞にとっての1日の時間が長くなった.しかも,ロングデイシンなどのCKI阻害剤とは異なり,KL001~KL003はPer2遺伝子レポーターの活性を顕著に抑制することが判明した.これらの効果はマウスの視交差上核や肺の組織培養,および,マウスNIH-3T3細胞においてもみられ,KL001~KL003は生物種や細胞種をこえて作用することがわかった.KL001~KL003はin vitroにおいてCKIの酵素活性に影響をあたえなかったことから,新たな作用機序が示唆された.
KL001の標的タンパク質を同定するためアフィニティー精製を試みた.これは,順遺伝学におけるポジショナルクローニングに相当する,手間のかかる作業である.まずは,アフィニティー担体を得るためKL001のさまざまな部位をエチレングリコールリンカーにより修飾した.たいていの部位では修飾により化合物の活性は失われてしまったが,最終的には概日時計の周期の延長活性をもつ(すなわち,標的タンパク質に作用しうる)リンカー化合物をみつけだすことに成功した.このリンカー化合物をアガロースビーズに結合させてアフィニティー担体とし,これと相互作用するタンパク質をヒトU2OS細胞の懸濁液から精製した.このとき,多くのタンパク質がアガロースビーズに対し非特異的に相互作用するため,遊離のKL001を用いた競合実験が標的タンパク質を同定するための鍵となる.質量分析の結果,KL001と特異的に結合するタンパク質として時計タンパク質であるCRY1を同定した.抗体を用いたイムノブロット解析により,CRY1だけでなくCRY2もKL001と特異的に結合していたことが判明した.さらに,時計タンパク質であるCLOCK,BMAL1,PER1,PER2,CRY1,CRY2をHEK293T細胞に過剰発現させアフィニティー精製を行ったが,KL001と結合したのはCRY1とCRY2のみであった.概日時計の中核を構成するCRYに作用する化合物を発見した興奮の瞬間であった.
HEK293T細胞および大腸菌に過剰発現させたのち精製したCRY1は,いずれもアフィニティー担体と特異的に相互作用したことから,CRYとKL001との結合は直接的であると考えられた.ほかにも,概日時計の周期の延長効果が非常に弱いKL001アナログを用いた解析や,KL001と結合できないCRY1変異体の同定から,CRYとKL001との結合の特異性が支持された.KL001によるPer2遺伝子レポーター活性の抑制はCRY1とCRY2のノックアウト(マウス線維芽細胞)およびノックダウン(ヒトU2OS細胞)により消失したことから,KL001の概日時計に対する効果はCRYに依存すると考えられた.
KL001はCRYに対しどのような作用を示すのだろうか? ヒトU2OS細胞においてKL001が内在性の時計遺伝子の発現にあたえる影響を解析した結果,CLOCK-BMAL1ヘテロ二量体の標的遺伝子であるPer1遺伝子,Per2遺伝子,Cry1遺伝子,Cry2遺伝子の発現が軒並み低下したことから,KL001はCRYのもつ転写の抑制活性を増強すると考えられた.PER1タンパク質の発現量はPer1 mRNA量の変化にともない減少したのに対し,CRY1およびCRY2のタンパク質量はmRNA量とは異なり減少しなかったことから,KL001はCRYタンパク質を安定化すると示唆された.そこで,CRYとルシフェラーゼとの融合タンパク質をHEK293細胞に発現させてその半減期を測定したところ,KL001はCRY1およびCRY2の分解を抑制することが判明した.一方,KL001と結合できないCRY1変異体はKL001により安定化されなかった.さらに,概日時計の周期の延長効果の非常に弱いKL001アナログはCRYを安定化しなかったことから,CRYの安定化がKL001による概日時計の周期の制御に重要であることが示された.
CRYはFBXL3というユビキチンリガーゼの基質となり,プロテアソームを介し分解される1)(図1).KL001はCRY1のin vitroにおけるユビキチン化を抑制することを見い出した.さらに,ヒトU2OS細胞においてFBXL3をノックダウンしたところ,KL001による概日時計の周期の延長効果およびPer2遺伝子レポーター活性の抑制効果は,両者とも著しく減弱した.以上の結果から,KL001はFBXL3を介したCRYの分解を抑制することにより概日時計に影響をあたえることをつきとめた.
では,CRYの安定化はどのように概日時計の周期を延長するのだろうか? CRY1のノックアウトは周期の短縮を導くのに対し,CRY2のノックアウトは逆に周期を延長させることから,CRY1とCRY2は概日時計の周期の制御において異なる役割をはたしているものと考えられてきた1).そこで,KL001を用いた実験と数理モデルとを組み合わせることによりこの問題に取り組もうと考えた.まず,ノックアウトの表現型にもとづきCRY1は長周期のループ,CRY2は短周期のループを構成すると仮定し,PER,CRY1,CRY2の三者のみからなるシンプルな数理モデルを構築した.このとき,PERとCRYとの複合体の形成と核への移行において,PERが律速となることが重要であった.この数理モデルから,KL001が概日時計の周期の延長をひき起こすためにはCRYが核において安定化される必要があると予測された.ヒトU2OS細胞の核画分を用いた実験から,KL001によりPER1のタンパク質量は減少するのに対し,CRY1およびCRY2は減少しないことが確認された.
つづいて,CRY1とCRY2のそれぞれの役割をどちらか一方をノックアウトした(すなわち,一方のCRYしか存在しない)条件で評価した.その結果,KL001を用いた実験と数理モデルの両方において,CRY1およびCRY2の安定化はどちらも概日時計の周期の延長を導くことが明らかになった.つまり,これまでの予想とは異なり,CRY1とCRY2の概日時計の周期の制御における役割は類似していることが明らかになった.CRY1ノックアウトの表現型とCRY2ノックアウトの表現型が逆になるのは,野生型ににおいて概日時計の周期は長周期のCRY1ループと短周期のCRY2ループとのバランスにより決定されているからだと考えられた.なお,CRY1ループとCRY2ループの周期の違いは,それぞれのタンパク質の転写抑制能や安定性の違いに起因すると予想された.
CRYは概日時計の発振だけでなく,ホスホエノールピルビン酸カルボキシキナーゼ遺伝子やグルコース-6-ホスファターゼ遺伝子の転写抑制を介し肝臓における糖新生にも関与する10,11).そこで,KL001が糖新生にあたえる影響をマウス初代培養肝細胞を用いて解析した.その結果,空腹時に膵臓から分泌されるホルモンであるグルカゴンによるホスホエノールピルビン酸カルボキシキナーゼ遺伝子およびグルコース-6-ホスファターゼ遺伝子の誘導を,KL001が用量に依存して抑制することを見い出した.興味深いことに,グルカゴンによる刺激がない場合にはこれらの遺伝子の発現は影響をうけなかった.さらに,KL001はグルカゴンの刺激によるグルコースの産生も抑制することが判明した.
この研究により,概日時計の中核機構が創薬のターゲットになりうることが示された.さらに,CRYが糖新生を制御するという最近の知見が支持されただけでなく,この過程を化合物により制御できることが明らかになった.2型糖尿病の原因のひとつとして,インスリンおよびグルカゴンの分泌の異常による過剰な糖新生があげられる.ヒトのCRY2遺伝子座は空腹時血糖値や2型糖尿病と関連することがゲノムワイド関連解析から見い出されていることを考えあわせると,将来的には,KL001を糖尿病の治療に応用する可能性に期待したい.まずは,薬物動態の特性にすぐれたアナログをみつけだし,生体においても同様の効果を示すことを確かめる必要がある.CRYは糖新生だけでなく,食塩に感受性の高血圧や炎症性サイトカインの産生などにも関与しており,これらに対しKL001がどのような影響をあたえるのかも興味深い課題である.
略歴:2003年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任助手を経て,2007年より米国Scripps Research Instituteおよび米国California大学San Diego校 研究員.
© 2012 廣田 毅 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Division of Biological Sciences)
email:廣田 毅
DOI: 10.7875/first.author.2012.093
Identification of small molecule activators of cryptochrome.
Tsuyoshi Hirota, Jae Wook Lee, Peter C. St. John, Mariko Sawa, Keiko Iwaisako, Takako Noguchi, Pagkapol Y. Pongsawakul, Tim Sonntag, David K. Welsh, David A. Brenner, Francis J. Doyle, III, Peter G. Schultz, Steve A. Kay
Science, 337, 1094-1097 (2012)
要 約
概日時計は睡眠や覚醒など,さまざまな生理現象にみられる約1日の周期をもつ概日リズムを制御しており,その機能障害は代謝疾患をはじめ多くの疾患と関連している.そのため,概日時計の機能を制御する薬剤はこれらの疾患を治療する助けとなりうるが,概日時計の中核を構成する時計タンパク質に直接的に作用する薬剤はほとんど知られていない.筆者らは,ヒト培養細胞を用いた薬剤スクリーニングから概日時計の機能を制御する新たな化合物を同定しKL001と名づけた.KL001は時計タンパク質であるCRYと特異的に結合してそのプロテアソームを介する分解を抑制し,概日時計の周期を延長させた.さらに,CRY1とCRY2の2つのアイソフォームは概日時計において類似した役割をはたしていることを数理モデルと組み合わせることにより明らかにするとともに,マウスの肝細胞においてKL001はグルカゴンによる糖新生の誘発を抑制することを見い出した.KL001はCRYの関与する生理現象を研究するための有用なツールとなるだけでなく,糖尿病の治療に新たな手がかりをあたえるかもしれない.
はじめに
これまでの遺伝学的および分子生物学的な研究から,概日時計の基本骨格を構成する分子が同定されてきた.哺乳類においては,時計遺伝子であるperiod遺伝子(Per1遺伝子とPer2遺伝子)およびcryptochrome遺伝子(Cry1遺伝子とCry2遺伝子)の転写および翻訳を介したフィードバックループが概日時計の中核を形成すると考えられている1).すなわち,CLOCKとBMAL1からなるヘテロ二量体が転写因子としてPer遺伝子およびCry遺伝子の転写を活性化し,翻訳されたPERとCRYが複合体の形成および核への移行をへてCLOCK-BMAL1ヘテロ二量体による転写の活性化を抑制する(図1).このループが1日に約1周することで,代謝律速酵素などの遺伝子の転写制御を介し生理現象における概日リズムが生み出される.なお,シアノバクテリアのもつ時計タンパク質KaiCのリン酸化リズムのように2),転写および翻訳を必要としない概日時計の機構は哺乳類にも存在することが最近になり発見された3).このペルオキシレドキシン酵素の酸化還元のリズムが時計遺伝子の転写および翻訳により生じるリズムとどのように関係しているのかは今後の課題である.
時計遺伝子の発現量は約1日の周期で増減をくり返すため,その転写制御領域にルシフェラーゼをレポーターとして連結することにより(Per2遺伝子レポーターおよびBmal1遺伝子レポーターがよく用いられる),発光量の経時変化として概日リズムを測定することができる.さらに,概日時計の機構は全身の個々の細胞に備わっていることから,マウスの個体を使わなくても培養細胞において研究を行うことが可能である1).筆者らは,発光レポーターをもつヒト培養細胞を用いて概日リズムをハイスループットで測定する系を確立し,RNAi法や薬剤を用いたスクリーニングを行うことで概日時計に関与する分子を探索してきた4-7).とくに,薬剤を用いるアプローチはケミカルバイオロジーとよばれ,ユニークな生理活性をもつ化合物は生理現象の分子機構を解き明かすためのプローブとなるだけでなく,創薬の起点にもなりうる.筆者ら,および,ほかのグループによる薬剤スクリーニングから,概日時計の周期を変化させる数十種類の化合物が見い出されてきた5-9).興味深いことに,周期の延長をひき起こす化合物の大部分はカゼインキナーゼIδ(CKIδ)あるいはCKIεを阻害する.たとえば,筆者らが見い出したロングデイシンは,CKIδだけでなくCKIαおよびERK2を並行して阻害することにより非常に強い周期の延長効果を示す6).CKIδおよびCKIεはPERをリン酸化して分解に導くことがすでに知られており1)(図1),その重要性が裏づけられたことになる.しかし,ほかの既知(および,未知)の時計タンパク質に作用する化合物は存在しないのか,という課題が残っていた.
1.概日時計の周期を延長させる新しい化合物
概日時計の周期に影響をあたえる新たな化合物を同定するため,Bmal1遺伝子レポーターを組み込んだヒトU2OS培養細胞を用いて約6万種類の化合物の効果を解析した.具体的には,約200枚の384ウェルプレートに細胞をまき,1ウェルごとに異なる化合物を投与したのち,2時間おきに4日間にわたり細胞の概日リズムを測定した.その結果,KL001~KL003と命名した,構造のよく似た3種類の化合物(図2)が,いずれも用量に依存して概日時計の周期の延長を導くことを見い出した.すなわち,この化合物をあたえればあたえるほど,細胞にとっての1日の時間が長くなった.しかも,ロングデイシンなどのCKI阻害剤とは異なり,KL001~KL003はPer2遺伝子レポーターの活性を顕著に抑制することが判明した.これらの効果はマウスの視交差上核や肺の組織培養,および,マウスNIH-3T3細胞においてもみられ,KL001~KL003は生物種や細胞種をこえて作用することがわかった.KL001~KL003はin vitroにおいてCKIの酵素活性に影響をあたえなかったことから,新たな作用機序が示唆された.
2.KL001はCRYに特異的に結合する
KL001の標的タンパク質を同定するためアフィニティー精製を試みた.これは,順遺伝学におけるポジショナルクローニングに相当する,手間のかかる作業である.まずは,アフィニティー担体を得るためKL001のさまざまな部位をエチレングリコールリンカーにより修飾した.たいていの部位では修飾により化合物の活性は失われてしまったが,最終的には概日時計の周期の延長活性をもつ(すなわち,標的タンパク質に作用しうる)リンカー化合物をみつけだすことに成功した.このリンカー化合物をアガロースビーズに結合させてアフィニティー担体とし,これと相互作用するタンパク質をヒトU2OS細胞の懸濁液から精製した.このとき,多くのタンパク質がアガロースビーズに対し非特異的に相互作用するため,遊離のKL001を用いた競合実験が標的タンパク質を同定するための鍵となる.質量分析の結果,KL001と特異的に結合するタンパク質として時計タンパク質であるCRY1を同定した.抗体を用いたイムノブロット解析により,CRY1だけでなくCRY2もKL001と特異的に結合していたことが判明した.さらに,時計タンパク質であるCLOCK,BMAL1,PER1,PER2,CRY1,CRY2をHEK293T細胞に過剰発現させアフィニティー精製を行ったが,KL001と結合したのはCRY1とCRY2のみであった.概日時計の中核を構成するCRYに作用する化合物を発見した興奮の瞬間であった.
HEK293T細胞および大腸菌に過剰発現させたのち精製したCRY1は,いずれもアフィニティー担体と特異的に相互作用したことから,CRYとKL001との結合は直接的であると考えられた.ほかにも,概日時計の周期の延長効果が非常に弱いKL001アナログを用いた解析や,KL001と結合できないCRY1変異体の同定から,CRYとKL001との結合の特異性が支持された.KL001によるPer2遺伝子レポーター活性の抑制はCRY1とCRY2のノックアウト(マウス線維芽細胞)およびノックダウン(ヒトU2OS細胞)により消失したことから,KL001の概日時計に対する効果はCRYに依存すると考えられた.
3.KL001はCRYのプロテアソームを介した分解を抑制する
KL001はCRYに対しどのような作用を示すのだろうか? ヒトU2OS細胞においてKL001が内在性の時計遺伝子の発現にあたえる影響を解析した結果,CLOCK-BMAL1ヘテロ二量体の標的遺伝子であるPer1遺伝子,Per2遺伝子,Cry1遺伝子,Cry2遺伝子の発現が軒並み低下したことから,KL001はCRYのもつ転写の抑制活性を増強すると考えられた.PER1タンパク質の発現量はPer1 mRNA量の変化にともない減少したのに対し,CRY1およびCRY2のタンパク質量はmRNA量とは異なり減少しなかったことから,KL001はCRYタンパク質を安定化すると示唆された.そこで,CRYとルシフェラーゼとの融合タンパク質をHEK293細胞に発現させてその半減期を測定したところ,KL001はCRY1およびCRY2の分解を抑制することが判明した.一方,KL001と結合できないCRY1変異体はKL001により安定化されなかった.さらに,概日時計の周期の延長効果の非常に弱いKL001アナログはCRYを安定化しなかったことから,CRYの安定化がKL001による概日時計の周期の制御に重要であることが示された.
CRYはFBXL3というユビキチンリガーゼの基質となり,プロテアソームを介し分解される1)(図1).KL001はCRY1のin vitroにおけるユビキチン化を抑制することを見い出した.さらに,ヒトU2OS細胞においてFBXL3をノックダウンしたところ,KL001による概日時計の周期の延長効果およびPer2遺伝子レポーター活性の抑制効果は,両者とも著しく減弱した.以上の結果から,KL001はFBXL3を介したCRYの分解を抑制することにより概日時計に影響をあたえることをつきとめた.
4.CRY1とCRY2は概日時計の周期の制御において類似した役割をはたしている
では,CRYの安定化はどのように概日時計の周期を延長するのだろうか? CRY1のノックアウトは周期の短縮を導くのに対し,CRY2のノックアウトは逆に周期を延長させることから,CRY1とCRY2は概日時計の周期の制御において異なる役割をはたしているものと考えられてきた1).そこで,KL001を用いた実験と数理モデルとを組み合わせることによりこの問題に取り組もうと考えた.まず,ノックアウトの表現型にもとづきCRY1は長周期のループ,CRY2は短周期のループを構成すると仮定し,PER,CRY1,CRY2の三者のみからなるシンプルな数理モデルを構築した.このとき,PERとCRYとの複合体の形成と核への移行において,PERが律速となることが重要であった.この数理モデルから,KL001が概日時計の周期の延長をひき起こすためにはCRYが核において安定化される必要があると予測された.ヒトU2OS細胞の核画分を用いた実験から,KL001によりPER1のタンパク質量は減少するのに対し,CRY1およびCRY2は減少しないことが確認された.
つづいて,CRY1とCRY2のそれぞれの役割をどちらか一方をノックアウトした(すなわち,一方のCRYしか存在しない)条件で評価した.その結果,KL001を用いた実験と数理モデルの両方において,CRY1およびCRY2の安定化はどちらも概日時計の周期の延長を導くことが明らかになった.つまり,これまでの予想とは異なり,CRY1とCRY2の概日時計の周期の制御における役割は類似していることが明らかになった.CRY1ノックアウトの表現型とCRY2ノックアウトの表現型が逆になるのは,野生型ににおいて概日時計の周期は長周期のCRY1ループと短周期のCRY2ループとのバランスにより決定されているからだと考えられた.なお,CRY1ループとCRY2ループの周期の違いは,それぞれのタンパク質の転写抑制能や安定性の違いに起因すると予想された.
5.KL001はグルカゴンによる糖新生の誘発を抑制する
CRYは概日時計の発振だけでなく,ホスホエノールピルビン酸カルボキシキナーゼ遺伝子やグルコース-6-ホスファターゼ遺伝子の転写抑制を介し肝臓における糖新生にも関与する10,11).そこで,KL001が糖新生にあたえる影響をマウス初代培養肝細胞を用いて解析した.その結果,空腹時に膵臓から分泌されるホルモンであるグルカゴンによるホスホエノールピルビン酸カルボキシキナーゼ遺伝子およびグルコース-6-ホスファターゼ遺伝子の誘導を,KL001が用量に依存して抑制することを見い出した.興味深いことに,グルカゴンによる刺激がない場合にはこれらの遺伝子の発現は影響をうけなかった.さらに,KL001はグルカゴンの刺激によるグルコースの産生も抑制することが判明した.
おわりに
この研究により,概日時計の中核機構が創薬のターゲットになりうることが示された.さらに,CRYが糖新生を制御するという最近の知見が支持されただけでなく,この過程を化合物により制御できることが明らかになった.2型糖尿病の原因のひとつとして,インスリンおよびグルカゴンの分泌の異常による過剰な糖新生があげられる.ヒトのCRY2遺伝子座は空腹時血糖値や2型糖尿病と関連することがゲノムワイド関連解析から見い出されていることを考えあわせると,将来的には,KL001を糖尿病の治療に応用する可能性に期待したい.まずは,薬物動態の特性にすぐれたアナログをみつけだし,生体においても同様の効果を示すことを確かめる必要がある.CRYは糖新生だけでなく,食塩に感受性の高血圧や炎症性サイトカインの産生などにも関与しており,これらに対しKL001がどのような影響をあたえるのかも興味深い課題である.
文 献
- Takahashi, J. S., Hong, H. K., Ko, C. H. et al.: The genetics of mammalian circadian order and disorder: implications for physiology and disease. Nat. Rev. Genet., 9, 764-775 (2008)[PubMed]
- Tomita, J., Nakajima, M., Kondo, T. et al.: No transcription-translation feedback in circadian rhythm of KaiC phosphorylation. Science, 307, 251-254 (2005)[PubMed]
- O'Neill, J. S. & Reddy, A. B.: Circadian clocks in human red blood cells. Nature, 469, 498-503 (2011)[PubMed]
- Zhang, E. E., Liu, A. C., Hirota, T. et al.: A genome-wide RNAi screen for modifiers of the circadian clock in human cells. Cell, 139, 199-210 (2009)[PubMed]
- Hirota, T., Lewis, W. G., Liu, A. C. et al.: A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3β. Proc. Natl. Acad. Sci. USA, 105, 20746-20751 (2008)[PubMed]
- Hirota, T., Lee, J. W., Lewis, W. G. et al.: High-throughput chemical screen identifies a novel potent modulator of cellular circadian rhythms and reveals CKIα as a clock regulatory kinase. PLoS Biol., 8, e1000559 (2010)[PubMed]
- Lee, J. W., Hirota, T., Peters, E. C. et al.: A small molecule modulates circadian rhythms through phosphorylation of the period protein. Angew. Chem. Int. Ed., 50, 10608-10611 (2011)[PubMed]
- Isojima, Y., Nakajima, M., Ukai, H. et al.: CKIε/δ-dependent phosphorylation is a temperature-insensitive, period-determining process in the mammalian circadian clock. Proc. Natl. Acad. Sci. USA, 106, 15744-15749 (2009)[PubMed]
- Chen, Z., Yoo, S. H., Park, Y. S. et al.: Identification of diverse modulators of central and peripheral circadian clocks by high-throughput chemical screening. Proc. Natl. Acad. Sci. USA, 109, 101-106 (2012)[PubMed]
- Zhang, E. E., Liu, Y., Dentin, R. et al.: Cryptochrome mediates circadian regulation of cAMP signaling and hepatic gluconeogenesis. Nat. Med., 16, 1152-1156 (2010)[PubMed]
- Lamia, K. A., Papp, S. J., Yu, R. T. et al.: Cryptochromes mediate rhythmic repression of the glucocorticoid receptor. Nature, 480, 552-556 (2011)[PubMed]
著者プロフィール
略歴:2003年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任助手を経て,2007年より米国Scripps Research Instituteおよび米国California大学San Diego校 研究員.
© 2012 廣田 毅 Licensed under CC 表示 2.1 日本