Mcm8とMcm9は複合体を形成しDNA二本鎖間架橋のひき起こす相同組換え修復において機能する
西村浩平・鐘巻将人
(国立遺伝学研究所 新分野創造センター分子機能研究室)
email:西村浩平,鐘巻将人
DOI: 10.7875/first.author.2012.092
Mcm8 and Mcm9 form a complex that functions in homologous recombination repair induced by DNA interstrand crosslinks.
Kohei Nishimura, Masamichi Ishiai, Kazuki Horikawa, Tatsuo Fukagawa, Minoru Takata, Haruhiko Takisawa, Masato T. Kanemaki
Molecular Cell, 47, 511-522 (2012)
遺伝子をコードしているDNAは化学物質や紫外線といった環境要因によりさまざまな損傷をうける.DNA損傷のひとつであるDNA二本鎖間架橋は,複製や転写といった細胞の増殖に必須な機能を阻害してしまうため,増殖している細胞に対する毒性は非常に高い.そのため,DNA二本鎖間架橋を形成するシスプラチンなどの薬剤は抗がん剤として利用されている.これまでの研究により,DNA二本鎖間架橋の修復はおもに細胞周期のS期においてDNA複製と共役して起こっており,ファンコニ貧血症原因遺伝子産物,TLSポリメラーゼ,相同組換えタンパク質など多くのタンパク質の関与した複雑な機構であることが明らかになりつつある.この研究では,DNA複製に必須の複製ヘリカーゼであるMcm2-7複合体の構成タンパク質のファミリータンパク質であるMcm8とMcm9が,脊椎動物においてMcm2-7複合体と類似した複合体を形成し,そのMcm8-9複合体がDNA二本鎖間架橋の修復のときに必要とされる相同組換え修復反応の促進に作用していることを示した.
Mcm2-7複合体は同一の祖先タンパク質から進化したMcm2からMcm7までの6つの構成タンパク質からなるリング状の六量体であり,複製ヘリカーゼとして機能するため真核生物のDNA複製において必須である.近年のめざましいゲノム解析により新たに,多くの真核生物のゲノムにおいて同じ祖先タンパク質から進化した2つのMCM遺伝子の存在していることが明らかになり,MCM8遺伝子,MCM9遺伝子と命名された(図1).興味深いことに,すべての真核生物はMCM2遺伝子からMCM7遺伝子までを保持しているのに対し,MCM8遺伝子とMCM9遺伝子は酵母や線虫など一部の真核生物には存在しない.さらに,ほとんどの生物種においてMCM8遺伝子とMCM9遺伝子は共進化しているようにみられる1).
アフリカツメガエル卵母細胞の無細胞複製系や培養細胞を用いた過去の研究において,Mcm8とMcm9は別個にDNA複製反応に関与すると報告されていた2-4).一方で,ショウジョウバエMcm8は減数分裂組換えに機能することや,ヒト女性の閉経時期にMCM8遺伝子の変異が影響していることも報告されている5-7).筆者らは,Mcm8とMcm9の機能的な関係性に焦点をあて,遺伝学的な改変が可能なニワトリDT40細胞を用いてその機能解析を行った.
細胞におけるMcm8およびMcm9の機能を解析するため,MCM8遺伝子のノックアウト細胞およびMCM9遺伝子のノックアウト細胞を作製した.この2つのノックアウト細胞におけるタンパク質の発現を解析したところ,MCM8遺伝子ノックアウト細胞においてはMcm9の減少が,また,MCM9遺伝子ノックアウト細胞においてもMcm8の弱い減少が確認された.この結果から,Mcm8とMcm9とが相互の安定性を保つために物理的な相互作用をもつことが示唆されたので,免疫沈降実験を行った.その結果,Mcm8あるいはMcm9を免疫沈降すると,互いの大部分は共沈降した.しかしながら,同じタンパク質ファミリーであるにもかかわらず,Mcm2-7複合体の構成タンパク質には共沈降はまったく認められなかった.この結果は,Mcm8とMcm9はMcm2-7複合体とは独立した複合体を形成していることを示していた.さらに,Mcm8-9複合体の大きさを調べるため細胞抽出液をゲルろ過により分画したところ,その大きさはMcm2-7複合体とほぼ同じであり,おそらく,類似の六量体を構成しているものと推察された.Mcm2-7複合体の個々の構成タンパク質はDNA複製に必須であるためノックアウト細胞を作製することはできないが,Mcm8とMcm9はそれぞれノックアウト細胞を作製することが可能であった.この結果は,Mcm8とMcm9はDNA複製に必須ではないことを示していた.さらに,Mcm8とMcm9は複合体として機能し,Mcm2-7複合体とは異なるはたらきをもつことが示唆された.
脊椎動物の培養細胞においてMcm8-9複合体がどのような機能をもつかを確かめるため,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞がどのような表現型を示すかを解析した.それぞれのノックアウト細胞において細胞周期におけるステージを比較したところ,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞では野生型の細胞と比べG2期/M期にある細胞の割合が増加していた.さらにくわしく調べたところ,DNA含量が2C未満の死細胞の割合も増加していることがわかった.以上の結果は,なんらかのDNA損傷が蓄積していることが原因として考えられたため,さまざまなDNA損傷に対する感受性を調べた.MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞は放射線,紫外線,メチルメタンスルホン酸に対して弱い感受性しか示さなかったが,シスプラチンやマイトマイシンCといったDNA鎖架橋剤に対し高い感受性を示した.さらに,レポータータンパク質であるGFPを結合させたMcm8あるいはMcm9を発現させ細胞における局在を観察したところ,マイトマイシンCで処理するとMcm8およびMcm9は核においてフォーカスを形成し,Rad51と部分的に共局在することがわかった.Rad51はDNAの損傷部位に集積し相同組換え修復を行うことが知られている.そのため,Mcm8-9複合体もDNA二本鎖間架橋の修復にかかわるのではないかと考えられた.
Mcm8とMcm9を含むすべてのMcmファミリータンパク質はAAA+ ATPaseファミリーに属しており,ファミリーのあいだで保存されたMcmヘリカーゼドメインをその中心部に保持している.Mcmヘリカーゼドメインの内部にはATPの結合および加水分解に必要なWalker AモチーフとWalker Bモチーフ,そして,となりあったサブユニットのATPase活性化に必要なArgフィンガーモチーフが含まれている.これらのモチーフがDNA鎖架橋剤に対する抵抗性に必要であるかどうかを解析した.MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞にそれぞれの野生型の遺伝子をコードするcDNAを導入するとシスプラチンに対する感受性は回復したが,Walker AモチーフあるいはArgフィンガーモチーフに変異をもつそれぞれの遺伝子をコードするcDNAを導入したときにはシスプラチンに対する感受性を回復させることはできなかった.以上の結果は,DNA鎖架橋剤に対する抵抗性を発揮するときにはMcm8とMcm9のもつATPase活性が必要であり,Mcm8-9複合体はヘリカーゼとして機能していることを示唆していた.
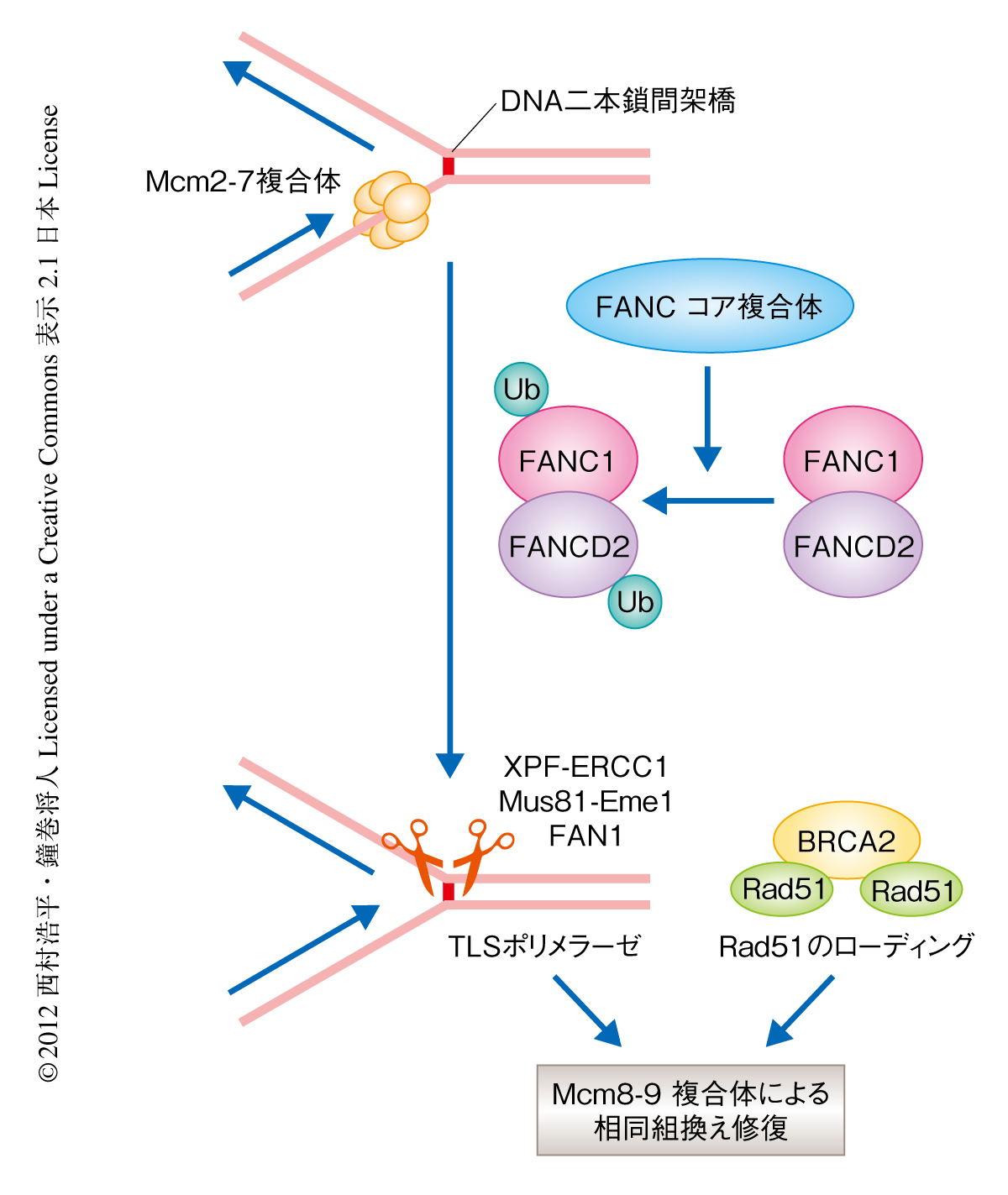
脊椎動物においてDNA二本鎖間架橋の修復には,ファンコニ貧血症原因遺伝子産物,TLSポリメラーゼ,Rad51など,多岐にわたるタンパク質が機能していることが明らかになっている8).この修復経路においては,ファンコニ貧血症原因遺伝子産物のひとつFANCD2のモノユビキチン化とRad51の損傷部位への結合の必要であることがすでにわかっている.そこで,Mcm8-9複合体がDNA二本鎖間架橋の修復にどのようにかかわっているのかを調べるため,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞においてFANCD2のモノユビキチン化やRad51のフォーカス形成およびクロマチンへの結合量を確認したが,野生型の細胞との違いは観察されなかった.しかしながら,FANCD2を欠失させた細胞やRad51の損傷部位への結合が阻害される変異をもつ細胞においては,野生型の細胞と比較してDNA二本鎖間架橋に依存的なMcm9のフォーカス形成が減少していた.この結果は,FANCD2のモノユビキチン化とRad51の損傷部位への集積ののちにMcm8-9複合体は呼び込まれることを示しており,Mcm8-9複合体はそのあとの相同組換え修復のときにはたらくことが予想された.実際に,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞において相同組換えの効率が大幅に減少していただけでなく,DNA二本鎖間架橋によりひき起こされる相同組換えによる娘染色体のあいだの交差の頻度が大きく低下していたことから,Mcm8-9複合体は相同組換えに機能することが明らかになった.以上の結果から,Mcm8-9複合体はDNA二本鎖間架橋のひき起こす相同組換え修復反応を促進する機能をもつと結論された(図2).
この研究では,ニワトリのDT40細胞を用いてMcm8およびMcm9の解析を行い,この2つのタンパク質が複合体を形成し,DNA二本鎖間架橋を修復するときの相同組換え修復においてはたらくことを示した.ショウジョウバエMcm8が減数分裂期における交差型の組換えに必要であるという報告,MCM9遺伝子のノックアウトマウスにおいては,がんが生じやすいだけでなく生殖細胞の形成に影響がみられるという報告,ヒトMCM8遺伝子と閉経時期との関連などは,非常に興味深い5-7,9).筆者らが明らかにしたMcm8-9複合体が相同組換え修復に関与するという事実は,Mcm8-9複合体が減数分裂組換えにも関与する可能性を示唆している.実際に,同じ時期に発表された論文は,マウスのMcm8およびMcm9が減数分裂組換えに機能していることを示している10).今後は,Mcm8-9複合体のより詳細な分子機能ならびに立体構造の明らかにされることが期待される.真核生物の祖先と考えられている古細菌にはMcm8およびMcm9の祖先と考えられるタンパク質を保持しているものもあり,Mcm8-9複合体による組換えの制御は真核生物への進化の初期過程から保存されているものと考えられる.酵母や線虫などいくつかの生物種はMCM8遺伝子およびMCM9遺伝子をもたないことから,組換え修復反応の進化なども明らかになるであろう.
略歴:2010年 大阪大学大学院理学研究科博士課程 修了,同年 同 特任研究員を経て,2011年より国立遺伝学研究所 研究員.
鐘巻 将人(Masato Kanemaki)
国立遺伝学研究所 准教授.
研究室URL:http://www.nig.ac.jp/labs/MolFunc/Molecular_Function_HP/Home.html
© 2012 西村浩平・鐘巻将人 Licensed under CC 表示 2.1 日本
(国立遺伝学研究所 新分野創造センター分子機能研究室)
email:西村浩平,鐘巻将人
DOI: 10.7875/first.author.2012.092
Mcm8 and Mcm9 form a complex that functions in homologous recombination repair induced by DNA interstrand crosslinks.
Kohei Nishimura, Masamichi Ishiai, Kazuki Horikawa, Tatsuo Fukagawa, Minoru Takata, Haruhiko Takisawa, Masato T. Kanemaki
Molecular Cell, 47, 511-522 (2012)
要 約
遺伝子をコードしているDNAは化学物質や紫外線といった環境要因によりさまざまな損傷をうける.DNA損傷のひとつであるDNA二本鎖間架橋は,複製や転写といった細胞の増殖に必須な機能を阻害してしまうため,増殖している細胞に対する毒性は非常に高い.そのため,DNA二本鎖間架橋を形成するシスプラチンなどの薬剤は抗がん剤として利用されている.これまでの研究により,DNA二本鎖間架橋の修復はおもに細胞周期のS期においてDNA複製と共役して起こっており,ファンコニ貧血症原因遺伝子産物,TLSポリメラーゼ,相同組換えタンパク質など多くのタンパク質の関与した複雑な機構であることが明らかになりつつある.この研究では,DNA複製に必須の複製ヘリカーゼであるMcm2-7複合体の構成タンパク質のファミリータンパク質であるMcm8とMcm9が,脊椎動物においてMcm2-7複合体と類似した複合体を形成し,そのMcm8-9複合体がDNA二本鎖間架橋の修復のときに必要とされる相同組換え修復反応の促進に作用していることを示した.
はじめに
Mcm2-7複合体は同一の祖先タンパク質から進化したMcm2からMcm7までの6つの構成タンパク質からなるリング状の六量体であり,複製ヘリカーゼとして機能するため真核生物のDNA複製において必須である.近年のめざましいゲノム解析により新たに,多くの真核生物のゲノムにおいて同じ祖先タンパク質から進化した2つのMCM遺伝子の存在していることが明らかになり,MCM8遺伝子,MCM9遺伝子と命名された(図1).興味深いことに,すべての真核生物はMCM2遺伝子からMCM7遺伝子までを保持しているのに対し,MCM8遺伝子とMCM9遺伝子は酵母や線虫など一部の真核生物には存在しない.さらに,ほとんどの生物種においてMCM8遺伝子とMCM9遺伝子は共進化しているようにみられる1).
アフリカツメガエル卵母細胞の無細胞複製系や培養細胞を用いた過去の研究において,Mcm8とMcm9は別個にDNA複製反応に関与すると報告されていた2-4).一方で,ショウジョウバエMcm8は減数分裂組換えに機能することや,ヒト女性の閉経時期にMCM8遺伝子の変異が影響していることも報告されている5-7).筆者らは,Mcm8とMcm9の機能的な関係性に焦点をあて,遺伝学的な改変が可能なニワトリDT40細胞を用いてその機能解析を行った.
1.Mcm8とMcm9はMcm2-7複合体とは独立した複合体を形成する
細胞におけるMcm8およびMcm9の機能を解析するため,MCM8遺伝子のノックアウト細胞およびMCM9遺伝子のノックアウト細胞を作製した.この2つのノックアウト細胞におけるタンパク質の発現を解析したところ,MCM8遺伝子ノックアウト細胞においてはMcm9の減少が,また,MCM9遺伝子ノックアウト細胞においてもMcm8の弱い減少が確認された.この結果から,Mcm8とMcm9とが相互の安定性を保つために物理的な相互作用をもつことが示唆されたので,免疫沈降実験を行った.その結果,Mcm8あるいはMcm9を免疫沈降すると,互いの大部分は共沈降した.しかしながら,同じタンパク質ファミリーであるにもかかわらず,Mcm2-7複合体の構成タンパク質には共沈降はまったく認められなかった.この結果は,Mcm8とMcm9はMcm2-7複合体とは独立した複合体を形成していることを示していた.さらに,Mcm8-9複合体の大きさを調べるため細胞抽出液をゲルろ過により分画したところ,その大きさはMcm2-7複合体とほぼ同じであり,おそらく,類似の六量体を構成しているものと推察された.Mcm2-7複合体の個々の構成タンパク質はDNA複製に必須であるためノックアウト細胞を作製することはできないが,Mcm8とMcm9はそれぞれノックアウト細胞を作製することが可能であった.この結果は,Mcm8とMcm9はDNA複製に必須ではないことを示していた.さらに,Mcm8とMcm9は複合体として機能し,Mcm2-7複合体とは異なるはたらきをもつことが示唆された.
2.MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞はDNA鎖架橋剤に高い感受性を示す
脊椎動物の培養細胞においてMcm8-9複合体がどのような機能をもつかを確かめるため,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞がどのような表現型を示すかを解析した.それぞれのノックアウト細胞において細胞周期におけるステージを比較したところ,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞では野生型の細胞と比べG2期/M期にある細胞の割合が増加していた.さらにくわしく調べたところ,DNA含量が2C未満の死細胞の割合も増加していることがわかった.以上の結果は,なんらかのDNA損傷が蓄積していることが原因として考えられたため,さまざまなDNA損傷に対する感受性を調べた.MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞は放射線,紫外線,メチルメタンスルホン酸に対して弱い感受性しか示さなかったが,シスプラチンやマイトマイシンCといったDNA鎖架橋剤に対し高い感受性を示した.さらに,レポータータンパク質であるGFPを結合させたMcm8あるいはMcm9を発現させ細胞における局在を観察したところ,マイトマイシンCで処理するとMcm8およびMcm9は核においてフォーカスを形成し,Rad51と部分的に共局在することがわかった.Rad51はDNAの損傷部位に集積し相同組換え修復を行うことが知られている.そのため,Mcm8-9複合体もDNA二本鎖間架橋の修復にかかわるのではないかと考えられた.
3.Mcm8-9複合体はATPaseおよびヘリカーゼとして機能する
Mcm8とMcm9を含むすべてのMcmファミリータンパク質はAAA+ ATPaseファミリーに属しており,ファミリーのあいだで保存されたMcmヘリカーゼドメインをその中心部に保持している.Mcmヘリカーゼドメインの内部にはATPの結合および加水分解に必要なWalker AモチーフとWalker Bモチーフ,そして,となりあったサブユニットのATPase活性化に必要なArgフィンガーモチーフが含まれている.これらのモチーフがDNA鎖架橋剤に対する抵抗性に必要であるかどうかを解析した.MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞にそれぞれの野生型の遺伝子をコードするcDNAを導入するとシスプラチンに対する感受性は回復したが,Walker AモチーフあるいはArgフィンガーモチーフに変異をもつそれぞれの遺伝子をコードするcDNAを導入したときにはシスプラチンに対する感受性を回復させることはできなかった.以上の結果は,DNA鎖架橋剤に対する抵抗性を発揮するときにはMcm8とMcm9のもつATPase活性が必要であり,Mcm8-9複合体はヘリカーゼとして機能していることを示唆していた.
4.Mcm8-9複合体はFANCD2とRad51の下流において相同組換え修復反応の促進に関与する
脊椎動物においてDNA二本鎖間架橋の修復には,ファンコニ貧血症原因遺伝子産物,TLSポリメラーゼ,Rad51など,多岐にわたるタンパク質が機能していることが明らかになっている8).この修復経路においては,ファンコニ貧血症原因遺伝子産物のひとつFANCD2のモノユビキチン化とRad51の損傷部位への結合の必要であることがすでにわかっている.そこで,Mcm8-9複合体がDNA二本鎖間架橋の修復にどのようにかかわっているのかを調べるため,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞においてFANCD2のモノユビキチン化やRad51のフォーカス形成およびクロマチンへの結合量を確認したが,野生型の細胞との違いは観察されなかった.しかしながら,FANCD2を欠失させた細胞やRad51の損傷部位への結合が阻害される変異をもつ細胞においては,野生型の細胞と比較してDNA二本鎖間架橋に依存的なMcm9のフォーカス形成が減少していた.この結果は,FANCD2のモノユビキチン化とRad51の損傷部位への集積ののちにMcm8-9複合体は呼び込まれることを示しており,Mcm8-9複合体はそのあとの相同組換え修復のときにはたらくことが予想された.実際に,MCM8遺伝子ノックアウト細胞およびMCM9遺伝子ノックアウト細胞において相同組換えの効率が大幅に減少していただけでなく,DNA二本鎖間架橋によりひき起こされる相同組換えによる娘染色体のあいだの交差の頻度が大きく低下していたことから,Mcm8-9複合体は相同組換えに機能することが明らかになった.以上の結果から,Mcm8-9複合体はDNA二本鎖間架橋のひき起こす相同組換え修復反応を促進する機能をもつと結論された(図2).
おわりに
この研究では,ニワトリのDT40細胞を用いてMcm8およびMcm9の解析を行い,この2つのタンパク質が複合体を形成し,DNA二本鎖間架橋を修復するときの相同組換え修復においてはたらくことを示した.ショウジョウバエMcm8が減数分裂期における交差型の組換えに必要であるという報告,MCM9遺伝子のノックアウトマウスにおいては,がんが生じやすいだけでなく生殖細胞の形成に影響がみられるという報告,ヒトMCM8遺伝子と閉経時期との関連などは,非常に興味深い5-7,9).筆者らが明らかにしたMcm8-9複合体が相同組換え修復に関与するという事実は,Mcm8-9複合体が減数分裂組換えにも関与する可能性を示唆している.実際に,同じ時期に発表された論文は,マウスのMcm8およびMcm9が減数分裂組換えに機能していることを示している10).今後は,Mcm8-9複合体のより詳細な分子機能ならびに立体構造の明らかにされることが期待される.真核生物の祖先と考えられている古細菌にはMcm8およびMcm9の祖先と考えられるタンパク質を保持しているものもあり,Mcm8-9複合体による組換えの制御は真核生物への進化の初期過程から保存されているものと考えられる.酵母や線虫などいくつかの生物種はMCM8遺伝子およびMCM9遺伝子をもたないことから,組換え修復反応の進化なども明らかになるであろう.
文 献
- Liu, Y., Richards, T. A. & Aves, S. J.: Ancient diversification of eukaryotic MCM DNA replication proteins. BMC Evol. Biol., 9, 60 (2009)[PubMed]
- Volkening, M. & Hoffmann, I.: Involvement of human MCM8 in prereplication complex assembly by recruiting hcdc6 to chromatin. Mol. Cell. Biol., 25, 1560-1568 (2005)[PubMed]
- Maiorano, D., Cuvier, O., Danis, E. et al.: MCM8 is an MCM2-7-related protein that functions as a DNA helicase during replication elongation and not initiation. Cell, 120, 315-328 (2005)[PubMed]
- Lutzmann, M. & Mechali, M.: MCM9 binds Cdt1 and is required for the assembly of prereplication complexes. Mol. Cell, 31, 190-200 (2008)[PubMed]
- Matsubayashi, H. & Yamamoto, M. T.: REC, a new member of the MCM-related protein family, is required for meiotic recombination in Drosophila. Genes Genet. Syst., 78, 363-371 (2003)[PubMed]
- Blanton, H. L., Radford, S. J., McMahan, S. et al.: REC, Drosophila MCM8, drives formation of meiotic crossovers. PLoS Genet., 1, e40 (2005)[PubMed]
- He, C., Kraft, P., Chen, C. et al.: Genome-wide association studies identify loci associated with age at menarche and age at natural menopause. Nat. Genet., 41, 724-728 (2009)[PubMed]
- Deans, A. J. & West, S. C.: DNA interstrand crosslink repair and cancer. Nat. Rev. Cancer, 11, 467-480 (2011)[PubMed]
- Hartford, S. A., Luo, Y., Southard, T. L. et al.: Minichromosome maintenance helicase paralog MCM9 is dispensible for DNA replication but functions in germ-line stem cells and tumor suppression. Proc. Natl. Acad. Sci. USA, 108, 17702-17707 (2011)[PubMed]
- Lutzmann, M., Grey, C., Traver, S. et al.: MCM8- and MCM9-deficient mice reveal gametogenesis defects and genome instability due to impaired homologous recombination. Mol. Cell, 47, 523-534 (2012)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院理学研究科博士課程 修了,同年 同 特任研究員を経て,2011年より国立遺伝学研究所 研究員.
鐘巻 将人(Masato Kanemaki)
国立遺伝学研究所 准教授.
研究室URL:http://www.nig.ac.jp/labs/MolFunc/Molecular_Function_HP/Home.html
© 2012 西村浩平・鐘巻将人 Licensed under CC 表示 2.1 日本