転写因子Nrf2はグルコースとグルタミンの代謝を変化させ代謝のリプログラミングを促進する
光石陽一郎・田口恵子・本橋ほづみ
(東北大学大学院医学系研究科 医化学分野)
email:本橋ほづみ
DOI: 10.7875/first.author.2012.087
Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming.
Yoichiro Mitsuishi, Keiko Taguchi, Yukie Kawatani, Tatsuhiro Shibata, Toshihiro Nukiwa, Hiroyuki Aburatani, Masayuki Yamamoto, Hozumi Motohashi
Cancer Cell, 22, 66-79 (2012)
活発に増殖するがん細胞では同化反応が活性化されており,静止期の細胞とは大きく異なる代謝様式を呈する.増殖シグナルは代謝様式を改変する代謝リプログラミングにより,増殖に有利な細胞内の環境を実現している.転写因子Nrf2は生体における酸化ストレス応答において重要な役割をはたしているが,近年,肺がんを中心とする固形腫瘍においてその機能亢進が報告され,がんの悪性化に貢献していることが明らかになった.Nrf2はがん細胞の薬剤耐性および放射線耐性の増強にくわえ,細胞増殖を促進することが知られていたが,その分子機構の理解は不十分であった.そこで,Nrf2ががん細胞の増殖を促進する分子機構を明らかにするため,がん細胞におけるNrf2の標的遺伝子を網羅的に解析した.その結果,Nrf2はペントースリン酸経路の酵素の遺伝子や,NADPHの産生に関与する酵素の遺伝子を直接的に活性化することがわかった.また,核酸のde novo合成に関与する酵素の遺伝子の発現にも関与していた.Nrf2の安定化が代謝に及ぼす影響を調べたところ,Nrf2はグルコースやグルタミンの代謝を変化させ同化反応を促進することがわかった.Nrf2による代謝関連遺伝子の発現促進と代謝リプログラミングは,静止期にある細胞よりも増殖細胞においてより強く認められた.とくに,PI3K-Aktシグナル伝達経路の活性化状態がNrf2の核への蓄積を促進し,その代謝への影響を増強することがわかった.さらに,Nrf2とPI3K-Aktシグナル伝達経路とが相互の活性を増強しあうという正のフィードバックの関係のあることも示された.以上のことから,がん細胞においてNrf2は,ストレス応答能の増強にくわえ同化反応を促進し,さらに,増殖シグナル自体の増強をもたらすことでがんの悪性化の駆動力となっているものと考えられた.
活発に増殖するがん細胞では,細胞を構成するさまざまな物質の生合成がさかんであり,グルコースやグルタミンなどの栄養分が大量に消費されている.さまざまながん遺伝子の活性化もしくはがん抑制遺伝子の機能喪失により,細胞内の代謝が改変され(代謝リプログラミング),がん細胞では細胞の増殖に有利な代謝様式が実現している1).がん細胞における特徴的な代謝様式のひとつとして,1世紀近くまえ,ドイツの生理学者ワールブルグは,好気的な条件にもかかわらず解糖系が活性化されていること(ワールブルグ効果)を見い出した.近年では,がん細胞に特異的な代謝経路の存在がつぎつぎと明らかにされている2-4).
ペントースリン酸経路は同化反応に必要な還元力の供給源であるNADPHの産生と核酸の合成に必要なリボース5-リン酸の産生をもたらし,がん細胞の増殖にとり重要である.これまでに,p53がペントースリン酸経路の活性制御に関与することが示されていたが5,6),がん細胞におけるその統括的な制御タンパク質の存在は明らかにされていなかった.
Keap1-Nrf2制御系は生体における酸化ストレス防御機構において中心的な役割をはたしている7).Nrf2は塩基性領域/ロイシンジッパー構造をもつCNC転写因子ファミリーに属する強力な転写活性化能をもつ転写因子である.通常,Nrf2はKeap1により抑制された状態にあり,細胞の内外から親電子性物質や活性酸素種などの酸化ストレスがくわわった際に活性化される.近年,多くのがん細胞においてNrf2が恒常的に安定化していることが見い出され8),Nrf2陽性の症例ではきわめて予後が不良であることが複数の施設から報告されている9-11).Nrf2はがん細胞の薬剤耐性および放射線耐性の増強にくわえ細胞増殖を促進することが知られていたが,その分子機構の理解は不十分であった.
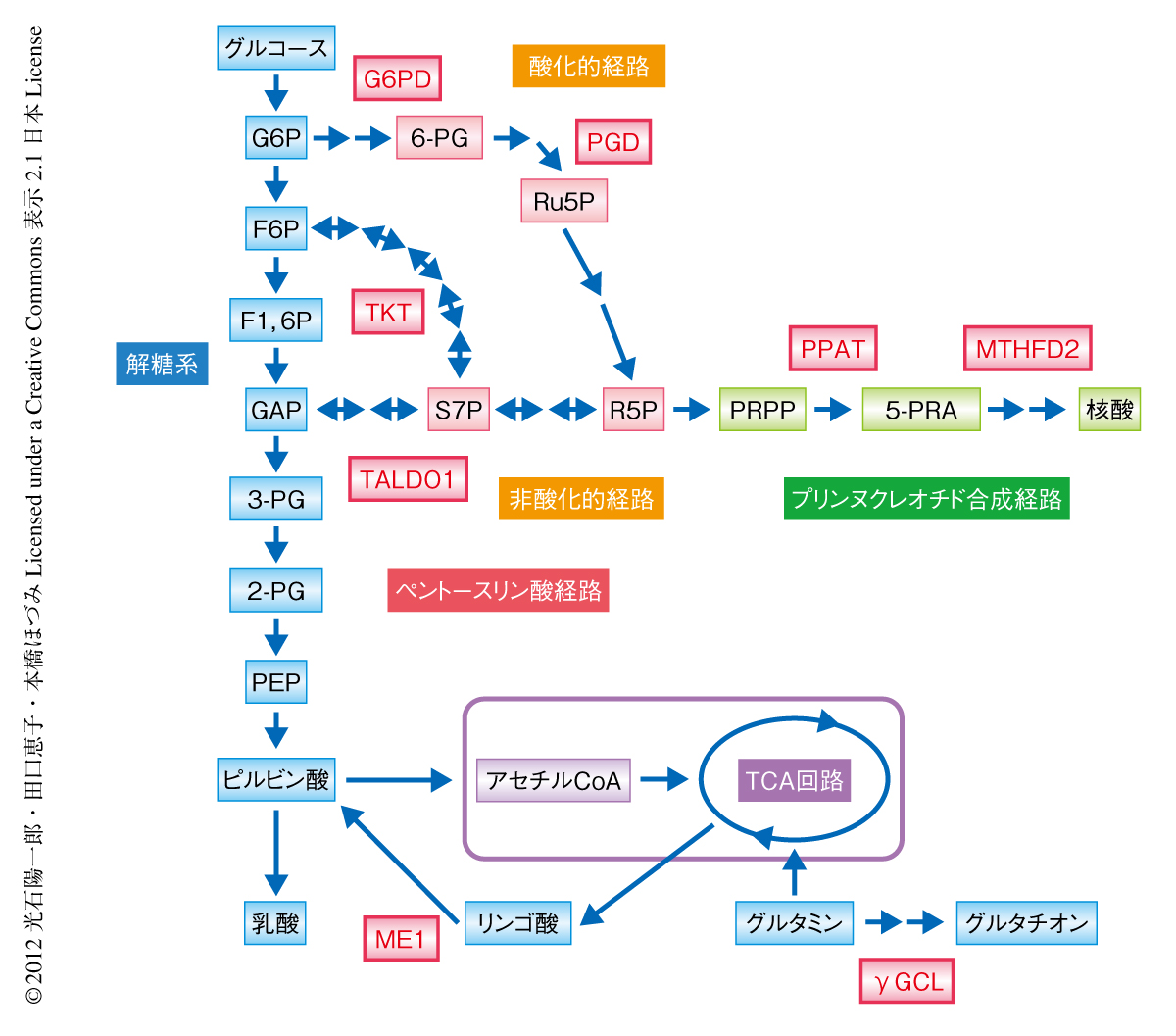
がん細胞におけるNrf2の機能を明らかにするため,肺腺がんに由来する細胞株で恒常的にNrf2が安定化しているA549細胞を用い,Nrf2のノックダウンによるトランスクリプトームの変化をマイクロアレイ法により調べた.また,抗Nrf2抗体を用いたクロマチン免疫沈降-シークエンス解析によりNrf2の結合部位のゲノムワイドな同定を行った.両方の結果を組み合わせることで,Nrf2の直接の標的遺伝子を決定した.その結果,Nrf2は,ペントースリン酸経路の酸化的経路および非酸化的経路を触媒する酵素,および,NADPHを産生する酵素の遺伝子を直接的に制御していることがわかった(図1).
Nrf2による細胞増殖の促進作用におけるペントースリン酸経路の貢献を調べた.まず,恒常的にNrf2が安定化しているA549細胞において,Nrf2をノックダウンすると細胞増殖が抑制されることを確認した.そこで,ペントースリン酸経路の主要酵素であるグルコース-6-リン酸デヒドロゲナーゼとトランスケトラーゼのダブルノックダウン実験を行ったところ,細胞数の増加は有意に抑制された.一方,通常はNrf2がKeap1による分解をうけておりその機能が抑制されている293T細胞において,Nrf2を過剰発現させると細胞数の増加が有意に促進された.そこで,293T細胞にグルコース-6-リン酸デヒドロゲナーゼまたはトランスケトラーゼを過剰発現させると,いずれの場合も細胞数の増加は有意に促進された.したがって,ペントースリン酸経路の活性化はNrf2による細胞増殖の促進効果の少なくとも一部を担っているといえた.
実際にNrf2が代謝産物の動態に変化を及ぼしているかどうかを調べるためメタボローム解析を行った.恒常的にNrf2が安定化しているA549細胞においてNrf2をノックダウンし,13C6-グルコースにより1時間の標識ののち13Cを取り込んだ代謝産物を定量すると,解糖系の代謝中間体が増加し,プリンヌクレオチド合成経路の最初の代謝産物であるイノシン1-リン酸が減少した.これは,ペントースリン酸経路の活性が抑制されたため,解糖系の代謝中間体がとどこおりイノシン1-リン酸が減少したものと考えられた.一方,13C5-グルタミンにより6時間の標識ののち同様に代謝産物を定量すると,グルタミンが増加し,乳酸とグルタチオンが減少した.これは,Nrf2の機能低下によりグルタミンからの乳酸の産生(グルタミノリシス)およびグルタチオンの合成が抑制されたためと考えられた.
13C6-グルコースにより標識した試料をより詳細に解析すると,おもしろい結果がみえてきた.A549細胞においてNrf2をノックダウンすると,リボース5-リン酸を含むペントースリン酸経路の代謝中間体の量も増加したのである.リボース5-リン酸のつぎの代謝産物であるホスホリボシルピルビン酸の量に変化はなくイノシン1-リン酸は減少する.このことから,Nrf2の機能低下によりリボース5-リン酸からイノシン1-リン酸にいたるプリンヌクレオチドのde novo合成経路が抑制されると予想した.そこで,Nrf2の機能亢進がもたらす影響を調べこの結果のさらなる検証を試みた.Nrf2が恒常的に安定化しているKeap1ノックアウトマウスに由来する胎仔線維芽細胞と野生型の胎仔線維芽細胞を用いて同様の比較を行った.その結果,A549細胞におけるNrf2のノックダウン実験とはちょうど逆の結果が認められた.すなわち,解糖系の代謝中間体の低下,ペントースリン酸経路の代謝中間体の低下,イノシン1-リン酸の増加である.このことから,Nrf2はリボース5-リン酸からイノシン1-リン酸までの経路に存在する律速段階を促進するものと推測された.
Nrf2がペントースリン酸経路の酵素を増加させるのにあわせ,リボース5-リン酸より後半の部分にもうひとつの制御ポイントをもつことは,核酸の合成を活発に進めようとする細胞にとりきわめて有利な戦略である.ペントースリン酸経路の酸化的経路は不可逆反応であるが,非酸化的経路は可逆反応であり,リボース5-リン酸と解糖系の代謝中間体との濃度勾配によりいずれの方向にも反応が進みうる.リボース5-リン酸より後半で強力に反応を促進すればリボース5-リン酸の濃度を低く維持でき,ペントースリン酸経路の酸化的経路および非酸化的経路の両方を使ってリボース5-リン酸を合成できることになる.
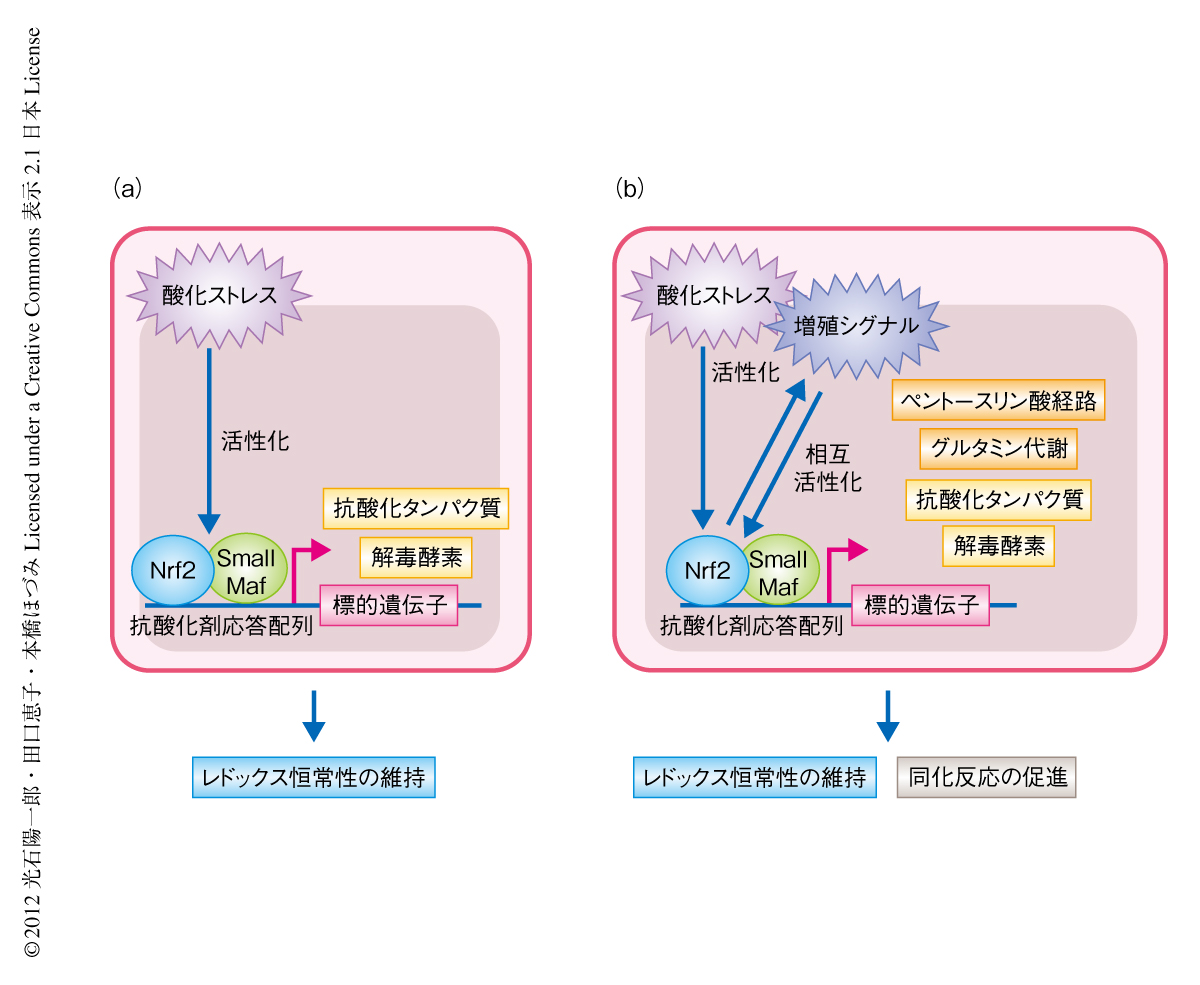
Nrf2の代謝リプログラミングという機能はどのような細胞においても認められるのだろうか? Nrf2が恒常的に安定化している正常な細胞として,Keap1ノックアウトマウスに由来する組織を用いてNrf2の標的遺伝子の発現レベルを検討した.通常,PI3K-Aktシグナル伝達経路が活性化状態にある増殖細胞で構成される前胃や小腸では代謝関連遺伝子の発現の上昇が認められたが,通常は大半の細胞が静止期にあると考えられる肝臓では,生体防御系遺伝子の発現は上昇するものの,代謝関連遺伝子の発現は有意な上昇をあまり示さなかった.しかし,肝臓においてPten遺伝子を欠損させPI3K-Aktシグナル伝達経路を強制的に活性化させると,Nrf2の活性化により代謝系遺伝子の発現は顕著に上昇した.また,肝臓における代謝産物を調べてみると,対照となるマウスと肝臓に特異的なKeap1ノックアウトマウス(静止期の細胞においてNrf2が蓄積している状態)とのあいだには有意な差異は認められなかった.肝臓に特異的なPtenノックアウトマウスと肝臓に特異的なPten Keap1ダブルノックアウトマウス(PI3K-Aktシグナル伝達系の活性化状態においてNrf2が蓄積している状態)とのあいだでは,野生型の胎仔線維芽細胞とKeap1を欠損した胎仔線維芽細胞との比較と同様に,解糖系の代謝中間体の低下,ペントースリン酸経路の代謝中間体の低下,イノシン1-リン酸の増加が認められた.ゆえに,Nrf2はPI3K-Aktシグナル伝達経路の活性化状態において代謝リプログラミングを起こすことが示された.
増殖シグナルがつねに活性化しているがん細胞において,生体防御系遺伝子を制御し恒常性の維持を担うNrf2は,酸化ストレス応答を増強するとともに,同化反応を促進して細胞の増殖をささえているものと考えられた(図2).また,Keap1ノックアウトマウスとPtenノックアウトマウスとを組み合わせた解析から,Keap1-Nrf2制御系とPten-PI3K-Aktシグナル伝達経路とのあいだに正のフィードバックの存在することが示された.この正のフィードバックががんの悪性化の駆動力となる分子機構のひとつであると推測された.
がん細胞において特異的にNrf2の機能を阻害することは,がんの治療にきわめて有効であると期待される.Nrf2は細胞の内外からの親電子性毒物や活性酸素種などに対する防御機構における鍵タンパク質であることを考えると,Nrf2阻害剤の全身への投与は正常な細胞におけるNrf2の機能抑制をもたらし,薬剤や放射線による副作用を悪化させることが危惧される.しかし,この研究から,がん細胞の悪性化をもたらすNrf2活性のレベルは,生体防御機能を発揮するのに必要なNrf2活性のレベルをはるかにうわまわっていることが確認された.がん細胞においてより効果的に作用するNrf2阻害剤の開発にあたり,こうしたNrf2活性のレベルの違いは有効な手がかりになるものと期待される.
一方,Nrf2は核に局在するタンパク質であることから創薬の標的としては難易度が高いとされており,Nrf2阻害剤の開発はほとんど進んでいない.また,Nrf2ノックアウトマウスでは野生型マウスと比較してがんの肺転移が起こりやすいという報告もあり12),Nrf2阻害剤の全身への投与は転移を促進してしまうおそれもある.今回,筆者らがNrf2の標的遺伝子として明らかにした,ペントースリン酸経路の酸化的経路および非酸化的経路の酵素の遺伝子の抑制は腫瘍の増大を効果的に抑制したことから,Nrf2が安定化しているがんに対しペントースリン酸経路の阻害が有効である可能性が示された.選択的なNrf2阻害剤の開発とあわせて,Nrf2により制御される代謝経路が抗がん剤の開発の有効な標的になるものと期待される.
略歴:2012年 東北大学大学院医学系研究科 修了,同年より平鹿総合病院 医長.
研究テーマ:Keap1-Nrf2制御系とがんの代謝.
田口 恵子(Keiko Taguchi)
略歴:2006年 筑波大学大学院人間総合科学研究科 修了,同年 科学技術振興機構ERATO山本環境応答プロジェクト 技術員および研究員を経て,2008年 東北大学大学院医学系研究科 助教.
研究テーマ:肝臓での病態の形成におけるKeap1-Nrf2制御系.
本橋 ほづみ(Hozumi Motohashi)
東北大学大学院医学系研究科 准教授.
© 2012 光石陽一郎・田口恵子・本橋ほづみ Licensed under CC 表示 2.1 日本
(東北大学大学院医学系研究科 医化学分野)
email:本橋ほづみ
DOI: 10.7875/first.author.2012.087
Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming.
Yoichiro Mitsuishi, Keiko Taguchi, Yukie Kawatani, Tatsuhiro Shibata, Toshihiro Nukiwa, Hiroyuki Aburatani, Masayuki Yamamoto, Hozumi Motohashi
Cancer Cell, 22, 66-79 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
Nrf2(Q16236), PI3K, Akt, p53(P04637), Keap1(Q9Z2X8), CNC転写因子, グルコース-6-リン酸デヒドロゲナーゼ(P11413), トランスケトラーゼ(P29401), Pten(O08586), リンゴ酸酵素(P48163), γグルタミルシステイン合成酵素, G6PD(P11413), PGD(P52209), ホスホグルコン酸デヒドロゲナーゼ(P52209), TKT(P29401), TALDO1(P37837), トランスアルドラーゼ1(P37837), PPAT(Q06203), ホスホリボシルピロリン酸アミドトランスフェラーゼ(Q06203), MTHFD2(P13995), メチレンテトラヒドロ葉酸デヒドロゲナーゼ2(P13995), ME1(P48163), γGCL
要 約
活発に増殖するがん細胞では同化反応が活性化されており,静止期の細胞とは大きく異なる代謝様式を呈する.増殖シグナルは代謝様式を改変する代謝リプログラミングにより,増殖に有利な細胞内の環境を実現している.転写因子Nrf2は生体における酸化ストレス応答において重要な役割をはたしているが,近年,肺がんを中心とする固形腫瘍においてその機能亢進が報告され,がんの悪性化に貢献していることが明らかになった.Nrf2はがん細胞の薬剤耐性および放射線耐性の増強にくわえ,細胞増殖を促進することが知られていたが,その分子機構の理解は不十分であった.そこで,Nrf2ががん細胞の増殖を促進する分子機構を明らかにするため,がん細胞におけるNrf2の標的遺伝子を網羅的に解析した.その結果,Nrf2はペントースリン酸経路の酵素の遺伝子や,NADPHの産生に関与する酵素の遺伝子を直接的に活性化することがわかった.また,核酸のde novo合成に関与する酵素の遺伝子の発現にも関与していた.Nrf2の安定化が代謝に及ぼす影響を調べたところ,Nrf2はグルコースやグルタミンの代謝を変化させ同化反応を促進することがわかった.Nrf2による代謝関連遺伝子の発現促進と代謝リプログラミングは,静止期にある細胞よりも増殖細胞においてより強く認められた.とくに,PI3K-Aktシグナル伝達経路の活性化状態がNrf2の核への蓄積を促進し,その代謝への影響を増強することがわかった.さらに,Nrf2とPI3K-Aktシグナル伝達経路とが相互の活性を増強しあうという正のフィードバックの関係のあることも示された.以上のことから,がん細胞においてNrf2は,ストレス応答能の増強にくわえ同化反応を促進し,さらに,増殖シグナル自体の増強をもたらすことでがんの悪性化の駆動力となっているものと考えられた.
はじめに
活発に増殖するがん細胞では,細胞を構成するさまざまな物質の生合成がさかんであり,グルコースやグルタミンなどの栄養分が大量に消費されている.さまざまながん遺伝子の活性化もしくはがん抑制遺伝子の機能喪失により,細胞内の代謝が改変され(代謝リプログラミング),がん細胞では細胞の増殖に有利な代謝様式が実現している1).がん細胞における特徴的な代謝様式のひとつとして,1世紀近くまえ,ドイツの生理学者ワールブルグは,好気的な条件にもかかわらず解糖系が活性化されていること(ワールブルグ効果)を見い出した.近年では,がん細胞に特異的な代謝経路の存在がつぎつぎと明らかにされている2-4).
ペントースリン酸経路は同化反応に必要な還元力の供給源であるNADPHの産生と核酸の合成に必要なリボース5-リン酸の産生をもたらし,がん細胞の増殖にとり重要である.これまでに,p53がペントースリン酸経路の活性制御に関与することが示されていたが5,6),がん細胞におけるその統括的な制御タンパク質の存在は明らかにされていなかった.
Keap1-Nrf2制御系は生体における酸化ストレス防御機構において中心的な役割をはたしている7).Nrf2は塩基性領域/ロイシンジッパー構造をもつCNC転写因子ファミリーに属する強力な転写活性化能をもつ転写因子である.通常,Nrf2はKeap1により抑制された状態にあり,細胞の内外から親電子性物質や活性酸素種などの酸化ストレスがくわわった際に活性化される.近年,多くのがん細胞においてNrf2が恒常的に安定化していることが見い出され8),Nrf2陽性の症例ではきわめて予後が不良であることが複数の施設から報告されている9-11).Nrf2はがん細胞の薬剤耐性および放射線耐性の増強にくわえ細胞増殖を促進することが知られていたが,その分子機構の理解は不十分であった.
1.Nrf2はペントースリン酸経路およびNADPHの産生にかかわる酵素の遺伝子を制御している
がん細胞におけるNrf2の機能を明らかにするため,肺腺がんに由来する細胞株で恒常的にNrf2が安定化しているA549細胞を用い,Nrf2のノックダウンによるトランスクリプトームの変化をマイクロアレイ法により調べた.また,抗Nrf2抗体を用いたクロマチン免疫沈降-シークエンス解析によりNrf2の結合部位のゲノムワイドな同定を行った.両方の結果を組み合わせることで,Nrf2の直接の標的遺伝子を決定した.その結果,Nrf2は,ペントースリン酸経路の酸化的経路および非酸化的経路を触媒する酵素,および,NADPHを産生する酵素の遺伝子を直接的に制御していることがわかった(図1).
2.Nrf2による細胞増殖の促進作用はペントースリン酸経路の酵素に依存する
Nrf2による細胞増殖の促進作用におけるペントースリン酸経路の貢献を調べた.まず,恒常的にNrf2が安定化しているA549細胞において,Nrf2をノックダウンすると細胞増殖が抑制されることを確認した.そこで,ペントースリン酸経路の主要酵素であるグルコース-6-リン酸デヒドロゲナーゼとトランスケトラーゼのダブルノックダウン実験を行ったところ,細胞数の増加は有意に抑制された.一方,通常はNrf2がKeap1による分解をうけておりその機能が抑制されている293T細胞において,Nrf2を過剰発現させると細胞数の増加が有意に促進された.そこで,293T細胞にグルコース-6-リン酸デヒドロゲナーゼまたはトランスケトラーゼを過剰発現させると,いずれの場合も細胞数の増加は有意に促進された.したがって,ペントースリン酸経路の活性化はNrf2による細胞増殖の促進効果の少なくとも一部を担っているといえた.
3.Nrf2はプリンヌクレオチド合成とグルタミン代謝を促進する
実際にNrf2が代謝産物の動態に変化を及ぼしているかどうかを調べるためメタボローム解析を行った.恒常的にNrf2が安定化しているA549細胞においてNrf2をノックダウンし,13C6-グルコースにより1時間の標識ののち13Cを取り込んだ代謝産物を定量すると,解糖系の代謝中間体が増加し,プリンヌクレオチド合成経路の最初の代謝産物であるイノシン1-リン酸が減少した.これは,ペントースリン酸経路の活性が抑制されたため,解糖系の代謝中間体がとどこおりイノシン1-リン酸が減少したものと考えられた.一方,13C5-グルタミンにより6時間の標識ののち同様に代謝産物を定量すると,グルタミンが増加し,乳酸とグルタチオンが減少した.これは,Nrf2の機能低下によりグルタミンからの乳酸の産生(グルタミノリシス)およびグルタチオンの合成が抑制されたためと考えられた.
13C6-グルコースにより標識した試料をより詳細に解析すると,おもしろい結果がみえてきた.A549細胞においてNrf2をノックダウンすると,リボース5-リン酸を含むペントースリン酸経路の代謝中間体の量も増加したのである.リボース5-リン酸のつぎの代謝産物であるホスホリボシルピルビン酸の量に変化はなくイノシン1-リン酸は減少する.このことから,Nrf2の機能低下によりリボース5-リン酸からイノシン1-リン酸にいたるプリンヌクレオチドのde novo合成経路が抑制されると予想した.そこで,Nrf2の機能亢進がもたらす影響を調べこの結果のさらなる検証を試みた.Nrf2が恒常的に安定化しているKeap1ノックアウトマウスに由来する胎仔線維芽細胞と野生型の胎仔線維芽細胞を用いて同様の比較を行った.その結果,A549細胞におけるNrf2のノックダウン実験とはちょうど逆の結果が認められた.すなわち,解糖系の代謝中間体の低下,ペントースリン酸経路の代謝中間体の低下,イノシン1-リン酸の増加である.このことから,Nrf2はリボース5-リン酸からイノシン1-リン酸までの経路に存在する律速段階を促進するものと推測された.
Nrf2がペントースリン酸経路の酵素を増加させるのにあわせ,リボース5-リン酸より後半の部分にもうひとつの制御ポイントをもつことは,核酸の合成を活発に進めようとする細胞にとりきわめて有利な戦略である.ペントースリン酸経路の酸化的経路は不可逆反応であるが,非酸化的経路は可逆反応であり,リボース5-リン酸と解糖系の代謝中間体との濃度勾配によりいずれの方向にも反応が進みうる.リボース5-リン酸より後半で強力に反応を促進すればリボース5-リン酸の濃度を低く維持でき,ペントースリン酸経路の酸化的経路および非酸化的経路の両方を使ってリボース5-リン酸を合成できることになる.
4.PI3K-Aktシグナル伝達経路の恒常的な活性化状態においてNrf2の機能は拡大する
Nrf2の代謝リプログラミングという機能はどのような細胞においても認められるのだろうか? Nrf2が恒常的に安定化している正常な細胞として,Keap1ノックアウトマウスに由来する組織を用いてNrf2の標的遺伝子の発現レベルを検討した.通常,PI3K-Aktシグナル伝達経路が活性化状態にある増殖細胞で構成される前胃や小腸では代謝関連遺伝子の発現の上昇が認められたが,通常は大半の細胞が静止期にあると考えられる肝臓では,生体防御系遺伝子の発現は上昇するものの,代謝関連遺伝子の発現は有意な上昇をあまり示さなかった.しかし,肝臓においてPten遺伝子を欠損させPI3K-Aktシグナル伝達経路を強制的に活性化させると,Nrf2の活性化により代謝系遺伝子の発現は顕著に上昇した.また,肝臓における代謝産物を調べてみると,対照となるマウスと肝臓に特異的なKeap1ノックアウトマウス(静止期の細胞においてNrf2が蓄積している状態)とのあいだには有意な差異は認められなかった.肝臓に特異的なPtenノックアウトマウスと肝臓に特異的なPten Keap1ダブルノックアウトマウス(PI3K-Aktシグナル伝達系の活性化状態においてNrf2が蓄積している状態)とのあいだでは,野生型の胎仔線維芽細胞とKeap1を欠損した胎仔線維芽細胞との比較と同様に,解糖系の代謝中間体の低下,ペントースリン酸経路の代謝中間体の低下,イノシン1-リン酸の増加が認められた.ゆえに,Nrf2はPI3K-Aktシグナル伝達経路の活性化状態において代謝リプログラミングを起こすことが示された.
増殖シグナルがつねに活性化しているがん細胞において,生体防御系遺伝子を制御し恒常性の維持を担うNrf2は,酸化ストレス応答を増強するとともに,同化反応を促進して細胞の増殖をささえているものと考えられた(図2).また,Keap1ノックアウトマウスとPtenノックアウトマウスとを組み合わせた解析から,Keap1-Nrf2制御系とPten-PI3K-Aktシグナル伝達経路とのあいだに正のフィードバックの存在することが示された.この正のフィードバックががんの悪性化の駆動力となる分子機構のひとつであると推測された.
おわりに
がん細胞において特異的にNrf2の機能を阻害することは,がんの治療にきわめて有効であると期待される.Nrf2は細胞の内外からの親電子性毒物や活性酸素種などに対する防御機構における鍵タンパク質であることを考えると,Nrf2阻害剤の全身への投与は正常な細胞におけるNrf2の機能抑制をもたらし,薬剤や放射線による副作用を悪化させることが危惧される.しかし,この研究から,がん細胞の悪性化をもたらすNrf2活性のレベルは,生体防御機能を発揮するのに必要なNrf2活性のレベルをはるかにうわまわっていることが確認された.がん細胞においてより効果的に作用するNrf2阻害剤の開発にあたり,こうしたNrf2活性のレベルの違いは有効な手がかりになるものと期待される.
一方,Nrf2は核に局在するタンパク質であることから創薬の標的としては難易度が高いとされており,Nrf2阻害剤の開発はほとんど進んでいない.また,Nrf2ノックアウトマウスでは野生型マウスと比較してがんの肺転移が起こりやすいという報告もあり12),Nrf2阻害剤の全身への投与は転移を促進してしまうおそれもある.今回,筆者らがNrf2の標的遺伝子として明らかにした,ペントースリン酸経路の酸化的経路および非酸化的経路の酵素の遺伝子の抑制は腫瘍の増大を効果的に抑制したことから,Nrf2が安定化しているがんに対しペントースリン酸経路の阻害が有効である可能性が示された.選択的なNrf2阻害剤の開発とあわせて,Nrf2により制御される代謝経路が抗がん剤の開発の有効な標的になるものと期待される.
文 献
- DeBerardinis, R. J., Lum, J. J., Hatzivassiliou, G. et al.: The biology of cancer: metabolic reprogramming fuels cell growth and proliferation. Cell Metab., 7, 11-20 (2008)[PubMed]
- Locasale, J. W., Grassian, A. R., Melman, T. et al.: Phosphoglycerate dehydrogenase diverts glycolytic flux and contributes to oncogenesis. Nat. Genet., 43, 869-874 (2011)[PubMed]
- Metallo, C. M., Gameiro, P. A., Bell, E. L. et al.: Reductive glutamine metabolism by IDH1 mediates lipogenesis under hypoxia. Nature, 481, 380-384 (2011)[PubMed]
- Frezza, C., Zheng, L., Folger, O. et al.: Haem oxygenase is synthetically lethal with the tumour suppressor fumarate hydratase. Nature, 477, 225-228 (2011)[PubMed]
- Bensaad, K., Tsuruta, A., Selak, M. A. et al.: TIGAR, a p53-inducible regulator of glycolysis and apoptosis. Cell, 126, 107-120 (2006)[PubMed]
- Jiang, P., Du, W., Wang, X. et al.: p53 regulates biosynthesis through direct inactivation of glucose-6-phosphate dehydrogenase. Nat. Cell Biol., 13, 310-316 (2011)[PubMed]
- Uruno, A. & Motohashi, H.: The Keap1-Nrf2 system as an in vivo sensor for electrophiles. Nitric Oxide, 25, 153-160 (2011)[PubMed]
- Taguchi, K., Motohashi, H. & Yamamoto, M. et al.: Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution. Genes Cells, 16, 123-140 (2011)[PubMed]
- Shibata, T., Ohta, T., Tong, K. I. et al.: Cancer related mutations in NRF2 impair its recognition by Keap1-Cul3 E3 ligase and promote malignancy. Proc. Natl. Acad. Sci. USA, 105, 13568-13573 (2008)[PubMed]
- Solis, L. M., Behrens, C., Dong, W. et al.: Nrf2 and Keap1 abnormalities in non-small cell lung carcinoma and association with clinicopathologic features. Clin. Cancer Res., 16, 3743-3753 (2010)[PubMed]
- Inoue, D., Suzuki, T., Mitsuishi, Y. et al.: Accumulation of p62/SQSTM1 is associated with poor prognosis in patients with lung adenocarcinoma. Cancer Sci., 103, 760-766 (2012)[PubMed]
- Satoh, H., Moriguchi, T., Taguchi, K. et al.: Nrf2-deficiency creates a responsive microenvironment for metastasis to the lung. Carcinogenesis, 31, 1833-1843 (2010)[PubMed]
著者プロフィール
略歴:2012年 東北大学大学院医学系研究科 修了,同年より平鹿総合病院 医長.
研究テーマ:Keap1-Nrf2制御系とがんの代謝.
田口 恵子(Keiko Taguchi)
略歴:2006年 筑波大学大学院人間総合科学研究科 修了,同年 科学技術振興機構ERATO山本環境応答プロジェクト 技術員および研究員を経て,2008年 東北大学大学院医学系研究科 助教.
研究テーマ:肝臓での病態の形成におけるKeap1-Nrf2制御系.
本橋 ほづみ(Hozumi Motohashi)
東北大学大学院医学系研究科 准教授.
© 2012 光石陽一郎・田口恵子・本橋ほづみ Licensed under CC 表示 2.1 日本